基于高分辨质谱的食品致敏蛋白检测研究进展
刘 楠,许利丽,张晓梅,宗爱珍,徐同成,尤艳莉,张鸿伟*,肖 晶
(1.烟台大学 生命科学学院,山东 烟台 264000;2.山东省农业科学研究院农产品加工与营养研究所,山东济南 250000;3.青岛海关技术研究中心,山东 青岛 266100;4.国家食品安全风险评估中心,北京 100022)
目前,食物过敏疾病已被公认为是危害公共健康的重大问题。在发达国家,因食物过敏引起的哮喘及过敏性鼻炎等疾病的发生率逐年增高[1-2]。据联合国粮农组织报告,在世界范围内,90%以上的临床过敏反应由8大类食物引起,包括甲壳类、鱼类、花生、坚果、小麦、牛奶、鸡蛋和豆类[3]。食物过敏影响1%~3%的成年人和4%~6%的儿童,且在过去的二十年中,该比例显著增加。据报道,在亚洲,儿童食物过敏的患病率为1.11%~7.65%;流行病学研究显示,在食物过敏的成年人中,中国的患病率为18%[4],印度为1.2%[5]。
致敏原是指能够使机体发生过敏反应的抗原,主要为大分子蛋白质或多肽,也包括一些小分子化合物等。本文主要探讨蛋白质致敏原的检测,为方便叙述,下文中致敏原主要指代致敏蛋白。致敏蛋白可分为水溶性蛋白(如清蛋白)、盐溶性蛋白(如原肌球蛋白)、醇溶性蛋白(如α-醇溶蛋白)、酸碱溶性蛋白(如谷蛋白)等不同类型。目前国内外对于食品过敏尚无有效的治疗措施,唯一有效的措施是对致敏原的严格预防,避免接触致敏原或含有致敏原的产品[6]。因此,对食品致敏原进行有效、快速、准确的检测具有重要的研究意义。根据检测对象不同,目前,致敏蛋白的检测技术主要分为两大类:即针对编码致敏蛋白质的核酸或致敏蛋白质本身进行检测。针对核酸检测的技术主要包括环介导等温扩增、聚合酶链式反应(PCR)等;针对致敏蛋白质检测的技术主要包括酶联免疫吸附(ELISA)、免疫印迹、免疫层析、液相色谱-质谱联用(LC-MS)等[7-8]。基于核酸的检测技术主要通过检测DNA 达到检测致敏原的目的,属于间接检测致敏原;基于免疫反应的食物致敏原检测技术主要利用抗原和抗体的特异性结合,通过同位素、荧光、酶等标记技术放大信号实现食品致敏原的定性定量检测,应用较为广泛。然而,该技术的特异性和灵敏度主要取决于抗原、抗体的制备质量,检测氨基酸序列高度相似的致敏蛋白时,会因存在交叉反应导致假阴性、假阳性结果。另外,ELISA 和PCR 方法均不能区分致敏原的蛋白种类和来源物种[9]。
LC-MS 技术是一种鉴定食品致敏蛋白的非免疫技术,具有灵敏度高、选择性好、准确性强等优点,其中高分辨质谱技术(HRMS)在质量准确度和分辨率方面更具分析优势,同时还具有全扫描、高通量、数据可回溯分析等特点,因此在食品致敏原检测领域的应用越来越广泛。本文对HRMS、基于HRMS技术的食品致敏蛋白检测进行了综述。
1 高分辨质谱
HRMS 技术能够实现对样品组分的高质量精度测量,按照质量分析器的类型,通常可分为磁质谱(MS)、飞行时间质谱(TOF MS)、静电场轨道阱质谱(Orbitrap-MS)和傅里叶变换离子回旋共振质谱(FTICR MS)[10-11]。目前常用的HRMS 技术包括TOF MS 和Orbitrap-MS 等[12]。TOF 检测器的基本工作原理是:电离源中运动的电子撞击样品,使其电离变成带电离子后经脉冲电场加速进入漂移区,根据到达检测器的时间,不同质量的离子按照m/z进行分离。TOF具有高质量精确度的特点,可以减少同位素离子的干扰,适用于复杂食品基质中致敏蛋白的检测[13]。Orbitrap装置用于捕获围绕一个中心电极旋转的带电离子,其质量分析器由一个中心纺锤形电极和电极外部左右两个半电极组成。带电离子以一定的初速度进入离子阱后,围绕中心电极在水平方向做旋转运动,同时在垂直方向做谐振荡;通过检测感应电流可得到时序信号,经傅里叶变换转换为频谱即得到样品质谱图[14]。
此外,目前可以采用串联质谱借助碰撞诱导裂解等多种碎裂方式对同位素离子或碎片离子的精确质量进行测定,实现复杂食品基质样品中致敏蛋白的鉴定分析。常见的联用质谱仪包括四极杆-飞行时间质谱(Q-TOF)、四极杆-静电场轨道阱(Q-Orbitrap)等[15]。不同的质谱串联形式产生了数据采集模式的多样性,其中数据依赖性采集模式(DDA)和数据非依赖性采集模式(DIA)是进行蛋白/多肽分析的主要数据采集技术。
2 基于HRMS技术的食品致敏蛋白检测前处理
食品致敏蛋白的前处理一般包括提取纯化和酶解两个部分。通常,食品基质需进行一定处理,如研磨或粉碎制备成固体粉末或均质液体,并去除样品中的脂质、色素等杂质。随后根据致敏蛋白的类型,加入不同离子浓度、pH 值的缓冲液(如碳酸氢铵、Tris-HCl、硼酸钠缓冲液、磷酸盐缓冲液等)进行蛋白质提取[16-18]。Sathe等[19]将溶液中氯化钠的离子浓度从0.2 mol/L提高到4 mol/L,使山核桃蛋白在缓冲液中的溶解度提高了9.2倍。
由于复杂的食品基质组分会影响色谱、质谱检测的灵敏度,故需进一步对蛋白质粗提液进行纯化。目前常见的蛋白质纯化方法包括有机溶剂沉淀法、固相萃取法、磁珠捕获法、亲和层析法等[20-21]。Zhao 等[22]采用Na2CO3溶液和70%乙醇溶液提取小麦、燕麦、藜麦和荞麦中的麸质蛋白,对比分析了不同来源麸质蛋白之间的交叉反应性。Mattarozzi等[23]对比分析了C18固相萃取柱、聚合物基体固相萃取柱和体积排阻纯化柱对蛋白质回收率的影响,结果显示采用体积排阻纯化柱的样品蛋白质回收率较高。赵鑫[24]使用免疫磁珠分离纯化银鳕鱼肌浆蛋白和基围虾肌肉蛋白溶液,将小鼠单克隆抗人IgE 抗体和磁珠偶联后与过敏患者的血清结合捕获样品中的未知致敏原,经HPLC-MS/MS 技术鉴定发现银鳕鱼体内的小血管抑制素结合蛋白是一种潜在致敏原。Xu等[25]采用亲和层析法纯化重组原肌球蛋白,根据致敏蛋白上的His 标签可与镍离子形成强配位键将目标蛋白保留在镍离子亲和层析柱上,通过调节洗脱缓冲液中咪唑的浓度来分离纯化原肌球蛋白,并使用Q-TOF MS 对比分析了重组蛋白与天然蛋白的免疫特性。
对于高盐溶性蛋白,如副肌球蛋白,为了保证其在溶液中的溶解性,需要在整个蛋白纯化过程中保持0.5 mol/L的盐缓冲液体系不变。然而当盐浓度过高时,普通离子交换层析(DEAE-Sepharose 及QSepharose Fast Flow 等)方法的吸附和洗脱效果将受到严重影响,而羟基磷灰石层析柱可耐受高盐浓度,其填料中的钙离子可与带负电荷的蛋白以金属螯合的方式结合,并可利用磷酸盐缓冲液洗脱体系对吸附的目标蛋白进行分段洗脱,根据吸收峰将每段洗脱液进行收集、验证,即可获得目标蛋白[26]。对于复杂食品基质,脂肪、碳水化合物、蛋白质和水等组分之间会发生相互作用,且基质组分和加工时的相互作用等因素会影响食品致敏原的检测。在致敏原检测过程中,抽提食品中致敏原的同时会带来其他蛋白质或组分,影响亲和材料与致敏原间的结合,该现象称为基质效应(Matrix effect),因此在检测方法的研究中必须细致评估食品基质的影响及优化抽提条件。Tiwari 等[27]对不同类型食品基质中苦杏仁球蛋白的回收率进行评估,发现乳制品、坚果和蔬菜基质中苦杏仁球蛋白的回收率较高,而茶叶、糖果和水果基质中该蛋白的回收率较低,表明不同食品基质对致敏蛋白检测产生的干扰程度差别较大。Bignardi等[28]使用Bio-Spin尺寸排阻色谱柱对饼干和黑巧克力样品中的致敏蛋白进行分离富集,实现了坚果类(腰果、榛子、杏仁、核桃和花生)样品中致敏蛋白的高灵敏度检测。然而,目前对简单食品基质(如牛奶、鸡蛋、鱼、虾等)和复杂食品基质(如面包、饼干、披萨等)样品中致敏蛋白的提取纯化仍存在提取时间长、富集效率低等问题,需要进一步深入研究。
在基于质谱鸟枪法技术的分析中,致敏蛋白被酶解成小分子肽段,经色谱分离后进行质谱分析。通常,胰蛋白酶作为蛋白质酶解消化的特异性裂解酶,需在37 ℃下孵育12~18 h。为了缩短孵育时间,固定化胰蛋白酶是游离胰蛋白酶的合适替代品,可将孵育时间缩短至15 min[29]。Mattarozzi等[23]对比分析了尿素、硫脲和十二烷基磺酸钠(SDS)对蛋白质酶解效率的影响,结果表明蛋白质在终浓度为6 mol/L尿素、2 mol/L硫脲和2 g/L SDS变性剂的环境中经还原和烷基化变性后的酶解效率较高。
3 基于HRMS的食品致敏蛋白检测
3.1 分析策略
质谱蛋白质分析主要包括“自上而下(Top-Down)”和“自下而上(Bottom-Up)”两种分析策略[30]。Top-Down 方案是一种直接检测致敏蛋白的方法,蛋白经十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDSPAGE)、二维凝胶电泳(2-DE)和液相色谱或毛细管电泳(CE)分离,直接导入质谱系统进行离子化碎裂,对完整蛋白和产生的碎片离子进行检测,通过匹配相关数据库如NCBI(https://www. ncbi. nlm.nih.gov/protein/)和/或UniProtKB(https://www.uniprot.org)对蛋白进行鉴定。该方法主要依据致敏蛋白的序列、分子质量及等电点等特征进行快速鉴定,能够分析致敏蛋白的不同亚基和修饰后蛋白[31-32]。然而,该方案易受基质的影响,尤其在对加工后样品的检测中,会产生基质电离抑制效应;另一方面,由于基质的复杂性,易导致蛋白质的众多峰叠加,无法有效对目标峰进行分离识别,如同位素差异蛋白的分析等。Top-Down方法无法实现致敏蛋白的高通量分析,且灵敏度及准确度不稳定,在应用中对致敏原的纯度要求较高[33]。
由于Top-Down 方法的缺陷,质谱蛋白质检测最常用的方法为Bottom-Up 方法,也称为鸟枪法(Shotgun),该法普遍应用于致敏原的质谱定性和定量检测[34]。其原理是先将蛋白质特异性酶解成小分子肽段,再根据多肽的极性进行色谱分离,离子化后质谱检测混合物中各种多肽的质荷比和强度信息,并使用蛋白鉴定软件将生成的肽段二级图谱与数据库原蛋白质的理论酶切图谱进行匹配,组合所鉴定出的多肽序列得到蛋白质的具体信息。目前该方法已被广泛应用于致敏蛋白的定量检测,尤其适用于复杂基质中致敏蛋白的分析[35]。
3.2 采集模式
基于HRMS 技术检测致敏蛋白目前主要有DDA 和DIA 两种采集模式[36](图1)。DDA 采集模式采用较窄的质荷比窗口对前体离子进行筛选,在满足设定的响应阈值后可同时得到目标蛋白/肽段的一级质谱和碎片信息,随后通过前体离子和碎片离子的精确质量数进行谱库检索鉴定。DIA 采集模式克服了DDA 采集数据记录的局限性(表1),肽段在进行第一次m/z扫描后,所有选定m/z范围内的母离子全部碎裂,子离子进行第二次m/z扫描[37-38]。

表1 DDA和DIA数据采集模式对比Table 1 Comparison of DDA and DIA data acquisition modes
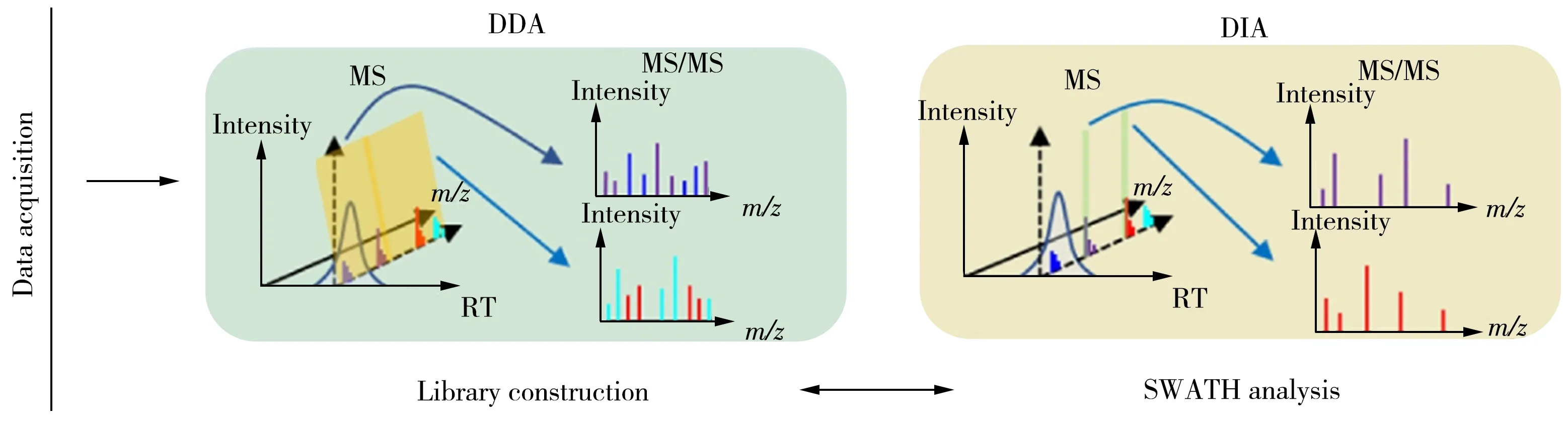
图1 DDA和DIA采集模式示意图[36]Fig.1 Schematic diagrams of DDA and DIA acquisition modes[36]
连续窗口采集所有理论碎片离子质谱(SWATH-MS)技术是DIA 技术的一种,根据前体离子在整个质荷比范围中的密度,将整个质谱扫描质量范围分为若干连续变化的小窗口,并使每个窗口中的前体离子数目达到均衡,然后高速循环地分别对每个窗口的所有离子进行碎裂。理论上,SWATH采集模式一次进样即可记录样品中化合物的所有碎片信息,然后通过目标数据提取方法进行分析[39]。这种采集模式的最大优势在于,当有新的蛋白质/肽段或其他化合物被发现时,不需要重新进样即可对数据进行回溯分析,这对于研究尚未完成基因组测序的非模式生物极其重要。Xu 等[40]采用SWATH-MS 方法对模拟胃肠液处理的不同来源原肌球蛋白中的特征多肽进行鉴定,通过与蛋白数据库对比,结合细胞表位最终确定特征多肽为VEKDKALSNAEGEVAAL,该方法可用于鉴定不同来源原肌球蛋白的特征多肽。
3.3 致敏蛋白的检测
致敏蛋白检测中常用的定性方法为肽碎片离子鉴定法(PFF)和肽质量指纹图谱法(PMF)[41]。PMF的理论基础为:蛋白质经酶解为不同类型的多肽,获得所有多肽的相对分子质量,所形成的专一性的、特异性的肽段分子质量图谱即为肽质量指纹图谱[42-44]。通过比对实验得到的图谱与蛋白质数据库中的理论图谱进行蛋白质鉴定,常用的蛋白数据库包括Uniport(www. uniprot. org)、 NCBI(www. ncbi. nlm.nih.gov)等,匹配的肽段可借助ProteinPilot、MaxQuant等质谱数据库检索软件进行分析。
PFF 方法使用串联质谱将特定多肽进行碎裂,结合母离子峰分析相邻同类型的峰质量差确定肽段的氨基酸残基,并推算目标多肽的氨基酸序列。根据MS 检测多肽的精准分子质量和MS/MS 所得的序列信息,结合蛋白质数据库即可实现蛋白质的准确鉴定。该方法可以用来鉴定致敏蛋白的特征多肽[45-49]。
PMF 方法主要是一级质谱方法,容易受到食品基质效应的影响,如脂质等;而PFF 方法受到基质效应的影响较小,应用更为广泛。
Zhao 等[50]采用TOF MS 技术检测7 种鱼类蛋白的交叉反应性,使用胰蛋白酶消化鱼蛋白质提取液,并基于Bruke FlexAnalysis 和ExPASy蛋白质组学服务器FindMod工具对酶解多肽的峰质量和强度进行检索分析,通过比较实际获得的多肽质量与Swiss-Prot/TrEMBL 计算的理论多肽质量进行峰鉴定。Montowska 等[51]采用nano-LC-TOF MS/MS 方法检测市售禽肉制品中功能性蛋白质添加剂衍生的非肉类蛋白,得到43条大豆蛋白、9条牛奶蛋白以及12条蛋清蛋白的热稳定性特征多肽,其主要致敏蛋白来源包括大豆甘氨酸、牛奶αs1-酪蛋白、β-乳清蛋白、鸡蛋卵转铁蛋白和溶菌酶C。
定量分析对深入分析蛋白质功能性具有重要作用,高效的液相色谱分离系统结合稳定精确的质量分析系统能够实现致敏原组分准确、快速及高通量的定量分析。相对定量检测方法可以通过稳定同位素标记法或无标记法对两个以上样品中致敏蛋白表达量的差异进行比较。稳定同位素标记法包括同位素编码亲和标记(ICAT)、同位素编码蛋白标记(ICPL)、同位素标记相对和绝对定量(iTRAQ)、串联质谱标记(TMT)等(表2)[52-54]。Gavage等[55]采用稳定同位素标记法比较了不同食品基质中鸡蛋(卵清蛋白、卵转铁蛋白和卵黄蛋白-1)、牛奶(αs1-酪蛋白和β-乳球蛋白)、花生(7S 球蛋白和11S 球蛋白)和榛子(11S球蛋白)中的致敏蛋白,实现了对饼干、巧克力和未烘烤的冻干曲奇饼干3种食品基质中8种致敏蛋白的同时高通量检测。

表2 稳定同位素标记检测方法对比Table 2 Comparison of detection methods for stable isotope labeling
相比之下,无标记技术在食品致敏蛋白定量检测中的应用较为广泛,通常采用DDA、DIA 两种采集模式进行数据采集。Xu等[56]基于Q-TOF MS 质谱仪结合DDA 和DIA 采集模式对不同加工方式处理的虾粗蛋白提取液进行检测,评估虾中4种致敏原(原肌球蛋白、精氨酸激酶、肌球蛋白轻链和肌浆钙结合蛋白)胰蛋白酶消化酶解的多肽,并鉴定了一条来自精氨酸激酶的特征多肽(MGLTEFQAVK)。在质谱技术定性定量检测方面,致敏蛋白特征多肽的筛选具有重要意义,此外,特征多肽的筛选可进一步与抗原表位匹配度相结合,以加强特征多肽在免疫学检测方面的应用。
4 总结与展望
质谱技术应用于食品致敏蛋白检测的灵敏度和准确度远远高于传统的免疫学方法和PCR 方法。高分辨质谱技术在分辨率和质量准确度方面得到了进一步的提升,同时还具有全扫描、高通量的特点,因此在复杂食品基质的致敏原检测中尤具优势。但复杂基质食品中致敏蛋白的前处理仍面临着巨大挑战,后续研究需重点聚焦提高样品前处理的效率,针对复杂基质食品和加工食品开发快速提取、纯化富集致敏蛋白的方法;在致敏蛋白检测方面,应重点关注其特征多肽的筛选和确定方法,提高复杂食品基质中致敏蛋白检测的特异性和准确性。

