颈胸段带状疱疹性神经痛患者血清IL-2、NPY及P物质水平与病情程度的相关性
景璟,吴隆延
(上海交通大学医学院苏州九龙医院疼痛科,江苏 苏州 215000)
带状疱疹(herpes zoster,HZ)是由水痘-带状疱疹病毒(varicella-zoster virus,VZV)引起的一种病毒性感染,多数患者在病毒活跃期过后会逐渐得到缓解,另有一部分则演变成持续性或复发性的带状疱疹性神经痛(postherpetic neuralgia,PHN)[1]。PHN的特点是疼痛持续、难忍,严重影响生活质量,颈胸段PHN不仅疼痛难忍,还可能影响患者的颈部活动。PHN的病理机制至今尚未完全明了,目前认为,神经炎症、神经纤维损伤、中枢神经系统的病理变化等都可能与PHN的疼痛发生有关[2]。白细胞介素2(interleukin-2,IL-2)是一种重要的细胞因子,在T细胞的活化和增殖中起到关键作用,研究发现其与神经炎症和神经损伤有关;神经肽Y(neuropeptide Y,NPY)是广泛分布在中枢和外周神经系统中的神经递质,参与疼痛的调节;P物质(substance P,SP)是与疼痛传导有关的神经递质,可在神经末梢释放,增强疼痛感。IL-2、NPY和SP在疼痛中的作用虽已有诸多报道[3],但它们在PHN中的具体作用机制及与疼痛严重程度的关系尚不明确。本研究旨在探讨颈胸段PHN患者血清IL-2、NPY和SP水平与病情严重程度的相关性。
1 资料与方法
1.1 一般资料
选取2020年4月至2023年4月上海交通大学医学院苏州九龙医院收治的105例颈胸段带状疱疹PHN患者、50例HZ未遗留神经痛的患者、50名健康体检者为研究对象,分别纳入PHN组、单纯HZ组、对照组。纳入标准:(1)年龄>18岁;(2)符合HZ诊断诊断标准[4],疱疹在C2~T4颈胸段神经支配区域;(3)PHN组HZ发作3个月仍有持续疼痛;(4)HZ组皮疹愈合后未有持续疼痛;(5)对照组无HZ史或任何类型的神经疾病、神经痛;(6)所有研究对象知情同意且自愿配合相关检查。排除标准:(1)孕期或哺乳期女性;(2)有严重的肝肾功能不全或其他严重的系统疾病;(3)过去3个月内使用过免疫抑制药物、皮质类固醇或其他可能影响研究结果的药物;(4)有全身慢性疼痛性疾病;(5)有血液系统疾病或凝血功能障碍;(6)有精神疾病或其他认知功能障碍,无法理解或不愿意配合研究要求;(7)6个月内有重大手术或创伤史。PHN组中,男性48例,女性57例;年龄(62.50±8.32)岁。单纯HZ组中,男性28例,女性22例;年龄(59.30±7.89)岁。对照组中,男性27例,女性23例;年龄(60.40±9.12)岁。各组研究对象一般资料比较,差异均无统计学意义(P>0.05)。本研究通过医院伦理委员会审核批准。
1.2 方法
1.2.1 病情严重程度评估 采用疼痛视觉模拟评分法(VAS)[5]评估疼痛程度,操作方法:白纸上画一条10 cm的线段,一端标记为“无疼痛”,另一端标记为“最剧烈的疼痛”,患者在线段上标记其当前的疼痛强度,测量标记距离“无疼痛”端的距离作为VAS评分。病情严重程度评估分类标准,轻度:VAS评分1~3分,每天疼痛持续时间不超过2 h,对睡眠和日常生活影响轻微;中度:VAS评分4~6分,每天疼痛时间2~6 h,日常活动受到影响;重度:VAS评分7~10分,每天疼痛时间超过6 h,日常生活和睡眠受到严重限制。
1.2.2 血清IL-2、NPY、SP水平测定 采集受试者清晨空腹肘静脉血5 mL,3 000 r/min离心15 min,分离上清液,存储于-80 °C冰箱中待检。采用酶联免疫吸附法测定血清IL-2、SP水平,采用放射免疫法测定血清NPY水平。
1.3 观察指标
比较PHN组、单纯HZ组、对照组及PHN不同亚组血清IL-2、NPY、SP水平,分析血清IL-2、NPY、SP水平与疼痛程度及IL-2、NPY、SP之间的相关性。
1.4 统计学分析

2 结果
2.1 PHN组、单纯HZ组、对照组血清IL-2、NPY、SP水平比较
各组血清IL-2、NPY、SP水平比较:PHN组>单纯HZ组>对照组(P<0.05)。见表1。
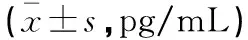
表1 PHN组、单纯HZ组、对照组血清IL-2、NPY、SP水平比较
2.2 PHN不同病情严重程度患者一般资料比较
PHN不同病情严重程度患者性别、年龄、病程、吸烟史、饮酒史比较:差异均无统计学意义(P>0.05)。见表2。
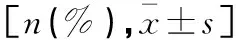
表2 PHN不同病情严重程度一般临床资料比较
2.3 PHN不同病情严重程度患者血清IL-2、NPY、SP水平比较
PHN不同病情严重程度患者血清IL-2、NPY、SP水平比较:PHN重度组>中度组>轻度组(P<0.05)。见表3。
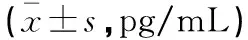
表3 PHN不同病情严重程度血清IL-2、NPY、SP水平比较
2.4 PHN患者血清IL-2、NPY、SP水平与疼痛程度相关性分析
Pearson相关分析显示,PHN患者血清IL-2、NPY、SP水平与疼痛VAS评分均正相关(P<0.05)。见表4。

表4 PHN患者血清IL-2、NPY、SP水平与疼痛程度相关性分析
2.5 PHN患者血清IL-2、NPY、SP水平之间相关性分析
Pearson相关分析显示,血清IL-2与NPY、SP及NPY与SP之间均正相关(P<0.05)。见表5。
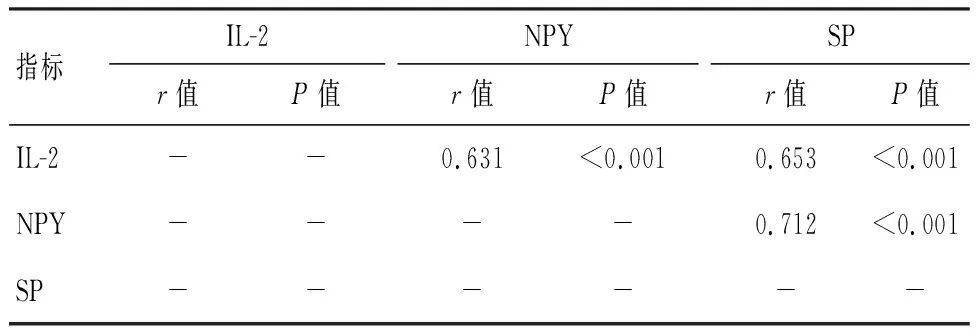
表5 PHN患者血清IL-2、NPY、SP水平之间相关性分析
2.6 PHN患者疼痛程度的独立相关因素分析
将轻度组、中度组、重度组比较差异有统计学意义的指标作为自变量,VAS评分为因变量,进行多元线性回归分析,结果显示IL-2、NPY、SP均可对PHN患者疼痛程度VAS评分产生独立影响(P<0.05)。见表6。

表6 PHN患者疼痛程度的独立相关因素分析
3 讨论
研究[6-7]发现,PHN的发病机制可能与炎症、神经纤维损伤和中枢神经系统改变等因素有关。近年来,细胞因子和神经递质在神经痛中的作用逐渐受到重视[8]。本研究旨在探讨颈胸段PHN患者的血清IL-2、NPY和SP水平与疼痛程度的关系,以期为PHN的病因学研究提供新的思路。
本研究显示,PHN组、单纯HZ组血清IL-2、NPY、SP水平均高于对照组,且PHN组均高于单纯HZ组。IL-2是主要由辅助T细胞产生的细胞因子,在炎症和自身免疫疾病中发挥关键作用,研究[9]显示,IL-2水平的增加可能与神经炎症和神经损伤有关,并可能加重疼痛的感觉。NPY是一种多功能神经递质,与疼痛调节、炎症和血管收缩等生理功能有关,在神经系统中,NPY通常具有抑制性作用,但在炎症和疼痛条件下,其水平增加。SP是一种与疼痛传导和调节有关的神经递质,其在PHN患者中的升高可能与持续的疼痛和炎症反应有关。研究[10]显示,SP可能通过增强炎症、增加神经元兴奋性、影响疼痛的中枢调节等多种机制加重神经痛。
本研究发现,PHN重度组、中度组血清IL-2、NPY、SP水平均高于轻度组,且重度组均高于中度组。进一步的Pearson相关分析显示,PHN患者血清IL-2、NPY、SP水平与疼痛VAS评分均正相关。证实PHN患者血清IL-2、NPY、SP水平与其病情程度密切相关。本研究中PHN患者IL-2水平升高可能有以下意义:一方面,IL-2的增加可反映体内持续炎症状态,炎症反应可导致疼痛信号放大,还可影响神经细胞的活性和稳定性,故IL-2水平升高提示患者PHN患者体内存在持续或慢性的炎症反应[11];另一方面,IL-2参与T细胞的活化和增殖,进而影响免疫反应,PHN患者免疫系统激活,导致神经组织进一步受损,加剧疼痛和不适,这也可在一定程度上解释PHZ组IL-2水平为什么比单纯HZ组更高,持续的免疫活动可能是PHN患者疼痛持续和加剧的重要原因。NPY在炎症和神经性疼痛中的作用也不容忽视。研究[11]发现,HZ患者急性期血清NPY水平升高,且与PHN疼痛持续时间有关,与本研究相吻合。NPY在PHN中的作用可总结为:其一,NPY是中枢神经系统的关键神经调节剂,尤其是在调节疼痛感知方面,NPY水平增加可能反映了中枢对疼痛信号的放大,也即是患者对疼痛更为敏感;其二,NPY是参与炎症反应的关键介质,尤其是在神经细胞损伤和修复中,因此随着PHN病情程度的加重,NPY也成升高趋势。PHN患者体内SP水平的升高也与神经损伤和炎症有关:首先,SP为疼痛传递的关键介质,可与NK1受体结合,导致疼痛信号在神经纤维中放大,中重度PHN患者持续的神经性疼痛与体内SP升高导致的持续性神经纤维活动化和过度兴奋有关[12];其次,SP可刺激免疫细胞释放炎症因子,从而加强炎症反应。故SP水平的异常升高可能与PHN患者体内持续的炎症状态有关。
本研究通过Pearson相关分析,证实了IL-2、NPY、SP之间存在相互关联。IL-2与NPY、SP的正相关性,提示在PHN中可能存在免疫-神经交互机制,IL-2是T细胞活化后的产物,而T细胞在炎症和神经损伤中发挥关键作用,NPY和SP则参与疼痛的传导和调节,可能的机制是IL-2通过促进炎症,增加神经元对NPY和SP的释放,从而增强疼痛传导[13]。此外,NPY与SP之间的正相关性,证实了二者在神经病理机制中的互作关系,尽管二者都涉及疼痛传递,但作用方式可能是互补的,例如SP主要通过增加神经元的兴奋性促进疼痛信号的传递,而NPY则可能通过调节中枢神经系统的反应来增强或维持这种传递[14]。最后,多元线性回归分析显示,IL-2、NPY、SP均与PHN患者的疼痛程度有独立的关系,也即是控制了其他变量的影响后,三者仍与PHN的疼痛程度相关,这意味着PHY患者的疼痛程度并非由一个简单的生物过程决定,而是多个机制共同影响的结果。
综上,颈胸段PHN患者血清IL-2、NPY、SP水平增加,且这些血清标志物水平与病情程度正相关,三者对疼痛程度具有独立影响,即可作为病情评估和早期干预的重要指标。

