托伐普坦在大鼠体内的代谢产物鉴定分析*
徐国佳,蒋欣,夏滨,斯陆勤,黄建耿,李丹,张永军
(1.石河子大学药学院,石河子 832003;2.石河子大学第一附属医院药学部,石河子 832008;3.华中科技大学同济医学院药学院,武汉 430030;4.武汉市第一医院药学部,武汉 430022;5.北京大学深圳医院药学部,深圳 518000;6.石河子大学医学院第三附属医院,石河子 832099)
托伐普坦(tolvaptan,TVP)是由大冢制药株式会社研发的首个新型口服非肽类选择性抗利尿激素V2受体拮抗剂,2009年美国食品药品管理局(Food and Drug Administration,FDA)批准用于高容性和等容性低钠血症的治疗,包括充血性心力衰竭、肝硬化和不适当抗利尿激素综合征等引起的过量水潴留[1,2]。与传统利尿剂不同,托伐普坦通过竞争性阻断精氨酸抗利尿激素与肾脏集合管上的抗利尿激素V2受体结合,抑制水通道蛋白2的激活,从而使V2受体介导的肾脏水重吸收降低,增加游离水的排泄而不损失电解质或肾功能恶化,从而达到降低容量负荷且有效纠正低钠血症[3]。此外,美国、日本等国家除了上述适应证外还被批准用于常染色体显性遗传性多囊肾病(autosomal dominant polycystic kidney disease,ADPKD)的治疗。然而,美国FDA发布托伐普坦在治疗ADPKD患者过程中存在潜在的致命肝损伤的风险[4]。
托伐普坦在体内主要通过肝脏中CYP3A4代谢酶进行生物转化,可降解形成多种结构相似的代谢物,如氧化、羟基化和羧基化等代谢产物。托伐普坦口服后可迅速从肠道吸收,绝对生物利用度约56%,与血浆蛋白结合率高达98%,其清除主要发生在粪便中,仅<1%以原型从肾脏排泄[5]。目前,关于托伐普坦的研究主要集中在托伐普坦在血浆中含量测定方面,例如HOSHIKAWA等[6]和JIANG等[7]采用LC-MS/MS法测定了人血浆中的托伐普坦及2或5种代谢物的含量;FURUKAWA等[8]也通过LC-MS/MS测定了大鼠血清中托伐普坦及其9种I相代谢物的药动学。然而,关于托伐普坦代谢物的定性分析几乎没有报道,仅MAZZARINO等[9]通过构建人肝微粒体与各种代谢酶共孵育模型从体外阐述托伐普坦的I相和II相代谢谱,分离和鉴定出20种托伐普坦代谢物。笔者未检索到体内托伐普坦代谢物谱研究报道,托伐普坦的体内代谢过程亟需进一步研究。
近年来,高分辨质谱由于具有快速、灵敏、专属的特点,可广泛筛查出预期和未预期的微量代谢物,极大地提升了代谢产物鉴定效率,已成为药物化学成分及其体内代谢过程研究的利器[10]。例如,超高效液相色谱-四极杆-静电场轨道阱高分辨质谱(ultra performance liquid chromatograph-quadrupole-exactive orbitrap high-resolution mass spectrometry,UFLC-Q-exactive orbitrap MS)技术,具有高分辨率、高选择性、高准确度和精确的结构表征,即使在没有对照品的情况下,对复杂基质中的微量代谢产物和非目标物的分析和鉴定均有良好效果[11]。因此,本研究作者采用UFLC-Q-Exactive Orbitrap MS技术,系统分析大鼠血浆、尿液和粪便中托伐普坦的代谢产物,探究托伐普坦在大鼠体内的代谢途径,以期为探究托伐普坦的药效物质基础和作用机制奠定基础。
1 材料与方法
1.1材料与仪器 托伐普坦原料药(含量≥99%)由武汉友联述康医药技术有限公司提供;聚维酮K29/32和羟丙甲基纤维素分别购于美国国际特品公司和上海振兴化工有限公司;甲醇和乙腈(色谱级)购于美国Fisher Scientific公司;其他常用分析纯规格试剂购于国药集团化学试剂有限公司。
UFLC超快速液相色谱(日本Shimadzu公司);Q-Exactive Orbitrap质谱仪(美国Thermo Fisher Scientific公司);MDF-U53V低温保存箱(日本SANYO公司);MS105DU 型电子天平(美国Mettler Toledo公司,感量:0.01 mg);SPD1010真空旋转浓缩仪(美国Thermo Fisher Scientific公司)。
1.2方法
1.2.1托伐普坦对照品溶液 精密称取托伐普坦原料药,用甲醇溶解得到1 mg·mL-1托伐普坦储备液后,再用50%甲醇逐级稀释为100 ng·mL-1的对照品溶液,用于UFLC-Q-Exactive Orbitrap分析。
1.2.2托伐普坦固体分散体溶液 以1:2比例精密称取托伐普坦原料药和聚维酮K29/32,用无水乙醇充分溶解,旋转蒸发后得到托伐普坦固体分散体。精密称取托伐普坦固体分散体粉末溶于羟丙甲纤维素溶液(1%)配成6 mg·mL-1托伐普坦固体分散体溶液。
1.2.3动物给药及样本处理 6~8周龄成年Sprague Dawley大鼠,体质量(200±20 g),6只,购于华中科技大学同济医学院动物中心。将大鼠置于代谢笼中,控制温度为(25±2) ℃、光照(12 h光/暗周期)饲养1周,自由饮水,给药前禁食12 h。按60 mg·kg-1灌胃给药托伐普坦固体分散体溶液后,分别收集0、1、3、6 h的血液及0~24 h的尿液和粪便。
粪便自然干燥研磨成粉末,用乙腈超声溶解,然后分别合并各时间点的血液、尿液和均质化后的粪便,加入乙腈(1:5)沉淀蛋白,4 ℃,15 000 r·min-1离心10 min后,取上清液于45 ℃条件下挥干,然后再加入50%甲醇复溶100 μL,离心后上清液用于检测。
1.2.4检测条件 色谱条件:色谱柱为ACQUITY UPLC BEH C18Column(2.1 mm×100 mm,1.7 μm,Waters Co.,Milford,MA,USA);流动相A:水(含0.1% 甲酸),流动相B:乙腈(含0.1%甲酸);柱温:40 ℃;梯度洗脱程序如下:0.01~12.00 min 30%→40% B;12.00~18.00 min 40%→70% B;18.00~18.01 min 70%→95% B;18.01~20.00 min 95% B;20.00~20.01 min 90%→30% B;20.01~22.00 min 30% B;流速:0.3 mL·min-1;进样体积:10 μL。
质谱条件:电喷雾离子源(ESI);正离子扫描模式监测;毛细管温度:320 ℃;电喷雾电压:4 500 V;辅助气流速:10 arb;扫尾气流速:3 arb;鞘气流速:35 arb;碰撞能量:10/15/25 V;扫描范围:m/z50~1 000 Da(全扫)。
1.2.5数据处理 采用Xcalibur 2.0版软件(美国Thermo Fisher Scientific公司)采集和处理质谱数据。根据精确分子质量、元素组成、二级碎片离子、保留时间和可能发生反应信息筛选出潜在代谢物,用Chemdraw 19.0中的Clog P值对异构体进行了表征,Clog P较高的代谢物通常保留时间较长[12]。然后,与之前发表的文献[9]进行比较,分析鉴定出以前未检测到的新代谢物。
2 结果
2.1托伐普坦质谱裂解规律分析 在ESI正离子模式下,托伐普坦的碎片离子和裂解模式信息,如图1所示。托伐普坦保留时间为14.49 min,母离子[M+H]+为m/z449.1621(C26H25ClN2O3),二级质谱碎片中m/z252处有最高响应丰度,这是苯并氮杂环和其余部位之间的酰胺键断裂,导致形成丰度最高的碎片离子m/z252。在更高碰撞能下,m/z119处也检测到对应于甲基苯甲酰胺部位裂解的碎片离子。

图1 托伐普坦的碎片离子和裂解模式信息Fig.1 Fragmentation ion and fragmentation pattern information of tolvaptan
2.2托伐普坦体内代谢物分析 对大鼠给药前后的血浆、尿液和粪便进行正离子模式下分析,结合精确分子质量、保留时间、二级碎片离子、Clog P值等参数,共初步鉴定出35种代谢物,代谢产物提取离子流色谱图见图2,具体质谱信息见表1。
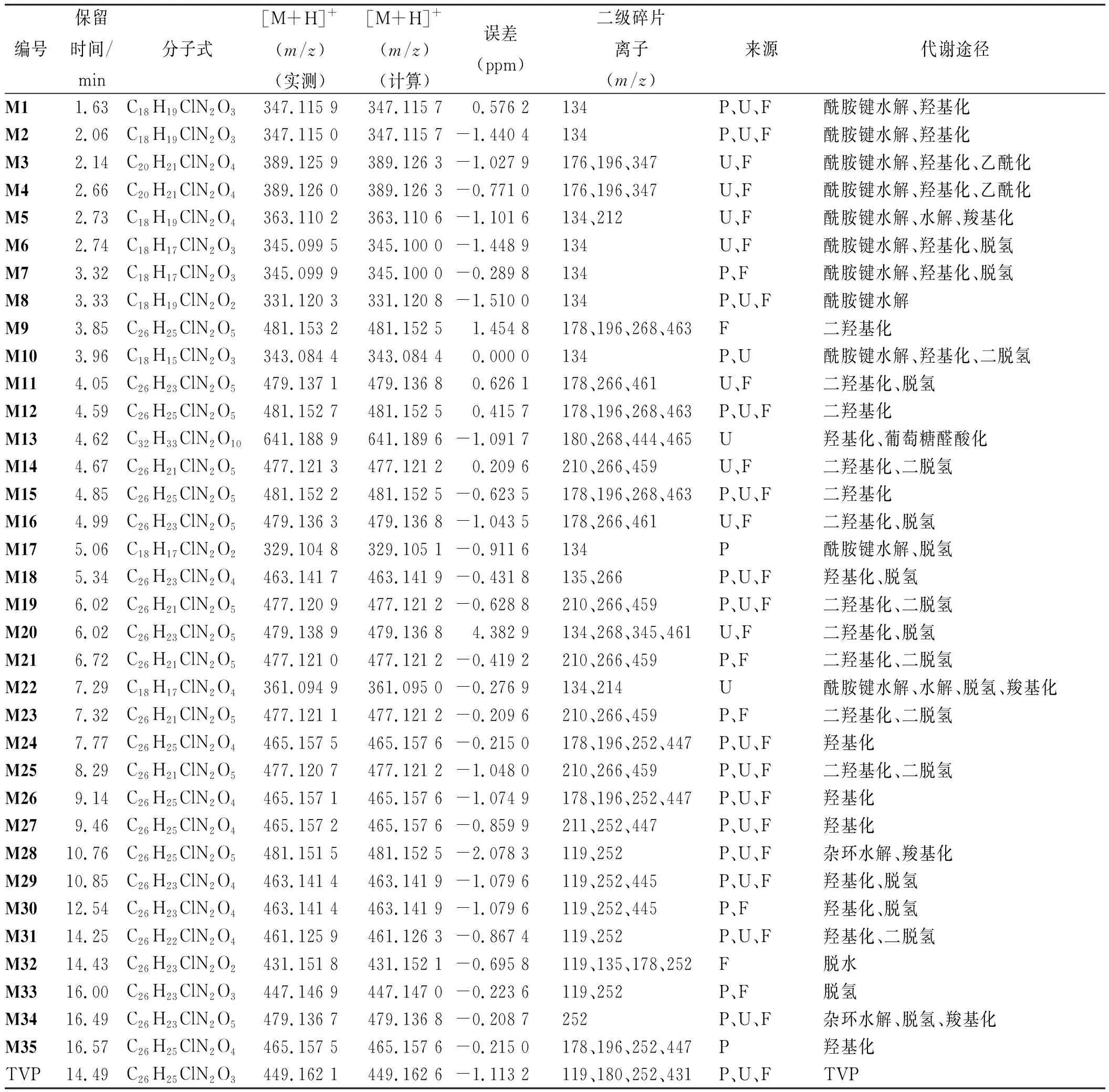
表1 托伐普坦在大鼠血浆、尿液、粪便中的代谢产物Tab.1 Metabolites of tolvaptan in plasma,urine and feces of rat
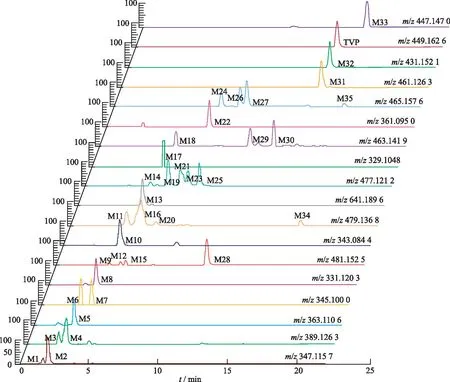
图2 托伐普坦代谢产物提取离子流色谱图Fig.2 Extracted ion chromatograms of tolvaptan metabolites
M1(tR=1.63 min)和M2(tR=2.06 min)准分子离子峰分别为m/z347.115 9和m/z347.115 2,推测其分子式为C18H19ClN2O3。二级质谱碎片中m/z252处没有代表性的碎片离子,而m/z134处有最高响应丰度,可能是由二级碎片m/z252中甲基苯甲酰胺部位水解所得;根据准分子离子峰推测苯并氮杂环还可能发生羟基化,可推测其为托伐普坦的酰胺键水解及羟基化产物。
M3(tR=2.14 min),M4(tR=2.66 min)准分子离子峰分别为m/z389.125 9和m/z389.126 0,推测其分子式为C20H21ClN2O4。比酰胺键水解羟基化代谢物(M1和M2)高出42 Da,在m/z176、196、347处存在碎片离子,m/z176可能是在特征碎片离子m/z134上发生乙酰化,推测两者均为托伐普坦的酰胺键水解羟基化乙酰化代谢物。
M5(tR=2.73 min)准分子离子峰为m/z363.110 2,推测其分子式为C18H19ClN2O4。比托伐普坦酰胺键水解代谢物(M8)高32 Da。m/z134、212处存在碎片离子,表示甲基苯甲酰胺部位的水解和苯并氮杂环上有修饰。32 Da的差异可能是由于两个羟基的存在或苯并氮杂环的水解羧基化所致,由于保留时间和文献中报告的数据,第二种解释似乎更有可能[8,13],推测其为托伐普坦的酰胺键水解及苯并氮杂环水解羧基化代谢物。
M6(tR=2.74 min)和M7(tR=3.32 min)准分子离子峰分别为m/z345.099 5和m/z345.099 9,推测其分子式为C18H17ClN2O3。比酰胺键水解及羟基化代谢物(M1和M2)少2 Da,且在m/z134处存在碎片离子,推测两者均为托伐普坦的酰胺键水解羟基化脱氢代谢物。
M8(tR=3.33 min)准分子离子峰为m/z331.120 3,推测其分子式为C18H19ClN2O2。在m/z134(而不是m/z252)处存在碎片离子,表示甲基苯甲酰胺部位发生水解,推测其为托伐普坦的酰胺键水解代谢物。M9(tR=3.85 min)、M12(tR=4.59 min)、M15(tR=4.85 min)和M28(tR=10.76 min)准分子离子峰分别为m/z481.153 2、m/z481.152 7、m/z481.152 2和m/z481.151 5,推测其分子式为C26H25ClN2O5。比托伐普坦高32 Da,可能发生二羟基化。M9,M12和M15在m/z178、196、268处存在碎片离子信息,表明苯并氮杂环和甲基苯甲酰胺部位都有可能发生羟基化;而M28在m/z119、252处存在碎片离子,表明仅在苯并氮杂环上发生修饰,由于该代谢物的保留时间高于羟基化代谢物,因此推测其可能在苯并氮杂环上发生水解和羧化。
M10(tR=3.96 min)准分子离子峰为m/z343.084 4,推测其分子式为C18H15ClN2O3,比酰胺键水解羟基化脱氢代谢物(M6、M7)低2 Da,推测其为托伐普坦的酰胺键水解羟基化二脱氢代谢物。
M11(tR=4.05 min)、M16(tR=4.99 min)、M20(tR=6.02 min)和M34(tR=16.49 min)准分子离子峰分别为m/z479.137 1,m/z479.1363,m/z479.138 9和m/z479.136 7,推测其分子式为C26H23ClN2O5。M11、M16在m/z178、266、461处有碎片信息,推测在甲基苯甲酰胺部位发生羟基化脱氢且苯并氮杂环上也可能发生羟基化;M20中的碎片离子m/z268可能是在甲基苯甲酰胺部位发生羟基化,而碎片离子m/z345可能是甲基苯甲酰胺部位发生水解后且苯并氮杂环上发生羟基化脱氢,因此推测M20为二羟基化二脱氢代谢物;M34有m/z119、252特征碎片离子,推测仅在苯并氮杂环上发生修饰,可能为羟基取代或发生羧化脱氢,结合保留时间考虑,M34可能是苯并氮杂环水解且发生羧化脱氢代谢物。
M13(tR=4.62 min)准分子离子峰为m/z641.188 9,推测其分子式为C32H33ClN2O10。在m/z180、268、444、465处存在碎片离子,m/z465比母离子少176 Da,推测是母离子丢失一份葡萄糖醛酸基,综合m/z268、444碎片离子信息,可能在m/z252特征结构上发生羟基化和葡萄糖醛酸化。因此,推测其为托伐普坦的羟基化脱氢葡萄糖醛酸化代谢物。
M14(tR=4.67 min)、M19(tR=6.02 min)、M21(tR=8.29 min)、M23(tR=6.72 min)和M25(tR=7.32 min)准分子离子峰分别为m/z477.121 3、m/z477.120 9、m/z477.121 0、m/z477.121 1和m/z477.120 7,推测其分子式为C26H21ClN2O5,这些代谢物在m/z133、210、266处都有碎片信息,表明在甲基苯甲酰胺部位发生羟基化脱氢且苯并氮杂环上也可能发生羟基化脱氢,推测它们为托伐普坦二羟基化二脱氢代谢物。
M17(tR=5.06 min)准分子离子峰为m/z329.104 8,推测其分子式为C18H17ClN2O2,M17比酰胺键水解代谢物(M8)低2 Da,推测其为托伐普坦酰胺键水解及苯并氮杂环上羟基脱氢代谢物。
M18(tR=5.34 min)、M29(tR=10.85 min)和M30(tR=12.54 min)准分子离子峰分别为m/z463.141 7、m/z463.141 4和m/z463.141 4,推测其分子式为C26H23ClN2O4。M18在m/z135、266处有碎片离子,表明仅在甲基苯甲酰胺部位上发生羟基化脱氢;M29和M30在m/z119、252、445处收集到较强信号,表明甲基苯甲酰胺部位上没有发生取代,可能在苯并氮杂环上发生羟基化脱氢。
M22(tR=7.29 min)准分子离子峰为m/z361.094 9,推测其分子式为C18H17ClN2O4,比酰胺键水解裂解苯并氮杂环羧化代谢物(M5)低2 Da,推测其为托伐普坦的酰胺键水解裂解苯丙氮杂环羧化脱氢代谢物。
M24(tR=7.77 min)、M26(tR=9.14 min)、M27(tR=9.46 min)和M35(tR=16.57 min)准分子离子峰分别为m/z465.157 5、m/z465.157 1、m/z465.157 2和m/z465.157 5,推测其分子式为C26H25ClN2O4,比托伐普坦多16 Da,推测这些化合物可能是托伐普坦发生羟基化。M24、M26和M35在m/z178、196、252处存在特征性碎片离子,表明苯并氮杂环上发生羟基化;而M27在m/z211、252、447处存在碎片离子,表明仅在苯并氮杂环上发生修饰,根据文献和保留时间,推测其为托伐普坦苯并氮杂环发生水解及脱氢代谢物。
M31(tR=14.25 min)准分子离子峰为m/z461.125 9,推测其分子式为C26H21ClN2O4,比托伐普坦羟基化代谢物少4 Da,在m/z119、252处存在特征碎片离子,推测其为托伐普坦的苯并氮杂环上发生羟基化二脱氢代谢物。
M32(tR=14.43 min)准分子离子峰为m/z431.151 8,推测其分子式为C26H23ClN2O2,碎片离子m/z119、252为特征碎片离子,m/z178(非m/z180)可能是苯并氮杂环上的羟基脱水,推测其为托伐普坦脱水代谢物。
M33(tR=16.00 min)准分子离子峰为m/z447.146 9,推测其分子式为C26H23ClN2O3,比托伐普坦少2 Da,没有m/z135、268碎片信息,只检测到m/z119、178、252碎片信息,表明仅苯丙氮杂环上的羟基发生了氧化,推测其为托伐普坦羟基氧化代谢物。
2.3托伐普坦的体内代谢途径分析 从大鼠血浆、尿液和粪便中共鉴定出35个代谢物,推测其相关的代谢途径见图3。通过与前期研究结果比对[9],代谢物M1、M2、M5、M8、M17、M22、M24、M26、M27、M28、M33、M34、M35为已发现的代谢产物,另外22种化合物为本研究新发现的托伐普坦代谢物。
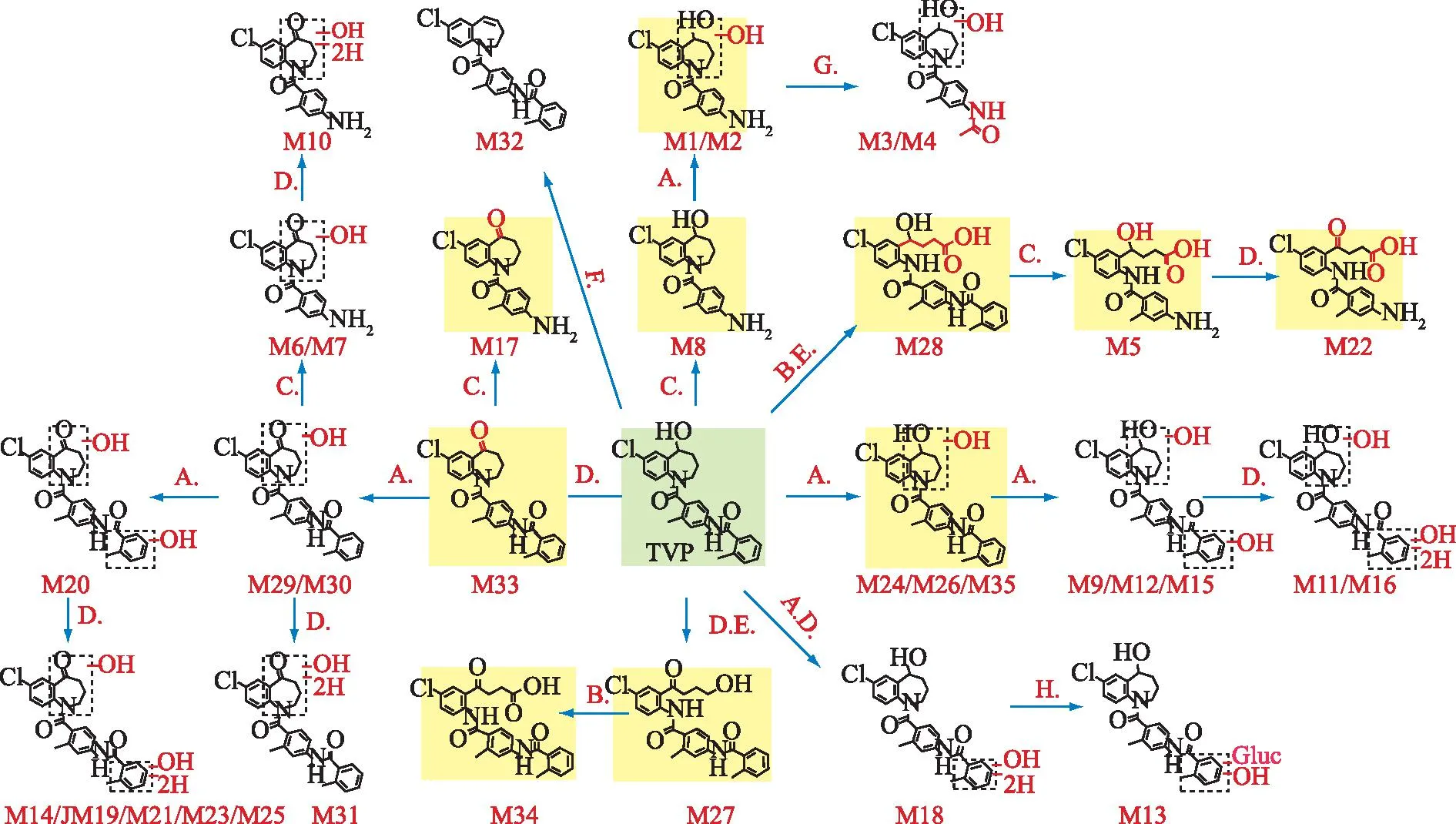
A.羟基化;B.羧基化;C.酰胺键水解;D.脱氢;E.杂环水解;F.脱水;G.乙酰化;H.葡萄糖醛酸化。图3 托伐普坦代谢途径总结 A.hydroxylation;B.carboxylation;C.amide bond hydrolysis;D.dehydrogenation;E.heterocyclic hydrolysis;F.dehydration;G.acetylation;H.glucuronidation.Fig.3 Summary of tolvaptan metabolic pathways
托伐普坦吸收入血后,在血液中检测到23种代谢物,尿液中检测到26种代谢物,粪便中检测到30种代谢物。托伐普坦在血液、尿液和粪便中主要以羟基化、羧基化、水解、脱氢以及上述反应组合的形式存在,而乙酰化结合产物只在尿液和粪便中检测到,葡萄糖醛酸结合产物只在尿液中检测到。
3 讨论
本研究采用UFLC-Q-Exactive Orbitrap HRMS系统联合Xcalibur 2.0版数据分析软件,对托伐普坦在大鼠血浆、尿液和粪便中的代谢产物进行全面鉴定与分析,结合相关文献以及各代谢物的保留时间、精确相对分子质量和特征碎片离子分析,共鉴定出35种代谢物,其中在血浆中检测到23种,尿液中检测到26种、粪便中检测到30种,为托伐普坦的药效物质基础和作用机制研究提供物质基础。
研究表明,托伐普坦在大鼠体内的半衰期为1.6~2.5 h[8]。为了保证在实验过程中收集更多的代谢产物,血浆样品的收集时间点选定为0、1、3、6 h这4个时间点。药物进入体内后,在多种药物代谢酶的生物转化下,化学结构发生改变,由无药理活性转化为有药理活性或毒性代谢物。CYP3A4和CYP3A5代谢酶为托伐普坦的主要代谢酶[9,14]。本研究发现托伐普坦在大鼠体内经过CYP3A4和CYP3A5代谢酶生成包括不同位置的羟基化、羧基化、水解、脱氢以及上述反应组合的I相代谢物,然后通过血液循环运输至各个组织发挥其药理作用。有研究发现单羟基代谢物具有相对较弱的V2受体拮抗活性,可能有助于托伐普坦的利尿作用[15];而代谢物M34是在人血浆中检测到浓度最高的托伐普坦代谢物,它无利尿作用,最近有报道发现代谢物M28和M34通过抑制肝脏转运蛋白和胆汁酸转运蛋白可能导致肝脏疾病[7,16]。本研究发现,托伐普坦的II相代谢产物乙酰化结合产物只在尿液和粪便中检测到,葡萄糖醛酸结合产物只在尿液中检测到,主要可能与乙酰化结合产物和葡萄糖醛酸结合产物的高水溶性相关[17]。此外,由于葡萄糖醛酸结合产物通过胆汁排泄后,容易被肠道菌群水解[18],这也可能是托伐普坦葡萄糖醛酸结合产物只在尿液中检测到的原因之一。
与MAZZARINO等[9]的体外研究相比,本研究从大鼠体内鉴定出22种未报道的代谢物。值得注意的是,虽在体内鉴定出II相代谢物,但托伐普坦在体内的代谢主要以I相不同位置的羟基化、羧基化和开环裂解为主,这可能是托伐普坦生成具有较强水溶性代谢物主要从粪便中消除的一个原因。另外,托伐普坦是一个具有手性季碳中心的外消旋体,它的羟基化代谢物也具有手性。本研究建立了一种简便、选择性高的分析方法可以将同分异构体较好地分开,但对于其确切的结构还需借助手性柱才能确定具体结合位点。在分析鉴定过程中发现托伐普坦具有多组同分异构体代谢产物,母体药物本身结构含有氯元素会产生同位素峰,在分离和鉴定过程中药物代谢物通过高压电离进入真空区域时可能发生离解,产生与药物母体离子相同的源内碎片以及相似的保留时间造成假阳性代谢物[19-20],因此,在分析鉴定过程中要特别注意利用保留时间和特征碎片离子信息来识别假阳性峰。
本实验从体内代谢过程的角度研究了托伐普坦在大鼠体内的代谢情况,对托伐普坦在体内的代谢途径和代谢时的相互转化进行了初步推测,为托伐普坦的药效和毒性物质基础提供了一定的依据,对保障托伐普坦临床使用的安全性和有效性具有重要意义。

