基于网络药理学和分子对接技术探究黄芪-地黄药对治疗糖尿病的作用机制▲
李杜廉 陶晓静 程辉标
[1 柳州市中医医院(柳州市壮医医院)药学部,广西柳州市 545001;2 广西壮族自治区卫生健康委员会办公室,广西南宁市 530021]
糖尿病是由胰岛素分泌缺陷或胰岛素抵抗引起的以高血糖为主要特征的代谢性疾病。流行病学调查显示,中国成人糖尿病标化患病率为10.9%,其中2型糖尿病患者约占90%以上[1-2]。目前,临床上治疗糖尿病主要依靠口服降糖药或注射胰岛素控制血糖,但药物治疗控制率仅为49.2%,仍有部分患者的疗效欠佳,且存在个体化药物治疗难实现、副作用多等问题[3]。中医药注重整体辨治,未病先防,在糖尿病的防治中有着极其重大的临床意义。糖尿病属于中医学“消渴病”范畴,病机为阴虚燥热、气血津液失调,临床表现多以气阴两虚为本、燥热为标,治疗当取补气益阴、清热润燥、生津止渴之法[4-5]。刘鑫等[6]对治疗2型糖尿病的中药方剂进行组方规律分析,发现使用频次较高的药物是黄芪、生地黄、山药、黄连、麦冬等益气健脾、养阴生津、清热泻火类药物,高频药对组合有黄芪-生地黄、黄芪-山药、生地黄-麦冬、黄芪-丹参、生地黄-天花粉等。现代药理学研究表明,黄芪、地黄治疗糖尿病的疗效明确[7-8],但未见有关黄芪-地黄药对联合使用治疗糖尿病的作用靶点及机制的研究报告。基于此,本研究利用网络药理学和分子对接技术,探讨黄芪-地黄药对治疗糖尿病的作用机制,为临床使用含黄芪-地黄药对的组方治疗糖尿病提供理论依据。
1 材料与方法
1.1 黄芪-地黄药对的活性化学成分及其作用靶点的筛选 在中药系统药理学数据库与分析平台(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP;http://tcmspw.com/tcmsp.php)检索黄芪的化学成分,以口服生物利用度≥30%、药物相似性≥0.18作为筛选标准[9],获得黄芪的活性化学成分。在中医药整合药理学研究平台(Integrative Pharmacology-based Research Platform of Traditional Chinese Medicine,TCMIP)v2.0(http://www.tcmip.cn/TCMIP/index.php/Home/Login/login.html)检索地黄的活性化学成分。将黄芪和地黄的活性化学成分分别输入PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)获得对应的简化分子线性输入规范名称后,利用SwissTargetPrediction数据库(http://www.swisstargetprediction.ch/)获得活性化学成分的作用靶点,去除重复的靶点。
1.2 糖尿病相关靶点的筛选与黄芪-地黄药对治疗糖尿病相关靶点的获取 以“diabetes mellitus”为关键词,在GeneCards®数据库(https://www.genecards.org/)和DisGeNET数据库(https://www.disgenet.org/home/)中检索糖尿病相关靶点,汇总并去除两个数据库检索到的重复靶点,得到糖尿病相关靶点。将黄芪-地黄药对活性化学成分的作用靶点与糖尿病相关靶点上传至微生信在线平台(http://www.bioinformatics.com.cn/),取交集后获得交集靶点,即黄芪-地黄药对治疗糖尿病的相关靶点,并绘制韦恩图。
1.3 蛋白-蛋白相互作用网络及药物-成分-靶点-疾病网络的构建 将交集靶点上传到 STRING平台(https://string-db.org/),运用“Multiple Proteins”项,设置物种为“homo sapiens”、蛋白相互作用最低分数为0.4进行筛选,构建蛋白-蛋白相互作用(protein-protein interaction,PPI)网络。将PPI网络数据导入Cytoscape 3.9.0软件,筛选出度值最高的前5个靶点作为核心靶点。将黄芪-地黄药对的活性化学成分和交集靶点上传至Cytoscape 3.9.0软件中,构建药物-成分-靶点-疾病网络,筛选出度值最高的前6个活性化学成分作为黄芪-地黄药对的核心活性化学成分。
1.4 交集靶点的功能富集分析和通路富集分析 采用Metascape软件(https://metascape.org/gp/)对交集靶点进行基因本体论(Gene Ontology,GO)功能富集分析和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集分析,以P<0.05作为筛选条件。进行GO功能富集分析时按照-lgP值由高到低排序,进行KEGG通路富集分析时按照基因比例从高到低排序,选取GO功能富集分析中排名前10的条目和KEGG通路富集分析中排名前20的条目,应用微生信在线平台对结果进行可视化处理。
1.5 分子对接分析 将1.3得出的核心靶点和核心活性化学成分分别作为受体和配体进行分子对接验证。在PDB数据库(https://www.rcsb.org)中下载5个核心靶点的.pdb格式文件,先应用PyMOL软件对靶点蛋白进行去水、去溶剂分子、去配体,再利用AutoDock Tools 1.5.7软件将靶点蛋白加全氢并转换为.pdbqt格式。从PubChem数据库中下载6个核心活性化学成分的3D结构,先使用在线工具Open Babel(http://openbabel.org/wiki/Main_Page)将其转换为.mol2格式,再利用AutoDock Tools 1.5.7软件进行加全氢、设置扭转键操作并导出为.pdbqt格式。根据每个受体蛋白结构的大小不同,选择不同的GridBox,其余选项选择默认参数,采用拉马克遗传算法(Lamarckian GA4.2)将受体蛋白和配体分子进行半柔性对接,获取对接的结合能(结合能为负值时表明配体与受体可以自由结合,绝对值越大代表两组结合的程度越高),最后利用PyMOL 2.6软件制作受体与配体的结合模式图。
2 结 果
2.1 黄芪-地黄药对治疗糖尿病的相关靶点 通过TCMSP和TCMIP数据库分别获得13个黄芪活性化学成分和12个地黄活性化学成分(见表1),经SwissTargetPrediction数据库检索并去重后得到上述25个活性成分的作用靶点共582个。通过GeneCards®和DisGeNET数据库获取糖尿病相关靶点共1 646个。通过微生信在线平台,对黄芪-地黄药对活性化学成分的作用靶点和糖尿病相关靶点取交集并绘制韦恩图,共获得176个黄芪-地黄药对治疗糖尿病的相关靶点,见图1。

表1 黄芪-地黄药对的活性化学成分
2.2 交集靶点的PPI网络 利用STRING平台和Cytoscape 3.9.0软件构建交集靶点的PPI网络(见图2),去除孤立节点后,该PPI网络由1 977条边和175个节点组成。度值排名前5位的靶点分别为丝氨酸/苏氨酸蛋白激酶(serine/threonine protein kinase,AKT)1、肿瘤坏死因子(tumor necrosis factor,TNF)、GAPDH、表皮生长因子受体(epidermal growth factor receptor,EGFR)、原癌基因酪氨酸蛋白激酶(proto-oncogene tyrosine-protein kinase,SRC)。
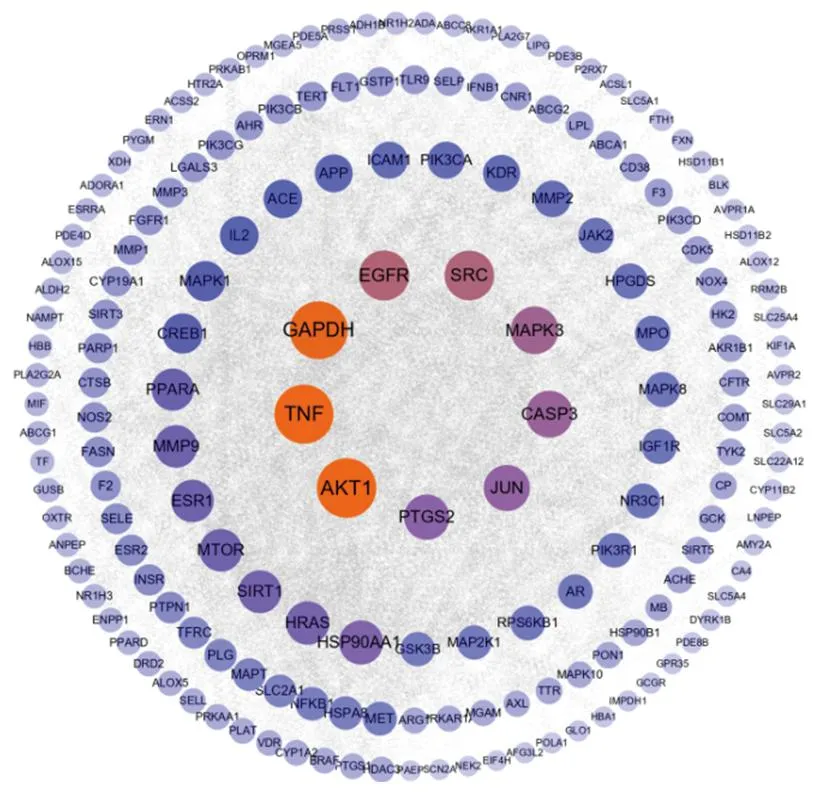
图2 黄芪-地黄药对治疗糖尿病相关靶点的PPI网络
2.3 药物-成分-靶点-疾病网络 通过Cytoscape 3.9.0软件构建药物-成分-靶点-疾病网络(见图3),该网络共有204个节点、963条边。度值排名前6位的核心活性化学成分为异鼠李素、华良姜素、山柰酚、槲皮素、3,9-di-O-美迪紫檀素、京尼平苷。

图3 药物-成分-靶点-疾病网络
2.4 GO功能富集分析和KEGG通路富集分析结果 GO功能富集分析结果显示,交集靶点主要涉及的生物过程包括对激素的反应、对无机物的反应、细胞对含氮化合物的反应等,涉及的细胞组分包括膜筏、膜微区、细胞质的核周区域等,涉及的分子功能包括以醇基为受体的磷酸转移酶活性、蛋白激酶活性、激酶活性等,见图4。
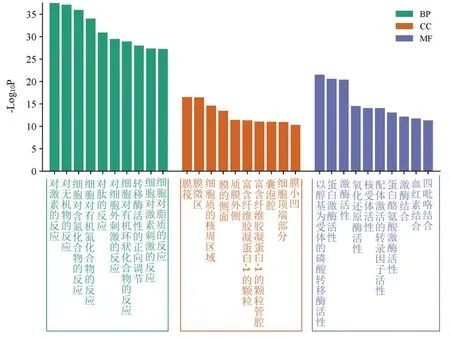
图4 GO功能富集分析结果柱状图
KEGG通路富集分析显示,交集靶点主要涉及癌症通路、脂质和动脉粥样硬化、磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/AKT信号通路、化学致癌-受体活化、胰岛素信号通路、前列腺癌、卡波西肉瘤相关疱疹病毒感染、胰岛素抵抗、乙型肝炎、内分泌抵抗、TNF信号通路、低氧诱导因子1(hypoxia inducible factor 1,HIF-1)信号通路、流体剪切应力与动脉粥样硬化、雌激素信号通路、糖尿病并发症中的晚期糖基化终末产物(advanced glycation end product,AGE)-AGE受体(receptor for AGE,RAGE)信号通路等,见图5。
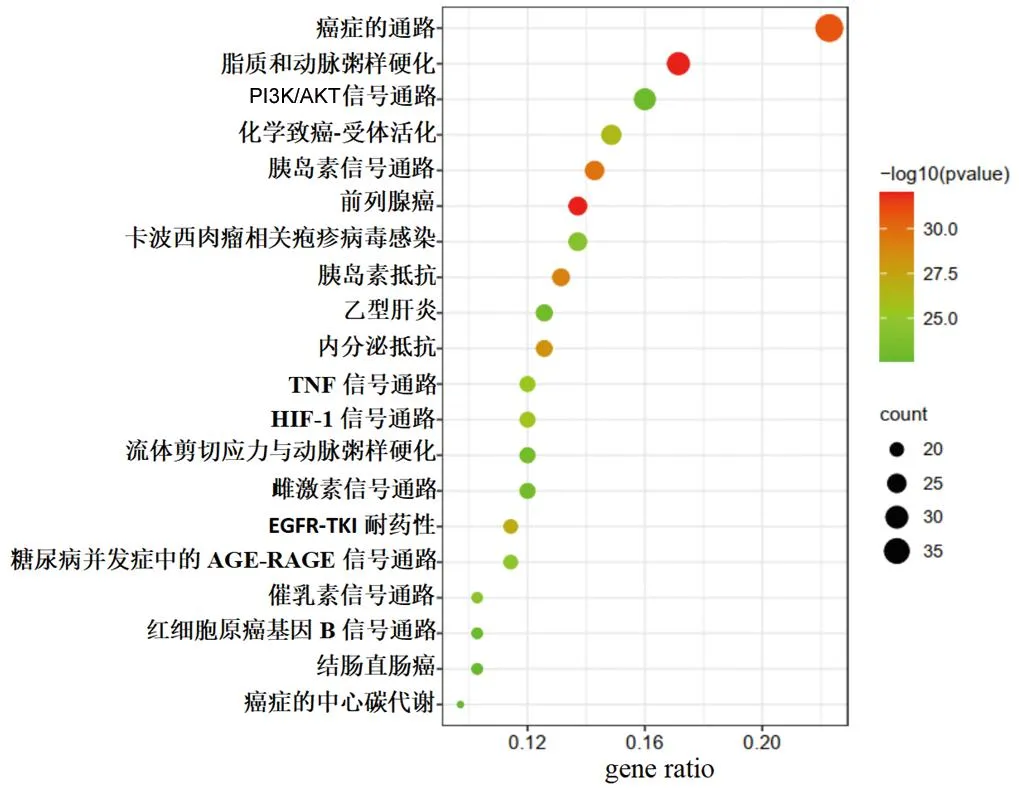
图5 KEGG通路富集分析气泡图
2.5 分子对接分析结果 分子对接分析结果显示,所有核心活性化学成分与核心蛋白的结合能均<-2.0 kcal/mol,见图6,说明配体与受体对接结果良好。将结合能绝对值由高到低进行排序,排名前4的对接组合为3,9-di-O-美迪紫檀素与GAPDH、山柰酚与GAPDH、3,9-di-O-美迪紫檀素与TNF、3,9-di-O-美迪紫檀素与SRC。其中,3,9-di-O-美迪紫檀素可与GAPDH上的ALA-238、ASN-239残基发生相互作用,山柰酚可与GAPDH上的ASN-239、ASN-287、PRO-236、LEU-203、GLN-204残基发生相互作用,3,9-di-O-美迪紫檀素可与TNF上的GLY-148、VAL-150残基发生相互作用,3,9-di-O-美迪紫檀素可与SRC上的MET-341、SER-345、THR-338残基发生相互作用,见图7。
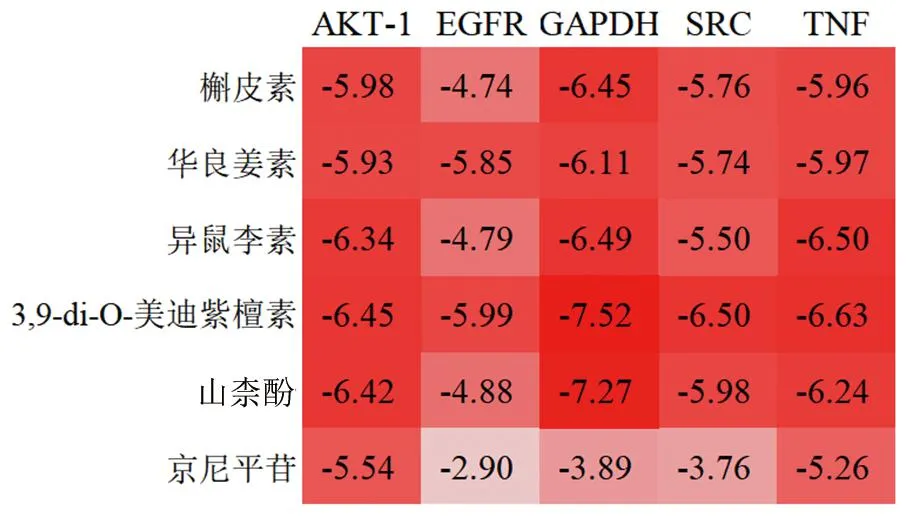
图6 分子对接结合能热图
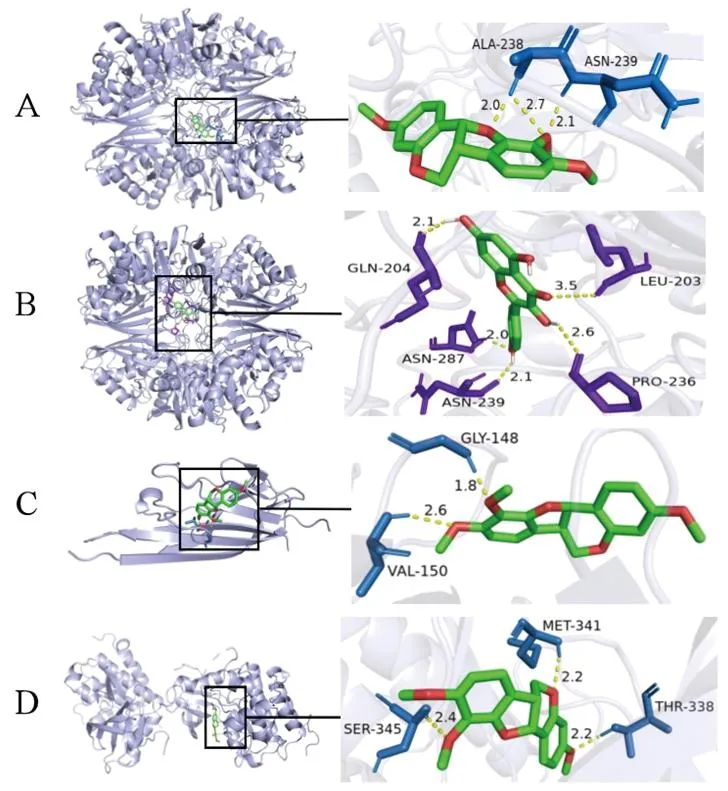
图7 结合能绝对值排名前4的分子对接结果模式图
3 讨 论
本研究结果显示,黄芪-地黄药对治疗糖尿病的核心活性化学成分为3,9-di-O-美迪紫檀素、异鼠李素、山柰酚、槲皮素、京尼平苷、华良姜素。研究显示,黄芪中的活性化学成分3,9-di-O-美迪紫檀素与2型糖尿病肾病密切相关,其可通过作用于3-羟酰辅酶A脱氢酶和乙酰辅酶A乙酰转移酶来影响丁酸和丙酸代谢,从而使2型糖尿病肾病大鼠模型的短链脂肪酸恢复至正常水平,起到调节脂肪组织、骨骼肌和肝组织功能的作用,进而改善葡萄糖稳态和胰岛素敏感性[10]。异鼠李素不仅可通过抑制IκB激酶/核因子κB抑制蛋白/核因子κB/诱导型一氧化氮合酶信号通路,来减轻高糖高脂诱导的胰岛β细胞损伤,还可抑制α-葡萄糖苷酶活性并增加胰岛素抵抗HepG2细胞的葡萄糖消耗量[11-12]。山柰酚与槲皮素结构相似,药理作用相近,可有效降低空腹血糖水平,改善胰岛素抵抗和糖脂代谢紊乱[13-15]。京尼平苷能减轻高糖对胰岛β细胞系INS-1细胞的损伤,抑制INS-1细胞的凋亡,保护胰岛功能,从而起到降糖的作用[16]。研究表明,华良姜素对异常血管新生具有较强的抑制作用,可用于治疗血管新生引发的癌症、糖尿病肾病、糖尿病视网膜病变等疾病[17]。上述研究表明黄芪-地黄药对主要通过上述核心活性化学成分发挥降血糖作用,是该药对治疗糖尿病的主要物质基础。
本研究通过PPI网络得到黄芪-地黄药对治疗糖尿病的5个核心靶点,分别为AKT1、TNF、GAPDH、EGFR和SRC。GO功能富集分析结果表明,黄芪-地黄药对治疗糖尿病的相关靶点涉及膜筏、膜微域、细胞质的核周区域等细胞组分,通过调节以醇基为受体的磷酸转移酶活性、蛋白激酶活性、激酶活性等分子功能,在对激素、无机物及含氮化合物的反应等生物过程中发挥关键作用。KEGG通路富集分析结果显示,黄芪-地黄药对治疗糖尿病的相关靶点涉及多个信号通路,包括PI3K/AKT信号通路、胰岛素信号通路、胰岛素抵抗、糖尿病并发症中的AGE-RAGE信号通路、HIF-1信号通路、TNF信号通路等。研究显示,胰岛素发挥降血糖作用主要是通过与胰岛素受体底物(insulin receptor substrate,IRS)结合,引起下游信号通路级联反应,即激活PI3K和AKT1,将信号传导至葡萄糖转运蛋白成员4(glucose transporter member 4,GLUT4)以开启葡萄糖转运,因此IRS-1/PI3K/AKT/GLUT4信号通路是胰岛素信号传导通路中的“主干道”,PI3K/AKT信号通路及下游靶蛋白功能障碍均会引起糖脂代谢异常,导致胰岛素抵抗,在胰岛素抵抗的发生、发展中发挥重要作用[18]。EGFR能够与胰岛素受体形成嵌合体,从而激活胰岛素抵抗相关的下游信号通路如PI3K/AKT信号通路、丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)信号通路,参与血糖的调节[19]。AGE与其主要的细胞受体RAGE结合后,可激活核因子κB、经典MAPK、非受体酪氨酸激酶/信号转导和转录激活因子、转化生长因子β等信号通路,调节各种转录因子和细胞因子的表达,参与炎症、氧化应激与β细胞损伤过程,进而影响糖尿病及其并发症的进程[20]。HIF-1信号通路是影响代谢性疾病的关键信号通路,该通路信号传导失调会导致胰岛、视网膜、肾脏、脂肪和皮肤等组织对低氧的适应性反应出现障碍,进一步促进糖尿病及其并发症的发生和发展[21]。此外,炎症因子如TNF-α、白细胞介素6等可增强胰高血糖素、肾上腺皮质激素等的升糖作用,并促进脂解过程,抑制IRS-1 的酪氨酸磷酸化,使IRS-1/PI3K/AKT信号通路受阻,GLUT4表达水平及活性降低,脂肪组织摄取葡萄糖障碍,机体氧化供能受损,导致胰岛素抵抗的发生与发展[22]。综上,黄芪-地黄的活性化学成分主要通过作用于AKT1、TNF、GAPDH、EGFR和SRC等核心靶点,调控PI3K/AKT信号通路、胰岛素信号通路、胰岛素抵抗糖尿病并发症中的AGE-RAGE信号通路、HIF-1信号通路、TNF信号通路等,影响葡萄糖代谢、糖酵解、脂质代谢和炎症等相关病理生理过程,进而起到治疗糖尿病的作用。
GAPDH为糖酵解过程中的关键酶,催化甘油醛-3-磷酸生成甘油酸酯1,3-二磷酸。2007年,Min等[23]首次报告了GAPDH激活磷酸酶的活性,发现其通过拮抗磷酸酰肌醇-3,4,5-三羟甲基氨基甲烷磷酸盐和磷酸酰肌醇-4,5-二羟甲基氨基甲烷磷酸盐,进而调节胰岛素信号通路,且其与视网膜病变、血管内皮组织损伤等糖尿病并发症的发生密切相关。这一发现为糖尿病的防治提供了新的药理靶点。有研究表明,GAPDH与糖尿病、年龄相关性神经退行性疾病、肿瘤的发生、发展关系密切,其中60%的2型糖尿病患者的GAPDH发生可逆性抑制[24-25]。GAPDH的表达过程不存在剪接及同工酶翻译,而是通过一系列翻译后修饰机制参与正常细胞的相关活动和疾病的发生[24]。在高血糖状态下,视网膜微血管细胞中GAPDH的共价修饰受到抑制,从而激活与糖尿病视网膜病变发病相关的多条通路,如AGE信号通路、蛋白激酶C信号通路、己糖胺信号通路和多元醇信号通路等,促进葡萄糖诱导的视网膜毛细血管细胞凋亡[26]。美迪紫檀素及其衍生物潜在的药理作用涉及抗肿瘤、抗炎、促骨骼生长、抗抑郁、促肌细胞增殖、保护神经元等方面[27]。其中,3,9-di-O-美迪紫檀素可通过改善葡萄糖稳态和胰岛素敏感性,治疗2型糖尿病肾病[10]。本研究分子对接结果显示,与核心靶点配对的活性化学成分中,3,9-di-O-美迪紫檀素与GAPDH的结合能最高,提示其为GAPDH的最优构象。综上,3,9-di-O-美迪紫檀素可能通过调节GAPDH翻译后修饰,影响糖尿病的发生、发展进程,但相关机制仍有待进一步探究。
综上所述,黄芪-地黄药对治疗糖尿病的机制具有多成分、多靶点和多通路的特点,其活性化学成分3,9-di-O-美迪紫檀素、异鼠李素、山柰酚、槲皮素、华良姜素、京尼平苷等可能通过作用于AKT1、TNF、GAPDH、EGFR和SRC等靶点,调控PI3K/AKT信号通路、胰岛素信号通路、胰岛素抵抗、AGE-RAGE信号通路、HIF-1信号通路、TNF信号通路等,从而发挥治疗糖尿病的作用。

