益肺宣肺降浊方对星形胶质细胞-神经元氧糖剥夺损伤的缓解作用及其可能机制▲
朱健敏 陈 炜 胡跃强 蒋凌飞 吴 林
(1 广西中医药大学研究生院,广西南宁市 530001; 2 江西中医药大学研究生院,江西省南昌市 330004; 3 广西中医药大学第一附属医院脑病科,广西南宁市 530023; 4 广西中医药大学科学实验中心,广西南宁市 530001)
血管性痴呆被认为是仅次于阿尔茨海默病的痴呆类型,占所有痴呆的15%~30%,其以认知障碍为特征。血管性痴呆目前还没有具体的治疗方法,该类患者的健康已经成为一个不容忽视的社会问题[1]。随着我国人口老龄化的日益加剧,血管性痴呆的患病率呈逐年增加趋势,且随着病情的进展,血管性痴呆患者的自理能力逐渐下降,这增加了患者家庭和社会的负担[2]。目前血管性痴呆的病理机制尚未完全清楚。慢性脑缺血导致的线粒体功能障碍引发大量活性氧簇在神经细胞中聚积,最终可导致神经元凋亡[3]。此外,脑缺血会导致多种病理反应,包括血脑屏障破坏、细胞凋亡、白质脱髓鞘和神经炎症[4-5]。已有研究表明,在神经退行性疾病的发展过程中,慢性脑血流灌注不足与认知能力下降及海马神经元损伤相关[6]。因此,长期慢性脑血流灌注不足或反复脑缺血再灌注被认为是血管性痴呆发生的主要原因之一[7]。
星形胶质细胞、小胶质细胞、神经元是中枢神经系统中主要的驻留细胞群[8]。其中,星形胶质细胞是突触传递和可塑性的主要调节细胞,其在维持正常大脑功能中发挥极其重要的作用。星形胶质细胞可与神经元建立双向通信,从而对突触释放的神经递质做出反应,进而释放影响神经元和突触活动的胶质递质。神经元损伤为进展性认知能力下降的潜在原因,而星形胶质细胞损伤与较差的认知功能亦有一定的相关性[9]。研究表明,慢性脑血流灌注不足小鼠模型中小胶质细胞和星形胶质细胞被激活并释放肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、白细胞介素(interleukin,IL)-1β和IL-6等炎症因子,参与大脑的神经免疫反应,而过度的免疫反应又可以促进神经元的凋亡和自噬[10]。由此推测,靶向干预受损的神经胶质细胞可发挥神经元保护作用,从而减轻缺血性脑疾病的炎症反应,促进脑组织的修复。
血管性痴呆属于中医学“健忘”“呆病”等范畴,病位在脑,临床多从肝肾论治。益肺宣肺降浊方为传统中药处方,具有调养五脏,补肾填精,祛瘀、化痰的功效。本课题组前期的临床研究表明,益肺宣肺降浊胶囊可改善血管性痴呆患者的神经递质水平,提高患者的行为和认知能力[11]。此外,有动物研究显示,益肺宣肺降浊方可能通过上调脑组织海马钙调素依赖蛋白激酶Ⅱ、突触蛋白的表达,减轻海马损伤和神经元凋亡,从而改善学习和记忆功能,达到治疗血管性痴呆的目的[12-13]。氧糖剥夺(oxygen glucose deprivation,OGD)模型是目前较为公认的研究脑血流灌注不足的细胞模型,能较好地模拟体内细胞缺血的环境[14]。在中枢神经系统中,烟碱型乙酰胆碱受体(nicotinic acetylcholine receptor,nAChR)由多个亚基构成,其中α7-nAChR是最重要的亚基之一,其在哺乳动物脑内分布最为广泛,与认知功能及记忆功能密切相关[15-16]。本研究通过体外星形胶质细胞-神经元共培养以建立星形胶质细胞-神经元OGD模型,基于胆碱能系统、α7-nAChR及炎症因子等分析益肺宣肺降浊方含药血清对该模型的干预作用,从而探讨益肺宣肺降浊方抗血管性痴呆的作用机制,为该方的临床应用与推广提供理论支持。
1 材料与方法
1.1 实验动物 约8周龄无特定病原体级雄性SD大鼠30只[体重(280±20)g]及新生24 h内的SD大鼠12只(雄雌不限),由广西壮族自治区食品药品检验所实验动物中心提供(动物许可证号:SYXK桂2019-0001)。将SD大鼠正常饲养于广西中医药大学动物实验中心无特定病原体级动物房,光照周期为12 h,明暗比为1 ∶1,饲养温度为(22±2)℃,相对湿度为(50±10)%,自由饮食。本实验已通过广西中医药大学动物伦理委员会的审查(审查号:DW20190213-007)。
1.2 药物及试剂 益肺宣肺降浊方(中药免煎颗粒)由广西中医药大学第一附属医院提供,组方包括黄芪15 g、人参15 g、麦冬15 g、桔梗10 g、苦杏仁10 g、三七15 g、苏子15 g、石菖蒲15 g、大黄6 g。α7-nAChR抗体购自Invitrogen公司(批号:PA5-115651),微管关联蛋白2(microtubule associated protein 2,MAP2)抗体购自Santa Cruz Biotechnology,Inc.(批号:sc-74421),胆碱乙酰转移酶(choline acetyltransferase,ChAT)抗体、兔抗胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)抗体、GAPDH抗体、山羊抗兔IgG H&L(Cy5®)荧光二抗及山羊抗小鼠 IgG H&L(Alexa Fluor®488)荧光二抗购自成都正能生物生物技术有限责任公司(货号分别为R23923、381012、301341、550083、550036);活性氧簇检测试剂盒、Triton X-100、RIPA细胞裂解液购自上海碧云天生物技术有限公司(货号分别为S0033S、P0096-500ml、P0013B),ChAT活性测定试剂盒购自南京建成生物工程研究所(货号:A079-1-1); IL-1β、TNF-α和IL-6 ELISA试剂盒购自上海江莱生物科技有限公司(货号分别为JL20884、JL13202、JL20896),高糖DMEM及无糖DMEM均购自Thermo Fisher Scientific公司(货号分别为11965126、11966025),NeurobasalTM-A培养基、B27、1%牛血清白蛋白、GlutaMaxTM均购自Gibco公司(货号分别为10888022、A3582801、10091-148、35050061),阿糖胞苷购自上海阿拉丁生化科技股份有限公司(货号:C111218-5g),山莨菪碱购自MedChemExpress公司(货号:HY-N0584);RNA抽提试剂盒、反转录试剂盒及Real Time PCR试剂盒购自TaKaRa公司(货号分别为9109、RR036A、RR820A),二喹啉甲酸蛋白浓度测定试剂盒、乳酸脱氢酶(lactate dehydrogenase,LDH)细胞毒性检测试剂盒购自上海碧云天生物技术有限公司(货号分别为P0012、C0016)。
1.3 主要仪器设备 细胞培养箱购自SANYO Trading CO.,LTD.(型号:MCO-15AC),荧光显微镜光镜购自OLYMPUS公司(型号:BX43);超声波细胞破碎仪购自Sonics &Materials,Inc.(型号:VCX750),Transwell-膜嵌套购自CORNING公司(型号:3412)。
1.4 实验方法
1.4.1 益肺宣肺降浊方含药血清的制备:根据随机数字表法将适应性喂养1周后的SD雄性大鼠分为对照组10只和益肺宣肺降浊方组20只,分别给予纯净水和益肺宣肺降浊方(经双蒸水溶解,给药剂量为3.045 g/100 g)灌胃,0.87 mL/100 g,早晚各1次,连续灌胃7 d。末次灌胃后2 h,经腹部皮下注射10%水合氯醛(3.75 mL/kg )麻醉大鼠,在腹主动脉采血至大鼠死亡。将血标本常温静置0.5 h,在4 ℃条件下以3 000 r/min离心10 min,取上清液,置于56 ℃水浴30 min,然后用0.22 μm过滤器过滤除菌。分别将对照血清和益肺宣肺降浊方含药血清分装至2 mL冻存管,于-80 ℃冰箱保存备用。
1.4.2 细胞分离培养:(1)神经元。取12只新生SD大鼠,按照相关文献[17]的方法分离海马组织的神经元。使用75%乙醇全身消毒新生SD大鼠后,断头处死,于冰上取全脑组织,分离顶部皮层组织后取部分海马组织置于预冷的PBS中,加入0.125%的胰蛋白酶在37 ℃下消化30 min后,过细胞筛(200目),收集细胞液,在4 ℃下以1 000 r/min离心5 min后收集细胞,用高糖完全DMEM(高糖DMEM+10%胎牛血清+1%青链霉素)重悬,计数后以1×107个/皿的细胞密度接种于培养皿,放置于5% CO2、37 ℃培养箱中培养,3 d后用5 μmol/L阿糖胞苷进行处理,24 h后更换为神经元培养基(96% NeurobasalTM培养基+2% B27+1% GlutaMaxTM+1%青链霉素)继续培养,10 d后在倒置显微镜下观察细胞的生长形态,并通过检测神经元标志物MAP2的表达情况鉴定为神经元后用于后续实验。(2)星形胶质细胞。参考相关文献[18-19]的方法分离海马组织的星形胶质细胞。取上述新生SD大鼠的其余海马组织,加入0.25%的胰酶在37 ℃下消化10 min后,在4 ℃条件下以1 000 r/min离心5 min,除去上清液,收集下层细胞,用高糖完全DMEM重悬,计数后以1×107个/皿的细胞密度接种于培养皿,放置于5% CO2、37 ℃培养箱中培养,1 h后取细胞悬液置于新的培养皿中继续培养,7 d后置于摇床(37 ℃ ,250 r/min),18 h后换成新鲜高糖完全DMEM清洗后消化传代,取培养总时间足10 d的细胞,通过检测星形胶质细胞标志物GFAP的表达情况鉴定为星形胶质细胞后用于后续实验。
1.4.3 神经元与星形胶质细胞共培养及OGD损伤模型的构建方法:将分离的神经元以1×107个/孔的细胞密度接种于24孔板,加入神经元培养基培养10 d后,在Transwell小室的上室中接种0.1 mL星形胶质细胞(接种密度为4×104个/mL) ,与下室神经元细胞共培养12 h。然后,参考相关文献[20]进行OGD(无糖DMEM、2%氧气)培养,4 h后将下室更换为神经元培养基,上室更换为高糖DMEM,在5% CO2、37 ℃下继续培养24 h。
1.4.4 实验分组及处理:将细胞分为4组进行干预。(1)对照组:将下室原代海马神经元和上室星形胶质细胞分别置于神经元培养基和高糖DMEM中常规(5% CO2、37 ℃)培养24 h。(2)OGD组:将原代海马神经元和星形胶质细胞按照1.4.3的方法处理后,将上室的培养基换为含5%对照血清的高糖DMEM。(3)OGD+YFXF组:将原代海马神经元和星形胶质细胞按照1.4.3的方法处理后,将上室的培养基换为含5%益肺宣肺降浊方含药血清的高糖DMEM。(4)OGD+YFXF+山莨菪碱组:将原代海马神经元和星形胶质细胞按照1.4.3的方法处理后,将上室的培养基换为含5%益肺宣肺降浊方含药血清及含100 μg/mL山莨菪碱的高糖DMEM。各组均干预24 h。
1.4.5 神经元标志物MAP2和星形胶质细胞标志物GFAP的检测:收集各组神经元及星形胶质细胞,经4.0%多聚甲醛溶液固定30 min后, 使用PBS清洗3次。使用Triton X-100破膜后用PBS清洗3次。使用1%牛血清白蛋白室温封闭1 h后,将MAP2抗体(1 ∶50)或GFAP(1 ∶50)加入湿盒中4 ℃摇床过夜。使用PBS清洗3次后,加入山羊抗小鼠IgG H&L(Alexa Fluor® 488)荧光二抗或山羊抗兔IgG H&L(Cy5®)荧光二抗室温避光孵育 1 h,DAPI染色液复染细胞核后,使用PBS清洗。荧光显微镜下观察拍照。MAP2蛋白呈绿色荧光,GFAP蛋白呈红色荧光,细胞核呈蓝色荧光。
1.4.6 活性氧簇含量的检测:收集各组星形胶质细胞,按照检测试剂盒使用说明书的步骤进行操作,检测各组活性氧簇的相对含量。设置3个复孔,实验重复3次。
1.4.7 LDH水平的检测:收集各组上室培养液上清液,以3 500 r/min离心10 min,保留上清液,根据LDH细胞毒性检测试剂盒说明书检测LDH水平。每组设置3个复孔,实验重复3次。
1.4.8 ChAT活性的检测:收集各组星形胶质细胞,用超声破碎后在4 ℃条件下以10 000 r/min离心30 min后取上清液,根据检测试剂盒说明书的步骤进行操作,检测各组ChAT活性。每组设置3个复孔,实验重复3次。
1.4.9 IL-1β、TNF-α和IL-6 水平的检测:收集各组上室培养液上清液,根据ELISA试剂盒说明书进行操作,检测各组IL-1β、TNF-α和IL-6水平。每组设置3个复孔,实验重复3次。
1.4.10 α7-nAChR和ChAT mRNA表达量的检测:收集各组星形胶质细胞,使用TRIzol试剂提取总RNA后,使用反转录试剂将其反转录为cDNA。配置20 μL反应体系,包括SYBR Green Mix 10 μL、上游引物0.5 μL、下游引物0.5 μL、cDNA溶液1 μL、焦碳酸二乙酯dH2O 8 μL。内参GAPDH上游引物序列为5′-GCATCTTCTTGTGCAGTGCC-3′,下游引物序列为5′-GATGGTGATGGGTTTCCCGT-3′;α7-nAChR上游引物序列为5′-TCTGCTCTGGACAGCCCTAT-3′,下游引物序列为5′-TAGCAAAGGCAGACAGCGAA-3′;ChAT上游引物序列为5′-CCTGGAAAAGGCTCCCCAAA-3′,下游引物序列为5′-CCCAAACCGCTTCACAATGG-3′。然后进行实时荧光定量PCR(两步法)检测,反应条件为95 ℃ 3 min,95 ℃ 3 s、60 ℃ 3 s(40个循环)。绘制溶解曲线,以2-△△Ct法进行相对定量分析。
1.4.11 α7-nAChR和ChAT 蛋白表达量的检测:收集各组星形胶质细胞,加入5 μL的RIPA裂解液裂解细胞,将裂解产物转移至新的1.5 mL EP管中,在4 ℃条件下以11 000 r/min离心20 min后将上清液转移至新的EP管中,使用二喹啉甲酸蛋白浓度测定试剂盒进行蛋白浓度测定。加入15 μL的上样缓冲液,100 ℃变性10 min。待冷却后将蛋白加样至上样孔进行SDS-PAGE,然后将蛋白转至PVDF膜。5%脱脂奶粉室温封闭1 h,分别加入α7-nAChR抗体(1 ∶1 000)、ChAT抗体(1 ∶500)及内参GAPDH抗体(1 ∶5 000)4 ℃孵育过夜后,置于脱色摇床上加入TBST 清洗10 min,重复3次;加入山羊抗兔IgG H&L(Cy5®)荧光二抗(1 ∶5 000)室温下孵育1 h,使用TBST清洗3次后用ECL显色,曝光成像,使用ImageJ软件分析蛋白条带的灰度值。
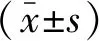
2 结 果
2.1 4组星形胶质细胞活性氧簇含量和上清液LDH水平的比较 与对照组相比,OGD组的星形胶质细胞活性氧簇含量和上清液LDH水平增加(P<0.05);与OGD组相比,OGD+YFXF组的星形胶质细胞活性氧簇含量和上清液LDH水平降低(P<0.05);与OGD+YFXF组相比,OGD+YFXF+山莨菪碱组的星形胶质细胞活性氧簇含量和上清液LDH水平增加(P<0.05),见表1。
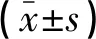
表1 4组星形胶质细胞活性氧簇含量和上清液LDH水平的比较
2.2 4组星形胶质细胞及神经元标志物表达情况的比较 与对照组相比,OGD组星形胶质细胞标志物GFAP的荧光强度减弱,神经元胞体皱缩、突起和分叉减少,出现打结现象,且标志物MAP2的荧光强度明显减弱;与OGD组相比,OGD+YFXF组星形胶质细胞标志物GFAP的荧光强度增强,神经元的突起、分叉增加,且标志物MAP2的荧光强度增强,但与对照组相比仍有一定的形态差异;与OGD+YFXF组相比,OGD+YFXF+山莨菪碱组星形胶质细胞标志物GFAP的荧光强度减弱,神经元细胞突起和分叉减少,且标志物MAP2的荧光强度减弱,见图1。
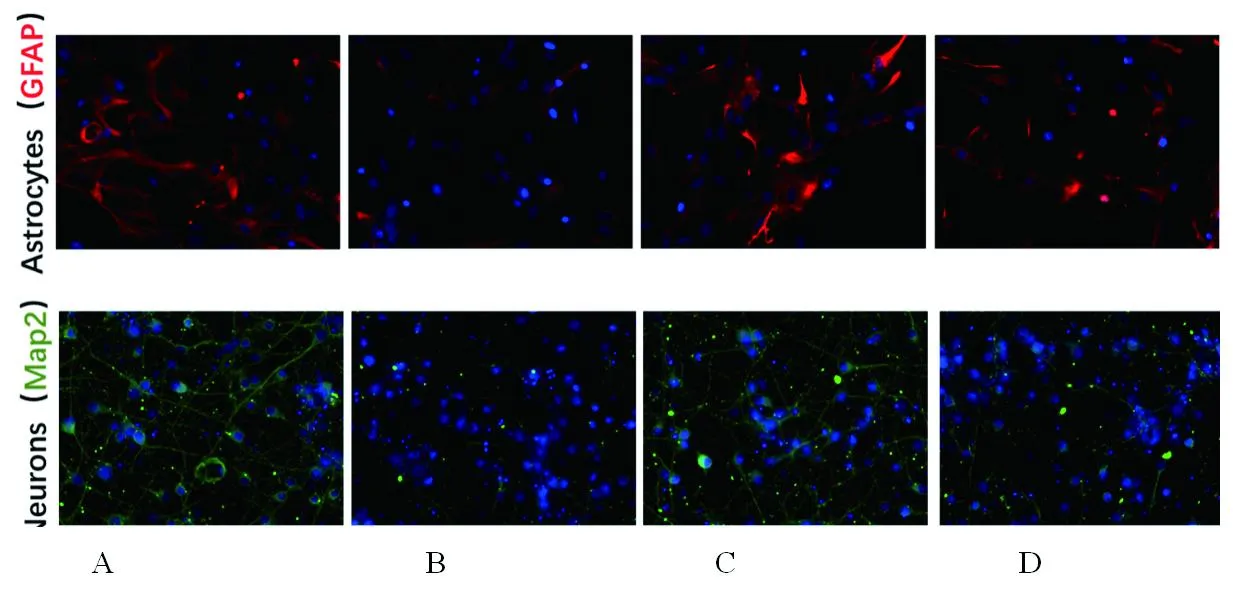
图1 4组星形胶质细胞及神经元标志物表达情况(免疫荧光染色,×400)
2.3 4组星形胶质细胞ChAT活性及上清液IL-1β、TNF-α和IL-6水平的比较 与对照组相比,OGD组上清液IL-1β、TNF-α和IL-6含量增加,星形胶质细胞ChAT活性降低(P<0.05);与OGD组相比,OGD+YFXF组星形胶质细胞上清液IL-1β、TNF-α和IL-6水平减少,星形胶质细胞ChAT活性增加(P<0.05);与OGD+YFXF组相比,OGD+YFXF+山莨菪组上清液TNF-α水平增加(P<0.05),上清液IL-1β和IL-6水平亦有所增加,且星形胶质细胞ChAT活性有所降低,但差异无统计学意义(P>0.05),见表2。
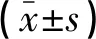
表2 4组星形胶质细胞ChAT活性及上清液IL-1β、TNF-α、IL-6水平的比较
2.4 4组星形胶质细胞α7-nAChR、ChAT的mRNA和蛋白表达量比较 与对照组相比,OGD组星形胶质细胞的α7-nAChR、ChAT的mRNA和蛋白表达量降低(P<0.05);与OGD组相比,OGD+YFXF组星形胶质细胞的α7-nAChR、ChAT的mRNA和蛋白表达量增加(P<0.05);与OGD+YFXF组相比,OGD+YFXF+山莨菪碱组星形胶质细胞的α7-nAChR的mRNA和蛋白表达量降低(P<0.05),ChAT的mRNA和蛋白表达量有所降低,但差异无统计学意义(P>0.05),见表3、表4、图2。
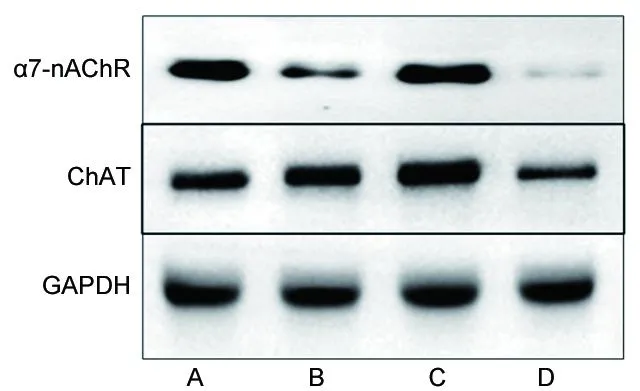
图2 4组星形胶质细胞α7-nAChR、ChAT的蛋白表达情况
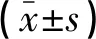
表3 4组星形胶质细胞α7-nAChR、ChAT mRNA相对表达量的比较
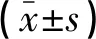
表4 4组星形胶质细胞α7-nAChR、ChAT蛋白相对表达量的比较
3 讨 论
脑缺血再灌注损伤与血管性痴呆密切相关,而认知功能障碍为血管性痴呆的主要症状之一[21]。本课题组前期的临床和动物实验研究表明,益肺宣肺降浊方具有改善血管性痴呆患者和血管性痴呆大鼠认知功能的作用[22- 23]。但是益肺宣肺降浊方的具体作用机制尚未明确。本研究建立海马星形胶质细胞-神经元OGD损伤模型,以探讨益肺宣肺降浊方治疗血管性痴呆的作用机制。本研究结果显示,经OGD处理后,OGD组星形胶质细胞活力降低(标志物GFAP荧光强度减弱),神经元形态异常(胞体皱缩、突起和分叉减少,出现打结现象)且活性降低(标志物MAP2荧光强度明显减弱);OGD组星形胶质细胞的活性氧簇含量及LDH释放水平升高(P<0.05),与吴明锋等[24]报告的结果相似。上述结果表明星形胶质细胞-神经元OGD损伤模型构建成功。而OGD+YFXF组星形胶质细胞活力增强,神经元的突起和分叉增加、活力增强,且星形胶质细胞的活性氧簇含量及LDH释放量低于OGD组(P<0.05),说明益肺宣肺降浊方可减轻星形胶质细胞-神经元OGD损伤。
海马中的乙酰胆碱是影响记忆的重要物质。有研究显示,机体在进行空间记忆任务训练时,胆碱能标志物胆碱乙酰转移酶的水平显著上升[25];认知功能、空间记忆能力等与海马中的乙酰胆碱水平呈正相关[26-27]。有学者发现,在海马中直接注入乙酰胆碱可间接激活海马的nAChR,从而逆转穹窿损害造成的认知功能障碍[28]。α7-nAChR是nAChR的亚型之一,其为表达于神经细胞、免疫细胞等多种细胞表面的配体依赖性离子通道受体,主要发挥抗炎作用。胆碱能系统可通过α7-nAChR来发挥抑制免疫效应的作用,从而减轻神经炎症反应[29]。这提示胆碱能系统通过作用于神经细胞上的相关受体来发挥相应作用。
在中枢神经系统中,星形胶质细胞具有支持神经细胞、调节神经炎症和调节神经可塑性的作用,并可表达α7-nAChR受体。乙酰胆碱可通过间接作用于海马星形胶质细胞从而引起齿状回神经元兴奋降低,而α7-nAChR拮抗剂可阻断这种作用,说明乙酰胆碱及α7-nAChR均具有抑制神经元兴奋的作用[30-31]。同时,在海马中,由乙酰胆碱引起的齿状回细胞兴奋抑制作用可被胶质细胞代谢抑制剂重新激活[30]。由此可见,海马释放的乙酰胆碱对齿状回兴奋的抑制作用是通过激活星形胶质细胞而不是直接作用于神经元来实现的。此外,海马星形胶质细胞在海马功能中发挥重要作用,激活的星形胶质细胞可以通过释放谷氨基酸等神经递质,进而抑制海马齿状回中间神经元的活性[32],而抑制海马星形胶质细胞释放神经递质,会损害海马依赖性记忆能力[33]。
基于胆碱能系统与α7-nAChR在抑制神经炎症反应方面的共同作用,以及海马星形胶质细胞及其表达的α7-nAChR对神经元的作用,本研究观察了益肺宣肺降浊方含药血清对海马星形胶质细胞-神经元OGD损伤模型中α7-nAChR、ChAT、炎症因子表达的影响。结果显示,与对照组相比,OGD组的星形胶质细胞ChAT活性降低,α7-nAChR和ChAT的mRNA和蛋白表达量下调,细胞分泌的炎症因子IL-1β、TNF-α和IL-6增多(P<0.05);而与OGD组相比,OGD+YFXF组的星形胶质细胞中ChAT活性增强,α7-nAChR和ChAT的mRNA和蛋白表达量上调,炎症因子的释放量减少(P<0.05)。以上结果表明益肺宣肺降浊方含药血清可能通过促进星形胶质细胞中α7-nAChR和ChAT的表达,抑制炎症因子的产生,从而减轻星形胶质细胞与神经元的损伤。此外,与OGD+YFXF组相比,OGD+YFXF+山莨菪碱组的星形胶质细胞和神经元受损加重,α7-nAChR mRNA和蛋白表达量降低,炎症因子TNF-α的释放量增加(P<0.05),ChAT的mRNA及蛋白表达也有一定程度的降低,这一结果说明胆碱受体拮抗剂山莨菪碱可拮抗益肺宣肺降浊方对ChAT、α7-nAChR、炎症因子的调控作用,从而逆转该方对星形胶质细胞与神经元损伤的改善作用。
综上所述,益肺宣肺降浊方可能通过上调海马星形胶质细胞中α7-nAChR的表达、增加ChAT活性、抑制炎症反应,从而减轻OGD诱导的星形胶质细胞和神经元损伤,这或许是该方改善缺血再灌注损伤介导的血管性痴呆的作用机制之一。

