黄芩苷对脂多糖诱导的小鼠炎症的保护作用

关键词 黄芩苷; 脂多糖; 免疫调节; TGF⁃β/SMAD2; T 细胞分化
在畜禽养殖产业中,由于饲养管理不当、畜禽养殖条件差引起的细菌入侵是炎症性疾病产生的重要因素[1],细菌在动物体内生长繁殖和死亡过程中能够产生大量内毒素—— 脂多糖(lipopolysaccharides,LPS),LPS 可通过结合宿主细胞膜表面的Toll 样受体TLR4 引起机体炎症反应,从而影响畜禽生理健康,降低养殖效益[2]。Soria 等[3]研究表明,细菌在感染家畜家禽后能够影响其生产性能,包括养殖效率低下、家禽输卵管炎、腹膜炎、呼吸道相关疾病等一系列炎症反应,表现为血浆中IL⁃6、IL⁃2 及干扰素γ等炎症细胞因子含量升高,从而造成机体免疫力和肠道消化与吸收功能降低。目前,细菌入侵带来的畜禽炎症性疾病在临床上仍依靠抗生素作为常规防治手段,但抗生素滥用不仅影响动物自身肠道微生物平衡,还会造成耐药菌株的出现,药物残留同样也威胁了人类的生命安全[4]。因此,如何绿色有效防治炎症性疾病、提高生产性能,仍然是当前养殖业亟待解决的问题。
黄芩苷(baicalin,BCN)是从黄芩中提取的一种黄酮类有效活性成分。研究表明,黄芩苷具有抗炎、抑菌和免疫增强效果[5],可通过抑制TNF/NF⁃κB/MAPK 等信号通路的激活,缓解动物机体自身和细胞的炎症反应[6]。在抑菌试验中,黄芩苷可以通过破坏革兰氏阴性细菌的细胞壁,导致蛋白质外泄,从而发挥其抑菌和杀菌性能[7],此外,黄芩苷还可以通过调节炎症因子的表达和T 淋巴细胞亚群水平来增强机体免疫效果[8]。
TGF⁃β/SMAD2 信号通路调节许多细胞反应,包括细胞分化、增殖和凋亡[9]。该通路与免疫调控和炎症反应紧密相关,研究表明,TGF⁃β/SMAD2 的激活能提升IL⁃17 和TNF⁃α 的比例,导致机体炎症损伤,促使Treg/Th17 平衡轴向Th17 偏移造成免疫异常[10]。TGF⁃β 可以诱导CD4+ T 细胞分化为Treg 细胞亚型,并且与IL⁃6 的联合作用下,诱导CD4+ T 细胞向Th17 细胞亚型分化,此外,TGF ⁃β 可以通过TGF⁃β 受体(transforming growth factor- β receptor,TβR)激活受体调节型SMAD2 并将信号转导至细胞核内,调控靶基因维A 酸相关孤儿受体γ(RORγt)和Foxp3 的转录,进而发挥免疫调节作用[11]。当前,关于黄芩苷调控TGF⁃β/SMAD2 信号通路和免疫平衡的报道较少。本研究采用体内体外试验结合,探讨黄芩苷通过免疫调节和TGF⁃β/SMAD2 缓解LPS 诱导的小鼠炎症反应的作用机制,旨在为中兽药的开发和临床应用提供科学依据。
1 材料与方法
1.1 试剂与仪器
RAW264.7 小鼠巨噬细胞(武汉普诺赛生命科技有限公司),RPMI-1640 培养基,胎牛血清,0.25%EDTA 胰酶(Gibco,赛默飞世尔科技(中国)有限公司),黄芩苷(纯度≥98%,上海源叶生物有限公司),DMSO(纯度gt;99.5%,北京索莱宝科技有限公司),LPS(纯度≥98%,北京索莱宝科技有限公司),一氧化氮含量检测试剂盒(S0021S,碧云天生物技术有限公司),总RNA 提取试剂盒(R1200,北京索莱宝科技有限公司),cDNA 逆转录酶(RK20428,武汉爱博泰克生物有限公司),Genious 2X SYBR Green Fast qP⁃CR Mix(RK21204,武汉爱博泰克生物有限公司),FoxP3/Transcription Factor Staining Buffer Kit、CD3e、CD4、CD8a 抗体(美国BD 生物公司)。
细胞培养箱(MCO-15AC,日本三洋电机有限公司),多功能酶标仪(SpectraMax iD3,美谷分子仪器有限公司),RT-qPCR 仪(CXT96,伯乐生命医学(上海)产品有限公司),BD FACSAria™ Fusion 细胞分选仪(美国BD 生物公司)。
1.2 细胞试验
1)RAW264.7 细胞活力的测定。将RAW264.7细胞培养于RPMI-1640 完全培养基(89% RPMI-1640+10% 胎牛血清+1% 青霉素-链霉素)中,接种96 孔板,待细胞贴壁弃上清,使用DMSO 溶解黄芩苷[12],并使用RPMI-1640 基础培养基分别稀释至1.562 5、3.125、6.25、12.5、25、50 及100 μg/mL,同时将LPS 分别稀释为质量浓度0.125、0.25、0.5、1、2 及4 mg/mL,采用CCK-8 法测定细胞活力。
2)RAW264.7 细胞吞噬能力的测定。参考易首利等[13]的方法进行。
3)RAW264.7 细胞NO 释放的测定。将RAW264.7 细胞接种6 孔板,设置分组并培养24 h 后取上清,3 000 r/min 离心10 min,按照试剂盒制造商提供的说明书检测NO 含量。
4)细胞炎症因子及TGF⁃β/SMAD2 信号通路相关mRNA 表达水平的测定。消化收集细胞,使用RNA 提取试剂盒进行总RNA 提取,随后使用Ab⁃conal 提供的试剂说明书进行逆转录。2-△△Ct法分析并计算目的基因mRNA 相对表达量。所有引物由Primer 5 软件设计并由上海生工生物有限公司合成,引物序列见表1。
1.3 动物实验
1)实验动物分组与试验设计。雄性BALB/c 小鼠55 只,体质量为(20±2) g,6~8 周龄,购自三峡大学动物实验中心,实验动物许可证号:SCXK(鄂)2022-0012,动物实验伦理经长江大学医学部审核批准(YJ202346)。在长江大学动物科学技术学院提供的标准动物房中饲养,环境条件为湿度(55±5)%、温度(23±2) ℃,明暗周期为12 h//12 h,试验开始前适应性饲喂1 周。使用10%DMSO 溶液配制1 g/mL黄芩苷母液,并使用生理盐水稀释DMSO 终含量为1%。
将55 只小鼠随机分为5 组[14]:组1(0.9%NaCl)、组2(BCN,0 mg/kg)、组3(BCN-L,50 mg/kg)、组4(BCN-M,100 mg/kg)及组5(BCN-H,200 mg/kg),每组11 只,每日采用灌胃方式饲喂200 μL 黄芩苷溶液,连续饲喂1 周后立即腹腔注射200 μL LPS 溶液建立急性炎症模型,6 h 后称体质量并记录。随后颈椎脱位处死,采集脾脏组织,PBS 润洗并吸干水分,称取小鼠脾脏质量,计算脾脏脏器系数。
2)T 细胞分化的测定。剪切新鲜脾脏,置于孔径200 μm 的滤网研磨,RPMI-1640 冲洗收集滤液,4 ℃、2 000 r/min 离心5 min,弃上清。加入500 μL红细胞裂解液静置2 min 后离心5 min,弃上清,1 mL RPMI-1640 完全培养基混匀重悬。使用孔径48 μm 灭菌尼龙膜过滤,即得T 细胞原液。取少量T 细胞悬液使用RPMI-1640 基础培养基稀释至1×106 个/mL。加入CD8a 抗体、CD4 抗体、CD3e 抗体(所有抗体使用PBS 按说明书提供比例稀释),4 ℃避光孵育,30 min 后使用PBS 洗涤2 次并离心弃上清,加入300 μL PBS 重悬细胞后上机检测。
3)调节性T 细胞Treg 细胞的测定。取T 细胞原液,加入CD4 抗体和CD25 抗体表面染色30 min;加入100 μL PBS 重悬,并立即加入转录因子固定破核剂500 μL,避光孵育50 min;收集细胞,加入10 μLFoxp3-APC 抗体再次孵育50 min,随后加入300 μLPBS 重悬细胞,混匀后上机检测。
4)辅助性T 细胞Th17 的测定。取T 细胞原液,每管加入刺激阻断剂100 μL,细胞培养箱中刺激培养6 h,加入100 μL PBS 重悬细胞,随后加入10 μLCD4 抗体,避光孵育30 min,孵育结束弃上清;加入1 mL 固定破膜剂重悬细胞,孵育1 h 弃上清,使用1×Perm/Wash 重悬细胞。最后用IL-17A-APC(Th17)抗体进行胞内染色,定容至300 μL 混匀后上机。
5)相关mRNA 的表达水平检测。利用总RNA提取试剂盒从小鼠脾脏中提取总RNA,使用逆转录试剂盒合成cDNA,储存在−20 ℃备用。RT-qPCR检测IL⁃1、TNF⁃α、IL⁃17、IL⁃22、TGF⁃β 及SMAD2 的mRNA 表达水平,引物见表1。
1.4 数据处理
流式细胞术下机数据采用Flow Jo V10.0 软件进行分析和统计,试验数据采用IBM SPSS 25.0 进行单因素方差分析,采用Duncan’s检验确定各组间的显著性差异。使用GraphPad Prism 8.0进行绘图。各组试验数据均以“平均值±标准差”(Mean ± SD)表示,Plt;0.05 表示差异显著,Plt;0.01 表示差异极显著。
2 结果与分析
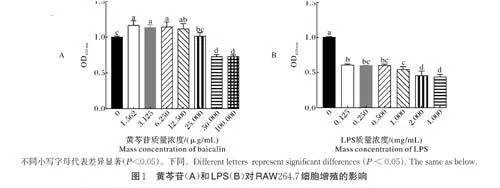
2.1 黄芩苷和LPS 处理RAW264.7 细胞的安全浓度
黄芩苷和LPS 对RAW264.7 细胞增殖的影响如图1 所示。由图1 可见,在0~25 μg/mL 范围内,不同质量浓度的黄芩苷对RAW264.7 细胞增殖无抑制作用,并且在一定程度上能够促进细胞增殖。当黄芩苷质量浓度为50 μg/mL 时,细胞活力明显下降(Plt;0.05)。与0 mg/mL 相比,当LPS 质量浓度为1 mg/mL 时,细胞活力显著下降(Plt;0.05),存活率为54.55%。因此,选择黄芩苷质量浓度分别为3.125、6.25、12.5、25 μg/mL 以及1 mg/mL LPS 进行后续试验。
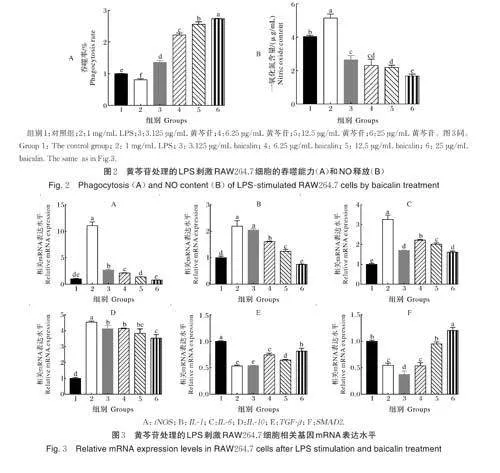
2.2 黄芩苷对LPS刺激RAW264.7 细胞的吞噬能力和NO释放的影响
细胞吞噬试验结果如图2A 所示,与组1 相比,组2 经LPS 刺激后RAW264.7 细胞的吞噬能力显著下降(Plt;0.05),与组2 相比,组3 黄芩苷细胞吞噬能力呈上升趋势(Plt;0.05);组4、组5 和组6 的差异显著(Plt;0.05),LPS 刺激RAW264.7 细胞NO 释放结果如图2B 所示,与组1 相比,组2 的NO 释放显著增加(Plt;0.05),相较组2,组3 黄芩苷能显著降低LPS 刺激的NO 释放,并随其剂量增加,NO 释放显著降低(Plt;0.05)。
2.3 黄芩苷对LPS 刺激细胞炎症因子与TGF-β/SMAD2 信号通路相关mRNA表达水平的影响
RAW264.7 细胞相关基因的mRNA 表达水平见图3。由图3 可见,与组1 相比,组2 经LPS 刺激后,RAW264.7 细胞iNOS、IL⁃1、IL⁃6 和IL⁃10 的mRNA表达均显著上调(Plt;0.05),而在组3补充黄芩苷后,上述细胞因子的mRNA 表达水平呈现下调趋势(Plt;0.05),与组2 相比,组4、组5 和组6 的差异显著(Plt;0.05),TGF⁃β和SMAD2的mRNA表达水平如图3E-F所示,与组1相比,组2经LPS刺激后,TGF⁃β和SMAD2的表达水平下降(Plt;0.05),与组2相比,组3并未提高TGF⁃β和SMAD2的mRNA表达水平(Pgt;0.05),但组5和组6 的TGF ⁃β 和SMAD2 的mRNA 表达差异显著(Plt;0.05)。
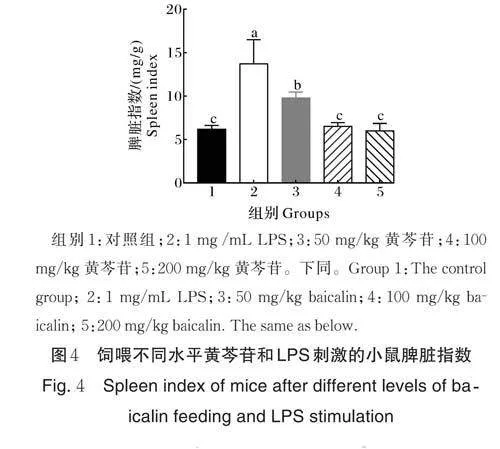
2.4 脾脏指数
小鼠脾脏指数见图4,与组1 相比,组2 的脾脏指数显著上升(Plt;0.05),与组2 相比,组3 的脾脏系数明显下降(Plt;0.05),组4 和组5 的脾脏指数差异显著(Plt;0.05),但与组1 无明显差异。
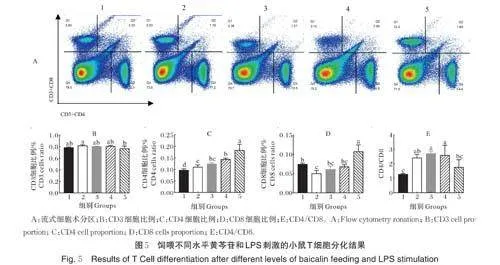
2.5 T细胞分化
小鼠脾脏T 细胞分化结果如图5A-F 所示,与组1 相比,组2 促进CD3+细胞比例增加,但差异不显著;与组2 相比,组5 能显著降低LPS 刺激下CD3 细胞的比例(Plt;0.05)。CD4 细胞增殖情况如图5C 所示,与组1 相比,组3 和组4 均显著促进CD4 细胞增殖(Plt;0.05),组5 差异显著(Plt;0.05);CD8 细胞增殖情况如图5D 所示,与组1 相比,组2 的CD8 细胞比例减少(Plt;0.05),与组2 相比,组5 能够显著促进CD8 细胞增殖(Plt;0.05);此外,CD4/CD8 如图5E 所示,与组1 相比,组2 的CD4/CD8 升高(Plt;0.05),与组2 相比,组5 的CD4/CD8 存在下调趋势,表明一定剂量的黄芩苷能够在一定程度上恢复LPS 刺激的小鼠T 细胞分化。
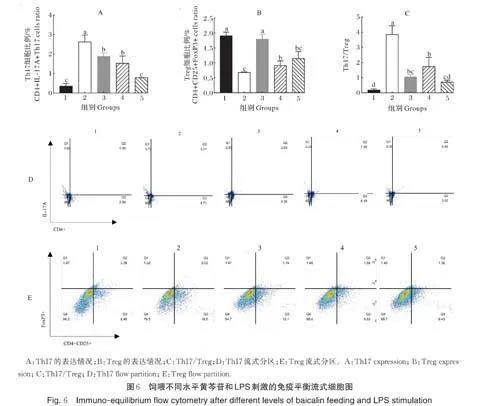
2.6 免疫平衡
如图6 所示,LPS 刺激后,组2 的Th17 细胞数量显著上升,Treg 的分化显著减少,TH17/Treg 平衡轴往Th17 方向分化(Plt;0.05),出现Th17/Treg 失衡。与组2 相比,组3 和组4 小鼠Th17 细胞的分化显著下降(Plt;0.05),组5 存在显著差异(Plt;0.05);此外,不同剂量的黄芩苷对于Treg 细胞的分化与表达均具有促进作用,其细胞比例明显增多。表明黄芩苷对于LPS 导致的Th17/Treg 平衡轴的失衡具有恢复作用。
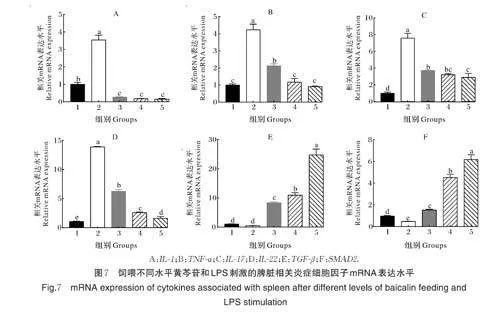
2.7 脾脏相关细胞因子表达水平
如图7 所示,与组1 相比,经LPS 刺激后,小鼠脾脏中IL⁃1、TNF⁃α、IL⁃17 及IL⁃22 的mRNA 表达水平显著上调(Plt;0.05),与组2 相比,组3 黄芩苷灌胃小鼠的上述炎症细胞因子的表达水平均显著下调(Plt;0.05),组4 和组5 的差异显著(Plt;0.05)。
图7E~F 展示了TGF⁃β 和SMAD2 基因的表达情况,与组1 相比,TGF⁃β 在LPS 刺激后表达水平呈下调趋势,但无显著性差异;与组2 相比,组3 显著上调了TGF⁃β 的表达水平(Plt;0.05),组4 和组5 差异显著(Plt;0.05)。与组1 相比,经LPS 刺激后,SMAD2 表达水平显著下调(Plt;0.05),与组2 相比,黄芩苷3 个剂量组均显著上调了SMAD2 的mRNA表达(Plt;0.05),表明黄芩苷可以通过激活TGF⁃β/SMAD2 缓解LPS 引起的炎症反应。
3 讨论
黄芩苷是中药黄芩中最主要的活性成分之一,调查发现,在众多黄酮类化合物中,黄芩苷含量最高可占生药材的20.7%[15]。因其含量高、源药材种植范围广,相较其他单一化合物,黄芩苷的提取工艺更简单,生产成本更低廉,在畜禽生产中应用很多,如提高家禽产蛋性能,减少畜禽病害等[16-18]。此外,与槲皮素、大豆异黄酮等化合物在抑菌、抗炎和抗病毒方面相比,黄芩苷较低剂量(100 mg/kg)应用在小鼠即可达到良好效果[19]。
炎症反应是机体稳态系统应对外界和内部刺激时的必要生理过程,在正常情况下,轻微的炎症反应能够刺激机体快速清除病原体,改善免疫失衡从而维持自身健康[20]。然而近年来,随着抗生素滥用,在产生耐药细菌的同时造成动物抵抗能力降低[21],导致多数情况下炎症往往不能自愈,且在不加干预的情况下逐步恶化,致使其他系列疾病出现[22]。研究指出,LPS 能通过Toll 样受体募集MYD88 从而激活NF⁃κB 引起细胞炎性损伤和机体炎症[23]。骆思园等[24]在RAW264.7 小鼠巨噬细胞上使用LPS 刺激后发现其活性下降,并且激活ERK 信号通路。在本研究中,使用1 mg/mL 的LPS 同样能够降低RAW264.7 细胞的活力,降低细胞存活率。巨噬细胞可通过自身吞噬功能清除外来病原微生物,吞噬能力降低可能会引起病原微生物的免疫逃逸[25],在本研究中,中性红染色试验发现LPS 刺激后的RAW264.7 细胞吞噬能力下降,而在补充黄芩苷后吞噬能力呈剂量依赖式增长,这可能与黄芩苷的特异性免疫增强作用相关[26]。
RAW264.7 等巨噬细胞在遭受外界刺激时能够促进NO 的释放,而这一机制是由iNOS 激活引起的[27]。NO 含量的升高能够导致细胞缺氧,进一步激活炎症与细胞程序性死亡,从而释放IL⁃1、IL⁃6及IL⁃10 等促炎细胞因子[28],在本研究中,LPS 刺激后小鼠巨噬细胞NO 释放含量显著增加,在随后的基因表达检测中发现iNOS、IL⁃1、IL⁃6 及IL⁃10 水平均显著升高,这也进一步佐证了细胞炎症的形成。
研究表明,TGF⁃β/SMAD 信号通路在细胞早期发育、免疫监督、组织修复及稳态平衡的过程中发挥重要作用,Lan 等[29]使用血流阻断法建立肾损伤小鼠模型后发现TGF⁃β 基因的mRNA 表达水平降低,而过表达TGF⁃β 后,小鼠肾损伤情况得到了改善,并且下游SAMD2/3 信号被激活,有效抑制了MAPK 和NF⁃κB 信号通路的激活,这一结果表明TGF⁃β/SMAD 能够通过负向调控炎症信号通路,从而改善组织损伤。在本研究中,LPS 刺激小鼠巨噬细胞后,TGF⁃β/SMAD 表达水平降低,而补充黄芩苷后,该情况得到了缓解,该结果也在后续的研究中得到验证,以上结果表明黄芩苷同样可能通过激活TGF⁃β/SMAD 信号通路减轻LPS 诱导的小鼠炎症。
T 细胞亚群紊乱可能与局部炎症和免疫反应激活有关[30],CD4 分子属于免疫球蛋白超家族,当CD4+细胞大量分化,能进一步促进单核和巨噬细胞活化,从而吞噬入侵病原体。在本研究中,黄芩苷灌胃后小鼠CD4+细胞表达显著上升,在本研究的细胞试验中黄芩苷同样提升了小鼠巨噬细胞的吞噬能力,提示CD4+细胞在抗炎效应中发挥了一定的作用。此外,本研究发现,LPS 刺激后,CD8+细胞表达显著降低,这可能与BALB/c 小鼠的免疫系统遭到破坏相关。CD4+/CD8+比值的高低往往作为免疫激活或抑制的标志物,在临床上可用于识别为炎症相关的慢性免疫疾病[31]。本研究发现,腹腔注射LPS 能够降低小鼠脾脏中CD4+/CD8+的比值,同样,在Ron 等[32]的研究中发现,一些因病毒或其他微生物感染的患者表现出高CD4+/CD8+比值,而使用药物干预的患者则降低了CD4+/CD8+比值。
Th17 细胞能够促进组织的炎症反应,而Treg 细胞则抑制自身免疫。IL⁃17 是许多自身免疫性疾病发病机制的核心,同样存在有效的宿主耐受与调节机制来控制自身反应性Th17 细胞与IL⁃17 诱导的炎症反应[33]。IL⁃22 由不同种类的淋巴细胞表达,尤其是Th17 细胞、T 细胞及NK 细胞等[34]。有研究表明,IL⁃17 在保护性免疫与破坏性炎症中具有双重作用,而在炎症性肠病患者中IL⁃22 的表达则显著升高[35]。在本研究中,使用LPS 注射的小鼠出现Th17/Treg失衡、IL⁃17 及IL⁃22 高度表达,而这一情况在灌胃黄芩苷后得到了一定程度的缓解,表明黄芩苷可以逆转小鼠体内炎症带来的免疫失衡。
综上所述,LPS 可刺激RAW264.7 细胞和小鼠产生炎症反应,促进炎症因子释放导致免疫失衡,黄芩苷干预后能够缓解LPS 诱导的小鼠炎症反应,该机制可能是通过降低相关炎症因子mRNA 表达、提高免疫能力、恢复Th17/Treg 平衡及激活TGF⁃β/SMAD 信号通路实现的。

