莱茵衣藻LRR-1蛋白多克隆抗体的制备与鉴定
关键词 莱茵衣藻; 富亮氨酸重复序列; 先天免疫; 防御反应; 多克隆抗体
富亮氨酸重复序列(leucine-rich repeat,LRR)长度为20~30 个氨基酸,可分为高度保守段(highlyconserved segment,HCS)和可变段(variable seg⁃ment,VS),HCS 通常由11 个氨基酸残基组成:Lxx⁃LxLxxNxL,其中L 为Leu、Ile、Val 或Phe;N 是Asn、Thr、Ser 或Cys[1-2]。大多数LRR 结构域由2~45 个LRR 折叠成弧形或马蹄形,介导蛋白与蛋白之间的相互作用[3-5]。含有LRRs 的蛋白包括酪氨酸激酶受体、细胞黏附分子、毒力因子和细胞外基质结合糖蛋白等,参与多种生物过程,如激素受体的相互作用、先天免疫反应、DNA 修复、RNA 转运、神经元发育、细胞抗病、凋亡等[6]。
LRR 结构域在许多与动植物先天免疫相关的蛋白质中是进化保守的。作为第一道防线,先天免疫反应是通过感知病原体相关分子模式(pathogen-as⁃sociated molecular patterns,PAMPs)启动的。在植物中,含有核苷酸结合位点(nucleotide binding site,NBS)的NBS-LRR 蛋白依赖LRRs 识别多种病原物[7];在哺乳动物中,Toll 样受体(toll-like receptors,TLRs)和NOD 样受体(NOD-like receptors,NLRs)通过其LRR 结构域,可感知来自细菌、真菌、寄生虫和病毒衍生物的结构多样的病原微生物标志分子[8-9]。研究发现,一些适应性免疫发育较差的水生动物主要依赖于它们的先天免疫,海胆和文昌鱼在缺乏适应性免疫的情况下极大地扩展了LRR 蛋白库[10]。LRR 蛋白在植物中主要参与植物防御反应、抵御外界胁迫和调节植物生长发育等。例如,LRR型伸展蛋白(leucine-rich repeat extensins,LRX)是植物细胞壁的结构蛋白,可抵御病原物的入侵,研究表明LRX 蛋白也能被植物非生物胁迫所诱导[11]。拟南芥细胞壁富亮氨酸重复序列伸展蛋白LRX3/4/5对拟南芥的耐盐性至关重要,LRXs 可以与快速碱化因子(rapid alkalinization factor,RALF)以及受体样蛋白激酶(feronia,FER)作为一个模块来转导细胞壁信号,调节植物的生长和耐盐性[12]。此外,植物中已鉴定的类受体激酶(receptor-like protein kinase,RLK)绝大多数也属于LRR 型蛋白[13-15]。水稻Xa21蛋白的胞外LRR 结构在细胞表面识别病原体配体后会诱导胞内激酶磷酸化,激活细胞内防御反应,保护水稻免受病原菌的侵害[16]。研究发现,当LRR-RLK胞外域LRR 基序之间的结构发生突变时,将会极大影响LRR-RLK 分子作为受体的结合能力[17-18]。目前,大多数LRRs 与其配体之间的相互作用方式以及结合位点仍不清楚,为深入研究LRR 型蛋白功能,阐明其参与生物体先天免疫反应的分子机制,需制备一支能特异性识别LRR 结构的多克隆抗体。利用分子生物学技术将某些功能明确的LRR 基因引入作物中,是提高作物抗逆性和促进作物生长发育的有效策略。
莱茵衣藻属于单细胞真核藻类,具有成本低、培养简单、生长周期短等优点,是一种成熟的模式生物。本研究利用莱茵衣藻内源LRR-1 肽段免疫新西兰白兔制备多克隆抗体,旨在为深入研究LRR 型蛋白功能及其分子机制提供材料。
1 材料与方法
1.1 试验材料
水稻(Oryza sativa L.)叶片,莱茵衣藻野生型藻株21gr 和突变藻株lrr-1 为江汉大学遗传与生物技术研究中心实验室保存。新西兰白兔(体质量2.0kg)购于湖北省实验动物中心。
1.2 多肽的设计与合成
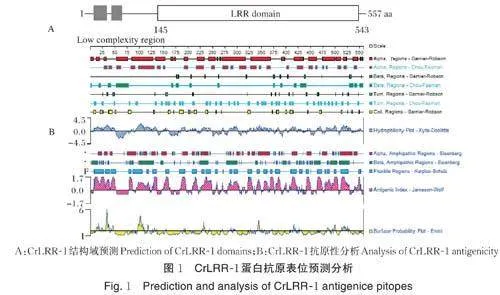
在NCBI 网站检索莱茵衣藻CrLRR-1 同源蛋白,分析该蛋白特异性,通过PHD、DSC、MLRC 和Sec.Cons 对CrLRR-1 的二级结构进行分析,利用TMHMM、SMART 预测CrLRR-1 跨膜区和结构域,使用DNA Star 软件分析CrLRR-1 蛋白亲水性、免疫原性及抗原表位暴露性,根据以上分析选择亲水性好、抗原性指数高的肽段。多肽的合成、纯化及偶联KLH 委托武汉爱博泰克生物科技公司完成。
1.3 动物免疫
免疫动物为2.0 kg 左右的雄性新西兰白兔,免疫前取耳缘静脉血作为阴性对照。第1 次免疫取200μg 纯化好的CrLRR-1 多肽抗原与等体积完全弗氏佐剂(Sigma F5881)混匀至完全乳化,进行颈背部皮下注射6~8 个点。首次免疫11 d 后进行第2 次免疫,取100 μg 多肽与等体积不完全弗氏佐剂(SigmaF5506)混匀并充分乳化,在颈背部皮下免疫4 个点,接着每隔2 周进行1 次加强免疫,连续3 次,免疫方法、剂量均与第2 次相同。全程共免疫5 次,免疫结束后第12 天进行动脉取血100 mL 左右,4 ℃离心收集上层血清。
1.4 间接ELISA法检测抗血清效价
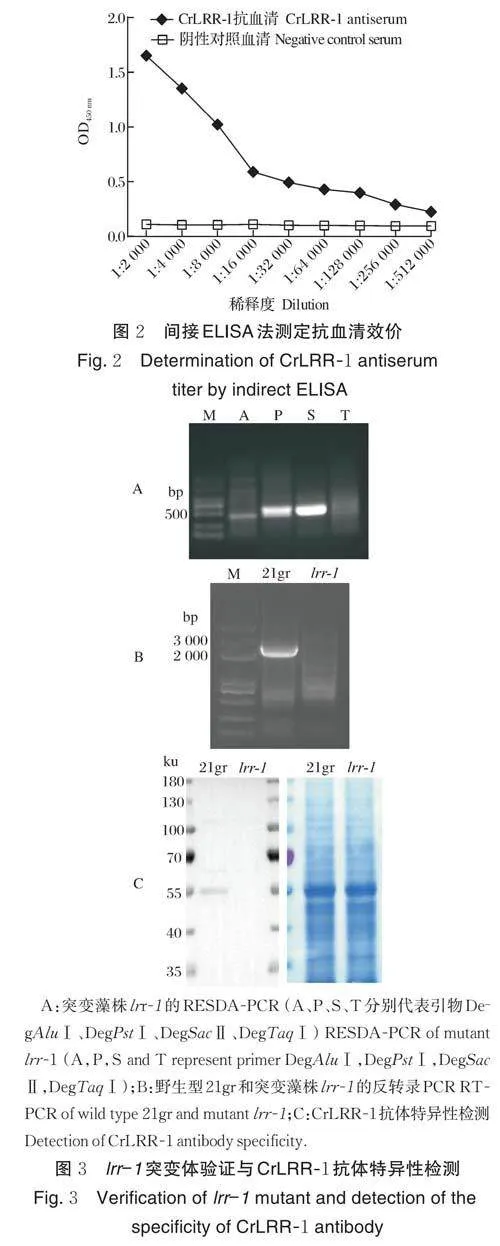
用包被液(Solarbio SEKF105)稀释CrLRR-1 多肽至1 μg/mL 作为包被抗原,以100 μL/孔包被酶标板,4 ℃过夜。用含0.05% Tween-20 的PBST 洗涤3次,每孔加入200 μL 封闭液(含5% BSA),37 ℃孵育2 h,PBST 洗涤3 次。待测抗血清为一抗,从1∶2 000开始2 倍梯度稀释至1∶512 000,并设同等稀释度的阴性兔血清做对照,每孔100 μL,37 ℃ 孵育1 h,PBST 洗涤3 次后每孔加入100 μL 辣根过氧化物酶(horseradish peroxidase,HRP)标记的羊抗兔二抗(1∶20 000 稀释),37 ℃孵育1 h,PBST 洗涤5 次。每孔加入100 μL TMB 显色剂,37 ℃避光反应10 min,每孔加入50 μL 终止液,即刻用酶标仪测定波长在450 nm 下的吸光值。抗血清OD450 nm 大于0.1,且与阴性对照血清OD450 nm 比值大于2,其对应的最高稀释倍数即为抗血清效价。
1.5 抗血清纯化
首先采用Protein A 纯化法,称取1.5 g Protein ASepharoseCL-4B 填料于纯化柱,使用去离子水使其充分溶胀,加入Protein A 结合缓冲液(0.1 mol/LTris,150 mmol/L NaCl,pH 7.5)平衡填料,将CrLRR-1 抗血清用结合缓冲液稀释后加入处理好的纯化柱,4 ℃过夜结合。用结合缓冲液洗去纯化柱中非特异性吸附的杂蛋白,加入0.1 mol/L(pH 2.7)甘氨酸洗脱液洗脱抗体,并立即用1 mol/L Tris-HCl(pH 9.0)中和抗体。采用抗原亲和纯化法进一步纯化,将CrLRR-1 多肽抗原结合到琼脂糖凝胶树脂上,使其专一性吸附CrLRR-1 的抗体,按上述方法将抗体洗脱下来。
1.6 抗体特异性检测
突变藻株lrr-1 是笔者所在实验室通过向野生型藻株21gr 基因组中引入随机插入突变的方式获得。首先利用RESDA-PCR(restriction enzyme site-di⁃rected amplification PCR)技术扩增出插入片段两侧的DNA 序列[19],测序后与衣藻基因组进行比对,确定突变基因及外源片段的插入位点;接着,分别提取野生型21gr 和突变藻株lrr-1 的总RNA 进行反转录PCR,鉴定CrLRR-1 基因的表达情况;然后,提取21gr 和lrr1 的全细胞蛋白进行SDS-PAGE 电泳,将蛋白从凝胶转移至PVDF 膜上,5% 脱脂乳粉室温封闭1 h,以1∶5 000 稀释纯化后的抗血清作为一抗,室温孵育1 h,用含0.05% Tween-20 的TBST 洗涤3次,加入HRP 标记的羊抗兔二抗室温孵育45 min,TBST 洗涤3 次,加ECL 化学发光液曝光显影。
1.7 免疫荧光检测蛋白亚细胞定位
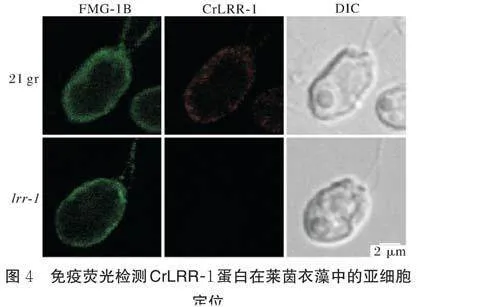
收集细胞状态良好的野生型21gr 和突变体lrr-1藻细胞,8% PFA 固定细胞,使用0.5% NP40 通透细胞2 min,将细胞轻滴在0.1% PEE 处理过的载玻片上,室温下用山羊血清封闭1 h。一抗采用CrLRR-1抗体(1∶100 稀释)和衣藻鞭毛膜蛋白(flagellar mem⁃brane glycoprotein 1B,FMG-1B)抗体,等量混合,37 ℃孵育4 h,二抗分别使用红色荧光素标记的羊抗兔二抗(Merck R37116)和绿色荧光素标记的羊抗小鼠二抗(Merck R37120),37 ℃ 避光孵育2 h,滴加Fluoromount-G(SBA-0100)防荧光淬灭剂后封片,激光共聚焦扫描显微镜下观察荧光信号并拍摄图像。
1.8 CrLRR-1 抗体检测水稻叶片总蛋白
称取0.2 g 水稻新鲜叶片,在液氮中将叶片迅速、充分研磨成粉末,装入1.5 mL 离心管,加入1 mL 蛋白裂解液并上下颠倒混匀,冰上放置20 min,期间每隔5 min 振荡1 次,充分裂解后4 ℃ 14 000 r/min 离心30min,上清即为叶片总蛋白。加入蛋白上样缓冲液将样品进行梯度稀释,采用CrLRR-1 抗体(1∶5 000 稀释)进行免疫印迹检测。
2 结果与分析
2.1 CrLRR-1 蛋白多肽的设计
CrLRR-1 在莱茵衣藻中的基因位点编号为Cre06.g302700(https://phytozome-next.jgi.doe.gov/report/gene/Creinhardtii_v5_6/Cre06. g302700) ,CrLRR-1 蛋白结构域分析如图1A 所示,该蛋白含有富亮氨酸重复序列,选择含有结构域的区域有助于增加抗体的特异性。CrLRR-1 蛋白经DNAStar 分析结果如图1B 所示,将CrLRR-1 蛋白369~386 aa 位置的多肽作为候选,用Kyte-Doolittle 方法对多肽序列进行亲水性分析,结果显示该序列亲水性较好,用Jameson-Wolf 方法预测CrLRR-1 蛋白上的抗原决定簇,结果显示候选多肽的抗原性指数较高,可能为潜在的抗原决定簇,经Emini 方法预测该候选多肽位于蛋白表面的可能性较高。同时,候选肽段属于LRR序列的高度保守段,综合分析,确认选择CrLRR-1 蛋白369~386 aa 处合成多肽:C-DNKGLSVLDLG⁃GNNIGPK,其中N 端的半胱氨酸提供巯基偶联到KLH 上。
2.2 抗血清效价的测定
利用间接ELISA 法测定CrLRR-1 抗血清效价,结果如图2 所示,CrLRR-1 抗血清最高稀释512 000倍,其OD450 nm 值为0.225,是阴性对照(OD450 nm=0.094)的2 倍,因此,本次免疫所制备抗血清效价为1∶512 000。
2.3 CrLRR-1 抗体的特异性分析
突变藻株lrr-1 的RESDA-PCR 扩增结果如图3A 所示,切取较亮条带测序后发现,外源片段插入到CrLRR-1 基因第一个外显子207~208 bp 处。提取野生型21gr 和突变藻株lrr-1 的总RNA 进行反转录PCR,结果显示,以21gr 的cDNA 为模板能够扩增出CrLRR-1 基因的CDS 全长序列,而突变藻株lrr-1 中不能扩增出CrLRR-1 基因的CDS 序列(图3B),表明lrr-1 中CrLRR-1 基因无法正常表达。制备的CrLRR-1 抗血清经Protein A 和抗原亲和纯化后通过Western blot 进行检测(图3C),野生型21gr 泳道显示特异性条带,与预期大小57 ku 接近,而突变体lrr⁃1泳道未检测到目标条带,表明制备的抗体能够特异性结合CrLRR-1 蛋白,可用于后续实验研究。
2.4 CrLRR-1 蛋白在莱茵衣藻中的定位
由图4 可知,野生型21gr 与突变体lrr-1 的鞭毛和细胞膜均被染上绿色荧光,在野生型21gr 细胞膜上观察到明显红色荧光,同时细胞质内存在少量弥散信号,而在突变体lrr-1 细胞内几乎看不到荧光信号,说明该抗体具有较强特异性,可特异性识别CrLRR-1 蛋白。
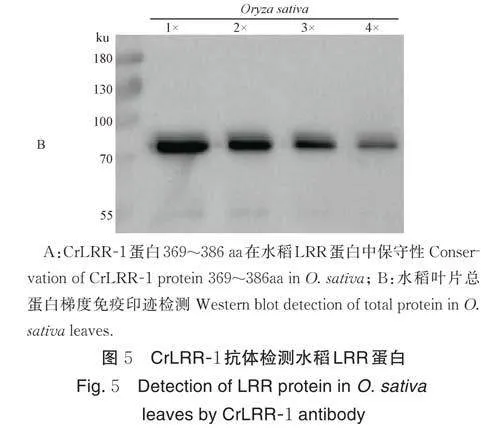
2.5 CrLRR-1 抗体特异性识别水稻LRRL1 蛋白
由图5A 可知,CrLRR-1 蛋白369~386 aa 肽段在水稻LRR 蛋白中具有较高保守性。提取水稻叶片总蛋白进行免疫印迹检测,结果显示(图5B),在水稻叶片总蛋白印迹的PVDF 膜上70~100 ku 之间有明显阳性条带,且随着样品浓度梯度稀释而逐级减弱。经质谱鉴定该阳性条带为水稻LRRL1(leucine richrepeat-like 1)蛋白,大小为90 ku,基因位点编号为LOC_Os06g13050。
3 讨论
抗体制备是研究目标基因的转录和表达、蛋白间相互作用、蛋白亚细胞定位及其生物学功能的基础。本研究通过生物信息学预测分析CrLRR-1 蛋白的二级结构、亲水性、免疫原性、抗原表位暴露性以及与衣藻中其他蛋白的同源性等,以此为依据选取CrLRR-1蛋白369~386 aa 区域,合成该特异性肽段与KLH 偶联后免疫新西兰白兔。与天然抗原或重组蛋白相比,人工合成多肽的抗原表位优势富集,与载体蛋白偶联后不仅能增加抗原的大小,也能增强免疫性,更好地刺激机体产生抗体[20]。本研究成功制备CrLRR-1 抗血清,采用间接ELISA 法检测其效价达到1∶512 000,经Protein A 和抗原亲和纯化后得到CrLRR-1 蛋白多克隆抗体。通过免疫印迹与免疫荧光检测该抗体能特异性识别莱茵衣藻内源LRR-1 蛋白,并初步判断CrLRR-1蛋白主要定位于莱茵衣藻细胞膜与细胞质。由于本研究选择作为免疫原的多肽属于LRR 高度保守段,因此制备的多克隆抗体可特异性识别水稻LR⁃RL1蛋白,具有一定的应用价值。
LRRs 是与先天免疫相关的蛋白质中最常见的蛋白结构域之一,先天免疫在保护生物体免受内源性和外源性病原物入侵方面发挥重要作用。已有研究表明,LRRs 主要作为特异性识别区域,参与生物体对病原物的感知与识别[21]。目前已克隆了很多植物的LRR 基因,并且发现大部分植物的LRR 型蛋白为病害抑制蛋白[22],但是对于这些基因参与植物先天免疫反应、调节植物生长发育的分子机制研究尚不完善。Chen 等[23]研究发现一个新的水稻LRRlike1蛋白YPD1(yellow and premature dwarf 1)定位在叶绿体膜上,ypd1 突变体对强光敏感,具有异常的叶绿体和较低水平的光合色素。YPD1 基因的突变加速了水稻细胞的衰老和死亡,但其具体的调控机制还不清楚。本研究制备的CrLRR-1 抗体可特异性识别水稻LRR-like1 蛋白,将为该蛋白调控水稻生长发育的机制研究提供有力工具。
综上所述,本研究通过生物信息学预测分析莱茵衣藻LRR-1 蛋白理化性质,设计并合成特异性多肽,与KLH 偶联后免疫新西兰白兔,成功制备了效价高、特异性好的CrLRR-1 多克隆抗体,并应用该抗体特异性识别了水稻内源LRRL1 蛋白。该抗体的制备可为后续深入研究LRR 型蛋白功能,阐明其作用机制奠定材料基础。

