Wnt/β-catenin/VEGF通路在副猪嗜血杆菌引起猪内皮细胞损伤中的作用



关键词 副猪嗜血杆菌; Wnt/β-catenin 信号通路; 血管内皮生长因子; 黏附连接; 细胞通透性
副猪嗜血杆菌(Haemophilus parasuis, HPS)早期定殖于猪上呼吸道,在猪处于应激、免疫力低下等情况时侵入动物机体,引起以全身性的渗出性纤维素炎为特征的猪格拉泽氏病(Glässer’s disease),严重时死亡率可达 50%[1-2]。然而,目前对于HPS 引起渗出性纤维素炎的病理机制缺乏充分研究。渗出性炎症的发生表明在HPS 感染过程中,血管内皮通透性增加。在针对出血性休克疾病的研究中发现,微血管通透性过高主要由于内皮细胞间黏附连接(adherens junctions,AJs)结构受到破坏[3],内皮细胞间AJs 由血管内皮钙黏蛋白(vascular endothelialcadherin,VE-cadherin)通过其胞外结构域与相邻内皮细胞的VE-cadherin 形成同型性黏附,同时通过胞内结构域与 β-catenin 连接,VE-cadherin/β-catenin 复合物共同锚定在构成细胞骨架的肌动蛋白上[4]。β-catenin 除了作为构成AJs 的结构蛋白,同时也是经典Wnt/β -catenin 信号通路中的核心信号转导蛋白[5]。Wnt/β-catenin 通路被激活后,β-catenin 通过转位入核发挥转录调控作用,调节通路下游纤溶酶原激活抑制剂-1(plasminogen activator inhibitor-1,PAI-1)、胶原蛋白Ⅲ(collagen Ⅲ)、纤连蛋白(fibro⁃nectin)和血管内皮生长因子(vascular endothelialgrowth factor,VEGF)等与细胞黏附及迁移相关基因的表达,影响细胞通透性和移动性[6-7]。
Wnt/β-catenin 信号通路的下游靶基因VEGF通过与其受体VEGFR 结合,阻断细胞连接中信号的传递,增强血管渗漏。VEGF 加强血管通透性的作用强于组织胺约50 000 倍[8]。细胞超微结构研究显示,VEGF 处理后的血管内皮细胞间出现大量裂隙及血管基底膜的退行性病变。临床血管渗漏相关研究表明,VEGF 可以在15 min 内切断内皮细胞中VE-cadherin/β-catenin 复合体间的连接,引起内皮通透性增高[9-10]。
本研究解析HPS 感染过程中Wnt/β-catenin 信号通路对内皮细胞间黏附连接结构变化的调节作用,分析Wnt/β-catenin 信号通路对内皮细胞通透性的影响。初步探究HPS 引起渗出性纤维素炎的分子机制,旨在为疫苗设计和药物靶标选择奠定理论基础。
1 材料与方法
1.1 细胞与菌株
猪血管内皮细胞(porcine aortic endothelial cell,PAEC)为原代分离细胞,根据Beijnum 等[11]的方法从30 日龄的仔猪主动脉中分离。PAEC 使用添加10% 胎牛血清且不含抗生素的M199 培养基于37 ℃、5% CO2条件下进行细胞培养。副猪嗜血杆菌SH0165 株为笔者所在研究室保存,在TSA 培养基中复苏,挑取单菌落到含5% 牛血清和1%NAD 的TSB 培养基中200 r/min 振荡培养过夜至OD600 nm=0.6。菌液收集至离心管中,12 000 r/min 离心10min,PBS 洗涤3 次后用于感染细胞。
1.2 Western blot 检测
待细胞长至80% 融合时进行siRNA 转染或HPS 感染。高毒力HPS 菌株HPS-SH0165(108CFU/mL)感染相应时间后收样。siRNA 转染24 h后继续用HPS 感染12 h 后收样。阴性对照组(CON)或siRNA 对照组(NC)加入等体积PBS 处理。LiCl(20 mmol/L)作为Wnt/β-catenin 通路激活的阳性对照。IWR-1-endo(10 μmol/L)处理作为抑制Wnt/β-catenin 通路激活的对照。PBS 洗涤细胞3 次,每孔加入200 μL 裂解液裂解细胞。收集细胞裂解液与2×SDS-PAGE 上样缓冲液混匀,沸水浴10min,12 000 r/min 离心10 min 后取上清上样。细胞膜质核蛋白分离样品根据试剂盒说明书制备。将SDS-PAGE 胶中的蛋白质转印至PVDF 膜,5% 脱脂牛奶封闭1 h 后放入根据说明书稀释的一抗和二抗溶液中分别孵育2 h 和1 h。洗涤3 次后经成像仪显影。LiCl 购自Sigma 公司。β -catenin 抗体为SantaCruz 公司产品。磷酸化β-catenin 抗体购自CellSignaling Technology 公司。β-actin 抗体和辣根过氧化物酶标记的羊抗兔IgG 购自碧云天生物技术研究所。
1.3 实时荧光定量RT-PCR(qRT-PCR)检测基因mRNA水平
根据说明书使用Omega 公司的细胞RNA 提取试剂盒及反转录试剂盒提取细胞总RNA 并反转录成cDNA,按照SYBR Green Real-time PCR Mix 说明书检测细胞中待测基因mRNA 水平,程序为:94 ℃预扩增10 min;94 ℃变性15 s,60 ℃退火30 s,72 ℃延伸30 s,40 个循环。mRNA 相对表达水平的定量采用比较Ct 法来计算相对定量,基因的相对mRNA 表达水平通过GAPDH 来标准化。荧光定量检测引物序列见表1。
1.4 间接免疫荧光试验
接种PAEC 于细胞爬片上,培养至50%~60%融合后进行siRNA 转染、抑制剂预处理或直接进行细菌感染。各组细胞处理方法本文“1.2”所述。HPS(108 CFU/mL)感染12 h 后依次使用4% 多聚甲醛和0.5% TritonX-100 于室温进行固定和通透。5%BSA 封闭1 h 后依次使用一抗和荧光二抗各孵育1 h。经DAPI 染色15 min 后用50% 甘油封片,使用激光共聚焦显微镜观察。Alexa Fluor 标记的羊抗兔及羊抗鼠IgG购自碧云天生物技术研究所。
1.5 跨内皮电阻测定
在Transwell 培养系统的上层小室中接种PAEC 细胞,按照说明书使用EVOM2 仪器连续监测其TEER 值直至数值稳定,接种HPS(108 CFU/mL)感染后连续监测上层小室细胞的TEER 值,记录数值。
1.6 小干扰RNA(siRNA)转染
细胞培养至80% 融合后,按脂质体转染试剂盒说明书对各组细胞分别进行siRNA 转染,每孔细胞转染40 pmol 的siRNA。转染24 h 后进行HPS(108CFU/mL)感染。各组细胞处理方法本文“1.2”所述。各干扰因子和阴性对照(negative control,NC)siRNA由上海吉玛公司设计合成(序列见表2),根据说明书要求配制。
1.7 统计学分析
所有试验进行3 次独立重复检测,数据以平均值±标准误差(SEM)表示。使用单向方差(ANO⁃VA)进行统计学显著性分析。*表示其统计值存在显著差异,Plt;0.05;**表示其统计值存在极显著差异Plt;0.01。统计分析使用软件Prism 8(GraphPad)。
2 结果与分析
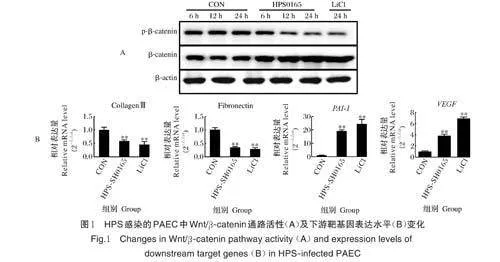
2.1 HPS 感染PAEC 对Wnt/β-catenin 信号通路活性及其下游靶基因表达的影响
Western blot 检测结果显示,HPS-SH0165 感染后PAEC 中β-catenin 的蛋白水平呈时间依赖性增高,磷酸化β-catenin(p-β-catenin)水平显著降低,表明HPS 感染的PAEC 中Wnt/β-catenin 通路被激活(图1A)。荧光定量PCR 检测结果显示,HPSSH0165感染PAEC 后,Wnt/β-catenin 通路下游维持细胞与基底的黏附力的纤连蛋白(fibronectin)和胶原蛋白Ⅲ(collagen Ⅲ)基因表达量下降,促进细胞迁移的纤溶酶原激活物抑制物(PAI-1)基因和和促进内皮细胞渗漏的血管内皮生长因子(VEGF)基因表达量明显上调,表明HPS 感染激活PAEC 中的Wnt/β-catenin 通路促使内皮细胞黏附性降低、移动性增加,使得内皮细胞构成的屏障稳定性被破坏(图1B)。
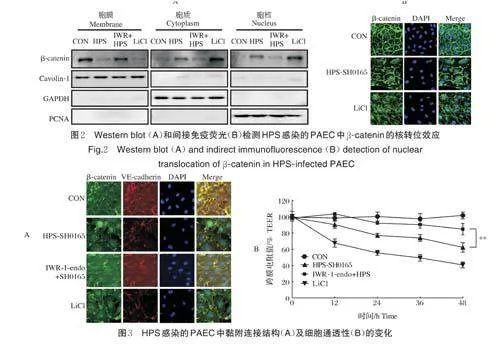
2.2 HPS 对PAEC 中β-catenin 蛋白核转位效应的影响
分离提取PAEC 不同细胞结构中的蛋白质,经过Western blot 检测发现,HPS-SH0165 刺激PAEC后,胞膜上的β-catenin 含量减少,而胞质和胞核中β-catenin 蛋白水平显著增加(图2A)。间接免疫荧光试验的结果同样显示,HPS-SH0165 刺激PAEC 后,胞膜上的β-catenin 含量减少,β-catenin 聚集于胞质并大量转位入核(图2B)。该结果进一步证明HPS 对PAEC 中Wnt/β-catenin 通路的激活效应。
2.3 Wnt/β-catenin 通路对HPS 感染的PAEC 中黏附连接结构及细胞通透性的影响
间接免疫荧光检测结果显示,HPS 感染的PAEC 细胞中β -catenin 转位入核,VE-cadherin 表达水皮降低,胞膜处构成细胞间黏附连接结构的β -catenin/VE-cadherin 复合物减少。在使用Wnt/β -catenin 通路特异性抑制剂IWR-1-endo 处理后,HPS 感染的PAEC 中β-catenin 的核转位效应减弱,VE-cadherin 表达水平升高,β-catenin/VE-cadherin复合物含量明显恢复(图3A)。Transwell 检测结果显示,HPS 刺激后,PAEC 形成的单层细胞屏障通透性增强,在用Wnt/β-catenin 通路特异性抑制剂IWR-1-endo 处理后通透性明显恢复(图3B)。以上结果表明,Wnt/β-catenin 通路介导了对HPS 感染时内皮细胞间黏附连接结构的调控,从而影响血管内皮细胞通透性。
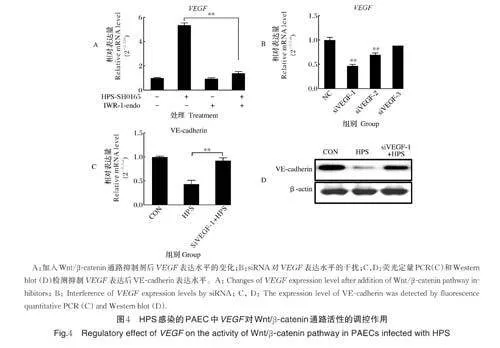
2.4 VEGF 对HPS感染的PAEC中VE-caherin 表达水平的影响
荧光定量检测结果显示,HPS 感染可以引起VEGF 基因的显著上调,在抑制Wnt/β-catenin 通路活性后,VEGF 的表达量明显下降,表明Wnt/β -catenin 通路调控HPS 感染引起的PAEC 中VEGF 基因的表达(图4A)。筛选特异性沉默猪VEGF 基因的siRNA 抑制PAEC 中VEGF 基因的表达(图4B),荧光定量(图4C)及Western blot(图4D)检测发现,抑制VEGF 表达可以显著恢复HPS感染的PAEC 中VE-cadherin 的表达水平。以上结果表明,HPS 通过激活Wnt/β -catenin 通路上调VEGF 表达,促使PAEC 中VE-cadherin 的表达水平降低。
2.5 VEGF 对HPS感染的PAEC中黏附连接结构的影响
间接免疫荧光检测结果显示,抑制VEGF 可以明显恢复HPS 感染的PAEC 胞膜处VE-cadherin 的蛋白水平,同时显著减少β-catenin 的核转位,增加胞膜处β-catenin/VE-cadherin 复合物含量,恢复内皮细胞间黏附连接结构(图5A)。表明VEGF 对Wnt/β-catenin 通路激活引起的β-catenin 核转位存在放大反馈调节作用,同时HPS 上调VEGF 可以显著抑制PAEC 中VE-cadherin 的表达。Transwell 试验结果显示抑制VEGF 的表达可以明显降低HPS 感染时单层PAEC 的通透性(图5B)。以上结果表明,HPS 感染的PAEC 中,VEGF 可以通过对Wnt/β-catenin 通路的放大反馈调节作用进一步破坏内皮细胞间黏附连接结构及内皮屏障的完整性。
3 讨论
前期研究表明,在HPS 感染过程中,猪肺泡巨噬细胞分泌的抵抗素(resistin)可以破坏血管内皮细胞间由Claudin-5 和Occludin 蛋白构成的紧密连接结构(tight junctions)[12]。但在该研究中发现,抵抗素对内皮细胞中负责构成黏附连接的VE-cadherin 表达水平没有明显影响。本研究结果显示,HPS 可以通过Wnt/β -catenin 通路直接调控PAEC 中VE-cad⁃herin 的表达,而不依赖于抵抗素的调节作用。
在HPS 感染过程中,Wnt/β-catenin 信号通路的作用存在一定的复杂性。在以上皮细胞作为HPS 感染模型的研究中发现,HPS 激活Wnt/β-catenin 信号通路后,可以抑制上皮细胞中E-cadherin 的表达,同时促进间质细胞标志性基因N-cadherin 的表达,促使上皮细胞表型向间质细胞转变,即发生上皮-间质转换效应(epithelial-mesenchymal transition, EMT),从而破坏上皮细胞屏障的稳定性,促进细菌向宿主全身的扩散[13-14]。在此过程中,Wnt/β-catenin 通路通过调控下游TCF/LEF 转录因子(如Snail 和Slug)与E-cadherin 基因启动子区域结合,直接调控细胞中Ecadherin的表达[15-16]。然而,目前尚未有研究证明Wnt/β-catenin 通路可以直接调控VE-cadherin 的表达,本研究的结果显示,在HPS 感染过程中,Wnt/β-catenin 通路通过上调VEGF 表达,降低PAEC 中VE-cadherin 的表达水平,抑制VE-cadherin 在细胞间形成黏附连接。有研究表明,VEGF 对VE-cad⁃herin 的调控在血管重塑与生成、人类卵巢癌的病理性腹水形成等生理和病理过程中都具有重要作用[17-18],这与本研究的结果相符。
综上所述,本研究证明Wnt/β-catenin 通路介导HPS 感染的猪内皮细胞中黏附连接结构的断裂,促使内皮细胞结构受损、细胞通透性增加。同时,HPS感染上调Wnt/β-catenin 通路下游靶基因VEGF 的表达,VEGF 通过正反馈调节放大HPS 感染引起的Wnt/β -catenin 通路的激活效应,并抑制PAEC 中VE-cadherin 的表达。本研究解析了HPS 感染过程中Wnt/β-catenin 通路对内皮细胞结构完整性的调节作用,明确了VEGF 在HPS 引起内皮屏障损伤的过程中所发挥的正反馈放大效应。

