紫花牡荆素通过上调miR-342-3p抑制宫颈癌HeLa细胞糖酵解
林佳芝, 宁舒婷, 邓金金, 冯伟峰, 宁映霞,3*
(1.广州医科大学 附属第一医院 妇产科, 广东 广州 510120; 2.暨南大学 附属第一医院 中医科, 广东 广州 510630;3.暨南大学 附属第一医院 妇产科, 广东 广州 510630)
宫颈癌是全球的四大癌症之一,同时也是女性肿瘤相关死亡的四大原因之一[1]。随着人乳头状瘤病毒疫苗的推广,宫颈癌的发病率在全球范围内有所下降,但是在全球大部分的中低水平发展中国家宫颈癌的发病率及相关的死亡人数仍然居高不下[2]。早期宫颈癌患者可通过手术治疗而治愈,但晚期患者生存率很低[3]。因此,迫切需要研究和开发新的治疗宫颈癌的靶向药物以改善宫颈癌晚期患者的临床结局。
据报道,相比于正常细胞,肿瘤细胞更加倾向于有氧糖酵解和葡萄糖的摄取[4],并将所摄取的葡萄糖代谢为乳酸,而不是在有氧条件下通过氧化磷酸化产生能量,这一现象被称为“Warburg效应”[5]。微小RNA(microRNAs, miRNAs)是一类长度大约为19~24个核苷酸的内源性、进化保守的非编码单链RNA,是一种转录后调节因子[6]。miRNAs异常表达通常会引起包括肿瘤在内的多种疾病发生[6-8]。研究发现miR-342-3p在宫颈癌中呈低表达状态,并且miR-342-3p与宫颈癌的增殖、侵袭和迁移有关[9-10]。然而有关于miR-342-3p与宫颈癌糖酵解关系的研究目前少见报道。
紫花牡荆素(Casticin)是从牡荆属植物提取的一种天然黄酮类化合物,是中国传统中草药蔓荆子的主要活性成分之一[11],已证明具有消炎和抗肿瘤等多种药理活性[12]。然而,关于紫花牡荆素能否通过上调miR-342-3p抑制宫颈癌HeLa细胞的糖酵解尚未见报道。
1 材料与方法
1.1 材料
1.1.1 细胞系
宫颈癌HeLa细胞系细胞和永生化人宫颈上皮细胞H8细胞系细胞购自中国科学院细胞库(上海),冻存于湖南师范大学医药学实验管理中心。
1.1.2 受试物
紫花牡荆素由湖南师范大学医学院药学系曹建国教授惠赠,本品性状为黄色晶状体,纯度为99%。将紫花牡荆素溶解于二甲亚砜(DMSO)中,配制成质量浓度为1 mg/mL的紫花牡荆素储存液,保存于4℃冰箱。
1.1.3 主要试剂与耗材
DMEM高糖培养基购自美国Gibco公司;胎牛血清购自OriCell®公司;双抗混合液购自Coolaber®公司;Costar 6孔板细胞培养板和T25培养瓶购自美国Corning公司;Cell Counting Kit-8购自美国MedChemExpress公司;micrON hsa-miR-342-3p mimic、micrOFF hsa-miR-342-3p inhibitor、RiboFECTTMCP Buffer转染试剂购自中国广州锐博生物科技有限公司;miRcute miRNA提取分离试剂盒购自中国天根生化科技有限公司;All-in-oneTMmiRNA first-strand cDNA synthesis kit和All-in-oneTMqPCR Mix试剂盒购自美国Genecopoeia公司;葡萄糖(GO)测定试剂盒和乳酸检测试剂盒购自Sigma公司。
1.1.4 主要仪器设备
超净工作台(苏州净化设备公司;型号YJ-875);二氧化碳培养箱(美国Thermo公司;型号311);普通高速离心机(上海安亭科学仪器厂;型号TGL-16C);荧光倒置显微镜(日本Olympus公司;型号:BX41);Mastercycler Gradient PCR仪(德国eppendorf公司);CFX connect荧光定量PCR分析仪(美国伯乐公司);多功能酶标仪(美国Bio-tek公司;型号Synergy 2型);分光计阅读器(上海赛默飞世尔仪器有限公司)。
1.2 研究方法
1.2.1 细胞培养
宫颈癌HeLa细胞和人宫颈上皮永生化细胞H8细胞用含双抗混合液和10%胎牛血清的DMEM高糖培养基,在37 ℃的二氧化碳培养箱中贴壁培养。
1.2.2 紫花牡荆素处理
为了确定紫花牡荆素合适的使用浓度,用不同浓度的紫花牡荆素(0,3,10,30,100,300 nmol/L)处理宫颈癌HeLa细胞和永生化人宫颈上皮细胞H8细胞24 h。
为了测定紫花牡荆素对HeLa细胞miR-342-3p表达、葡萄糖消耗量和乳酸产量的影响,使用0,10,30,100 nmol/L的紫花牡荆素处理HeLa细胞24 h。
为了检测紫花牡荆素联合miR-342-3p模拟物或抑制物对HeLa细胞miR-342-3p表达、葡萄糖消耗量和乳酸产量的影响,用或不用紫花牡荆素(30 nmol/L)处理经miR-342-3p模拟物或抑制物转染的HeLa细胞24 h。
1.2.3 CCK-8实验
按照Cell Counting Kit-8试剂盒说明书,将宫颈癌HeLa细胞和永生化人宫颈上皮细胞H8细胞以(1×103)/孔接种于96孔板中,用紫花牡荆素(0,3,10,30,100,300 nmol/L)处理上述细胞,置于37 ℃二氧化碳培养箱中培养24 h。用含10 μL CCK-8溶液的100 μL生长培养基更换原有的培养基, 37 ℃培养箱继续孵育2 h。用分光计阅读器测量450 nm处的吸光度,评估上述两种细胞的细胞活性,确定紫花牡荆素的合适的药物使用浓度。
1.2.4 miRNA转染
将对数生长期HeLa细胞以(1×106)/孔接种于6孔板中,随后按照micrON hsa-miR-342-3p mimic的说明书的方法,将miR-342-3p模拟物(miR-342,转染浓度50 nmol/L)和模拟物阴性对照寡核苷酸(miR-NC)用RiboFECTTMCP Buffer转染试剂转入HeLa细胞。按照micrOFF hsa-miR-342-3p inhibitor说明书将miR-342-3p抑制物(Anti-342,转染浓度100 nmol/L)和抑制物阴性对照寡核苷酸(Anti-NC)使用RiboFECTTMCP Buffer转染试剂转入HeLa细胞。细胞转染后继续于二氧化碳培养箱培养24 h获得转染的细胞,用于后续实验。
1.2.5 RT-qPCR
根据miRcute miRNA提取分离试剂盒的说明书提取各组细胞的总microRNA,使用酶标仪测定总microRNA的A260/A280值,并根据All-in-oneTMmiRNA first-strand cDNA synthesis kit说明书将所提取的各组总microRNA在PCR仪上进行逆转录反应合成cDNA链,随后根据All-in-oneTMqPCR Mix试剂盒说明书用CFX connect荧光定量PCR分析仪完成qPCR反应。以U6作为内参,结果用 2-ΔΔCt方法分析。miR-342-3p和内参 U6 引物如表1所示。

表1 引物序列Table 1 Primer sequences
1.2.6 葡萄糖消耗和乳酸产物的测定
将对数生长期HeLa细胞以(1×106)/孔接种于6孔板,使用不含酚红的DMEM高糖培养基进行培养,24 h后收集细胞培养液,按照葡萄糖(GO)测定试剂盒说明书检测各组细胞培养液中葡萄糖浓度,与对照组细胞培养液的葡萄糖浓度的浓度差即为葡萄糖消耗量。按照乳酸检测试剂盒的说明书检测不同处理组细胞和对照组细胞培养液中乳酸盐水平。
1.3 统计学分析
使用SPSS 20.0软件分析所获得的各组实验数据。各实验组数据用均数±标准差表示,使用One Way ANOVA方差分析;当方差齐性时,多组均数间比较采用LSD法,当方差不齐时,多组均数间采用Dunnett’s检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 紫花牡荆素对HeLa细胞的细胞活力的影响
检测不同浓度紫花牡荆素对 HeLa细胞和 H8细胞的存活力的影响,结果如图1所示:与对照组(0 nmol/L)紫花牡荆素处理的细胞相比,100和300 nmol/L的紫花牡荆素显著抑制HeLa细胞的存活力,但不影响正常H8细胞的存活力(P<0.05)。由于100 nmol/L和300 nmol/L的紫花牡荆素均对H8细胞无细胞毒性,而对HeLa细胞具有显著的细胞毒性,因此在后续实验中选用最少用药剂量为本研究的最大用药浓度,即确定本研究实验中紫花牡荆素的用药浓度范围为0,10,30,100 nmol/L。
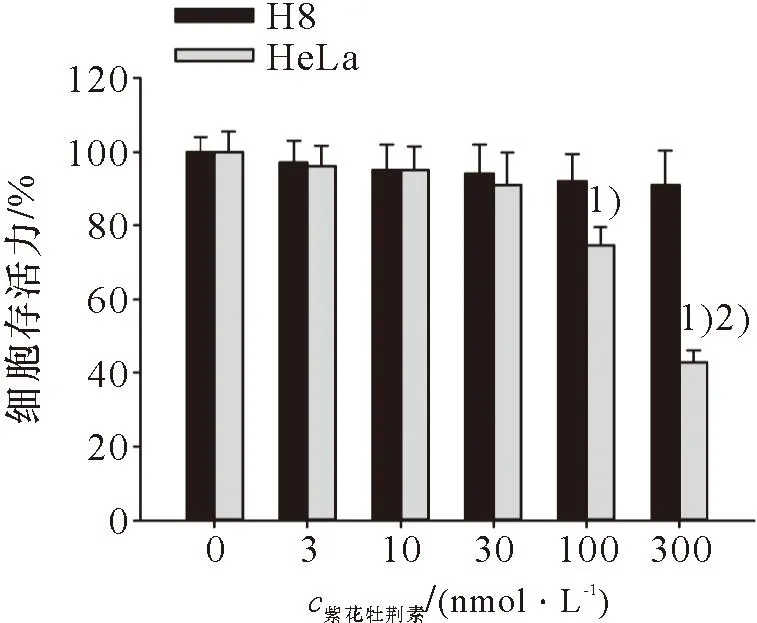
1)与对照组比较,P<0.05;2)与100 nmol/L的紫花牡荆素比较,P<0.051)Compared with control group, P<0.05; 2)Compared with 100 nmol/L Casticin,P<0.05图1 紫花牡荆素对宫颈癌HeLa细胞的细胞毒性作用Figure 1 The toxic effect of Casticin on cervical cancer HeLa cells
2.2 紫花牡荆素对宫颈癌抑癌性miRNAs表达水平的影响
紫花牡荆素对宫颈癌抑癌性miRNAs表达水平的影响结果如图2所示:紫花牡荆素明显上调miR-342-3p、miR-43c-5p、miR-1284的表达水平,尤其是显著上调miR-342-3p的表达水平(P<0.05)。

1)与对照组(0.1%DOSM)比较,P<0.051) Compared with control group (0.1%DOSM), P<0.05图2 紫花牡荆素对宫颈癌抑癌性miRNAs表达水平的影响Figure 2 The effect of Casticin on the expression level of cancer-suppressing miRNAs in cervical cancer
2.3 紫花牡荆素对HeLa细胞miR-342-3p表达的影响
紫花牡荆素对HeLa细胞miR-342-3p表达的影响结果如图3所示:10、30、100 nmol/L的紫花牡荆素上调HeLa细胞miR-342-3p表达,其中100 nmol/L的紫花牡荆素上调HeLa细胞miR-342-3p表达最为显著。
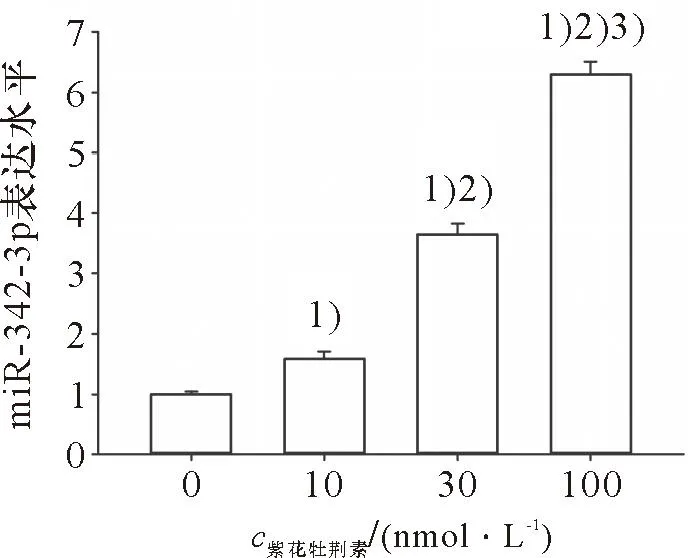
1)与对照组比较,P<0.05;2)与10 nmol/L的紫花牡荆素比较,P<0.05;3)与30 nmol/L的紫花牡荆素比较,P<0.051) Compared with control group, P<0.05; 2)Compared with 10 nmol/L Casticin,P<0.05; 3)Compared with 30 nmol/L Casticin,P<0.05图3 紫花牡荆素对HeLa细胞miR-342-3p表达的影响Figure 3 The effect of casticin on the expression of miR-342-3p in HeLa cells
2.4 紫花牡荆素对HeLa细胞糖酵解的影响
紫花牡荆素对HeLa细胞糖酵解的影响结果如图4所示:10、30、100 nmol/L的紫花牡荆素处理24 h后均降低HeLa细胞对葡萄糖的消耗量(图4A)和抑制HeLa细胞的乳酸产量(图4B),与浓度10、30 nmol/L的紫花牡荆素相比,100 nmol/L的紫花牡荆素显著降低体外培养HeLa细胞的葡萄糖消耗量和乳酸产量。
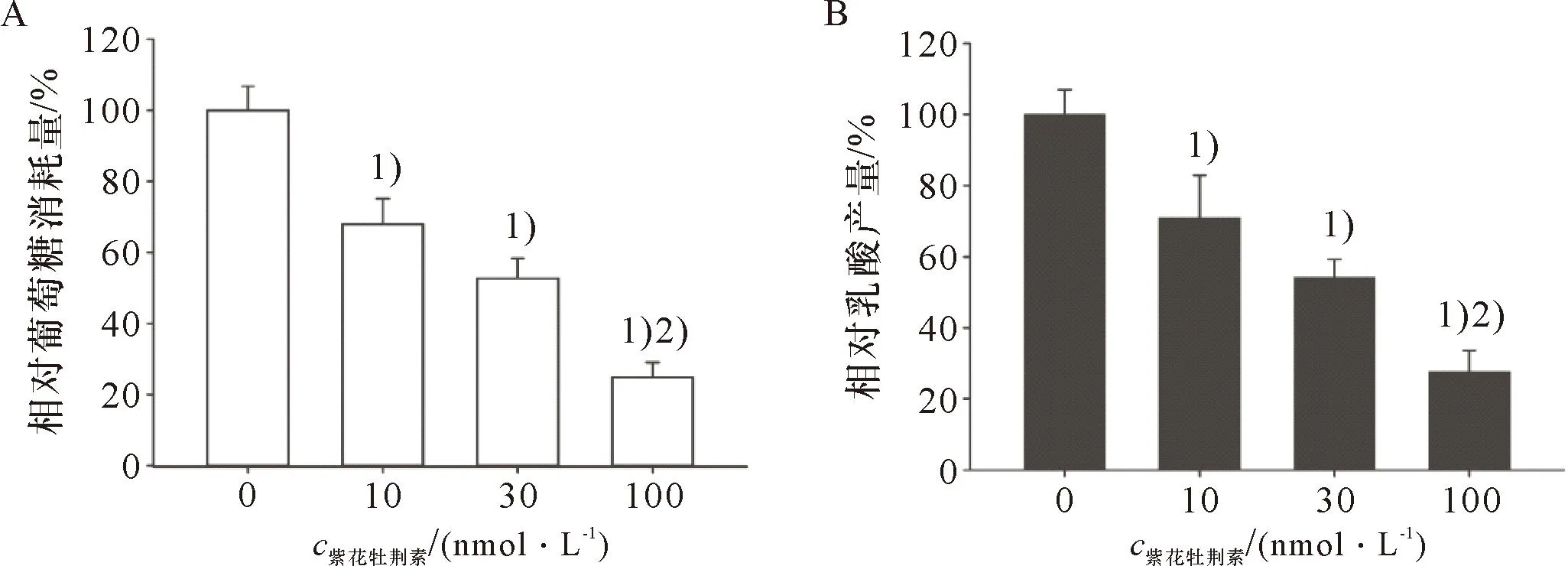
1)与对照组比较,P<0.05;2)与10或30 nmol/L的紫花牡荆素比较,P<0.051)Compared with control group, P<0.05; 2)Compared with 10 nmol/L or 30 nmol/L Casticin,P<0.05A:紫花牡荆素处理的HeLa细胞葡萄糖消耗量;B:紫花牡荆素处理的HeLa细胞乳酸产量A: The glucose consumption in HeLa cells treated with Casticin; B: The lactate production in HeLa cells treated with Casticin.图4 紫花牡荆素对HeLa细胞糖酵解的影响Figure 4 The effect of Casticin on glycolysis of HeLa cells
2.5 miR-342-3p模拟物对HeLa细胞miR-342-3p表达的影响
miR-342-3p模拟物对HeLa细胞miR-342-3p表达的影响结果如图5所示:与未转染的HeLa细胞和转染阴性对照组的细胞(miR-NC)相比,miR-342-3p模拟物显著上调HeLa细胞的miR-342-3p表达(P<0.05)。
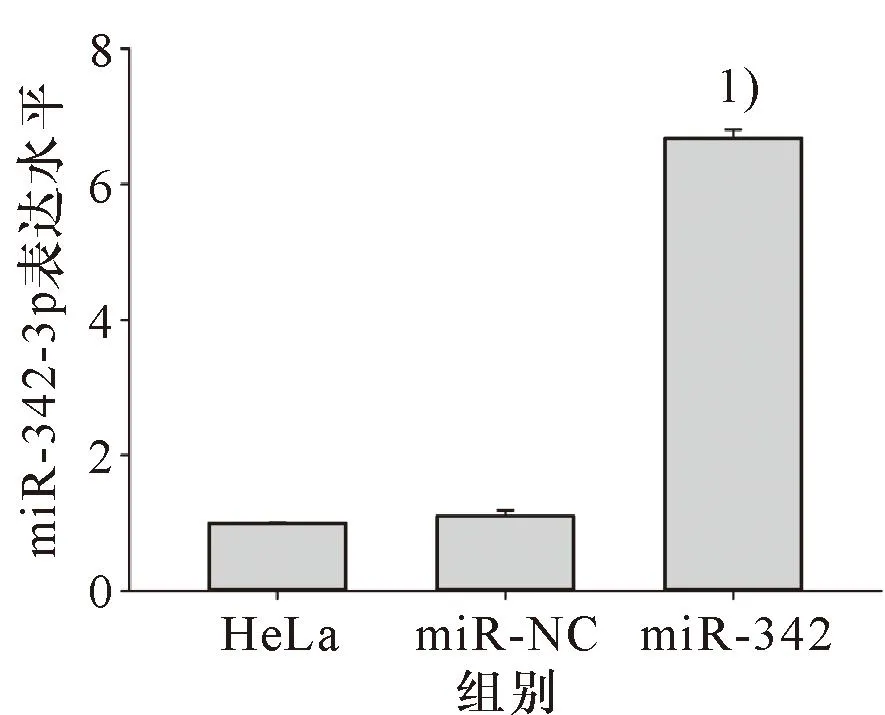
1)与未转染的HeLa细胞或转染miR-NC的HeLa细胞比较,P<0.05。1) Compared with HeLa or miR-NC, P<0.05.图5 miR-342-3p模拟物对HeLa细胞miR-342-3p表达的影响Figure 5 The effect of miR-342-3p mimic on the expression of miR-342-3p in HeLa cells
2.6 miR-342-3p模拟物对HeLa细胞糖酵解的影响
miR-342-3p模拟物对HeLa细胞糖酵解的影响结果如图6:miR-342-3p模拟物降低HeLa细胞的相对葡萄糖消耗量和乳酸产量(P<0.05)。
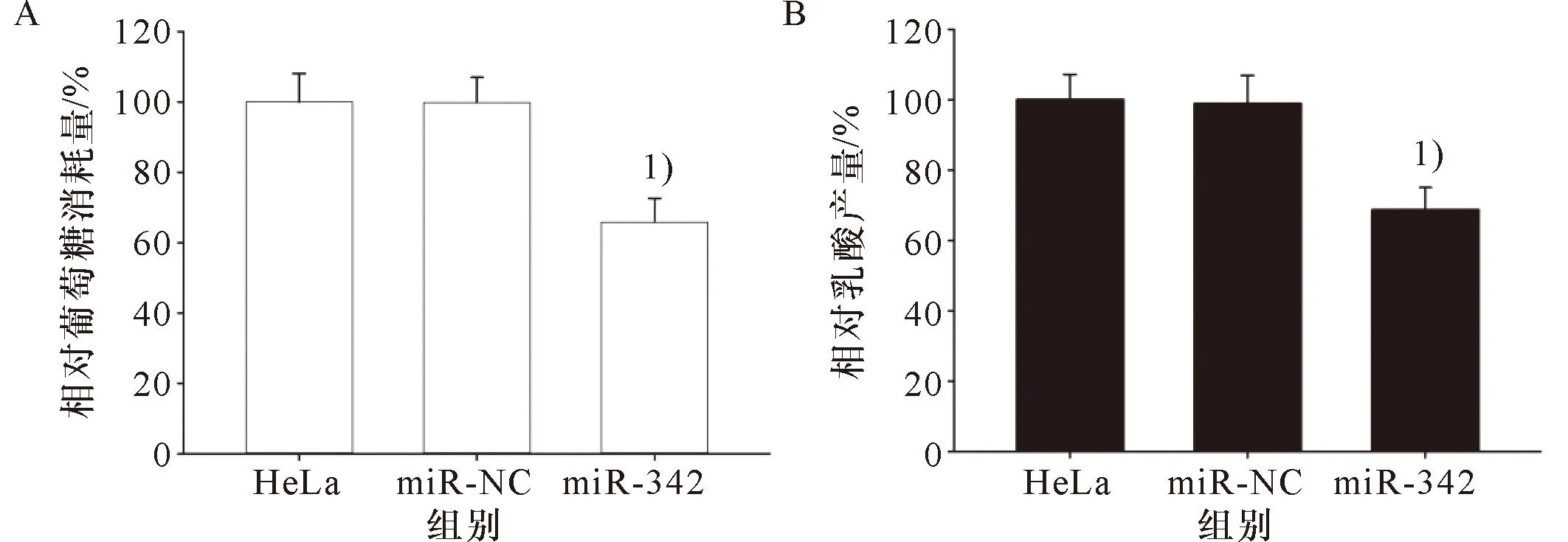
1)与HeLa细胞或miR-NC比较,P<0.051)Compared with HeLa cells or miR-NC, P<0.05A:miR-342-3p模拟物对HeLa细胞的葡萄糖消耗量的影响;B:miR-342-3p模拟物对HeLa细胞乳酸产量的影响A: The effect of miR-342-3p mimic on glucose consumption in HeLa cells; B:The effect of miR-342-3p mimic on lactate production in HeLa cells.图6 miR-342-3p模拟物对HeLa细胞糖酵解的影响Figure 6 The effect of miR-342-3p mimic on glycolysis of HeLa cells
2.7 miR-342-3p模拟物联合紫花牡荆素对HeLa细胞miR-342-3p表达的影响
miR-342-3p模拟物联合紫花牡荆素对 HeLa细胞miR-342-3p表达水平的作用,结果如图7所示:miR-342-3p模拟物和30 nmol/L紫花牡荆素均上调HeLa细胞的miR-342-3p表达;miR-342-3p模拟物增强紫花牡荆素上调HeLa细胞的miR-342-3p表达的作用(P<0.05)。

1)与miR-NC比较,P<0.05;2)与单独的miR-342或30 nmol/L的紫花牡荆素比较,P<0.051)Compared with miR-NC, P<0.05; 2)Compared with miR-342 or 30 nmol/L Casticin alone,P<0.05图7 miR-342-3p模拟物联合紫花牡荆素对HeLa细胞miR-342-3p表达水平的影响Figure 7 The effect of miR-342-3p mimic combined with Casticin on the expression level of miR-342-3p in HeLa cells
2.8 miR-342-3p模拟物联合紫花牡荆素对HeLa细胞糖酵解的影响
miR-342-3p模拟物联合紫花牡荆素对HeLa细胞糖酵解的影响结果如图8所示:miR-342-3p模拟物转染和30 nmol/L的紫花牡荆素处理均降低HeLa细胞葡萄糖消耗量(A)和抑制HeLa细胞的乳酸产生(B),并且miR-342-3p模拟物增强紫花牡荆素抑制HeLa细胞葡萄糖消耗量(A)和抑制HeLa细胞的乳酸产生的作用(B)。
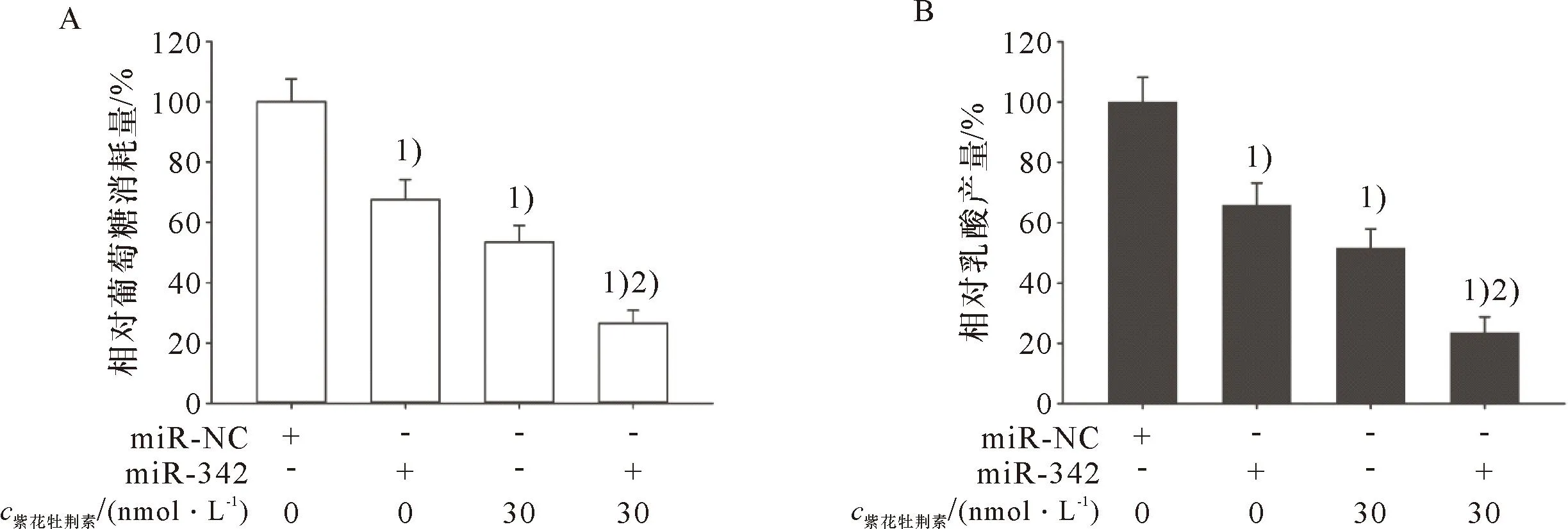
1)与miR-NC比较,P<0.05;2)与单独的miR-342或30 nmol/L的紫花牡荆素比较,P<0.051)Compared with miR-NC, P<0.05; 2)Compared with miR-342 or 30 nmol/L Casticin alone,P<0.05A:miR-342-3p模拟物联合紫花牡荆素处理的HeLa细胞的葡萄糖消耗量;B:miR-342-3p模拟物联合紫花牡荆素处理的HeLa细胞的乳酸产量A:The glucose consumption in HeLa cells treated with miR-342-3p mimic combined with Casticin; B: The lactate production in HeLa cells treated with miR-342-3p mimic combined with Casticin.图8 miR-342-3p模拟物联合紫花牡荆素对HeLa细胞糖酵解的影响Figure 8 The effect of miR-342-3p mimic combined with Casticin on glycolysis of HeLa cells
2.9 miR-342-3p抑制物对HeLa细胞miR-342-3p表达的影响
miR-342-3p抑制物对HeLa细胞miR-342-3p表达的影响结果如图9所示:与未转染的HeLa细胞和阴性对照组的细胞(Anti-NC)相比,miR-342-3p抑制物降低HeLa细胞miR-342-3p表达水平(P<0.05)。
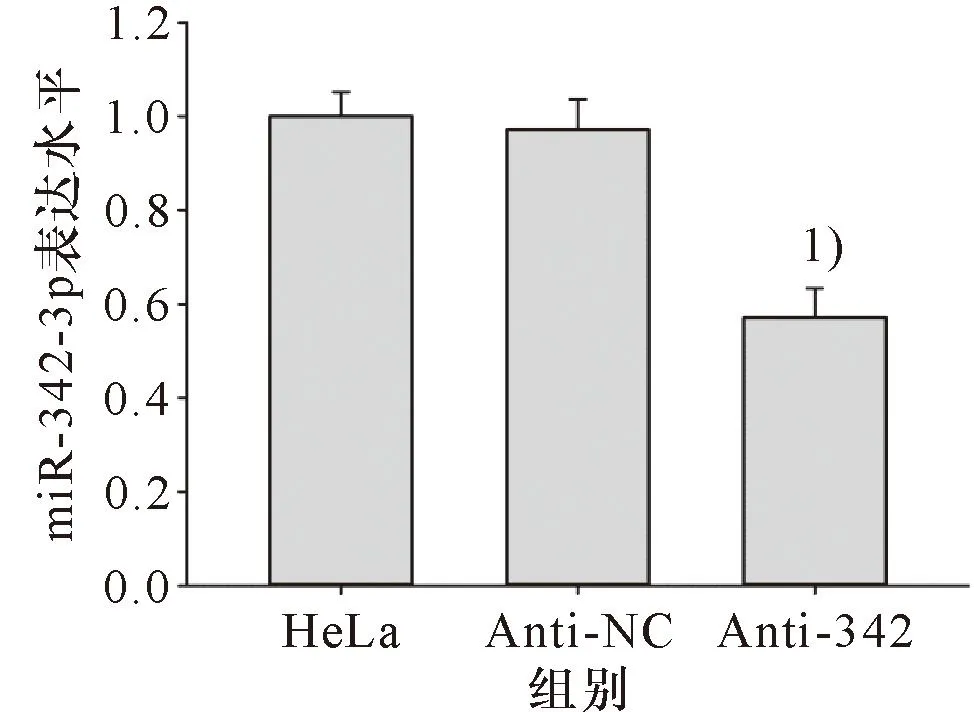
1)与未转染的HeLa细胞或转染Anti-NC的HeLa细胞比较,P<0.05。1) Compared with HeLa or Anti-NC, P<0.05.图9 miR-342-3p抑制物对HeLa细胞miR-342-3p表达的影响Figure 9 The effect of miR-342-3p inhibitor on the expression of miR-342-3p in HeLa cells
2.10 miR-342-3p抑制物对HeLa细胞糖酵解的影响
miR-342-3p抑制物对HeLa细胞糖酵解的影响结果如图10所示:miR-342-3p抑制物增加HeLa细胞的相对葡萄糖消耗量和乳酸产量(P<0.05)。
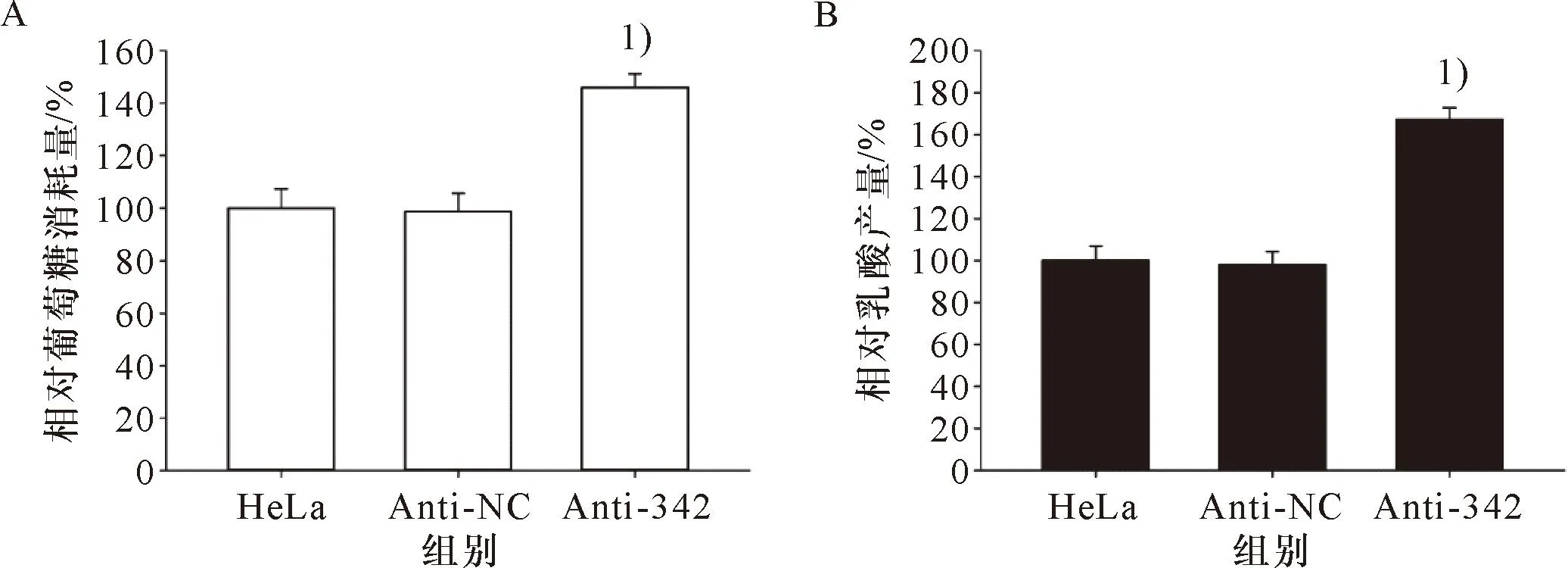
1)与HeLa细胞或Anti-NC比较,P<0.051)Compared with HeLa cells or miR-NC, P<0.05A:miR-342-3p抑制物对HeLa细胞的葡萄糖消耗量的影响;B:miR-342-3p抑制物对HeLa细胞乳酸产量的影响A: The effect of miR-342-3p inhibitor on glucose consumption in HeLa cells; B:The effect of miR-342-3p inhibitor on lactate production in HeLa cells.图10 miR-342-3p抑制物对HeLa细胞糖酵解的影响Figure 10 The effect of miR-342-3p inhibitor on glycolysis of HeLa cells
2.11 miR-342-3p抑制物联合紫花牡荆素对HeLa细胞miR-342-3p表达的影响
紫花牡荆素和 miR-342-3p模拟物联合使用对 HeLa细胞 miR-342-3p表达水平的作用,结果如图11所示:miR-342-3p抑制物降低HeLa细胞的miR-342-3p表达水平;30 nmol/L紫花牡荆素处理上调HeLa细胞的miR-342-3p表达;miR-342-3p抑制物救援紫花牡荆素上调HeLa细胞miR-342-3p表达作用(P<0.05)。

1)与Anti-NC比较,P<0.05;2)与Anti-342比较,P<0.05;3) 与 30 nmol/L紫花牡荆素比较,P<0.051)Compared with miR-NC, P<0.05; 2)Compared with Anti-342, P<0.05; 3)Compared with 30 nmol/L Casticin, P<0.05图11 miR-342-3p抑制物联合紫花牡荆素对HeLa细胞miR-342-3p表达的影响Figure 11 The effect of miR-342-3p inhibitor combined with Casticin on the expression level of miR-342-3p in HeLa cells
2.12 miR-342-3p抑制物联合紫花牡荆素对HeLa细胞糖酵解的影响
miR-342-3p抑制物联合紫花牡荆素对 HeLa细胞糖酵解的影响,结果如图12所示:miR-342-3p抑制物增加HeLa细胞的葡萄糖消耗量(A)和乳酸产量(B);30 nmol/L紫花牡荆素处理降低HeLa细胞葡萄糖消耗量(A)和抑制乳酸产量(B);miR-342-3p抑制物减弱紫花牡荆素降低HeLa细胞葡萄糖消耗量(A)和乳酸产量(B)作用。
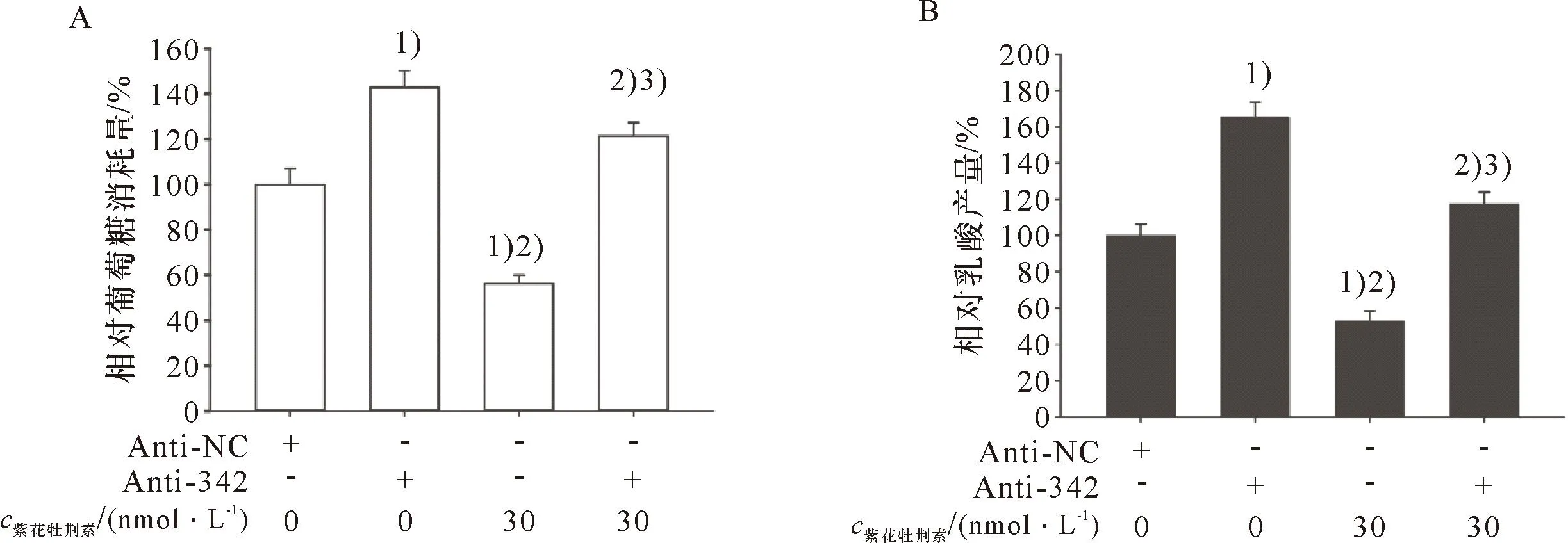
1)与Anti-NC比较,P<0.05;2)与Anti-342比较,P<0.05;3)与 30 nmol/L紫花牡荆素比较,P<0.051)Compared with miR-NC, P<0.05; Compared with Anti-342, P<0.05; 3)Compared with 30 nmol/L Casticin, P<0.05A:miR-342-3p抑制物联合紫花牡荆素处理的HeLa细胞的葡萄糖消耗量;B:miR-342-3p抑制物联合紫花牡荆素处理的HeLa细胞的乳酸产量A: The glucose consumption in HeLa cells treated with miR-342-3p inhibitor combined with Casticin; B: The lactate production in HeLa cells treated with miR-342-3p inhibitor combined with Casticin.图12 miR-342-3p抑制物联合紫花牡荆素对HeLa细胞糖酵解的影响Figure 12 The effect of miR-342-3p inhibitor combined with Casticin on glycolysis of HeLa cells
3 讨论
宫颈癌是女性肿瘤死亡的主要原因之一[1]。机体表达异常的miRNAs是引起肿瘤及其他疾病发生的一个关键因素[6-8],同时肿瘤的进展与肿瘤细胞自身的能量代谢特征相关[5]。因此研究和开发治疗宫颈癌的新药物对改善宫颈癌患者的临床结局具有重要的意义。
miRNAs与肿瘤细胞的糖酵解有着密切联系。现有的研究表明,在结直肠癌中,低氧的环境下miR-103a-3p能促进结直肠癌细胞的糖酵解[13]。在肝细胞癌中,miR-30a-5p则降低肝细胞癌的乳酸生成和葡萄糖消耗[14],并且miR-210-3p、miR-105-5p和miR-767-5p促进三阴性乳腺癌细胞的乳酸生成和葡萄糖消耗[15]。Hou等[16]研究发现miR-30d通过直接靶向转录因子RUNX1抑制胰腺癌细胞的糖酵解;miR-34a抑制HeLa和SiHa细胞的葡萄糖消耗;miR-145降低宫颈癌细胞的糖酵解[17]。本团队前期研究中同样发现,miR-99a-5p抑制卵巢癌SKOV3细胞的糖酵解[18]。Wang等[19]研究发现使用 miR-99a-5p模拟物转染宫颈癌SiHa细胞后显著降低其糖酵解并诱导细胞凋亡,Zhang等[20]的研究也表明miR-34a显著抑制HeLa和SiHa细胞的葡萄糖消耗。Romero-Cordoba等[21]的研究发现,miR-342-3p的低表达导致MCT1过度表达最终促进三阴性乳腺癌细胞的糖酵解。刘文鹏[22]的研究表明,miR-342-3p抑制肝细胞癌对葡萄糖的摄取和乳酸的产生。然而有关于miR-342-3p与宫颈癌糖酵解关系目前未见报道。在本研究中,用miR-342-3p模拟物或抑制物转染宫颈癌HeLa细胞,发现miR-342-3p模拟物降低HeLa细胞的葡萄糖消耗量和乳酸产量,相反miR-342-3p抑制物则促进宫颈癌HeLa细胞对葡萄糖的摄取和乳酸的产生,这些结果证实miR-342-3p抑制宫颈癌细胞的糖酵解。
研究报道,紫花牡荆素可上调急性髓细胞白血病细胞miR-338-3p的表达[23]。本团队前期研究表明紫花牡荆素上调肝细胞癌miR-148a-3p表达[24]。来自大豆中的天然黄酮类化合物金雀异黄素能通过miR-199a-5p抑制卵巢癌细胞的糖酵解[18]。另外本团队前期研究还发现,蔓荆子总黄酮能上调肝细胞癌的 miR-342-3p,并抑制肝细胞癌的干性特征[25],在鼻咽癌中,紫花牡荆素通过靶向抑制磷脂酰肌醇 3-激酶抑制鼻咽癌细胞的生长[26],经紫花牡荆素处理后的大肠腺癌(DLD-1)、结直肠癌(HCT116)和结肠腺癌(Caco-2)细胞的增殖活性降低,同时抑制DLD-1细胞的集落形成能力[27]。另外,紫花牡荆素抑制人转化因子-β1诱导的宫颈癌HeLa细胞上皮——间质转化和侵袭能力[28]。然而,对于天然黄酮类类化合物的紫花牡荆素在宫颈癌microRNA调节和宫颈癌细胞糖酵解的作用尚未见报道。据此,本研究为探讨紫花牡荆素对宫颈癌HeLa细胞miR-342-3p表达和糖酵解的影响,用RT-qPCR检测不同浓度(0,10,30,100 nmol/L)的紫花牡荆素处理宫颈癌HeLa细胞后miR-342-3p表达水平,结果发现紫花牡荆素以浓度依赖的方式上调HeLa细胞miR-342-3p表达及以浓度依赖方式降低HeLa细胞葡萄糖消耗量和乳酸产量。研究显示另一种天然的黄酮类化合物金雀异黄素通过上调miR-199a-5p表达抑制卵巢癌SKOV3细胞的糖酵解[18]。因此,为进一步探究天然黄酮类化合物紫花牡荆素是否以类似的方式对宫颈癌HeLa细胞糖酵解进行调控,本研究用或不用紫花牡荆素(30 nmol/L)处理miR-342-3p模拟物或抑制物转染的HeLa细胞24 h,随后用RT-qPCR分析细胞miR-342-3p表达和测定细胞葡萄糖消耗量及乳酸产量,结果发现miR-342-3p模拟物增强花牡荆素上调HeLa细胞miR-342-3p表达,同时增强紫花牡荆素抑制HeLa细胞葡萄糖消耗量及乳酸产量,相反,miR-342-3p抑制物减弱紫花牡荆素上调HeLa细胞miR-342-3p表达作用及减弱紫花牡荆素抑制HeLa细胞葡萄糖消耗量与乳酸产量作用。因此,本研究揭示紫花牡荆素通过上调miR-342-3p表达抑制宫颈癌HeLa细胞糖酵解的药物作用机制。
天然黄酮类化合物已被证实具有抑制肿瘤干细胞活性[28]的作用,例如紫花牡荆素抑制人转化因子-β1所诱导的宫颈癌 HeLa细胞上皮间质转化和侵袭能力[29]。金雀异黄素抑制鼻咽癌肿瘤干细胞特性[30]及本团队前期研究[24]表明紫花牡荆素通过破坏DNA甲基转移酶1和miR-148a-3p之间的相互负调控联系抑制肝细胞癌的干性。然而,有关于紫花牡荆素调控宫颈癌细胞miR-342-3p表达抑制糖酵解的具体机制尚有待进一步研究。
作者贡献声明
林佳芝:实验操作,统计分析数据,撰写论文;宁舒婷、邓金金:实验操作;冯伟峰:设计实验,修改论文;宁映霞:提出研究思路和框架,修改论文。
利益冲突声明
本研究未受到企业、公司等第三方资助,所有作者之间不存在潜在利益冲突。

