土壤微生物群落结构对宅基地复垦种植禾草的响应
康 瑛, 胡 佳, 谢富贵, 郭芸君, 李 芹, 朱永群, 林超文, 张建华, 胡容平, 王 谢
(1. 成都天府绿道建设投资集团有限公司,成都 610041;2. 四川省农业科学院农业资源与环境研究所/农业农村部西南山地农业环境重点实验室,成都 610066)
【研究意义】随着城镇化发展,因村庄“空心化”出现大量闲置宅基地,极大浪费了土地资源。为了再利用废弃宅基地,盘活土地存量,全国各地政府纷纷开展宅基地复垦,以实现土地资源的有效利用。宅基地复垦土壤表层一般来源于地基翻耕土或土墙捣碎土,通常存在瓦片石块多、物理结构破坏严重、土壤板结、通气性差、养分含量低和生物活性弱等问题[1]。因此,宅基地复垦土壤必须经过整治和培肥措施,改善土壤理化性质、提升微生物活性和肥力,才能达到耕作的一般要求[2]。【前人研究进展】近年来,对于宅基地复垦土壤的研究逐渐增多,但多集中在复垦适宜性评价、复垦土壤物理性质和矿质养分变化等方向[3-4]。采用人工施肥结合作物种植或种植翻压绿肥的方式进行土壤改良和培肥,是解决复垦土壤物理结构不佳、养分贫瘠等限制的有效措施[5-6]。宅基地复垦种植后,植物生长代谢和分泌物可有效增加有机质组分输入,改善土壤生物活性,增强耕作适宜性。种植绿肥(苜蓿)、番茄、玉米等作物会明显提高耕层有机质含量,且土壤微生物量也会由几乎为0增加至100~400 mg/kg[7]。闫锐等[8]在宅基地复垦土壤上开展麦-玉轮作发现,耕层微生物量碳含量可提升54.59%,亚表层则可提升150.12%。这些研究都反映出作物种类和耕作方式对宅基地复垦土壤生物活性的影响具有异质性[9]。【本研究切入点】土壤微生物是土壤的重要组成部分之一,其活性是衡量土壤健康的重要指标。目前大多研究仅限于宅基地复垦前后土壤微生物数量的变化,对于微生物群落结构的变化情况知之甚少[9]。鉴于研究土壤微生物群落结构与作物种类之间的强关联性,如何选择肥土作物成为当前研究亟需解决的重要问题。【拟解决的关键问题】禾本科饲草因其耐贱踏、多年生且粗蛋白含量高,常作为荒山草坡修复和疏林改良的先锋植物,本研究以自然恢复为对照,以南方山区商业化最成熟的3种禾本科饲草(高羊茅、鸭茅和黑麦草)为例,研究禾本科饲草种植对宅基地复垦土壤细菌和真菌群落结构及其多样性的影响,剖析复垦土壤中关键菌群对饲草品种的响应,为禾草在改良宅基地复垦土壤中的应用提供科学依据。
1 材料与方法
1.1 试验设计与样品采集
本研究设4个处理,3次重复,共建立1.00 m×1.00 m试验小区12个。每个试验小区用1.00 m×0.30 m 塑料板(材质为PE)分割,小区内填充宅基地土壤厚度为30 cm。4个处理分别种植高羊茅(Festucaelata,处理简称FEA,包括FEA1、FEA2、FEA3共3个小区)、种植鸭茅(Dactylisglomerata,处理简称DGA,包括DGA1、DGA2、DGA3共3个小区)、种植黑麦草(Loliumperenne,处理简称LPE,包括LPE1、LPE2、LPE3共3个小区)和自然生态修复(Natural ecological restoration,简称NER,包括NER1、NER2、NER3共3个小区)。NER主要植被为狗尾草(Setariaviridis)、千里光(Senecioscandens)、一年蓬(Erigeronannuus)。宅基地土壤来自成都市锦江区狮子山(104.11° E,30.62° N,海拔492.31 m),该地区属亚热带湿润季风气候,终年温暖湿润,四季分明,年平均气温16.2 ℃左右;年平均降雨量800~1000 mm,雨量充沛,年无霜期大于300 d。试验土壤为黄壤,宅基地历史20年以上。2019年5月挖掘于坚硬水泥地下,6月布设小区,10月种植饲草,连续种植2年。2021年取样测定土壤微生物群落结构。
1.2 土壤微生物群落测定
采用高通量法[10]测定土壤微生物群落结构。土壤细菌群落分析基于16S rDNA通用引物PCR扩增及Illumina平台Miseq高通量测序技术。特异性引物为341F和806R。16S使用RDP classifier比对RDP数据库(http://rdp.cme.msu.edu/misc/resources.jsp),测序区间为V3~V4。土壤真菌群落分析基于真菌内转录间隔区(ITS)序列的Illumina MiSeq高通量测序技术,特异性引物为F2045和R2390。ITS使用Blast比对UNITE数据库(http://unite.ut.ee/index.php),测序区间为ITS1~ITS2。
1.3 统计与分析
为揭示土壤微生物多样性,分别对各处理细菌域和真菌域的观测物种数(Observed OTU,简称OBS指数)、Chao’s指数、基于丰度的物种覆盖度估值(Abundance-based Coverage Estimator,简称ACE指数)、Shannon多样性指数、Simpson多样性指数、Pielou均匀度指数进行方差分析和Turkey多重比较。
在注释的3587个细菌OTU和760种OTU中存在大量的稀少微生物。这些稀少微生物由于丰度较低,易造成计算的系统性误差。因此,以所有样本的绝对丰度之和大于100为标准对OTU进行筛选,构建新的关键物种OTU分类学信息数据集OTUs,以排除稀少微生物的影响。新构建的OTUs含602种细菌和339种真菌。
为揭示OTUs中物种丰度的数量级差异,利用密度图进行表示。为揭示土壤细菌群落和真菌群落对处理响应差异的可识别度,采用ward法进行聚类分析。为揭示OTUs中的关键微生物菌群和指示OTU,对每个细菌OTU和真菌OTU进行描述性统计分析、方差分析和Turkey多重比较,并将平均相对丰度大于1%、P<0.05的OTU作为关键指示物种。随后通过对关键指示物种进行聚类分析和相关性分析,以展示其内在关联。所有数据整理与分析基于R project 4.2.1。
2 结果与分析
2.1 宅基地复垦种植禾草对土壤细菌和真菌物种数量的影响
由表1可知,细菌物种数明显多于真菌,且各处理中细菌平均观测物种数、Chao’s指数、ACE指数、Shannon多样性指数、Simpson多样性指数和Pielou均匀度指数皆显著高于真菌(student’st检验的P>0.05)。由图1可知,在OTUs中,真菌丰度数量级高于细菌,表明相对于细菌而言,种植禾草更有利土壤真菌繁殖。此外,OTUs中细菌丰度数量级表现为(DGA,LPE)>FEA>NER(图1-A),真菌丰度数量级表现为LPE>DGA>(FEA,NER)(图1-B)。表明相对自然修复,种植禾草可以明显增加关键细菌和关键真菌丰度。但无论是细菌还是真菌,DGA、LPE、FEA和NER之间物种多样性和均匀性皆无显著差异(P>0.05,表1)。表明种植禾草植物对土壤微生物多样性和均匀性不会产生显著影响。

图1 处理间OTUs的数值分布特征Fig.1 The numerical distribution characteristics of the OTUs among the treatments
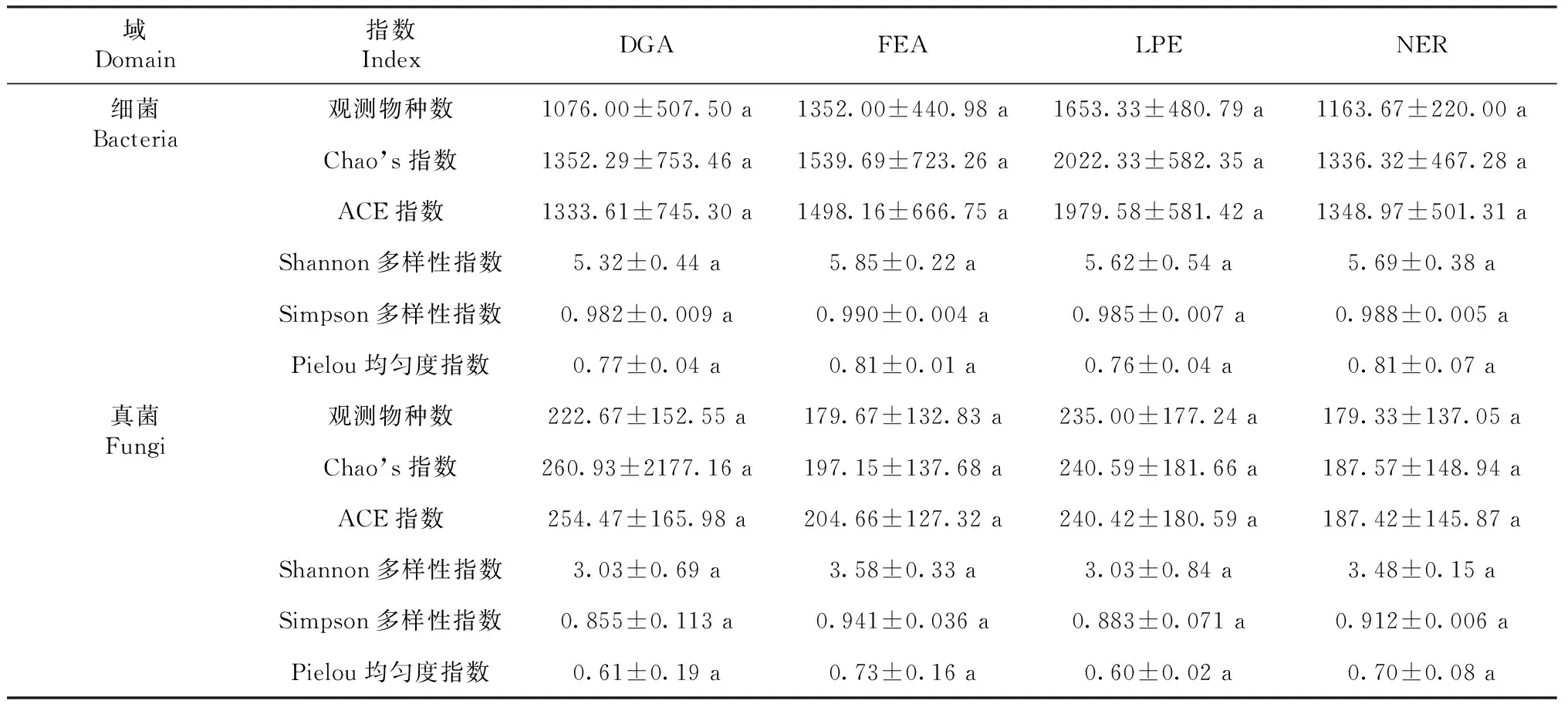
表1 各处理细菌域和真菌域物种分布多样性和均匀性Table 1 Diversity and uniformity of species distribution in bacterial and fungal domains in each treatment
2.2 宅基地复垦种植禾草对土壤微生物结构特征的影响
由聚类分析结果(图2)可知,利用OTUs细菌子集可较好区分NER、FEA,但对LPE和DGA处理无法有效区分其菌群结构差异。利用OTUs真菌子集可较好区分出NER,但不能有效区分FEA、LPE和DGA。表明相对自然恢复,种植禾草可显著改变细菌和真菌的群落结构,但不同禾本科植物种对细菌的影响比对真菌的影响更明显。

图2 各处理OTUs中细菌和真菌在门水平上的物种组成Fig.2 Species composition of bacteria and fungi at the phylum level in OTUs of different treatments
2.3 宅基地复垦种植禾草对土壤细菌和真菌物种组成的影响
由图3可知,各处理间OTUs中部分关键细菌和真菌组成在门水平上存在显著差异。
在细菌中(图3-A),有13个细菌门的相对丰度对处理具有显著响应(P<0.05)。相对于自然恢复,种植禾草显著增加了酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、装甲菌门(Armatimonadetes)、拟杆菌门(Bacteroidetes)、绿弯菌门(Chloroflexi)、芽单胞菌门(Gemmatimonadetes)、俭菌总门(Parcubacteria)、浮霉菌门(Planctomycetes)、变形菌门(Proteobacteria)、其他未分类细菌(unclassified_Bacteria)和疣微菌门(Verrucomicrobia)的相对丰度(P<0.05),显著降低了candidate_division_WPS-1菌门、Candidatus_Saccharibacteria菌门的相对丰度(P<0.05),而对蓝细菌(Cyanobacteria)-叶绿体(Chloroplast)菌门、厚壁菌门(Firmicutes)、Latescibacteria菌门、硝化螺旋菌门(Nitrospirae)的相对丰度无显著影响(P>0.05)。而在真菌中(图3-B),仅担子菌门(Basidiomycota)和未知真菌门(unclassified)的相对丰度对处理具有显著正响应(P<0.05),其他真菌门则对处理无显著响应(P>0.05)。
其中,在上述门水平上,较自然恢复而言,种植禾草下放线菌门(Actinobacteria)细菌、绿弯菌门(Chloroflexi)细菌、浮霉菌门(Planctomycetes)细菌和担子菌门(Basidiomycota)真菌的相对丰度增加5倍以上。FEA、DGA和LPE的放线菌门(Actinobacteria)细菌相对丰度分别是NER的5.09、6.16和6.05倍,绿弯菌门(Chloroflexi)细菌相对丰度分别是NER的13.07、4.63和6.96倍,浮霉菌门(Planctomycetes)细菌相对丰度分别是NER的3.39、6.36和6.48倍,担子菌门(Basidiomycota)真菌相对丰度分别是NER的14.24、1.56和2.12倍。
2.4 宅基地复垦种植禾草的土壤指示微生物物种
在OTUs中,显著响应处理的细菌OTU为206个(P<0.05)。各处理平均相对丰度大于1%的OTU有7个(表2)。其中,4个OTU相对丰度高于NER,分别是OTUB0008(沉积物杆状菌属Sediminibacterium细菌)、OTUB0041(Ohtaekwangia菌属细菌)、OTUB0024(未分类β-变形菌纲Betaproteobac teria细菌)和OTUB0007(链球菌属Streptococcus细菌)。3个OTU相对丰度低于NER,皆为鞘氨醇单胞菌属Sphingomonas细菌,分别是OTUB0045、OTUB0009和OTUB0002。
在OTUs中,显著响应处理的真菌OTU为74个(P<0.05)。各处理平均相对丰度大于1%的OTU有9个(表2)。其中,OTUF0564(未分类伞菌纲Agaricomycetes真菌)为FEA独有,OTUF0247(须壳孢属Pyrenochaeta真菌)和OTUF0322(有孔疣苔属Verrucaria真菌)为NER独有。OTUF0028(未知真菌)在DGA中相对丰度最高。OTUF0458(鬼伞属Coprinopsis真菌)、OTUF0059(未分类的银耳纲Tremellomycetes真菌)显著高于其他处理,在FEA中相对丰度最高。OTUF0015(考克氏菌属Knufia真菌)、OTUF0068(Capronia属真菌)和OTUF0056(考克氏菌属Knufia真菌)在NER中相对丰度最高。表明处理之间真菌结构具有典型的特异性,暗示种植禾本科植物种更容易促进土壤中与之强关联的真菌物种生长与繁殖。
2.5 宅基地复垦种植禾草的土壤指示微生物之间的相关性
由图4可知,宅基地复垦种植禾草的指示微生物之间具有明显共线性,根据其相关性大致可分为5类。OTUF0564独成一类,主要表征FEA。OTUF0247、OTUF0322、OTUF0015、OTUB0045、OTUB 0009、OTUF0068、OTUF0056和OTUB0002为一类,主要表征NER。OTUF0458和OTUF0059为一类,主要表征FEA处理。OTUF0028独成一类,主要表征DGA。无菌单独表征LPE。OTUB0008、OUTB00 24、OTUB0041和OUTB0007为一类,主要表征种植禾草。

图4 指示物种之间的相关性Fig.4 Correlations between indicator species
3 讨 论
3.1 宅基地复垦对土壤微生物数量的影响
复垦土壤由于压实或人为破坏较大,土壤板结、通气性差,土壤中微生物和原生动物数量和种类很少,但通过不同方式培肥,土壤生物活性有了不同程度提高。外源新增的土壤有机物为微生物繁殖提供了丰富碳源和氮源,均可促进宅基地复垦土壤中细菌、真菌和放线菌的生长,但培肥使用的有机质种类也调控了土壤中不同微生物的变化速率和变化幅度。如施用化肥可使宅基地复垦土壤真菌数量提高3.5倍,有机肥和菌肥配合使用可显著提高土壤真菌和放线菌数量,但对细菌数量无影响[11]。又如秸秆还田可使宅基地复垦土壤微生物总量增加36%,而菌渣和猪粪还田可使微生物总量增加100%以上[12]。除施肥外,复垦种植作物后,根系死亡及其分泌物的输入对土壤微生物的生长具有促进作用。且宅基地复垦土壤微生物的繁殖规律与种植的作物种类有紧密关系。如宅基地复垦种植番茄、玉米和茄子等作物后,0~20 cm土层土壤微生物量明显增加,且种植番茄对土壤微生物的促进作用优于种植玉米和茄子[7]。本研究也发现,相比于自然恢复,种植禾草后土壤细菌和真菌丰度的数量级明显增加,且种植鸭茅和黑麦草下土壤细菌和真菌的丰度大于种植高羊茅。这在证明“种植禾草可促进土壤细菌、真菌繁殖,有改善宅基地复垦土壤生物活性的作用”同时,也强调了“饲草种类对土壤微生物群落结构的特异性调控”。
3.2 植物种定向构建土壤微生物群落结构
土壤微生物参与调节土壤团聚体结构形成和养分循环,受土壤中可供利用的物质和能源影响,其群落结构和物种组成也会对不同环境特性作出特异性响应。本研究发现,相比于自然恢复,种植禾草后,宅基地复垦土壤微生物群落组成发生了一系列特异性变化,细菌和真菌在门和属水平上表现出明显差异。赵文等[13]在研究祁连山草地时指出无论是天然草地还是人工草地,土壤细菌均以变形菌门、酸杆菌门、放线菌门和浮霉菌门为主要类群,属水平上因种植牧草类型不同而具有明显差异,但鞘氨醇单胞菌属细菌仍是次优势类群。本研究也得到相似结论,即种植禾草促进复垦土壤中放线菌门、浮霉菌门大量繁殖。但在属水平上却有明显差异。鞘氨醇单胞菌属细菌对贫营养条件的适应能力较强,具有促进有机物料腐解和养分释放的功能[17],在自然恢复宅基地复垦土壤中较丰富,可能与植物种类较多、土壤中有机物质组成更复杂有关。本研究对处理具有显著正响应的是1种沉积物杆状菌属细菌、Ohtaekwangia菌属细菌、链球菌属细菌及1种未分类β-变形菌纲细菌。一些研究指出,这4种细菌在消解作物秸秆、降解纤维素方面也具有明显优势,它们可能发挥着代替鞘氨醇单胞菌属细菌功能的作用[14-16]。这也暗示了宅基地复垦后细菌主要功能需求一致,即需要快速分解有机物料以获取养分供给给植物。
自然界约有150万真菌种类,但至今只有5%~10%已被正式描述,人类仅了解当中极少部分真菌[18]。真菌有参与有机质分解、与植物共生(为植物提供养分)和病原真菌3个主要功能。其中,担子菌门腐生或寄生,在潮湿土壤中可分解木质纤维素,是土壤中主要的真菌分解者。本研究发现,种植禾草后,宅基地复垦土壤中担子菌门相对丰度显著增加。种植禾草有利于真菌繁殖,虽不显著影响真菌群落多样性,但对关键物种的丰度有较大改变。在属水平上,本研究发现某些具有典型特异性的真菌,如:自然恢复下宅基地土壤独有1种须壳孢属Pyrenochaeta真菌(OTUF0247)和1种有孔疣苔属Verrucaria真菌(OTUF0322),而1种未知真菌(OTUF0028)仅存在于种植禾草的复垦土壤中。其中,Pyrenochaeta属真菌多为农作物土传病原真菌,如P.lycopersici[19]、P.terrestris[20]和P.glycines[21]。这一发现与其他研究结论[22]基本一致,如人工种植牧草后土壤中病原真菌丰度较天然草地土壤大幅增加,同时还显著提高了土壤中生防菌类群的相对丰度。因此,宅基地复垦土壤中人工种植禾草对真菌群落的组成演替暂不能一概而论,还需对上述特有的真菌进一步培养和鉴定。
3.3 植物效应与土壤效应的关系
植物和土壤生物相互依存,土壤中的微生物组由生长在土壤中的植物塑造[23-24]。这是由于植物根际微生物大多是从周围的土壤中招募而来[25]。若将土壤效应与植物效应分开,则明确反映出植物物种对土壤真菌起着关键控制作用[26]。Kos等[27]指出植物功能类型之间的这些差异可以调节土壤微生物群落。当前,一些学者已经认识到植物对土壤生物群的调节效应超过了对土壤非生物特征的影响,并且这种驱动植物生长的土壤生物因素会长期保留在土壤中[28-29]。但更多的人认为这种驱动力主要来自于真菌,而非细菌[30-31]。本研究得出细菌的影响明显强于真菌,可能是由于本研究的土壤来自于多年的宅基地土壤,没有任何的植物背景,而其他研究对象是具有一定植被的土壤。虽然当前研究[32]已经证实土壤微生物可以通过植物根部募集有益细菌形成共生关系来直接影响作物生长,也可以通过改变土壤养分间接影响作物生长。但作物种植模式在时间上可以相对静态,也可以高度动态。作物与复垦土壤之间的长期关系仍需持续关注,特别是要将作物类型与耕地质量和耕地健康的长期稳定性关系耦合起来,思考复垦土地的开发和利用。
4 结 论
种植禾草可以增加宅基地复垦土壤关键细菌和关键真菌的丰度,改变微生物群落结构。不同禾草品种对宅基地复垦土壤中真菌繁殖的促进作用具有特异性。关键菌群的功能性差异为宅基地复垦土壤改良中饲草品种的选择提供了科学依据。

