镉污染对山区水库消落带湿地土壤细菌群落结构及多样性的影响
陈海生,姜 伟,徐蒋来,刘守平,罗 文,高永胜,蔡林生,方 昉,姚金兰
(1.浙江同济科技职业学院,杭州 311231;2.浙江省台州市农业科学研究院,浙江 临海 317000)
【研究意义】近年来,随着我国经济发展,大量含镉(Cd)肥料的施用及工业废水、废渣排放导致土壤中镉污染程度日益加剧。Cd是一种毒性和迁移性较强的重金属,容易通过食物链传递,具有较大的环境生态风险[1-3]。Cd也是水环境中危害最严重的污染物之一[4]。水库消落带湿地由于其土壤-水的交互作用,长期处于干湿交替的交换过程,重金属Cd污染具有持久性和积累放大性,且随空气中悬浮物在消落带中的沉积,带来水库库区水体镉污染潜在风险增加[5]。湿地土壤微生物是湿地生态系统最活跃的部分,在促进土壤物质和能量循环、重金属污染物降解、维持生态系统平衡方面起着重要作用。微生物群落结构和多样性指数能够直接反映土壤和水体的污染程度,其对环境条件的变化响应灵敏,能够真实评估各种污染物对生态系统的危害程度[6]。【前人研究进展】高通量测序能同时大批量对污染水体样品、湿地沉积物和植物根际土壤样品微生物的优势菌群、稀有物种等进行检测[7]。Duan等[8]采用高通量测序技术研究不同浓度镉污染对我国东北普通始成土细菌群落结构和多样性的影响,发现高浓度Cd能提高普通始成土细菌群落的丰富度和多样性指数,罗尔斯通菌属(Ralstonia)、慢生根瘤菌属(Bradyrhizobium)、根微菌属(Rhizomicrobium)和阿菲波菌属(Afipia)是高抗Cd污染的细菌菌属。Guo等[9-10]采用高通量测序研究了陕西省商洛市被Cd、铅(Pb)和锌(Zn)污染的农田土壤的细菌群落结构,发现对这些重金属敏感的细菌菌属,如罗尔斯通菌属(Ralstonia)、芽单胞菌属(Gemmatimona)、罗思河小杆菌属(Rhodanobacter)、水恒杆菌属(Mizugakiibacter),以及能够耐受这些重金属的菌属,如未分类的硝化螺旋菌科、Blastocatella和未分类的酸杆菌科。赵立君等[11]研究砷(As)污染湿地土壤细菌多样性及群落结构特征,发现细菌群落对As污染具有较为敏感的响应。在As浓度为400 mg/kg时存在大量的Pseudomonasveronii,可为As污染湿地微生物修复提供借鉴,但关于应用高通量测序分析外源Cd污染环境条件下水库消落带湿地土壤细菌群落结构与多样性指数变化的研究不多见。【本研究切入点】消落带湿地生长的很多植被具有较强的Cd耐性、Cd转移能力和地上部分Cd富集能力,适宜用作Cd污染土壤的植物修复物种[12-13]。本研究采用室内盆栽模拟不同Cd浓度污染土壤,种植木本植物落羽杉并长期保持覆水状态,以模拟湿地生境。利用Miseq测序平台采用高通量测序技术分析不同浓度Cd污染条件下落羽杉根际土壤细菌群落结构组成及多样性指数变化特征。【拟解决的关键问题】研究Cd污染对水库消落带湿地土壤细菌群落结构的影响,并探索有利于Cd污染修复的抗Cd细菌菌落,以期为浙江省山区水库消落带生态恢复进行微生物修复提供技术依据。
1 材料与方法
1.1 试验设置
研究区域为浙江省长潭水库消落带。长潭水库位于浙江台州黄岩区西部山区,库区面积441.3 km2,四周高山海拔350~780 m,于1964年建成运行,库存容量6.91×108m3。其消落带湿地长86 km,水位深度36~29 m,消落带湿地面积达0.61 km2。水库上游12 km处有浙江省排列第一的大型铅锌矿,即黄岩铅锌矿,矿石的主要成分是铅、锌、镉等多种重金属元素。黄岩铅锌矿库储量在1.5×106t以上。该矿虽已于2000年闭库,但所留下的尾矿库在暴雨季节仍可能会给水库的水质安全带来隐患。
试验所用土壤采用浙江省台州市黄岩区上垟乡政府旁边的长潭水库消落带湿地土壤(表层0~15 cm),为泥沙土。土壤pH 6.38,镉0.62 mg/kg, 有机质5.23 g/kg,全氮0.89 g/kg,全磷0.82 g/kg,全钾11.97 g/kg,碱解氮79.03 mg/kg,有效磷12.19 mg/kg,速效钾73.51 mg/kg。先把土样自然晾干,再进行粉碎,过2 mm尼龙筛。取10 kg土样置于培养盆内,试验用盆规格:内口径44 cm,底径32 cm,高32 cm。共设置3个Cd污染浓度梯度(0、100、400 mg/kg),依次标记为Cd0、Cd100、Cd400组。将CdCl2·2.5H2O按照0、100、400 mg/kg的浓度梯度(浓度以纯Cd计,Cd起始浓度参考国家土壤环境质量二级标准)配成水溶液,均匀浇灌于盆土中(渗出液反复回收浇灌,直到Cd离子与盆栽土壤均匀混合),以浇清水作对照为Cd0。每个处理5次重复[14]。
于2021年4月10日选取生长旺盛且大小均匀一致的落羽杉幼苗种植于试验盆。每个试验盆内栽植3株落羽杉幼苗,株高80 cm左右,全部试验盆置于上垟乡政府遮雨棚下,肥水管理和其他措施包括除草等均一致。保持盆内覆水深度在5 cm内,以模拟消落带湿地环境。培养3个月后进行土样取样,取样前先让试验盆自然落干,在土壤表层0~10 cm处采集直径少于0.1 cm的植株细根,用抖落法[15]收集粘附在植株细根上的土壤作为落羽杉根际土壤样品,取土样时进行3次重复,将土样混合均匀、去杂和过筛后,取10 g土样置于冰盆内直接寄往杭州联川生物公司。
1.2 土壤细菌基因组 DNA 提取
采用 E.Z.N.A.Soil DNA Kit 试剂盒(D5625,Omega,Inc.,USA),提取土样总DNA。经1%琼脂糖凝胶电泳检测DNA提取质量,采用紫外分光光度计Nano Drop ND-1000(Nano Drop,Wilmington, DE,USA)对DNA进行定量测定。各样品的5份DNA样品随机取3份等量混均,分别制成3个平行样品,于-20 ℃保存、备用。
1.3 PCR扩增及高通量测序
参考Caporaso等[16]的方法,通过细菌16S rDNA V3~V4 区段引物扩增各样品,使用上下引物分别为341F (5′-CCTACGGGNGGCWGCAG-3′)和805 R (5′-GACTACHVGGGTATCTAATCC-3′)对16S rDNA基因(V3~V4)进行PCR扩增。DNA扩增的反应条件:35个循环(98 ℃,30 s;98 ℃,10 s;54 ℃,30 s;72 ℃,45 s),72 ℃ 延伸扩增10 min。PCR产物经2%琼脂糖凝胶电泳确证。DNA提取过程使用超纯水,以排除假阳性PCR结果作为阴性对照的可能性。PCR产物经AMPure XT beads (Beckman Coulter Genomics,Danvers,MA,USA)纯化,经 Qubit(Invitrogen,USA)定量。扩增子池用于测序,扩增子文库的大小和数量分别在Agilent 2100生物分析仪(Agilent,美国)和 Illumina (Kapa Biosciences,Woburn,MA,美国)的文库定量试剂盒上进行评估。在NovaSeq PE250平台上对库进行排序。
1.4 生信分析流程
各样品在Illumina NovaSeq平台上测序,由LC-Bio提供。根据样品独特的条形码,将配对端序列分配给样品,并将建库引入的barcode和引物序列去除。采用FLASH合并匹配端读取。根据 fqtrim(v0.94),在特定的过滤条件下对原始序列进行质量过滤,以获得高质量的clean标签。采用Vsearch软件(v2.3.4)对嵌合序列进行过滤。利用DADA2进行解调,获得特征表和特征序列。Alpha多样性通过归一化到相同的随机序列计算。然后根据SILVA(release132)分类器,利用每个样本的相对丰度对特征丰度进行归一化。Alpha多样性用于分析样本物种多样性的复杂性,各样品中各Alpha多样性指标都采用QIIME2计算。Beta多样性由QIIME2计算,R包绘制。采用Blast进行序列比对,每个代表性序列用SILVA数据库对特征序列进行注释。其它图片均使用R包(v3.5.2)实现。
2 结果与分析
2.1 Cd污染对消落带湿地落羽杉根际土壤细菌Alpha多样性的影响
Miseq测序所得土壤样品经质检后,获得各处理样品的细菌有效序列数。由表1可知,消落带落羽杉根际土壤细菌有效序列以Cd100处理组最高,其次是Cd400处理组,而以对照组(不设镉污染)的落羽杉根际土壤细菌有效序列最低。各处理及对照的有效序列比例均大于71%。序列长度在400~500和300~400 bp的分别占99.90%和0.08%,总计大于99.98%,符合分析要求。

表1 不同程度Cd污染消落带湿地落羽杉根际土壤细菌有效序列读数及OTUs数Table 1 The sequence readings and OTUs of soil bacteria of rhizosphere of T. distichum planting in riparian wetland under different gradients of cadmium pollution
经质控和去除嵌合体后,所得有效序列以97%的一致性聚类成OTUs,各处理及对照组的OTUs数为419~1687个,共计2577个。其中以Cd100的样品OTUs数最多,为1687个,其次是对照组样品,其OTUs数为1065个,而以Cd400组样品的OTUs数最少,仅419个,三者之间的差异均达显著水平(P<0.05)。
不同Cd浓度污染下落羽杉根际土壤细菌共有OTUs数96个,占总数3.73%;Cd100组样品特有的细菌OTUs数为1216个,占总数47.18%;Cd400组样品特有的细菌OTUs数为229个,占总数8.89%;而对照组Cd0样品特有的细菌OTUs数为634个,占总数24.60%。Cd100组样品土壤细菌特有OTUs数比对照增加191.80%,而Cd400组样品土壤细菌特有OTUs数比对照减少63.88%(图1)。
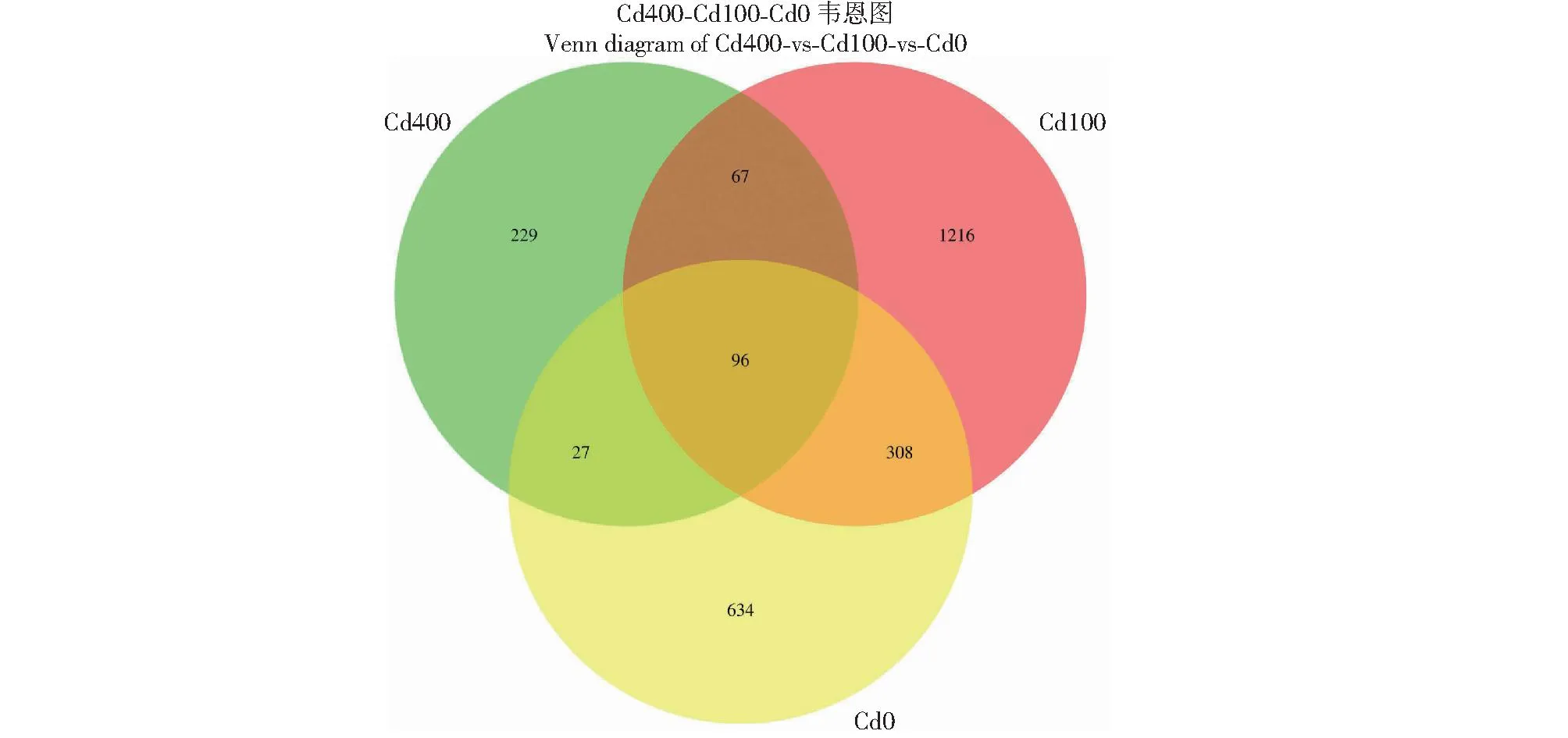
图1 基于OTU丰度的不同浓度Cd污染条件下消落带湿地土壤细菌群落Fig.1 Soil bacterial communities in riparian wetlands of mountain reservoir under different gradients of cadmium pollution
稀释曲线(图2)反映土壤样品的取样深度,可用来估计测序量是否已覆盖所有类群。由图2可知,3种土壤样品的稀释曲线均趋于平缓,文库的覆盖率均已超过91%,说明取样方法基本合理。样品的细菌OTUs覆盖度已经饱和,说明本次测序深度可以反映不同Cd浓度污染条件下长潭水库消落带湿地落羽杉根际土壤细菌群落的实际情况。

图2 不同浓度Cd污染条件下消落带湿地土壤细菌群落的稀释曲线Fig.2 Rarefaction curve of soil bacterial communities in riparian wetlands of mountain reservoir under different gradients of cadmium pollution
从表2可以看出,不同程度Cd污染对消落带落羽杉根际土壤细菌Chao1指数和Shannon指数的影响程度不同。Chao1指数和Shannon指数均以Cd100处理组样品为最高,其值分别是1704.58和9.67,比对照分别增加58.58%和11.02%,而Cd400处理组样品的Chao1指数和Shannon指数下降至419.01和7.12,分别比对照降低61.02%和18.26%,3个处理的差异程度均达极显著水平(P<0.01)。

表2 不同程度Cd污染消落带湿地落羽杉根际土壤细菌Alpha多样性指数Table 2 Alpha diversity in soil bacterial communities of rhizosphere of T. distichum planting in riparian wetland under different gradients of cadmium pollution
2.2 Cd污染下消落带湿地土壤细菌群落结构在门水平上的组成特征
通过对测序结果的物种注释,各处理组土壤样品中共获得34门、96纲、202目、313科、502属的细菌群落。在门水平上,各处理组土壤细菌群落组成均以变形菌门(Proteobacteria,48.26%~60.38%)为主,其次是放线菌门(Actinobacteria,4.78%~19.50%),其他占比较大的还有酸杆菌门(Acidobacteria,3.56%~10.31%)、拟杆菌门(Bacteroidetes,4.24%~8.54%)、芽单胞菌门(Gemmatimonadetes,3.21%~4.88%)、髌骨菌门(Patescibacteria,1.02%~8.57%)、绿湾菌门(Chloroflexi,2.62%~4.60%)、棒状杆菌门(Rokubacteria,2.37%~3.14%)、浮霉菌门(Planctomycetes,0.77%~3.38%)、疣微菌门(Verrucomicrobia,1.27%~2.56%)、硝化螺旋菌门(Nitrospirae,0.70%~1.48%)、厚壁菌门(Firmicutes,0.20%~1.62%)。
不同程度Cd污染条件下,消落带湿地落羽杉根际土壤细菌群落组成在门水平上发生了明显变化。如图3所示,在门水平上,未经Cd污染处理的Cd0组土壤变形菌门的相对丰度为48.92%,经Cd100组处理后,变形菌门的相对丰度稍有下降,但与Cd0相比差异不显著(P>0.05,下同)。当Cd浓度增加至400 mg/kg时,土壤变形菌门的相对丰度增加至60.38%,增加了23.43%,与Cd0和Cd100组的差异均达显著水平(P<0.05,下同)。土壤放线菌门的相对丰度随着Cd浓度上升呈下降趋势,Cd100组比Cd0组下降30.62%,其差异达极显著>水平(P<0.01,下同),Cd400组比Cd0组下降75.49%,其差异达极显著水平。土壤酸杆菌门的相对丰度在低浓度Cd污染时呈上升趋势,在Cd100组样品其相对丰度比Cd0时增加30.34%,其差异程度达极显著水平,而在高浓度Cd污染时呈下降趋势,Cd400组样品酸杆菌门相对丰度比Cd0时降低54.99%,其差异达极显著水平。土壤拟杆菌门的相对丰度在低浓度Cd污染时上升幅度不大,与对照差异未达显著水平,而在高浓度Cd污染时上升幅度较大,比Cd0增加101.42%,其差异达极显著水平。土壤芽单胞菌门的相对丰度也随着Cd污染程度的加剧呈升高趋势,Cd400组的比Cd0高52.03%,差异达显著水平。土壤绿湾菌门的相对丰度在低浓度Cd污染时呈上升趋势,Cd100组样品相对丰度比Cd0组增加27.42%,差异达极显著水平,在高浓度Cd污染时呈下降趋势,Cd400组样品相对丰度比Cd0组的下降27.42%,差异达极显著水平。棒状杆菌门的相对丰度在低浓度Cd污染时呈上升趋势,Cd100组比Cd0组增加30.83%,差异达极显著水平,而在高浓度Cd污染时呈下降趋势,但Cd400组与Cd0相比差异未达显著水平。浮霉菌门的相对丰度随着Cd污染程度加剧一直呈下降趋势,在Cd100时下降26.33%,差异达极显著水平,而到Cd400时下降77.22%,差异达极显著水平。土壤疣微菌门的相对丰度在低浓度Cd污染时呈上升趋势,Cd100组样品相对丰度比Cd0虽有增加,但差异未达显著水平,在高浓度Cd污染时呈下降趋势,Cd400组样品的相对丰度比Cd0降低45.02%,差异达极显著水平。土壤硝化螺旋菌门和厚壁菌门的相对丰度也呈同样趋势,在低浓度Cd污染时其相对丰度分别比Cd0增加37.04%和110.39%,差异均达极显著水平,而在高浓度Cd污染时其相对丰度呈急剧下降趋势,分别比对照降低35.19%、74.03%,差异均达极显著水平。

图3 门水平上不同浓度Cd污染条件下消落带湿地土壤细菌群落结构Fig.3 The bacterial communities at phylum level in riparian wetlands of mountain reservoir under different gradients of cadmium pollution
2.3 Cd污染下消落带湿地细菌群落结构在属水平上组成特征
在属水平上,各处理组土壤样品中细菌群落均以罗思河小杆菌属(Rhodanobacter,4.52%~21.25%)为主,其次为鞘氨醇单胞菌属(Sphingomonas,2.45%~4.83%)、马赛菌属(Massilia,1.59%~4.03%)、未分类的噬几丁质科(Chitinophagaceae-unclassified,1.42%~2.56%), 其他相对丰度比较大的还有假节杆菌属(Pseudarthrobacter,0.36%~3.22%)、未分类的α-变形菌(Alphaproteobacteria-unclassified,1.07%~2.08%)、黏液杆菌属(Muciaginibacter,0.97%~2.12%)、慢生根廇菌属(Bradyrhizobium,1.08%~1.54%)、链霉菌属(Streptomyces,0.18%~1.86%)、黄杆菌属(Flavobacterium,0.20%~2.78%)、杜擀氏菌属(Duganella,0.62%~1.49%)、红假单胞菌属(Rhodopseudomonas,0.46%~1.87%)、硝化螺旋菌属(Nitrospira,0.70%~1.32%)、亚硝化螺菌属(Nitrosospira,0.49%~1.06%)、中慢生根廇菌属(Mesorhizobium,0.73%~0.91%)、火山岩海球菌属(Marmoricola,0.63%~0.82%)、诺卡氏菌属(Nocardioides,0.19%~1.27%)。
不同程度Cd污染条件下,消落带湿地落羽杉根际土壤细菌群落结构在属水平上发生了明显变化。如图4所示,未经Cd污染处理土样的罗思河小杆菌属相对丰度为8.84%,经Cd100组处理后,其相对丰度大幅度下降,下降幅度为48.87%,其差异达极显著水平(P<0.01,下同)。当Cd浓度增加到400 mg/kg时,土壤罗思河小杆菌属相对丰度增加至21.25%,增加了140.38%,差异达极显著水平。土壤鞘氨醇单胞菌属的相对丰度在低浓度Cd污染时呈上升趋势,但上升幅度只有5.69%,与Cd0组的差异不明显,在高浓度Cd污染时呈下降趋势,下降幅度达46.39%,其差异程度达极显著水平。土壤假节杆菌属、黏液杆菌属以及红假单胞菌属的相对丰度随Cd浓度增加一直呈下降趋势。土壤黄杆菌属的相对丰度随着Cd污染程度的加剧呈持续升高趋势,其Cd400组的相对丰度比Cd0组增加1290.00%,差异达极显著水平。

图4 属水平上不同浓度Cd污染条件下消落带湿地土壤细菌群落结构Fig.4 The bacterial communities at genus level in riparian wetlands of mountain reservoir under different gradients of cadmium pollution
3 讨 论
研究表明,不同程度重金属污染对土壤微生物多样性的影响会出现拱桥形趋势[17]。当重金属污染剂量较低时,胁迫程度较轻的重金属会抑制优势种群的竞争性排除效应,促进劣势种群的生长和繁殖,导致微生物多样性升高。而重金属污染剂量较高时,胁迫程度较重的重金属会对微生物产生毒性,造成某些微生物物种消亡,致使微生物多样性下降。邢奕等[18]研究了密云水库上游铁矿区重金属污染对土壤微生物群落的影响,发现细菌、放线菌的种群多样性水平随重金属污染程度加剧呈先上升后下降趋势。郑涵等[19]研究发现,低浓度Zn胁迫(200 mg/kg)促进微生物群落数量增加,提高了群落结构多样性,而高浓度Zn胁迫(>800 mg/kg)时,较重程度的锌胁迫对微生物产生了明显的抑制作用。赵立君等[11]研究As胁迫对湿地生境下土壤微生物生物多样性及群落结构特征,发现低浓度As条件下的As胁迫在一定程度上会刺激As敏感微生物的生长繁殖,造成微生物多样性增加,而高浓度As胁迫会对微生物产生明显的抑制作用,导致某些物种消亡,使微生物多样性下降。本研究在山区水库消落带湿地土壤上的研究也表明,低浓度Cd污染时消落带湿地建群种植物落羽杉根际土壤细菌Chao1指数和Shannon指数与对照相比大幅上升(P<0.01),而高浓度Cd污染时消落带湿地落羽杉根际土壤细菌Chao1指数和Shannon指数大幅下降(P<0.01)。各样品土壤细菌特有的OTUs数变化也呈同样趋势(P<0.01),即低浓度Cd污染时土壤细菌特有的OTUs数与对照相比呈大幅增加趋势,而在高浓度Cd污染时土壤细菌特有的OTUs数与对照相比呈大幅减少趋势(P<0.01)。
赵立君等[11]在研究As污染湿地生境下土壤细菌群落结构特征时检测到,在高浓度As污染条件下,土壤变形菌门的相对丰度为75.00%,而厚壁菌门的相对丰度只有7.00%。本研究结果也表明,在高浓度Cd污染下土壤变形菌门的相对丰度升高至60.38%,而厚壁菌门的相对丰度下降至0.20%,说明土壤变形菌门能在高浓度Cd污染条件下生存下来的耐Cd微生物,并能成为土壤细菌群落的主导,这一点与赵立君的研究结果一致。另外,土壤酸杆菌门、绿湾菌门、疣微菌门、硝化螺旋菌门、棒状杆菌门在低浓度Cd污染时其相对丰度增加,而在高浓度Cd污染时其相对丰度降低,说明在这些菌门中可能存在大量Cd敏感的细菌群落,且在Cd刺激下大量出现,而随着Cd浓度升高,Cd对土壤细菌产生毒性,大量对Cd敏感的细菌逐渐消失,而使群落结构趋于单一、稳定。
4 结 论
(1)Cd污染使水库消落带湿地建群种植物落羽杉根际土壤细菌群落结构在门水平上发生变化。随着Cd污染程度加重,湿地土壤放线菌门和浮霉菌门的相对丰度呈下降趋势,拟杆菌门和芽单胞菌门的相对丰度呈升高趋势,土壤变形菌门和髌骨菌门的相对丰度则呈先下降后上升趋势。而酸杆菌门、棒状杆菌门、疣微菌门、硝化螺旋菌门和厚壁菌门的相对丰度均呈先上升后下降趋势,说明该5个菌门中可能存在大量对Cd敏感的菌群,在Cd刺激下大量出现,群落结构变得复杂多样,导致该菌群的相对丰度上升。而当Cd污染程度继续加重时,该菌门的相对丰度呈下降趋势,说明随着Cd污染程度增强,Cd对土壤细菌产生毒性,大量对Cd敏感的细菌不断消失,使变形菌门、拟杆菌门、髌骨菌门、芽单胞菌门中能够在高浓度Cd污染环境下生存下来的耐Cd细菌门成为湿地细菌的主体,整体的群落结构也趋于稳定。
(2)不同程度Cd污染条件下,消落带湿地落羽杉根际土壤细菌群落结构在属水平上发生明显变化。土壤罗思河小杆菌属相对丰度在低浓度Cd污染时呈下降趋势,而在高浓度Cd污染时呈升高趋势,土壤鞘氨醇单胞菌属的相对丰度在低浓度Cd污染时呈上升趋势,在高浓度Cd污染时呈下降趋势。土壤假节杆菌属、黏液杆菌属以及红假单胞菌属的相对丰度随着Cd浓度增加呈下降趋势。土壤黄杆菌属的相对丰度随着Cd污染程度的加剧呈升高趋势。
(3)在高浓度Cd污染处理下,水库消落带湿地建群种植物落羽杉根际土壤细菌群落结构趋于简单、稳定,耐Cd细菌菌群占主导地位。高浓度Cd污染处理下在属水平上仍然具有高丰度的菌群有罗思河小杆菌属,其相对丰度占比21.25%,可认为该菌属属于耐Cd能力较强的菌群。在高浓度Cd污染下,相对丰度升高的还有Gemmatimonadaceae-unclassified、马赛菌属、Candidatus-Adlerbacteria-unclassified、Chitinophagaceae-unclassified、Alphaproteobacteria-unclassified、黄杆菌属、杜擀氏菌属,这些菌属也可被认为是消落带湿地土壤上高抗Cd污染的细菌菌群。

