耕作深度对植烟土壤理化特征及氨氧化微生物的影响
杨如意,陈 涛,廖 睿,况 帅,徐艳丽,宋文静,张 波
(1.中国农业科学院烟草研究所/农业部烟草生物学与加工重点实验室/中国农业科学院青岛烟草资源与环境野外科学观测试验站,山东 青岛 266101;2. 中国农业科学院研究生院,北京 100081;3. 贵州中烟工业有限责任公司,贵阳 550001)
【研究意义】随着农业机械化的发展,农户开始大量使用农业机械进行种前的翻耕、旋耕松土,但往往农业机械的耕作深度只能达到表层耕层[1]。耕层较浅、土壤质地粘是目前我国烟区土壤存在的重要问题,尤其是云南产区[2]。保山市位于云南西部,处于红壤地区,云南红壤含有大量的次生无机铁、铝矿物质,透水、透气、不易板结,非常适合烟草种植[3]。但由于农户耕作方式不合理,导致有效耕层变浅、土壤板结[4-5]。【前人研究进展】长期旋耕会导致耕层变浅,土壤容重增大,保肥保水性减弱等[6-8]。深耕通过打破犁底层,疏松土壤,使土壤孔隙增大、容重降低[2,9],从而促进水分和空气进入,加速土壤微生物的生命活动和有机物的氧化分解,提高土壤肥力[6,10]。田慎重等[11-12]研究表明,旋耕转变为深耕能有效提高有机质的累积、增加土壤团聚体碳库等。氮循环主要包括生物体内有机氮的合成、硝化作用、反硝化作用、氨化作用、固氮作用。土壤微生物是驱动氮循环的重要环节,其在土壤中的生命活动将会对土壤肥力等产生较大影响。硝化作用作为氮循环的核心环节,能够有效减少氮素损失,促进植物对氮素的吸收利用。氨氧化是氨氧化成硝酸盐的主要步骤[13],是硝化作用的限速步骤,氨氧化古菌(Ammonia-oxidizing archaea,AOA)和氨氧化细菌(Ammonia-oxidizing bacteria,AOB)是氨氧化过程中的主要功能菌群[14],影响氨氧化速率。土壤pH、温度、有机质等会对AOA和AOB的种群结构和丰度产生影响[15-18]。【本研究切入点】目前对深耕方面的研究主要集中在不同耕深下烟草的产量、质量[2,10,19],根系生长及土壤的物理性状[9],不同耕深下土壤理化性质和功能菌群的对比研究鲜有报道。【拟解决的关键问题】AOA和AOB作为氨氧化反应的主要驱动者,其群落结构受土壤环境因子影响,耕作措施则通过改变土壤环境因子从而影响土壤氨氧化过程。因此,本研究采用耕深10 cm、耕深20 cm、耕深30 cm 3种不同的耕作深度,探究不同耕深对植烟土壤理化特征及功能菌群的影响,对土壤氨氧化过程和机制及实现农业的可持续发展具有重要意义。
1 材料与方法
1.1 试验区概况
在云南省保山市隆阳区西邑乡(99°30′E, 24°93′N)开展试验,试验地形为丘陵山区,年均气温16.20 ℃,年均降水量1082.70 mm,属亚热带季风气候,种植制度为烟草-油菜轮作。供试土壤为红壤、砂壤土(砂粒61.05%、粉粒29.90%、粘粒9.05%),土壤基本理化性质和肥料的基本养分特征如表1所示。
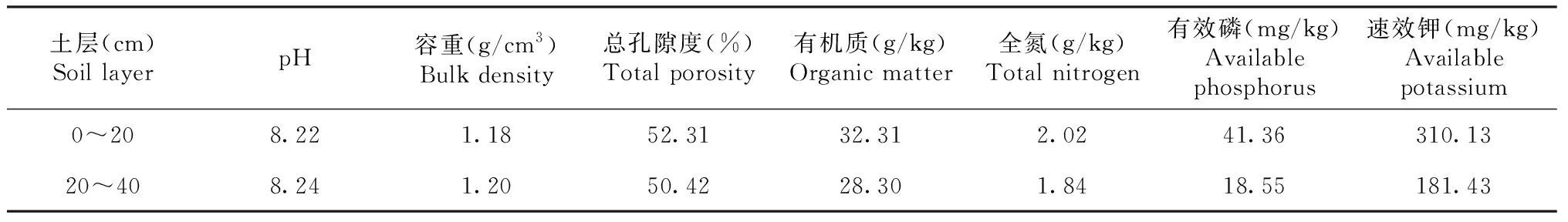
表1 供试土壤基本理化性质Table 1 Basic physical and chemical properties of soil
1.2 试验设计
试验开始于2020年2月,设耕深10 cm(CK)、耕深20 cm(S1)和耕深30 cm(S2)3个处理,3次重复,采用随机区组排列。植烟前采用2遍旋耕机械作业和1遍深耕机械作业,旋耕采用手扶旋耕机,潍坊鲁科机械有限公司生产,型号:LK14,功率:6.3 kW,深耕采用轮式拖拉机,雷沃重工股份有限公司生产,型号:M954-D,功率:69.8 kW。烤烟品种为K326,2月中旬开始育苗,5月7日采用复合肥(N 7%,P2O516%,K2O 26%)750 kg/hm2、氮钾肥(N 16%,K2O 30%)300 kg/hm2、商品有机肥(N 2.77%,P2O51.48%,K2O 1.15%)1200 kg/hm2进行基肥条施并起垄,5月8日进行健康壮苗移栽,其中行距为1.20 m,株距为0.50 m,种植密度为16 500株/hm2,每个小区种植240株烟,面积144 m2(长×宽:20.0 m×7.2 m)。
1.3 样品采集与测定方法
1.3.1 样品采集 样品采集于2020年8月(烤烟采收期)。①土壤物理指标样品采样方式:每个小区按照对角线法选取3~5个采样点[20],用环刀分别采集各处理0~20、20~40 cm土层根围土壤样品用于测定土壤结构指标。②土壤养分指标样品采样方式:每个小区内按“S”形随机取样8~10个点,用直径为5 cm土钻分别采集0~20、20~40 cm土层根围土壤样品充分混匀后四分法留取1.5 kg土壤备用,重复3次,详见鲁如坤[21]的方法,1份风干后研磨过筛,用于测定土壤养分指标及土壤相关酶活性;1份置于4 ℃冰箱中,用于测定土壤中硝态氮、铵态氮的含量;1份置于-80 ℃冰箱,用于测定土壤生物学指标。
1.3.2 测定方法 (1)土壤物理指标的测定:采用环刀法测定土壤容重[22]、总孔隙度[23]。
(2)土壤养分指标的测定:有机质采用重铬酸钾容量法-外加热法,全氮采用半微量凯氏定氮法测定,铵态氮、硝态氮采用1 mol/L KCl溶液浸提,用SEALAA3连动流动分析仪测定;有效磷采用钼锑抗比色法,速效钾采用火焰光度计法,具体参照鲁如坤[21]的方法。
(3)土壤相关酶活性的测定:蔗糖酶、纤维素酶采用3,5-二硝基水杨酸比色法[24],土壤脲酶采用靛酚蓝比色法(以NH3-N计)[25]。
(4)土壤微生物16S rRNA的测序:根据 Illumina Miseq 平台 (Illumina,SanDiego,USA)标准操作规程将纯化后的扩增片段构建 PE 2×250 的文库。利用 Illumina 公司的 Miseq PE250 平台进行测序(上海美吉生物医药科技有限公司)。
1.4 数据分析
采用Excel 2019处理数据和制作图表。交互作用及主成分分析采用SPSS 20软件进行双因素方差分析。
2 结果与分析
2.1 耕作深度对植烟土壤物理性状的影响
由图1可见,在0~20 cm土层,与CK相比,S1和S2处理的土壤容重均显著下降,在20~40 cm土层,CK、S1和S2处理间土壤容重均差异不显著;不同处理间不同土层的土壤总孔隙度均差异不显著。表明深耕能有效降低土壤容重。

不同小写字母表示处理间差异显著(P<0.05)。下同。Different small letters mean significant difference between treatments at 0.05 level, respectively.The same as below.图1 土壤物理性状Fig.1 Physical properties of soil
2.2 耕作深度对植烟土壤养分的影响
由图2可见,在0~20和20~40 cm土层,与CK相比, S2处理土壤有机质含量均显著增加,增幅分别为10.68%、11.45%,而S1处理差异不显著;在0~20 cm土层,与CK相比,S1处理全氮显著降低,降幅为16.06%,与CK相比,S2处理显著增加20~40 cm土层的全氮含量,增幅为32.67%;在0~20 cm土层,不同处理间的土壤铵态氮含量差异不显著,在20~40 cm土层,与CK相比,S2处理铵态氮显著增加,增幅为28.19%; 在0~20 cm土层,与CK相比,S1、S2处理土壤硝态氮均显著增加,增幅分别为106.42%、103.26%,在20~40 cm土层,与CK相比,S2处理硝态氮显著增加,增幅为159.74%;不同耕深处理下不同土层的有效磷含量均差异不显著;在0~20 cm土层,与CK相比,S1、S2处理的土壤速效钾含量均显著增加,增幅分别为98.05%、90.59%;在20~40 cm土层,与CK相比, S2处理速效钾显著增加,增幅为103.52%。说明,深耕30 cm有效提高20~40 cm土层的有机质、全氮、铵态氮、硝态氮、速效钾等土壤养分。

图2 土壤化学性状Fig.2 Soil chemical properties
2.3 耕作深度对耕层土壤生物学特征的影响
2.3.1 土壤微生物碳、土壤微生物氮和土壤酶活 由表2可知,与CK相比,S2处理的耕层土壤(0~20 cm)微生物碳含量显著降低,降幅为27.77%,不同耕作深度的土壤微生物氮含量差异不显著;与CK相比,S2处理的脲酶含量显著降低,降幅为36.84%,土壤不同耕深处理间的纤维素酶活性差异不显著。

表2 土壤微生物碳、土壤微生物氮和土壤酶活Table 2 Soil microbial carbon, soil microbial nitrogen and soil enzyme activity
2.3.2 土壤氨氧化微生物多样性 由图3可知,不同耕深处理下AOA群落在门和属水平相对丰度大于0.10%的均有3个菌群,与CK相比,门水平下,S1处理提高unclassified_k__norank_d__Archaea的相对丰度,S2处理提高泉古菌门(Crenarchaeota)的相对丰度;属水平下,S1处理提高unclassified_k__norank_d__Archaea的相对丰度,S2处理提高norank_c__environmental_samples_p__Crenarchaeota的相对丰度。不同耕深处理下AOB群落在门水平相对丰度大于0.10%均有2个菌群,与CK相比,S1、S2处理均提高变形菌门(Proteobacteria)的相对丰度;AOB群落在属水平相对丰度大于0.10%均有5个菌群,与CK相比,S1处理提高亚硝化螺菌属(Nitrosospira)的相对丰度,S1、S2处理均提高亚硝化弧菌属(Nitrosovibrio)的相对丰度,均降低亚硝化单胞菌目(unclassified_o__Nitrosomonadales)的相对丰度。说明,不同耕深处理下,土壤氨氧化微生物多样性没有显著差异,相对丰度存在差异。

图3 不同耕深土壤微生物群落在门、属水平上的组成和相对丰度Fig.3 Composition and relative abundance of microbial communities at phylum and genus level in soils with different tillage depths
2.3.3 土壤氨氧化微生物群落组成 由图3可知,不同耕深处理下AOA群落在门水平的优势种群为unclassified_k__norank_d__Archaea、泉古菌门(Crenarchaeota)、奇古菌门(Thaumarchaeota);AOA群落在属水平的优势种群为unclassified_k__norank_d__Archaea、norank_c__environmental_samples_p__Crenarchaeota、norank_c__environmental_samples_p__Thaumarchaeota。不同耕深处理下AOB群落在门水平下的优势种群为变形菌门(Proteobacteria)、unclassified_k__norank_d__Bacteria; AOB群落在属水平的优势种群为亚硝化单胞菌目(unclassified_o__Nitrosomonadales)、norank_f__environmental_samples、亚硝化螺菌属(Nitrosospira)、亚硝化弧菌属(Nitrosovibrio)、unclassified_k__norank_d__Bacteria。表明,不同耕深处理下的菌群组成相同,但是各菌群所占比例发生了改变。


图4 不同耕深土壤微生物群落结构和土壤养分的冗余分析Fig.4 Redundancy analysis of bacterial community structure and soil nutrients at different tillage depths
3 讨 论
3.1 耕作深度对植烟土壤理化特征的影响
烟草根系生长直接影响烟叶的产量和品质[26],根系生长与土壤的理化性状密切相关[27]。土壤容重和总孔隙度作为土壤的物理性状,发现在同一耕作深度处理下,深层土壤较表层土壤更紧实、孔隙更少,通过深耕打破犁底层能够较好地改善这一问题,在深耕30 cm处理下,土壤容重降低,总孔隙度增大。深耕在一定程度上显著降低土壤容重,使土壤疏松多孔[28-29],与本研究相符。有机质反映土壤的肥力,是为微生物提供生命活动必需的营养物质[30]。铵态氮、硝态氮、速效钾作为营养元素的无机态,是微生物活动的产物[31]。深耕后土壤有机质含量提高,深层土壤的全氮显著增加,与0~20 cm土层相比,20~40 cm土层的全氮含量增加。可能是由于深耕对土壤的破坏性较大,翻动土壤中的秸秆残茬,将表层土壤中的秸秆残茬带入深层土壤,激发土壤微生物的活性[32-33],从而影响20~40 cm土层的全氮含量。深耕下铵态氮、硝态氮、速效钾在深层土壤中的含量有效提高,可能是因为深耕促进了氧气和水分进入富含有机质的深层土壤,加速微生物活动,从而促进有机质的腐殖化作用及矿化作用[34],与何京等[35]的研究结果一致。
3.2 耕作深度对植烟土壤生物学特征的影响

4 结 论


