Sau MurA的表征及依布硒啉对Sau MurA和金黄色葡萄球菌的抑制作用
李明华,马郁芳
(1.锦州医科大学,辽宁 锦州 121000;2.大连医科大学,辽宁 大连 116044)
金黄色葡萄球菌是细菌感染中的重要病原体,主要存在皮肤表面和上呼吸道黏膜表面,可引起皮肤和软组织感染[1],也可引起心内膜炎、脑膜炎、脓毒症等多种疾病[2]。机体感染金黄色葡萄球菌后,细菌利用黏附分子黏附到感染部位的组织或细胞表面,通过获取营养完成增殖,导致宿主免疫系统和抗菌药物对它们难以清除[3]。金黄色葡萄球菌会产生多种致病的毒力因子,通过侵害宿主细胞引发病症,主要包括结构成分、酶以及毒素等,有助于细菌黏附定殖、营养获取和抵抗宿主免疫防御[4],是细菌产生致病性的主要原因[5]。同时金黄色葡萄球菌还可通过多种方式破坏宿主免疫反应,导致机体持续感染,加重病症[3]。
金黄色葡萄球菌是一种革兰氏阳性耐药菌,外层包裹着细胞壁,可以防御细胞质和细胞外部渗透压,并保持细胞形状和结构的完整性。肽聚糖层是细胞壁的主要成分,其生物合成途径中涉及许多对细胞存活具有重要作用的酶,抑制酶活性可导致细菌的裂解死亡,是抗菌药物发现的重要靶向途径之一。因此,靶向细菌细胞壁组分,对其生物合成途径中酶的特性进行了解,有利于更好的发现和开发新型抗菌药物。
金黄色葡萄球菌引起的感染一般采用抗生素药物进行治疗,主要包括青霉素、甲氧西林、万古霉素等抗菌药物。然而抗生素的广泛使用和不规范使用,降低了细菌对抗菌药物的敏感性,导致耐药性病原菌的出现。此外,生物被膜的形成导致抗生素难以渗透[6],以及耐药相关基因发生突变都会引发细菌产生耐药性,使细菌的治疗过程非常困难,迫切需要寻找新的抗菌药物。
依布硒啉是一种含硒化合物,具有抗动脉粥样硬化、抗菌抗毒性、抗氧化特性,具有免疫调节作用,对神经和心脏具有保护作用,在临床中主要用于关节炎、哮喘、中风、糖尿病等疾病的治疗[7]。该化合物的抑制机制已经在酵母和大肠杆菌中进行了详尽的研究,具有巨大的应用前景。因此,研究依布硒啉对MurA和金黄色葡萄球菌的抑制作用具有重要意义。
UDP-N-乙酰葡糖胺烯醇丙酮转移酶(MurA)作为细胞壁应急刺激相关蛋白的代表基因之一[8],是肽聚糖生物合成途径细胞质阶段的第一个酶,可催化两个底物UDP-N-乙酰葡萄糖胺(UNAG)和磷酸烯醇丙酮酸(PEP),反应过程中会释放磷酸。在反应过程中,UNAG首先与MurA的活性位点结合,然后PEP的C-2被UNAG的3′-羟基攻击,产生四面体中间体(THI);然后MurA催化THI向最终产物的转化,在反应过程中捕获和释放无机磷酸[9]。由于MurA是细菌生长的必需基因,在哺乳动物中不存在同源基因,因此MurA可成为重要的潜在靶标。许多细菌菌株的MurA结构和特性都已经被鉴定,关于金黄色葡萄球菌MurA酶及其抑制剂鲜有报道,因此对金黄色葡萄球菌MurA的特性进行研究具有十分重要的意义。
在本研究中以SauMurA为研究对象,构建了SauMurA蛋白表达系统,并利用亲和层析方法获得MurA蛋白,对其酶学特性进行了探究,以期理解其生化特性;利用定点突变的方法对MurA的6个特定氨基酸位点进行突变,并构建了突变蛋白的表达体系,通过亲和层析方法获得纯化的突变蛋白并对其活性进行鉴定,旨在确定MurA的活性位点。此外,本研究还测定了依布硒啉对MurA酶和金黄色葡萄球菌的抑制作用,为MurA抑制剂的研究提供了重要的理论依据。
1 材料和方法
1.1 材料
金黄色葡萄球菌(ATCC 25923),美国模式培养物集存库(ATCC);UDP-N-乙酰葡糖胺(UNAG)、磷酸烯醇式丙酮酸(PEP)、刃天青钠盐、结晶紫,依布硒啉,美国Sigma公司;异丙基-β-D-硫代半乳糖苷(IPTG)、Mutant BEST Kit试剂盒,TaKaRa大连生物工程有限公司。
1.2 方法
1.2.1SauMurA蛋白的表达和纯化
利用引物从Sau基因组DNA扩增SauMurA基因,然后将SauMurA基因(1266 bp)连接到pJET1.2/钝载体,产生克隆质粒pJET-SauMurA。测序后,将SauMurA连接到 pEHisTEV载体的NcoI和XhoI位点。
将pEHisTEV-SauMurA转化到大肠杆菌BL21(DE3)感受态细胞,使细菌在LB培养基中生长。然后用1 mM异丙基-β-D-硫代乳糖苷(IPTG)在37 ℃下诱导4 h,使MurA蛋白充分表达。将细菌培养物以5000×g离心,将细胞沉淀与裂解缓冲液(50 mM Tris-HCl,pH=8.0,100 mM NaCl,1 mM EDTA,5%甘油)与1 mM苯甲基磺酰氟(PMSF)重悬。通过超声波法破碎细胞,然后以10 000×g离心25 min。
首先利用平衡缓冲液(20 mM Tris-HCl,pH=8.0,500 mM NaCl,20%甘油)平衡镍柱,然后将上清液加到10 mL体积的Ni-NTA色谱柱上;用10 mL 20 mM咪唑缓冲液和5 mL 25 mM咪唑缓冲液洗涤镍柱;再用5 mL含有1 mM PMSF的洗脱液(20 mM Tris-HCl,pH=8.0,500 mM NaCl,200 mM咪唑)洗脱蛋白。利用SDS-PAGE和Western Blot检测纯化后的蛋白。
1.2.2SauMurA 蛋白的活性检测
采用孔雀石绿比色法检测SauMurA活性,该方法广泛用于无机磷酸的测定。MurA催化UNAG和PEP,以及反应过程中无机磷酸的释放。该反应体系包括50 mM Tris-HCl、1 mM DTT、0.5 mM PEP、1 mM UNAG、0.25 ng纯化的SauMurA蛋白。将底物UNAG、MurA蛋白等组分加入到96孔板中,在37 ℃下孵育5 min,将底物PEP加入到混合物中开始反应10 min。然后加入50 μL孔雀石绿溶液反应5 min,测定620 nm处的吸光度值。在测定中,反应中无SauMurA蛋白的实验体系作为阴性对照,Na2HPO4作为阳性对照。
1.2.3SauMurA酶学特性的测定
测定SauMurA酶的酶促动力学性质,在96孔板中进行实验,重复3次。
在37 ℃条件下将不同浓度的SauMurA蛋白(10、15、20、25 ng/mL)加入到96孔板中,反应时间分别为10、15、20、25 min。绘制酶浓度曲线和时间浓度曲线,以确定最佳的酶浓度和反应时间。
反应分别在18、30、37、42、60、80 ℃下进行,测定最佳温度;利用6种不同pH值的缓冲液(5、6、7、7.5、8、9、10)进行反应,以确定最佳pH值。此外,不同浓度的Ca2+和Mg2+(0、2.5、5、10、20 mM)加入到反应中以确定其对酶促反应的效果。
对于Km和Vmax,将5种不同浓度的UNAG(0.5、1、2、4、7 mM)和PEP(0.5、1、2、3、4 mM)添加到反应中,然后绘制1/V-1/S曲线,并计算Km和Vmax。
1.2.4SauMurA 活性位点的确定
为了研究SauMurA的活性位点,设计了编码丙氨酸的引物,利用定点突变的方法将6种氨基酸(K22、N23、C119、R124、D308、R400)突变为丙氨酸,通过TaKaRa mutant BEST Kit试剂盒进行突变实验。
突变蛋白的表达条件与野生型蛋白的表达条件相似。然而,突变蛋白的可溶性表达条件可能会因为氨基酸的取代而改变。因此,MurA突变蛋白在30 ℃和37 ℃下以0.1、0.3、0.5、1 mM IPTG 诱导表达4 h。
至于突变蛋白的纯化,该过程与野生型蛋白相同。特别的是,6种突变蛋白的洗涤缓冲液浓度不同。MurAD308A蛋白洗涤缓冲液的浓度为10 mL 20 mM咪唑缓冲液和5 mL 25 mM咪唑缓冲液,其他蛋白质则由10 mL的20 mM咪唑缓冲液洗脱。采用SDS-PAGE和Western Blot检测突变蛋白纯度,采用孔雀石绿比色法检测纯化的MurA突变蛋白的活性,然后计算蛋白质的相对活性,实验重复3次。
1.2.5 依布硒啉对MurA抑制活性和类型的测定
将浓度为0.2 mg/mL的依布硒啉用MurA酶和UNAG预孵育5 min,将底物PEP加入混合物中以在37 ℃条件下开始反应10 min。然后通过加入50 μL孔雀石绿溶液停止反应,5 min后,测量620 nm处的吸光度值。抑制率的计算公式为:(OD抑制组-OD正常组)/(OD正常组-OD阴性组)×100%。抑制组含有50 mM Tris-HCl,1 mM DTT,1 mM UNAG,0.5 mM PEP,10 ng/mL MurA蛋白,0.2 mg/mL依布硒啉。阴性组不含MurA和依布硒啉,正常组不含依布硒啉。如果该值小于50%,则化合物的浓度将继续半倍稀释,直到其没有抑制作用,IC50由GraphPad计算。为了探究依布硒啉的抑制类型,将1×IC50(4.9 μM)和2×IC50(9.8 μM)的依布硒啉加到MurA酶促反应中,然后测定MurA酶活性。
1.2.6 依布硒啉对金黄色葡萄球菌MIC的测定
依布硒啉对金黄色葡萄球菌(ATCC 25923)的抗菌活性通过刃天青染色法法测定,是测量细菌MIC的最常用方法。氧化状态下的刃天青溶液呈蓝紫色无荧光,如果发生氧化还原反应,可用荧光还原成粉红色还原物质,测定OD600可反映细菌的活性。
MIC测量在在96孔板中进行,将生长24 h后的金黄色葡萄球菌浓度稀释至1×106CFU/mL。在每个孔内加入50 μL LB培养基,并以2倍稀释法连续稀释依布硒啉溶液,最终浓度为0.54~68.5 μg/mL。将只加50 μL LB培养基的孔作为阴性对照,50 μL终浓度为25 μg/mL卡那霉素(Kan)的孔为阳性对照。最后,向每个孔中加入50 μL细菌培养物。用Bemis Parafilm(PM-996)密封板并在37 ℃下孵育24 h,然后将100 μL刃天青染料加入每个孔中,孵育12 h,观察颜色并测量OD600。培养物颜色不变的浓度即药物的MIC。
1.2.7 依布硒啉对金黄色葡萄球菌生长的作用
分别利用0.5×MIC,1×MIC,4×MIC的依布硒啉处理细菌培养物,对照组不作处理。每隔4 h测定OD600,同时取10 μL细菌培养物进行CFU测定。CFU/mL=菌落数×稀释倍数×100%。
1.2.8 依布硒啉对金黄色葡萄球菌生物膜的作用
培养金黄色葡萄球菌当OD600达0.05时,用改进的M63培养基稀释100 μL的细菌培养物。将150 μL的细菌培养物稀释到U-Bottom 96孔板(Costar)中,并用Bemis Parafilm(PM-996)密封板。在37 ℃孵育24 h后,轻轻取出培养物并用PBS洗涤3次。分别用0.5×MIC,1×MIC,2×MIC,4×MIC,8×MIC,16×MIC的依布硒啉处理生物膜,对照组不作处理。孵育24 h后,用0.01%结晶紫染色生物膜15 min,然后用PBS洗涤3次。最后加入95%乙醇溶解生物膜2 min,将结合生物膜的染料移至96孔板中并测定OD600,实验重复3次。
1.3 统计学方法
利用GraphPad Prism 6.0软件对实验数据进行统计学分析,组间比较应用单因素方差分析,两组间比较应用独立样本t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 表达并纯化Sau MurA蛋白
成功构建了SauMurA的表达系统,MurA 蛋白在大肠杆菌BL21(DE3)中表达,并通过Ni柱亲和层析法纯化。通过SDS-PAGE和Western Blot检测蛋白质的纯度,MurA蛋白的预期分子量为48.28 kDa,见图1。

图1 Sau MurA蛋白的SDS-PAGE(a)和Western Blot(b)检测
2.2 分析Sau MurA蛋白的酶促动力学性质
采用孔雀石绿法检测SauMurA的活性,结果表明MurA蛋白表现出UDP-N-乙酰葡糖胺烯醇丙酮基转移酶的活性。为了了解MurA的酶促性质,探究了SauMurA蛋白的酶促动力学,首先确定最佳反应系统,蛋白质的最佳浓度为10 ng/mL、反应时间为10 min,见图2a、2b。MurA蛋白在37 ℃,pH=7.5下显示出最大活性,见图2c、2d。此外,MurA活性不依赖于Ca2 +和Mg2 +,见图2e、2f;并计算了两个底物UNAG和PEP的Km和Vm。UNAG和PEP的Km值分别为(0.2379±0.0434)mM和(0.5305±0.0461)mM,UNAG和PEP的Vm值分别为(0.1546±0.0077)mM/min和(0.7772±0.0658)mM/min,见图2g、2h。
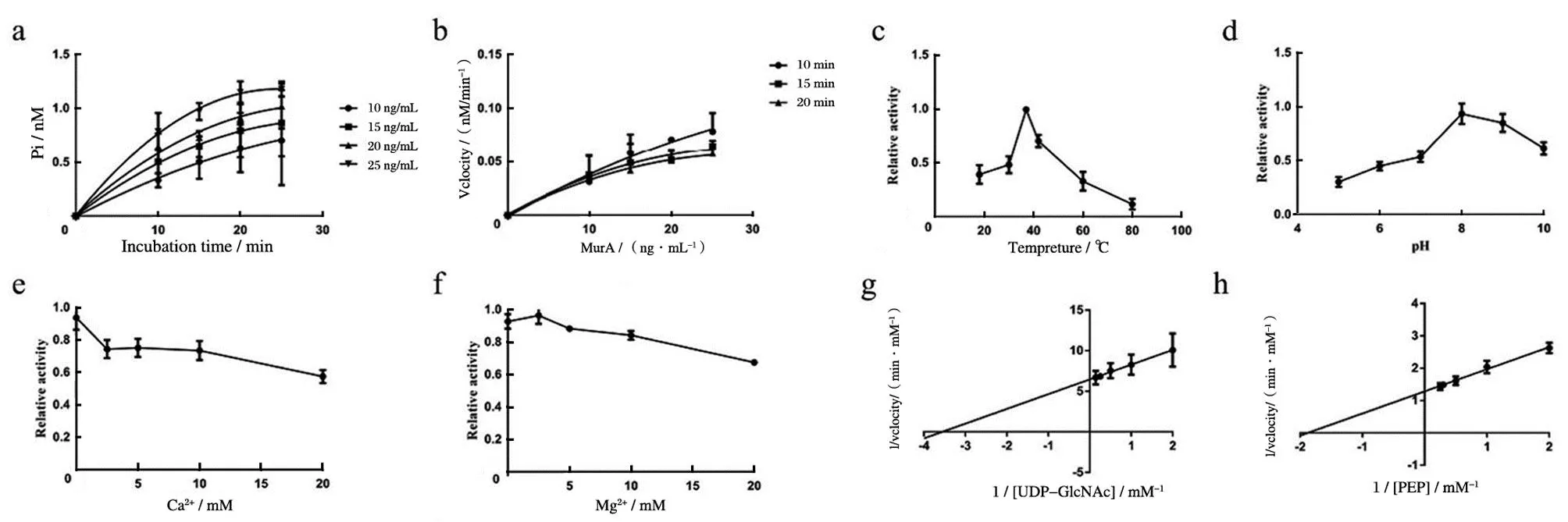
a:MurA时间曲线;b:MurA酶浓度曲线;c~d:温度(c)和pH(d)对MurA活性的影响;e~f:Ca2+(e)和Mg2+(f)对MurA活性的影响;g~h:UDP-GlcNAc(g)和PEP(h)的Km和Vmax。
2.3 确定Sau MurA酶的活性位点
利用定点突变的方法对氨基酸的重要活性位点进行验证。在本研究中,设计了编码丙氨酸的引物,将6种氨基酸(K22,N23,C119,R124,D308,R400)替换为丙氨酸。通过SDS-PAGE和Western Blot检测,对6种突变蛋白进行纯化和检测,见图3,并计算出突变蛋白的相对活性。结果表明,所有突变蛋白都没有显示出活性,见图4。
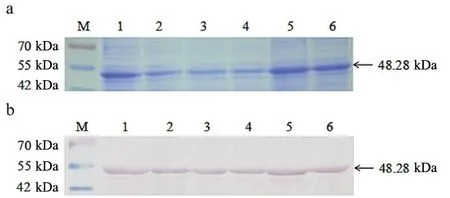
a、b:M:蛋白标准品;1:Sau MurAK22A;2:Sau MurAN23A;3:Sau MurAC119A;4:Sau MurAR124A;5:Sau MurAD308A;6:Sau MurAR400A。
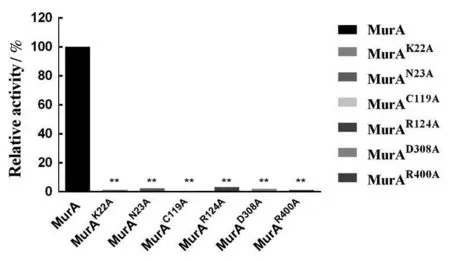
与对照组相比,**P<0.01。
2.4 依布硒啉对MurA的抑制作用和类型
依布硒啉对MurA活性具有抑制作用,IC50为4.9 μM,见表1,同时探究了该化合物对MurA的抑制类型。结果表明依布硒啉与PEP是竞争性抑制,见图5b,与UNAG是反竞争性抑制,见图5c。
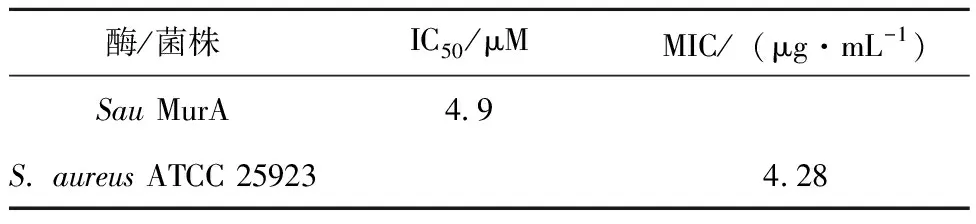
表1 依布硒啉的IC50和MIC
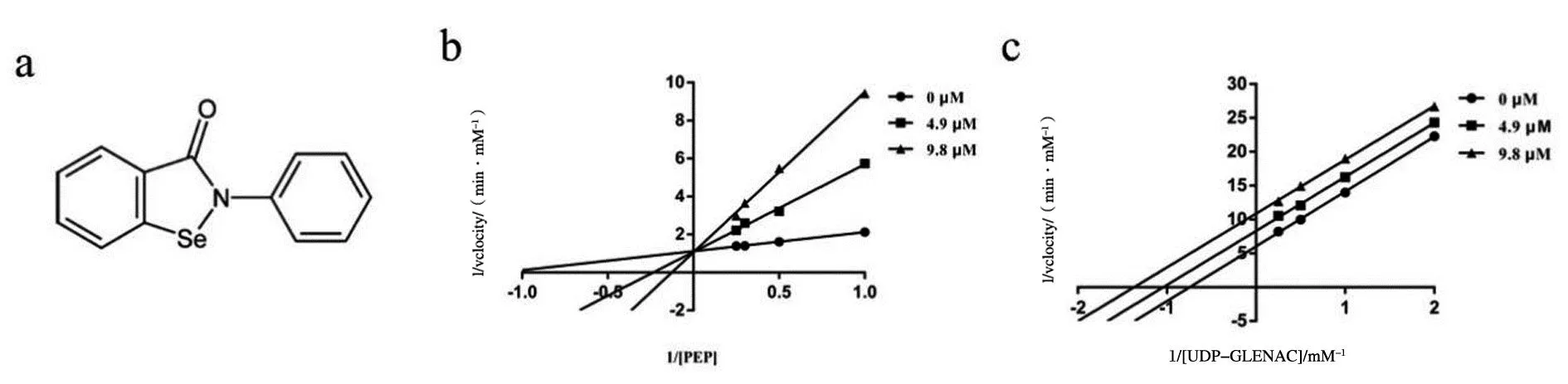
a:依布硒啉的化学结构;b:依布硒啉与PEP的抑制作用;c:依布硒啉与UNAG的抑制作用。
2.5 依布硒啉对金黄色葡萄球菌的生长抑制作用
本研究测定了依布硒啉对金黄色葡萄球菌的抑制活性,依布硒啉对金黄色葡萄球菌的最小抑制浓度为4.28 μg/mL,见表1。然后分别用0.5×MIC,1×MIC,4×MIC的依布硒啉处理金黄色葡萄球菌,绘制生长曲线和CFU曲线,见图6。结果表明,当依布硒啉浓度为0.5×MIC和1×MIC时,细菌生长趋势缓慢,低于对照组;当浓度达到4×MIC时,细菌明显受到抑制,活菌数量逐渐减少直至死亡。
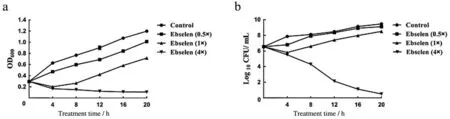
图6 金黄色葡萄球菌ATCC 25923的生长曲线和CFU曲线
2.6 依布硒啉对金黄色葡萄球菌生物膜的去除作用
此外,本文还探究了依布硒啉对金黄色葡萄球菌的成熟生物膜的作用。结果表明,当利用不同浓度的化合物处理细菌生物膜时,该化合物可以明显去除粘附的生物膜。当药物浓度为16×MIC时,对于金黄色葡萄球菌的抑制率约为80%,相比之下,作为对照组的利福平仅减少了约40%的生物膜,见图7。这些数据表明,依布硒啉对成熟的生物膜有高效的去除作用。
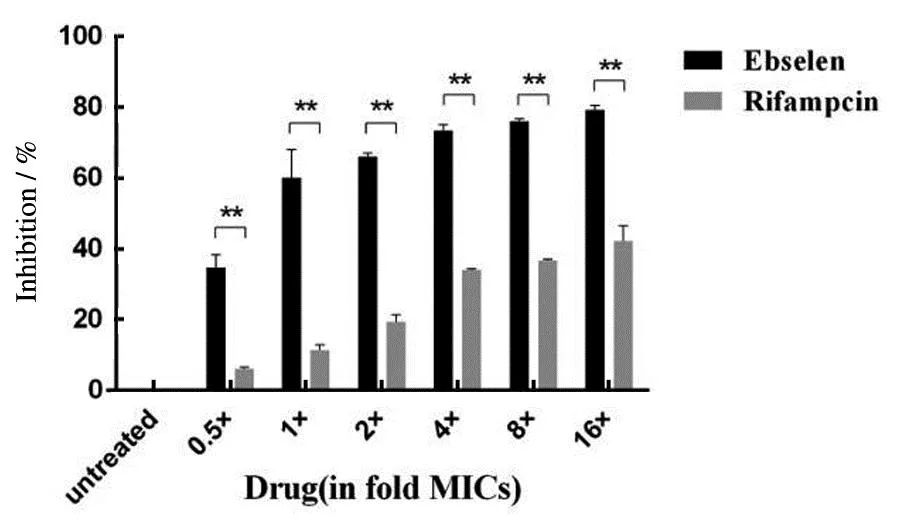
与对照组相比,** P<0.01。
3 讨 论
在过去的几十年里,MurA作为重要的靶标,对许多细菌MurA酶的结构和特征进行了深入研究。近年来国内外报道了几篇有关MurA酶的文章。FUNES CHABN等人[10]研究发现了来自植物的抗菌二萜及其合成类似物对大肠杆菌MurA和金黄色葡萄球菌MurA具有有效的抑制作用。CHANG等人[11]在费希新萨托菌中提取分离了3种对MRSA具有抑制作用的燕麦曲菌素,其中1号和2号化合物能同时抑制野生型菌株和耐磷霉素菌株的MurA酶;并通过分子对接实验证明了2号燕麦曲菌素竞争性地阻断了四面体中间复合物的形成。SONKAR等人[12]对鲍曼不动杆菌的MurA进行了生物化学和结构性质的研究,结果表明最佳温度是37 ℃、pH=8,UNAG和PEP的Km分别是(1.062±0.09)mM和(1.806±0.23)mM,证明Cys116是与磷霉素结合的重要活性位点。在我们的研究中,确定了SauMurA的动力学性质。UNAG和PEP的Km分别为(0.2379±0.0434)mM和(0.5305±0.0461)mM。基于不同细菌MurA酶的数据,将本研究中SauMurA与其他细菌MurA酶的Km数值进行了对比[13-20]。SauMurA对UNAG的Km值低于肺炎链球菌,结核分枝杆菌,耻垢分枝杆菌,鲍曼不动杆菌;对PEP的Km值仅低于鲍曼不动杆菌。这说明了不同物种的MurA对两个底物UNAG和PEP的亲和性是不同的,SauMurA对UNAG和PEP的亲和力较低。
对SauMurA与其他细菌序列的对比显示,该菌株具有保守的氨基酸残基。此外,通过定点突变方法对MurA重要的活性位点(K22,N23,C119,R124,D308,R400)进行了验证。据报道,Lys22参与酶的催化过程以及与PEP形成共价键[21]。Cys119作为主要的催化残基,它的取代可以导致细菌对磷霉素产生抗性。此外,Cys119还参与了MurA产物释放过程,进而影响酶的催化过程。Asn23和Asp308分别与UNAG形成一个氢键和两个氢键[15],同时Asp308在四面体中间复合物的形成过程中也发挥了重要作用[14]。另外,Lys22,Arg124和Arg400参与了无机磷酸的产生与释放过程[9]。
金黄色葡萄球菌在体内会产生20多种毒力因子[22],包括α-溶血素、肠毒素、血浆凝固酶、中毒性休克毒素-1、凝集因子A、杀白细胞毒素、剥脱毒素A等[23],这些毒力因子通过调控宿主的免疫应答系统,增强金黄色葡萄球菌的致病性及耐药性[1]。随着耐药性金黄色葡萄球菌菌株的产生,传统的抗生素不再奏效。因此,迫切需要寻找新的抗菌药物。依布硒啉是一种含有硒的化合物,具有抗炎、抗氧化和细胞保护活性,主要用于心脑血管疾病的治疗以及抗炎和噪声致听力损伤防治的研究[24]。本研究中我们发现依布硒啉抑制了金黄色葡萄球菌MurA酶的活性,此外有研究报道依布硒啉对耐药金黄色葡萄球菌临床分离株的强效杀菌活性,在我们的研究中证实了依布硒啉的抗菌活性,对金黄色葡萄球菌的MIC为 4.28 μg/mL。
生物膜的形成是大多数细菌的自然现象,主要附着在机体或物体表面,当机体组织受损时,细菌会分泌大量毒素导致感染[25]。金黄色葡萄球菌及其分泌的毒素会形成密集的生物膜,向外分泌细胞外聚合物基质,形成具有组织性和功能性的细菌聚合体[26]。生物膜阻碍药物的渗透,降低对宿主防御系统、抗生素和其他药物的敏感性,导致了金黄色葡萄球菌在慢性感染中的持久性,从而产生耐药菌株[27-28]。因此,需要探索新的药物治疗细菌的生物膜感染。本部分实验证明了依布硒啉能够有效去除金黄色葡萄球菌的生物膜,与对照组相比,抑制率高出40%,展现了依布硒啉对成熟生物膜高效的去除能力。这些研究结果为耐药金黄色葡萄球菌抑制作用的进一步研究以及依布硒啉在临床治疗中的应用提供了理论基础。

