脐带间充质干细胞对骨质疏松大鼠骨密度相关指标及Wnt/β-catenin/Runx2信号通路的影响
高辉,吴江,李超
(上海市金山区亭林医院骨科,上海 201500)
骨质疏松症(osteoporosis,OP)是一种多见于绝经后中老年妇女的以骨量减少、骨密度(BMD)下降、骨骼脆性增加为特征的骨代谢性疾病[1]。OP患者日常活动中易于发生骨折,其致残、致死率高严重影响中老年人的生活质量[2]。OP主要是由于成骨细胞和破骨细胞的代谢平衡导致的,OP患者通常成骨细胞活性较弱、破骨细胞活性较强导致骨组织密度下降、脆性增加[3]。目前对于OP的治疗药物主要分为两类:一类为促骨形成类药物,另外一类为抑制骨吸收药物。常见的促骨形成类药物包括:他汀类药物、重组人甲状旁腺激素以及生长激素等;常见的抑制骨吸收药物包括:双膦酸盐、性雌激素受体调节剂等[4]。但目前治疗OP的药物均有一定的副作用且疗效较长、费用较高等不足之处[5]。人脐带间充质干细胞(human umbilical cord mesenchymal stem cells,HUC-MSCs)是一种具有较强增殖能力且分化潜力大、免疫原性低的细胞[6]。HUC-MSCs经过特定的诱导可以分化成多种组织细胞且无道德伦理问题限制,因此具有较大的应用前景[7]。XIA[8]等研究表明通过体外移植HUC-MSCs可以显著改善OP症状,但目前关于HUC-MSCs治疗OP的机制尚不完全统一。基于此本研究通过建立OP大鼠模型,并利用HUC-MSCs干预检测其OP症状及相关通路情况蛋白表达情况。
1 实验材料
1.1 动物
SPF级8周龄雌性SD大鼠60只,体质量(220±30)g,购自武汉华联科有限公司,SYXK(鄂)2018-0104。本实验经过动物伦理委员会批准同意,伦理审批号:J2021-0002。
1.2 材料
HUC-MSCs细胞株购自深圳市豪地华拓生物科技有限公司;碱性磷酸酶(alkaline phosphatase,ALP)试剂盒(货号:ab83369)购自abcam;Ⅰ型胶原 C 端肽(c-terminal peptide of type Ⅰ collagen,CTX)试剂盒(货号:XG-E990132)购自上海西格科技有限公司;Runx2抗体(货号:ab92336)、β-catenin抗体(货号:ab68183)、GAPDH(货号:ab181602)均购自Abcam。
1.3 主要仪器
双能X线骨密度仪(型号:AKDX-09W-I)购自艾克瑞公司;超低温冰箱(型号:VIP ECO MDF-DU502VHL-PC)购自phcbi公司;蛋白电泳及转膜仪购自美国Bio-Rad公司;凝胶成像系统购于以色列DNR公司。
2 方 法
2.1 分组及建立模型
大鼠适应性喂养 1 w,采用随机数字表法分为3组,其中Sham组20只,Model组30只和HUC-MSCs组30只,采用两侧卵巢切除法制成OP大鼠模型,方法参考YANG等[9]研究:Model组和HUC-MSCs组大鼠采用水合氯醛麻醉后,从腰背部切口进入腹腔切除双侧卵巢,Sham组大鼠切除卵巢等重量的脂肪组织,手术后常规饲养。10 w后每组处死3只大鼠,心脏穿刺取血检测大鼠雌激素水平,若雌激素水平差异有统计学意义则表明造模成功。
2.2 药物干预
取冻存的HUC-MSCs细胞,复苏后,在37 ℃、5%CO2条件下培养,3 d换1次培养基,当细胞密度 80%~90%时,用0.25%胰酶消化,并传3代。用生理盐水配制成细胞密度为4×106/mL的细胞悬液。HUC-MSCs组大鼠完成手术后以4×106/3 d的细胞数目进行尾静脉注射,Sham组和Model组注射等量生理盐水。
2.3 检测项目
2.3.1 大鼠相关血清指标检测
各组取5只大鼠,碘伏消毒暴露心脏后,使用7号采血针刺入心脏,抽取10 mL全血,静置1 h后,使用离心机以3000 r/min离心15 min,取上层血清按照试剂盒检测方式检测各组大鼠雌激素水平、血钙水平、ALP水平、CTX水平。
2.3.2 大鼠骨组织相关指标检测
各组取5只大鼠右侧胫骨,使用4%多聚甲醛固定后,置于双能X线骨密度仪上检测大鼠BMD。采用 Micro CT 检测大鼠即骨小梁数量(Tb.N)、骨小梁厚度(Tb.Th)、骨小梁分离度(Tb.Sp)。
各组取5只大鼠骨组织进行石蜡切片,使用抗酒石酸酸性磷酸酶染色,用显微镜观察,使用Image-Pro Plus分析成骨细胞的表面与骨表面积比例(Obs/BS)和破骨细胞表面积与骨表面积比例(Ocs/BS)。
2.3.3 大鼠骨组织大鼠Wnt/β-catenin/Runx2信号通路相关蛋白检测
各组取5只大鼠骨组织在研钵内磨碎后,加入裂解液,加入量按照每100 mg骨组织加入1 mL裂解液,使用10% SDS聚丙烯酰胺凝胶电泳法提取样本中的蛋白,使用半干法将提取的蛋白转移到PVDF膜上,使用5%脱脂奶粉室温封闭,加入各蛋白对应的抗体并孵育,彰显后拍照,使用Image J软件进行灰度值分析各蛋白的相对表达水平,本研究使用的内参蛋白为GAPDH。
2.4 统计学方法
采用SPSS 22.0软件对数据进行统计学分析,作图采用 GraphPad Prism 7.0软件,大鼠雌激素水平、血钙水平、ALP水平、CTX水平采用单因素方差分析,两两比较采用LSD-t检验法,骨组织切片成骨细胞、破骨细胞面积、体积比采用Image-Pro Plus软件分析,组间两两比较采用t检验,以P<0.05为差异有统计学意义。
3 结 果
3.1 大鼠血清指标检测结果
检测大鼠CTX、雌激素、血钙和ALP水平发现,相比Sham组,Model组和HUC-MSCs组大鼠雌激素水平(t=15.556,P<0.001;t=12.502,P<0.001)、血钙水平(t=15.071,P<0.001;t=5.211,P<0.001)和ALP水平(t=3.721,P=0.006;t=2.357,P=0.046)均降低,差异均有统计学意义,CTX水平(t=6.417,P<0.001;t=2.407,P=0.043)升高,差异有统计学意义;相比Model组,HUC-MSCs组大鼠血钙水平(t=6.620,P<0.001)和ALP水平(t=4.150,P=0.002)均升高,差异有统计学意义,CTX水平(t=4.895,P=0.001)降低,差异有统计学意义,见图1。
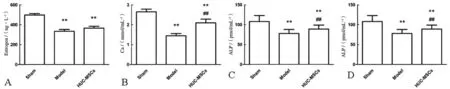
A为雌激素水平检测结果;B为血钙水平检测结果;C为ALP水平检测结果;D为CTX水平检测结果;与Sham组相比,**P<0.05;与Model组相比,##P<0.05。
3.2 大鼠骨组织检测结果
检测各组大鼠骨组织情况发现,相比Sham组,Model组和HUC-MSCs组大鼠BMD水平(t=11.530,P<0.001;t=3.116,P=0.014)、Tb.N水平(t=19.750,P<0.001;t=5.757,P<0.001)、Tb.Th水平(t=7.800,P<0.001;t=3.004,P=0.017)均降低,差异均有统计学意义,Tb.Sp水平(t=22.577,P<0.001;t=8.016,P<0.001)升高,差异有统计学意义;相比Model组,HUC-MSCs组大鼠BMD水平(t=6.142,P<0.001)、Tb.N水平(t=10.898,P<0.001)、Tb.Th水平(t=4.000,P=0.004)均升高,差异有统计学意义,Tb.Sp水平(t=16.775,P<0.001)降低,差异均有统计学意义(P<0.01),见图2。

A为BMD检测结果;B为Tb.N检测结果;C为Tb.Th检测结果;D为Tb.Sp检测结果;与Sham组相比,**P<0.05;与Model组相比,##P<0.05。
3.3 大鼠骨组织染色结果
通过抗酒石酸酸性磷酸酶染色发现Sham组破骨细胞较少、单位长度内破骨细胞数量较少,Model组和HUC-MSCs组破骨细胞较多、单位长度内破骨细胞数量较多且骨小梁周长较长,见图3。
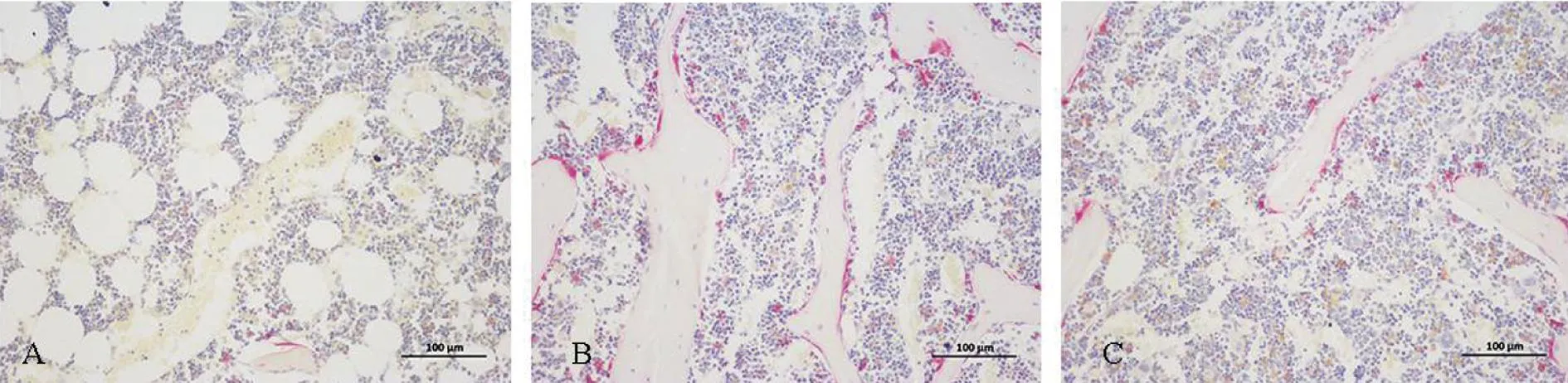
A为Sham组;B为Model组;C为HUC-MSCs组。
3.4 大鼠成骨/破骨细胞表面与骨表面积比例检测结果
检测各组大鼠成骨细胞和破骨细胞与骨面积比例发现,相比Sham组,Model组和HUC-MSCs组大鼠Ocs/BS值(t=4.581,P=0.002;t=2.530,P=0.035)升高,差异有统计学意义,Obs/BS值(t=5.459,P=0.001;t=2.339,P=0.047)降低,差异有统计学意义;相比Model组,HUC-MSCs组大鼠Ocs/BS值(t=2.530,P=0.035)降低,差异有统计学意义,Obs/BS值(t=3.794,P=0.005)升高,差异有统计学意义,见图4。
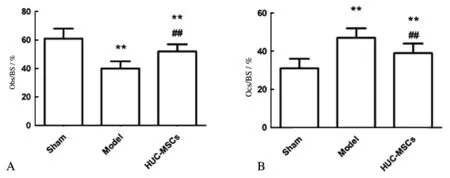
A为成骨细胞表面积与骨表面积比例值;B为破骨细胞表面积与骨表面积比例值;与Sham组相比,**P<0.05;与Model组相比,##P<0.05。
3.5 大鼠骨组织Wnt/β-catenin/Runx2通路蛋白检测结果
检测各组大鼠骨组织Wnt/β-catenin/Runx2通路蛋白表达情况发现,相比Sham组,Model组和HUC-MSCs组大鼠β-catenin蛋白(t=15.531,P<0.001;t=4.437,P=0.002)和Runx2蛋白(t=12.750,P<0.001;t=2.923,P=0.019)相对表达水平降低,差异有统计学意义;相比Model组,HUC-MSCs组大鼠β-catenin蛋白(t=9.035,P<0.001)和Runx2蛋白(t=14.484,P<0.001)相对表达水平升高,差异有统计学意义,见图5。
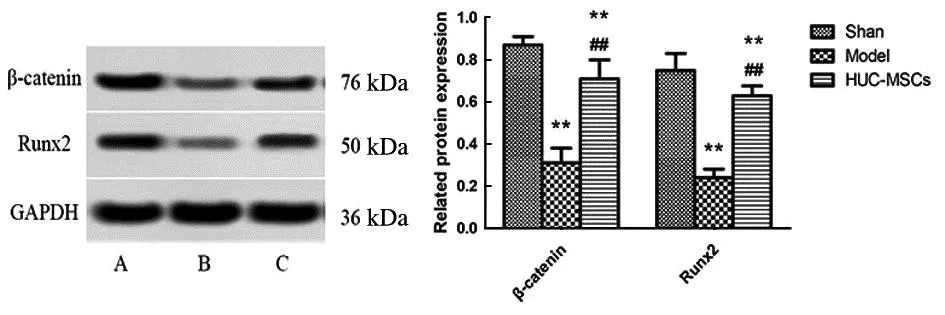
A为Sham组;B为Model组;C为HUC-MSCs组;左图为蛋白质印迹图,右图为相对表达量柱状图;与Sham组相比,**P<0.05;与Model组相比,##P<0.05。
4 讨 论
OP的发生与骨代谢紊乱密切相关,正常情况下成骨细胞和破骨细胞存在一定的平衡,成骨细胞主要调节骨形成,破骨细胞控制骨吸收[10]。当成骨细胞活性弱于破骨细胞则会使得骨组织吸收量大于形成量。最终导致骨小梁结构稀疏、骨小梁分离度较大、骨骼脆弱、BMD下降等[11]。OP常发于绝经后的女性,当女性绝经后卵巢功能减退,会使得骨代谢紊乱,导致破骨细胞活性增强,加速骨小梁的吸收同时会抑制成骨细胞的活性使得骨形成速度缓慢,导致骨量丢失,最终导致OP[12]。基于此本研究使用切除大鼠双侧卵巢构建OP大鼠模型。本研究使用HUC-MSCs作用OP大鼠模型,检测大鼠血清骨代谢指标以及大鼠骨组织状况以期探究HUC-MSCs对OP的作用效果,同时检测了与OP密切相关的Wnt/β-catenin/Runx2通路蛋白表达,初步探究HUC-MSCs改善OP症状可能涉及的分子机制。
骨代谢有较多的血清学指标,其中常见的有血钙、血磷、CTX、ALP等[13]。其中CTX是骨形成和骨吸收的重要指标之一。人体的钙元素可以是骨钙和血钙,血钙降低,说明人体组织中的钙总量下降[14]。ALP是成骨细胞早期特异性标志物,在成骨过程中能水解磷酸酯和焦磷酸盐活性,有利于骨矿化,促进骨形成[15]。ALP会随着骨组织中成骨细胞的分化的增多,ALP的表达也随之增强[16]。成骨吸收过程中破骨细胞会释放CTX,CXT水平升高说明骨细胞被吸收使得骨量降低,可以作为OP的重要参考指标。本研究检测了各组大鼠雌激素水平、血钙水平和ALP水平发现,相比Sham组,Model组大鼠Model组大鼠雌激素水平、血钙水平和ALP水平均显著降低,CTX水平显著升高。使用HUC-MSCs作用后雌激素水平、血钙水平和ALP水平均显著升高,CTX水平显著降低。说明HUC-MSCs作用可以显著改善大鼠OP症状。除了血清指标外骨小梁在OP的发展中起着重要的作用,通常情况下OP患者会出现骨质量降低、骨小梁数量减少、厚度变薄、骨小梁之间的间隙变大。本研究也检测了骨小梁相关指标发现相比Sham组,Model组大鼠BMD、Tb.N、Tb.Th水平均显著降低,Tb.Sp水平显著升高,使用HUC-MSCs所用后BMD、Tb.N、Tb.Th水平均显著升高,Tb.Sp水平显著降低。这表明HUC-MSCs可以有效增加大鼠骨组织中骨小梁的数目和密度来改善大鼠OP症状。
成骨细胞和破骨细胞是骨具有调节骨代谢的作用,成骨细胞主要负责骨基质的合成是骨形成的主要细胞。破骨细胞内,无机质被降解,骨组织以钙离子的形式排入血流中是骨吸收的主要功能细胞[17]。当体内成骨细胞活性降低破骨细胞活性升高会使得骨形成能力不足及功能减退,成骨细胞数量减少,骨量减少,进而发展成OP[18]。本研究检测了成骨细胞和破骨细胞状况发现相比Sham组,Model组大鼠Ocs/BS值显著升高,Obs/BS值显著降低,使用HUC-MSCs作用后Ocs/BS值显著降低,Obs/BS值显著升高。说明使用HUC-MSCs可以增加成骨细胞的数量,降低破骨细胞数量,使得骨组织向合成方向进展。这可能是因为骨髓具有较好的分化潜力,可以分化为成骨细胞,改善大鼠OP症状。
Wnt/β-catenin/Runx2通路在骨代谢中起着重要的作用[19]。当Wnt信号被激活时β-catenin会发生磷酸化并进入细胞核,激活下游的信号因子Runx2。Runx2是Runx家族的重要成员之一,在骨代谢中是一种骨组织特异性转录因子[20]。当Runx2含量减少时,会使得成骨组织中的成骨细胞的活性和分化均受到抑制,除此之外Runx2还会促进Ⅰ型胶原合成,提高ALP、血清骨钙素和I型原骨胶原氨基酸前肽的水平,使得成骨细胞活性增强加速骨组织的积累[21]。本研究采用WB检测了大鼠骨组织中β-catenin和Runx2蛋白的表达水平发现,Model组大鼠β-catenin和Runx2蛋白相对表达水平显著降低,使用HUC-MSCs干预后大鼠β-catenin和Runx2蛋白相对表达水平显著升高。这说明HUC-MSCs可以有效通过激活Wnt/β-catenin/Runx2通路,增强成骨细胞的活性使得大鼠OP症状得到了显著的改善。
综上所述,HUC-MSCs可以有效改善大鼠OP,其作用机制可能通过抑制破骨细胞活性并促进成骨细胞活性有关,同时HUC-MSCs改善OP症状与Wnt/β-catenin/Runx2信号通路也有密切关系。

