搭载吉西他滨的SiO2@Fe3O4纳米材料抑制裸鼠胰腺癌移植瘤生长的实验研究
全棋,管时伟,林泉,彭明晖,俞海波
温州医科大学定理临床学院/温州市中心医院 肝胆胰外科,浙江 温州 325000
胰腺癌是目前世界上高度恶性肿瘤之一,尽管近年来胰腺癌患者的5 年生存率有所上升,但仍低于10%[1-2]。在免疫治疗对胰腺癌疗效并不显著的现今,化疗仍是胰腺癌临床治疗的重要手段[3-4]。吉西他滨(gemcitabine,GEM)在卵巢癌、膀胱癌和非小细胞肺癌等多种肿瘤中取得了不错的效果。但在胰腺癌中,GEM的临床疗效面临两个巨大的问题:GEM的毒副作用和GEM耐药性。GEM的化疗耐药涉及多个方面,如药物代谢途径的改变、肿瘤微生物的影响和肿瘤微环境改变等[5-6]。如何改善GEM对胰腺癌的治疗效果是一个值得深入研究的问题。其中一种有效改善GEM耐药的策略是采用纳米材料包载GEM,提高其递送效率和选择性[7]。而基于SiO2包被的Fe3O4复合纳米颗粒在弥补Fe3O4较不稳定的缺点同时具有较好的水溶性,可作为一种具有应用潜力的材料。
1 材料和方法
1.1 实验材料
氨水(浓度为28%)、三氯化铁(FeCl3)、聚乙烯吡咯烷酮(PVP)、甲醇、乙二醇、乙酸铵、冰乙酸、盐酸GEM、硅酸四乙酯(TEOS)购自阿拉丁公司。1640 培养基、胎牛血清FBS、胰酶、磷酸盐缓冲液(PBS)、青霉素-链霉素购自Gibco公司。二甲苯、酒精、中性树胶购自国药公司。苏木素伊红(HE)染色试剂盒购自Solarbio公司。CCK-8试剂盒购自碧云天公司。PANC02小鼠胰腺癌细胞和PaEC小鼠胰腺上皮细胞购自普诺赛公司,Balb/c裸鼠购自斯贝福公司。实验的实施得到温州医科大学实验动物伦理委员会的批准(批号:xmsq2023-1361)。
1.2 SiO2@Fe3O4复合纳米颗粒制备和表征
SiO2@Fe3O4复合纳米颗粒的制备分为两步(图1)。(1)将1.5 g FeCl3、1 g PVP和2 g乙酸钠加入乙二醇中,搅拌至完全溶解并加热,洗涤烘干后得Fe3O4微球。(2)称取0.2 g Fe3O4分散于无水乙醇∶水(5∶1)溶液中,随后滴加TEOS与氨水的溶液,洗涤烘干后得SiO2@Fe3O4微球。透射电镜(transmission electron microscopy,TEM)照片由美国FEI Talos F200S型高分辨透射电子显微镜测得;采用布鲁克Tensor Ⅱ型傅立叶红外光谱仪测试样品的特征吸收峰及表面基团的变化,扫描范围为4 000~400 cm-1进行分析。
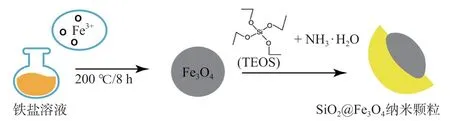
图1 SiO2@Fe3O4复合纳米颗粒制备流程示意图
1.3 搭载GEM的SiO2@Fe3O4纳米复合材料的制备及载药性能研究
取SiO2@Fe3O4复合纳米颗粒分散于无水乙醇中,加入GEM,避光磁力搅拌。得到产物装于透析袋中透析24 h。精密称定GEM对照品,配制成1.0 mg/mL贮备液,用超纯水稀释成一系列标准溶液。将GEM-SiO2@Fe3O4溶液置于透析袋中透析24 h。取标准品溶液过滤后注入HPLC系统中进行测定,测得GEM标准工作曲线。取透析介质过滤后进行测定,测得游离GEM含量,计算包封率、载药率。
1.4 药物体外释放实验
称定GEM对照品适量,配制成1.0 mg/mL贮备液,用超纯水稀释成一系列标准溶液。精密称定1.0 mg GEM-SiO2@Fe3O4和0.1 mg GEM干燥粉末,分别溶于1 mL PBS缓冲液中。以恒定速率振荡,分别在1、2、4、6、8、12、18、24、36、48 h时取出1 mL缓冲溶液,并补加相对应体积的缓冲溶液。取10 μL缓冲溶液通过0.22 μm过滤器过滤后注入HPLC系统中进行测定。测得缓冲溶液的峰面积,结合GEM标准曲线,计算出各个时间点的药物释放量,绘制体外药物释放曲线。体外药物释放曲线计算公式如下:
式中Q,累积释药百分率;Ct,各时间点缓冲溶液中的药物浓度(μg/mL);V0,缓冲溶液总体积(mL);V,取出的缓冲溶液的体积(mL);W,透析袋中的药物含量(mg)。
1.5 SiO2@Fe3O4复合纳米颗粒稳定性实验
取SiO2@Fe3O4复合纳米颗粒适量,分别用PBS(pH=7.4)缓冲液和RPMI-1640 培养基稀释至0.1 mg/mL,使用Malvern Zetasizer纳米粒度仪在1、2、3、4、5、6和7 d的时间内测量粒径,取3个读数的平均值作为结果。
1.6 细胞活性检查
采用CCK-8 法。将PANC02 小鼠胰腺癌细胞和PaEC小鼠胰腺上皮细胞进行细胞培养及传代并制备细胞悬液。在计数板每孔加入100 μL 5 000个细胞。过夜贴壁后,分别给予不同浓度的SiO2@Fe3O4复合纳米颗粒溶液,并设定仅加细胞不加任何刺激的空白对照组和仅加培养液的溶剂对照组,每组设6 个复孔,分别避光培养48 和72 h。培养结束,弃去原培养液,加入100 μL含10% CCK8试剂的无血清培养液。1 h后在450 nm波长下测量吸光度值。
1.7 胰腺癌移植瘤裸鼠制备及体内抗肿瘤实验
PANC02 细胞用胰酶消化后洗去胰酶并制备细胞悬液。选择Balb/c雄性裸鼠皮下接种PANC02细胞。将24 只裸鼠随机分为4 组,前三组分别经尾静脉注射生理盐水(空白对照组/NS组)、5 mg/kg的GEM(GEM组)和以5 mg/kg GEM计的GEM-SiO2@Fe3O4(GEM-SiO2@Fe3O4组)。最后一组注射以5 mg/kg GEM计GEM-SiO2@Fe3O4后麻醉并在体外接近靶区肿瘤部位施加磁场2 h(GEM-SiO2@Fe3O4-M组)。每次间隔3 d给药一次并用游标卡尺测量肿瘤大小,计算相对肿瘤体积。实验终点将动物处死,测量并计算肿瘤体积。将肿瘤制作组织切片,进行病理分析。游标卡尺测量肿瘤最长(a)和最短(b)部位。肿瘤体积(V)按以下公式计算:
1.8 药物组织分布实验
PANC02 细胞接种于裸鼠皮下。将36 只裸鼠按照体质量均分为3 组:尾静脉注射5 mg/kg GEM(GEM组),以5 mg/kg GEM计的GEM-SiO2@Fe3O4(GEM-SiO2@Fe3O4组)和以5 mg/kg GEM计的GEMSiO2@Fe3O4,麻醉后在体外接近靶区部位施加磁场(GEM-SiO2@Fe3O4-M组)。于给药或外加磁场处理后0.5、1、2、4 h各取3只裸鼠解剖并取心、肝、脾、肺、肾及肿瘤组织,称定质量。
将GEM贮备液稀释制备得到的对照品溶液用于计算校准曲线。吸取裸鼠各组织匀浆200 μL,加入GEM标准溶液适量,制成一系列浓度组织匀浆样品。离心后,将有机相蒸发干燥,残渣溶解后混合离心。取10 μL上清过滤后进行测定。各组织加入3倍量生理盐水,用匀浆器制备组织匀浆液,用相同的方法得到上清液。利用校准曲线计算各样品中GEM的浓度。
1.9 肿瘤组织切片制作
用生理盐水冲洗组织后,干燥后放入10%甲醛固定。观察形态学变化后,石蜡包埋,连续切片。烤片后经过脱蜡-蒸馏水冲洗-苏木素和2%伊红染色-梯度酒精脱水-二甲苯透明-中性树胶封片等过程,得到组织切片。最后在光学显微镜下观察组织切片。
1.10 统计学分析
2 结果
2.1 SiO2@Fe3O4复合纳米颗粒的FT-IR和TEM分析结果
采用傅里叶变换红外光谱法(FT-IR)对Fe3O4、SiO2和Fe3O4@SiO2纳米颗粒进行了鉴定,得到的FTIR如图2A所示。FT-IR结果显示Fe3O4中570 cm-1处有铁氧键的伸缩振动峰[8]。SiO2中807 cm-1处是Si-OSi的伸缩振动峰,1 047cm-1处是Si-OH的不对称振动峰,SiO2@Fe3O4复合纳颗米粒中既有铁氧键特征峰又有Si-O-Si和Si-OH特征峰,这说明SiO2成功包覆在Fe3O4纳米颗粒上[9]。
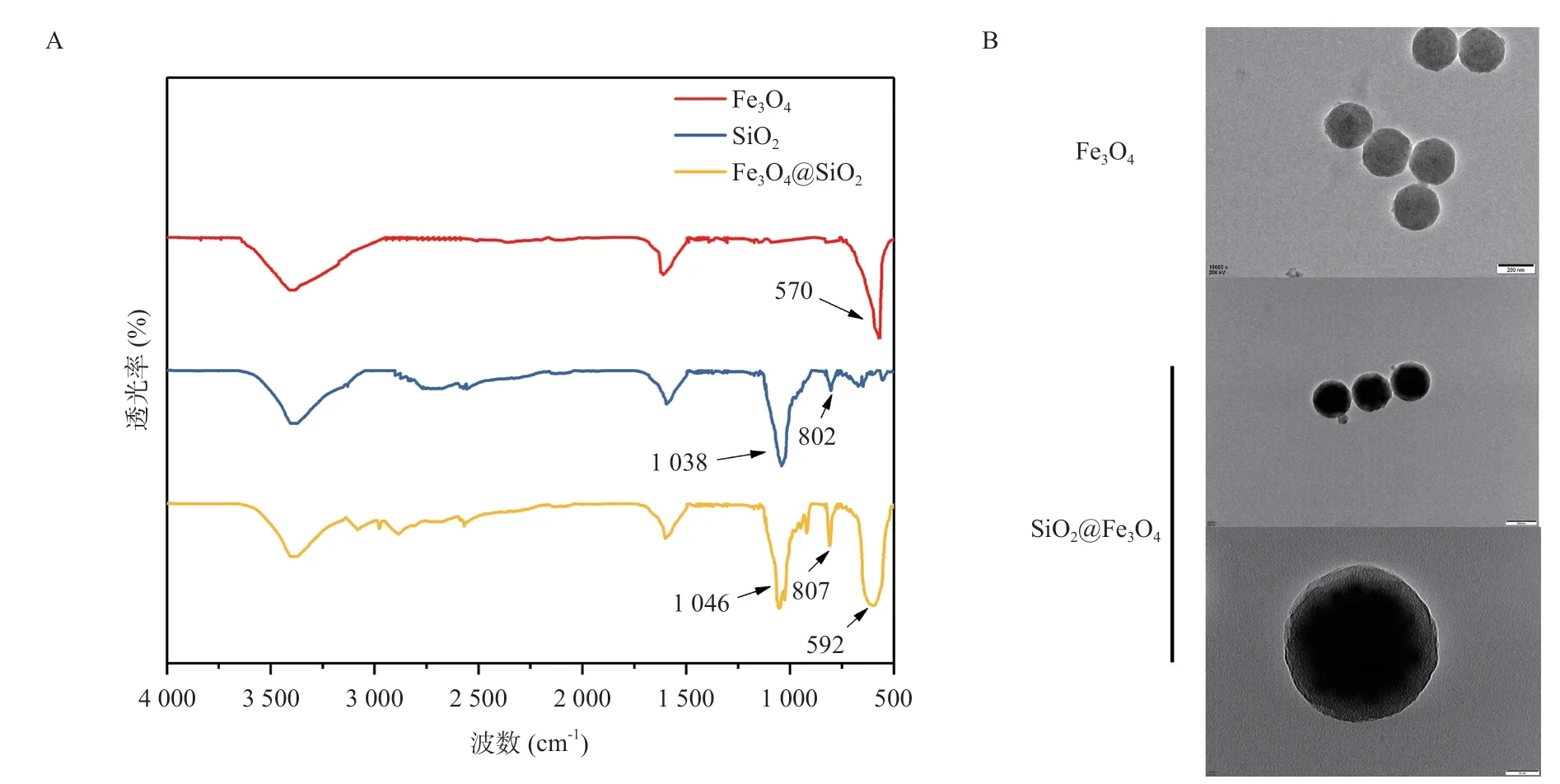
图2 Fe3O4、SiO2及SiO2@Fe3O4复合纳米颗粒的FT-IR(A)和Fe3O4纳米颗粒及SiO2@Fe3O4复合纳米颗粒TEM结果(B)
从TEM中可见制得的Fe3O4颗粒为球形,粒径大小均匀(200 nm)。此外,TEM示SiO2@Fe3O4粒径220~260 nm,中间部分颜色较深,证明Fe3O4被包覆在里面,外层相对明亮的部分具有介孔SiO2结构,说明Fe3O4与SiO2复合颗粒制备成功(图2B)。
2.2 SiO2@Fe3O4复合纳米颗粒对GEM的载药性能
载药率是指单位质量或单位体积微球/纳米颗粒所负载的药量,其中能释放的药量为有效载药量。除药物与基质发生不可逆结合外,载药量可看成是微球/纳米颗粒的含药量。包封率是指被包裹物质在纳米颗粒悬液中占药物总量的百分量。它是纳米颗粒质量控制的一个重要的指标,反映了药物被载体包封的程度。因此我们计算了SiO2@Fe3O4复合纳米颗粒对GEM的载药量和包封率。我们利用HPLC法,测定不同浓度的GEM标曲溶液,记录峰面积,建立的回归方程为:
结合相应标准曲线计算得出(图3),GEM的包封率为84.8%,载药率为7.8%。

图3 GEM标准溶液在HPLC系统中测定的标准工作曲线
2.3 GEM-SiO2@Fe3O4复合纳米颗粒的药物体外释放情况
与游离GEM相比,GEM-SiO2@Fe3O4复合纳米颗粒12 h内的GEM释放率达到30%,24 h左右达到50%左右,随后维持在60%左右,而游离GEM在12 h内释放率即达约75%(图4)。

图4 GEM-SiO2@Fe3O4复合纳米颗粒和GEM的药物体外释放曲线
2.4 SiO2@Fe3O4复合纳米颗的稳定性及生物相容性
SiO2@Fe3O4复合纳米颗粒稳定性实验显示,随着时间的变化,该纳米材料的径粒在PBS 或RPMI-1640 培养基中均无明显变化,说明制备的纳米颗粒具有一定的稳定性(图5A)。为了进一步评估空载体SiO2@Fe3O4复合纳米颗粒对PANC02胰腺癌细胞和PaEC小鼠胰腺上皮细胞的增殖影响,我们使用CCK8 检测了细胞活性。结果显示,两种细胞的活性均高于80%(图5B)。这表明细胞的生长状态和数量未受到SiO2@Fe3O4复合纳米颗粒本身材料的影响。这表明制备的纳米复合颗粒无明显的细胞毒性,生物相容性良好。

图5 SiO2@Fe3O4复合纳米颗粒的稳定性及生物相容性
2.5 GEM-SiO2@Fe3O4联合磁场治疗对裸鼠胰腺癌移植瘤的作用及安全性
从裸鼠胰腺癌移植瘤组织大体标本上看,GEM组和GEM-SiO2@Fe3O4组的裸鼠胰腺癌移植瘤体积均小于NS组,但与GEM组相比,GEM-SiO2@Fe3O4组的胰腺癌肿瘤体积更小(图6A)。此外,比较裸鼠胰腺癌组织质量和体积时,GEM组和GEM-SiO2@Fe3O4组之间差异无统计学意义(均P>0.05,图6B、6C)。外加磁场作用下的GEM-SiO2@Fe3O4与GEM组相比,显示GEM-SiO2@Fe3O4组的胰腺癌肿瘤组织的质量和体积更少(均P<0.05)。这表明,SiO2@Fe3O4能将GEM富集在附加磁场附近释放,并产生显著疗效。各组心、肝、脾、肺和肾HE染色没有显示明显的器官损伤迹象,表明该材料具有良好的生物相容性。与NS组相比,GEM组和GEM-SiO2@Fe3O4组肿瘤组织出现局部坏死,而GEM-SiO2@Fe3O4-M组的肿瘤组织坏死更广泛(图7)。
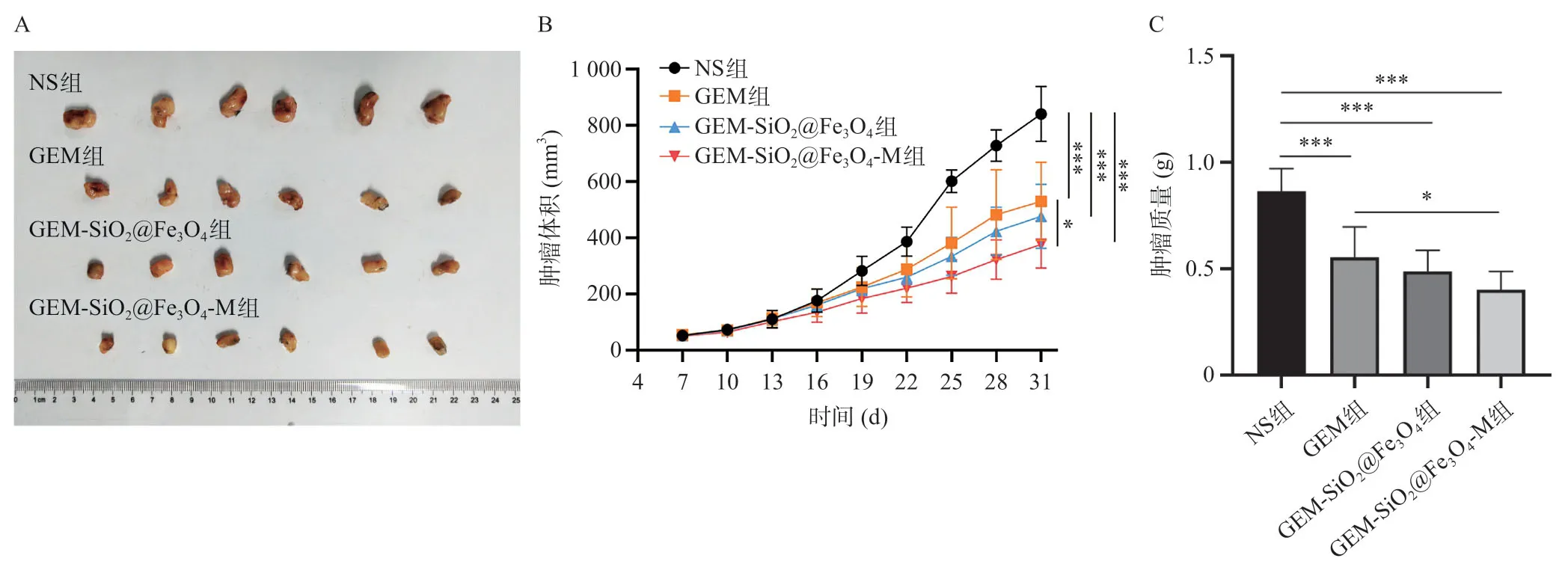
图6 不同实验条件下的裸鼠胰腺癌移植瘤的大小、生长曲线及质量

图7 不同实验条件下裸鼠心、肝、脾、肺、肾和肿瘤组织病理图片(HE,×200)
2.6 GEM、GEM-SiO2@Fe3O4 和GEM-SiO2@Fe3O4-M的药代动力学及组织分布
GEM-SiO2@Fe3O4的从0时到最终可定量时间点的血药浓度-时间曲线下面积(AUC0-t)、从0到无穷大时间的血药浓度-时间曲线下面积(AUC0-∞)升高(均P<0.01),平均驻留时间(MRT0-∞)、末端消除半衰期(t1/2β)延长(均P<0.05),清除率(CL)显著降低(P<0.001),表明该材料可延长GEM的半衰期并延长其在体内的作用时间。表观分布容积(Vd)显著升高(P<0.01),说明药物在全身分布且有可能在某脏器浓集(表1)。游离GEM在裸鼠肝、肾组织内分布较多,GEM-SiO2@Fe3O4除在肝肾中分布外,在肿瘤组织中的分布有增加,且消除较慢(图8)。在外加磁场的作用下,GEM在肿瘤组织中富集更明显。

表1 GEM组、GEM-SiO2@Fe3O4组和GEM-SiO2@Fe3O4-M组的药代动力学结果
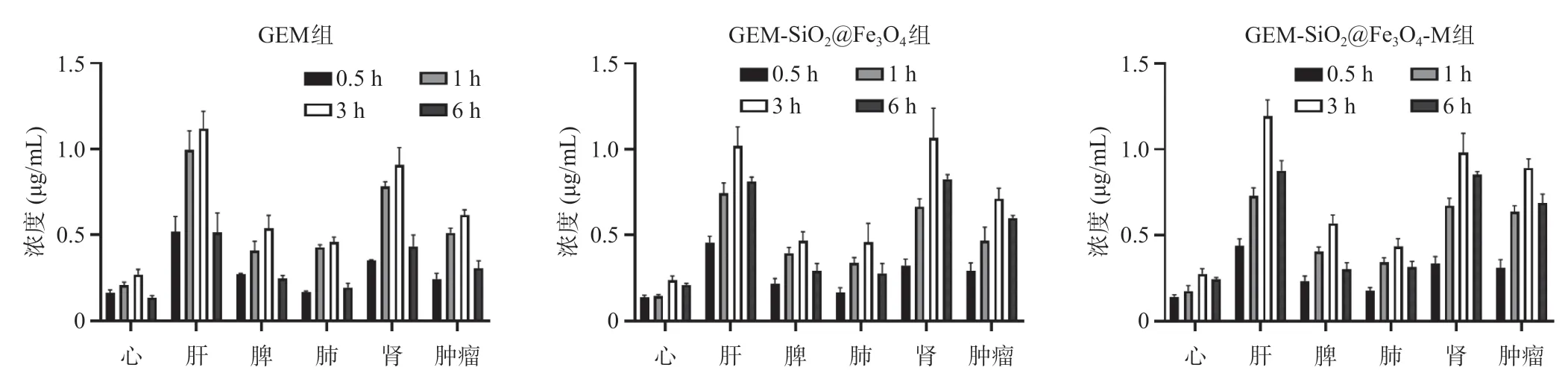
图8 GEM组、GEM-SiO2@Fe3O4组和GEM-SiO2@Fe3O4-M组中的GEM在不同时间下心、肝、脾、肺、肾和肿瘤中的分布浓度
3 讨论
在本研究中,我们通过TEM和FT-IR对SiO2@Fe3O4的结构进行表征,结果显示SiO2成功实现了对Fe3O4颗粒的包被。既往研究已表明裸露的Fe3O4颗粒结构在有氧环境中极不稳定,而SiO2具有低毒性、高亲水性等特点[10-11]。基于SiO2包被的Fe3O4纳米颗粒具有较好的水溶性,并且部分弥补了Fe3O4较不稳定的缺点,为改善GEM的化疗耐药提供了实践基础[12]。
此前研究表明,SiO2@Fe3O4可与药物联合治疗肿瘤。Shahabadi等[9]的研究表明,Fe3O4@SiO2复合纳米颗粒可作为一种有效载体,提高阿糖胞苷的生物利用度,增强其对早幼粒细胞白血病的疗效。此外,GEM-SiO2@Fe3O4复合纳米颗粒的维持时间较游离GEM长。这表明我们设计的GEM-SiO2@Fe3O4可以持久地释放。这可以减少突释效应的同时起到药物缓释的作用。为了降低GEM的毒性,提高其治疗效果,其中一种方法是通过纳米载体包载GEM,提高其递送效率和选择性[7]。本研究初步证明SiO2@Fe3O4纳米颗粒在体外具有一定的稳定性及组织相容性。并且相较于游离GEM,有附加磁场下的GEMSiO2@Fe3O4有更好的抗肿瘤效果,并且不会损伤正常组织。但附加磁场下的GEM-SiO2@Fe3O4抗肿瘤效果与游离GEM相比未显示出统计学意义上的差异。部分原因可能是由于纳米颗粒粒度小,使得纳米颗粒易穿出血管而滞留于肿瘤组织,因此药物相对富集,但被动靶向的作用有限。此外,药代动力学结果显示,SiO2@Fe3O4可延长GEM在体内的作用时间,并增加GEM在肿瘤组织中的浓度。但关于SiO2@Fe3O4纳米材料在体内的副反应和毒性仍需后续实验进一步验证。此外,搭载GEM的SiO2@Fe3O4在裸鼠内的毒副反应也需进一步实验明确。本研究中,我们依据SiO2@Fe3O4复合纳米颗粒设计了一种全新的GEM药物递送材料,初步证实其在胰腺癌移植瘤裸鼠中发挥GEM的治疗效果的同时,也展示了良好的生物安全性。本研究结果为后续胰腺癌的治疗提供一定的实验基础,也为将来胰腺癌治疗的策略提供借鉴。

