乙肝肝硬化门静脉高压症脾切除术后腹腔积液预测模型
李芷西,黄少坚,贺卓,黄嘉明,张起帆,周杰,王恺
南方医科大学南方医院 肝胆外科,广东 广州 510515
门静脉高压症是指由各种原因引起门静脉系统压力增高所导致的一系列临床症状,其中最常见的病因为各种原因所致的肝硬化[1]。在我国,慢性乙型病毒性肝炎是肝硬化最常见的病因[2];而导致患者预后不良或死亡的原因通常是急性的消化道大出血或肝性脑病[3]。对于失代偿期的门静脉高压症治疗,指南推荐有胃镜治疗、脾切除和或门-奇静脉断流术、经颈静脉门体分流术、血管介入治疗和肝移植等方式[3]。脾切除手术作为一种成熟的术式,能够很大程度上纠正门静脉高压症所引起的脾功能亢进、降低门脉血流和压力[4]。腹腔积液作为脾切除术后的最常见并发症,部分学者认为可能与门静脉血栓形成、术后肝功能异常或低白蛋白水平有关[5-7],但其发生原因没有总结性报道,也是一个亟待解决的临床难点问题。本研究通过回顾性分析乙肝肝硬化门静脉高压症行脾切除患者的临床数据,旨在建立能够预测导致术后腹腔积液的模型,为腹腔积液的治疗和预防提供参考。
1 资料和方法
1.1 一般资料
回顾性收集南方医科大学附属南方医院肝胆外科2017年1月1日至2023年2月28日收治的121例乙肝肝硬化门静脉高压症行脾切除患者资料。根据患者术后B超是否存在腹腔积液,将患者分为腹腔积液组(n=32)和无腹腔积液组(n=89)。
纳入标准:(1)乙肝肝硬化门静脉高压症诊断明确,经术前评估符合脾切除手术适应证无绝对禁忌证,Child-Pugh分级均为A级或B级;签署知情同意书;(2)术者为有开展超过50 例腹腔镜或开放脾切除手术经验的医师。排除标准:(1)围术期死亡及术后出血、胰瘘及淋巴瘘患者;(2)因地中海贫血、淋巴瘤等血液系统疾病而切脾患者;(3)合并肾病或心功能异常患者;(4)病例资料不完整。
1.2 术后腹腔积液诊断及分析指标
所有患者在术前均接受上腹部CT和或B超,术中常规放置腹腔引流管,并在术后1 周时接受腹水B超检查,若液性暗区深度>3 cm或腹腔引流管每日引流量>100 mL/d,则被认为存在术后腹腔积液。
门静脉直径、脾静脉直径、脾脏长径及厚度数据来自于CT和或B超检查;门静脉血栓数据来自于术后B超评估;其余临床资料包括患者年龄、性别、身体质量指数(BMI)、总住院时间、术后住院时间、既往出血史(呕血、黑便)、高血压、糖尿病史、血红蛋白(HB)、白细胞(WBC)、血小板(PLT)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、白蛋白(ALB)、总胆红素(TBIL)、凝血酶原时间(PT)、D-二聚体、乙肝病毒定量、术后第1、5天白蛋白(POD1-ALB)等均来自于病历文书及检验结果;术前是否存在腹腔积液来自于CT及B超检查及术中探查共同评估;手术时间、术中失血量、手术方式、是否行贲门周围血管离断术来自于手术及麻醉记录。
1.3 手术方式
开放脾切除术:麻醉成功后取平卧位,取左上腹“L”型切口,长约20 cm,逐层切开;探查腹部情况后,首先打开胃结肠韧带,显露分离脾动脉后结扎夹闭;依次游离脾结肠韧带、脾肾韧带,脾胃韧带,离断胃短血管后,打开脾蒂后方间隙,丝线结扎提起,一次性切割吻合器穿过间隙后离断脾蒂,再离断脾膈韧带上级后将标本取出腹腔。彻底止血放置引流管后关腹。
腹腔镜脾切除术:麻醉成功取“大”字位,头高脚低左腰下垫高,使用气腹针,于脐下穿刺建立气腹,五孔法布局,使用3个12 mm Trocar及2个5 mm Trocar,气腹压力维持在14 mmHg(1 mmHg=0.133 kPa),置入12 mm Trocar作为观察孔。在腹腔镜直视下于右锁骨中线脐上2 cm水平线交点处置入12 mm Trocar。于左锁骨中线脐上置入12 mm Trocar。再于剑突下置入5 mm Trocar,于左腋前线脾脏下极偏下2 cm处置入5 mm Trocar,其余操作步骤基本同开放脾切除。
贲门周围血管离断术:将左半肝向右方牵拉,充分暴露胃壁,进一步分离胃底及贲门左缘,从贲门切迹沿胃小弯向上逐步分离胃小弯侧胃右动静脉及韧带,游离并用超声刀离断胃冠状血管至食管右缘,将胃向右侧翻起,暴露食管后壁,依次分离食管旁静脉,剥离食管右侧静脉丛,继续分离左侧,顺着食管壁向上游离食管前后壁各6~8 cm,显露胸膜,使食管下段长6~8 cm处于游离状态,检查无残留扩张静脉。
1.4 统计学分析
采用SPSS 25.0、R语言进行统计分析及图形绘制。正态分布的计量资料采用()表示,组间比较采用t检验;偏态分布计量资料则采用中位数M(P25,P75)表示,组间比较采用Mann-WhitneyU检验。计数资料以[例(%)]表示,组间比较采用χ2检验或Fisher精确概率法。将P<0.2的指标采用向后逐步回归法纳入多因素Logistic回归分析,采用方差膨胀系数(VIF)衡量模型中自变量是否存在多重共线性。将多因素分析结果引入R-4.2.1软件建立列线图预测模型,绘制校准曲线并使用Hosmer-Lemeshow拟合优度检验以评估列线图的一致性。使用Harrell’s C-index和ROC曲线下面积来评估列线图的评估能力。绘制临床决策曲线评价预测模型的临床效用。P<0.05为差异具有统计学意义。
2 结果
2.1 脾切除术后腹腔积液的单因素分析
腹腔积液组与无腹腔积液组患者性别、合并糖尿病、高血压、出血史、血常规、术前肝功能、凝血功能、术前脾脏大小、手术方式及住院时间差异无统计学意义(P>0.05),两组年龄、BMI、术前脾静脉直径、术前门静脉直径、术前合并腹水、术中失血量、是否行贲周血管离断术、术后第1天、第5天白蛋白等,差异具有统计学意义(P<0.05)。两组基线数据比较及单因素分析结果详见表1。此外,两组患者术后5 d内的肝功能指标及血液三系指标差异均无统计学意义(P>0.05),未在表中列出。

表1 腹腔积液组与无腹腔积液组基线资料及围手术期指标比较
2.2 脾切除术后腹腔积液的多因素分析
Logistic 回归分析显示,门静脉直径(OR=229.127,95%CI9.348-5 615.995)、术前合并腹水(OR=3.331 95%CI1.128-9.842)、行贲周血管离断术(OR=6.745 95%CI1.334-34.093)为乙肝肝硬化门静脉高压症患者脾切除术后腹腔积液的独立危险因素,详见表2。

表2 术后腹腔积液Logistic回归分析结果
2.3 脾切除术后腹腔积液的列线图预测模型构建与验证
根据Logistic回归结果,将门静脉直径,术前是否合并腹水,有无行贲周血管离断术三个指标变量纳入,构建列线图模型(图1),该模型的校准曲线在预测概率与实际概率有较好的一致性,绘制ROC曲线评估列线图预测模型的预测能力,曲线下面积(AUC)为0.852(95%CI0.781-0.924),见图2。Hosmer-Lemeshow拟合优度检验P值为=0.779,说明曲线的拟合程度良好;Bootstrap法经1 000次重抽样对模型进行内部验证,校准曲线的平均绝对误差为0.016,准确度良好。见图3。临床决策曲线表明预测模型有明显的临床净效应,见图4。

图1 乙肝肝硬化脾切除术后腹腔积液发生的预测模型列线图

图2 模型预测乙肝肝硬化脾切除术后腹腔积液发生的ROC曲线

图3 乙肝肝硬化脾切除术后腹腔积液发生预测模型的校准曲线
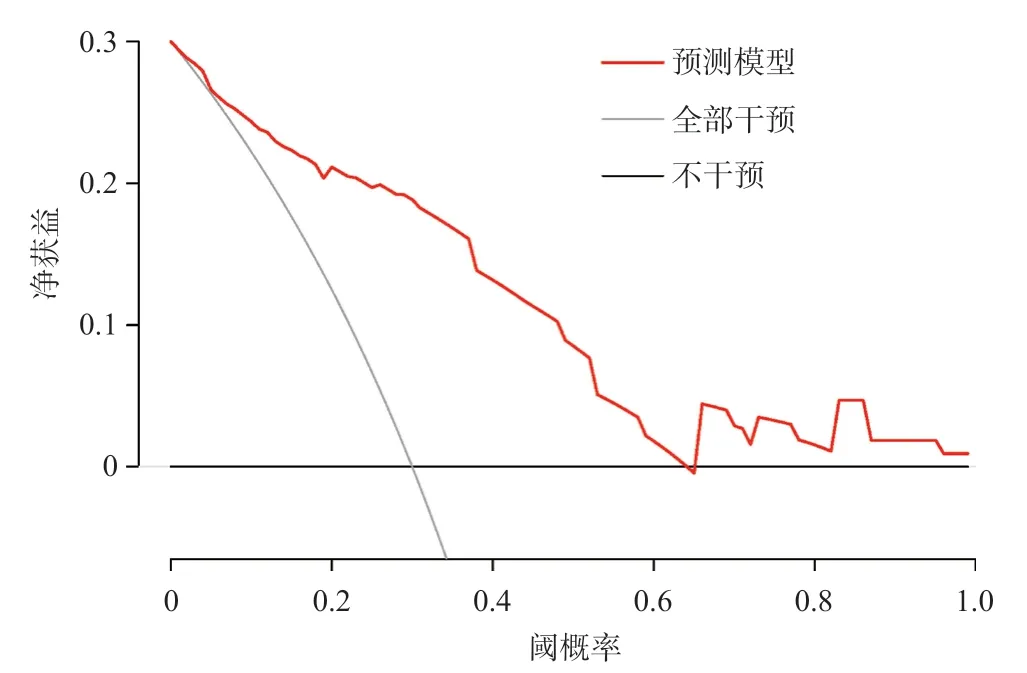
图4 乙肝肝硬化脾切除术后腹腔积液发生预测模型的临床决策曲线
3 讨论
脾切除术是治疗失代偿期门静脉高压症的重要方式之一,通过切除功能亢进的脾脏,一方面可以消除因此引起的三系减少症状,另一方面,离断了胃脾区的门体侧支,阻断了侧支的血流通道,可以有效防止或预防食管胃底静脉曲张出血。脾切除术较肝移植手术费用低,对于反复出血或胃镜食管胃底静脉栓塞或套扎效果不理想患者,脾切除也几乎是最优的选择。脾切除术后1 周内腹腔积液的发生率较高[8-9],本研究显示术前门静脉直径、术前合并腹水、行贲周血管离断术是门静脉高压症患者脾切除术后产生腹腔积液的危险因素。
贲周血管离断术作为断流手术的一种,常作为脾切除的合并手术,通过阻断异常的侧支血流,防止食管胃底静脉曲张出血。国内指南推荐断流术作为内镜等治疗曲张静脉初次止血失败时的补救措施,而国外的指南共识中,则将“药物+内镜+介入”治疗方案作为首选方案[10-13]。脾切除联合断流手术是否能降低门静脉压力,学术界未有定论,研究显示门静脉压力有升高、有降低也有不变的[14-16]。笔者认为,贲周血管离断手术虽能够有效解决门静脉高压症所致的出血问题,但并不能够真正降低门静脉压力。具体机制可能包括以下两个方面。(1)门静脉主要由脾静脉及肠系膜上、下静脉汇合而成,而当门静脉高压症时,部分血流通过门脉与冠状静脉及奇静脉间形成的侧支循环,分流进入下腔静脉,从而缓解门静脉高压症,也同时产生食管-胃底部的静脉曲张,引起症状。(2)脾切除时门静脉回流血流减少而导致门静脉压力下降,而后续贲周血管离断异常的门奇静脉交通支时,由于高压血流失去了分流的途径,则引起门静脉压力增高。二者综合产生的变化则使门静脉压力总体保持不变或轻微下降,具体变化程度则取决于两种来源血流量所占的比例。其最终结果则是脾切除联合贲周血管离断术所降低的门静脉压力不如行单纯脾切除手术降压效果显著,脾切除联合贲周血管离断术后门静脉压力仍然较高,较单纯脾切除术后更容易产生腹水。术后腹腔积液可能导致引流管延迟拔除,增加引流管压迫、脱出、伤口愈合不良、伤口感染风险,腹腔积液亦会导致腹痛及影响静脉血液回流,甚至引起腹腔感染和腹膜炎[17]。因此是否需要合并行贲周血管离断术及术后再出血风险和腹水问题,需要术前术者权衡利弊,综合评估。
多项研究提示较宽的门脉直径是食管胃底静脉曲张破裂出血的独立危险因素[18-20]。本研究结果也显示,较宽的门脉直径是导致脾切除术后腹腔积液的独立危险因素。目前普遍认为肝硬化腹水的产生原因与血管阻力增加和钠水潴留相关[9,21]。而门静脉的宽度能够反映门脉的压力及血管阻力,两者呈正相关,表现为术后腹腔积液组患者术前门静脉直径较宽的比例更高[22]。本研究中两组患者的术前白蛋白水平中位数都高于35 g/L,我们对术后白蛋白低于35 g/L的患者均采取了补充白蛋白策略来预防腹腔积液;无腹腔积液组术后第5 天白蛋白中位数为36.8 g/L,而腹腔积液组的患者术后第5 天白蛋白中位数也能达到34.7 g/L,但是在术后仍然出现的腹腔积液,提示该类患者术后腹腔积液的主要原因可能仍是门静脉高压症而非白蛋白水平的降低。本研究多因素分析也证实术前及术后白蛋白水平并非产生腹腔积液的独立危险因素。术前腹腔积液也可能代表了更高水平的RASS系统激活,但临床开展检测较少[23]。故尽管所有低白蛋白患者在术后采取积极的措施,效果并不显著,甚至可能出现顽固性和感染性腹水,而腹水的出现也会影响患者的远期预后[23-25]。长期的腹腔积液无法吸收也可进一步加重门静脉高压症。
门静脉直径、术前是否合并腹水和是否合并行贲周血管离断术三个危险因素指标对于预测门脉脾切除术后腹水的AUC分别为0.776,0.686,0.610,三者联合预测模型的AUC为0.852,具有良好的预测价值。但由于本研究性质为回顾性分析,所以还需要更高级别的证据验证。此外,乙肝病毒定量似乎不会影响术后腹水的产生。因此术前术者除了关注脾门部解剖变异及脾脏大小外,还应该重点关注术前门静脉压力、术式和术前情况带来的影响;既往研究基本仅是阐述了脾切除术后存在腹水的并发症、而极少探究背后的影响因素,仍缺乏一个确切的预测模型。本研究基于Logistic回归结果建立的列线图预测模型具有良好的预测能力和价值。临床医师可以在术前更好地评估患者情况而制定手术和术后治疗方案,患者也可以更好地了解术后腹腔积液并发症的风险。

