2017-2021年辽宁省市售食品中沙门菌的血清型、分子分型及耐药性分析
于 淼,耿英芝,张铭琰,张眉眉
沙门菌是自然界中最常见的人兽共患病原菌,是导致食源性疾病暴发的主要因素之一[1]。沙门菌易通过污染的蛋类、奶类和肉类等食物进入身体引发疾病。据报道,国内多地多次暴发沙门菌引起的食物中毒事件[2-4]。沙门菌的流行具有地域性,不同地区流行的沙门菌分子特征和耐药性也明显不同。因此沙门菌之间的同源性鉴定对疾病的溯源有重要意义,可以借助脉冲场凝胶电泳(PFGE)技术来分析该地区沙门菌的流行病学特征。
由于养殖业的不合理使用抗菌药物,加上耐药株的广泛传播,导致沙门菌的耐药现象日趋严重,并出现了多重耐药的情况。其耐药基因通过水平转移的方式,最终进入对人致病或机会致病的病原体中[5],导致人类对沙门菌的耐药谱不断拓宽。本研究收集了2017-2021年辽宁省食品中分离出的沙门菌菌株,了解血清型分布、分子分型和耐药性情况,为控制和治疗食源性沙门菌引起的传播和疾病提供科学依据。
1 材料与方法
1.1 材料
1.1.1 菌株来源 本研究的89株沙门菌来自2017-2021年辽宁省各市采集的市售食品,包括水产品、肉与肉制品、食用菌及其制品、蔬菜及其制品等6 069份样品,按照GB4789.4-2016《食品安全国家标准食品微生物学检验沙门菌检验》检验方法[6]分离获得,其中2017年7株、2018年9株、2019年8株、2020年55株和2021年10株。PFGE分子分型方法选用沙门菌H9812作为Marker菌株,药敏试验质控菌株选用大肠埃希菌ATCC25922,所有菌株均保藏于辽宁省疾病预防控制中心微生物实验室。
1.1.2 主要试剂与仪器 沙门菌科玛嘉显色培养基(CHROMAgar);GN生化鉴定卡(梅里埃);沙门菌诊断血清(日本生研);革兰阴性需氧菌药敏测试板(星佰);蛋白酶K(Sigma);Seakem Gold琼脂糖(LONZA);10×TBE、EDTA、Tris-HCl等缓冲液(Promega公司);XbaⅠ限制性内切酶(美国Promega公司);Gelred染液(美国BIOTIUM 公司),以上试剂均在有效期内。比浊计(法国bioMrieux公司);CHEF-Mapper脉冲场电泳仪凝胶成像分析仪(美国Bio-Rad );GELDOC凝胶成像系统(美国Bio-Rad公司)。
1.2 方法
1.2.1 分离培养及血清学鉴定 将各市上送的沙门菌株进行复核检验,所有菌株经VITEK 2 Compact全自动细菌鉴定仪鉴定为沙门菌。采用玻片凝集法,根据国家标准GB4789.4-2016和沙门菌诊断血清说明书,对沙门菌株进行O相凝集反应和H相血清诱导分型,参照Kauffman-White沙门抗原表鉴定沙门菌血清型,沙门菌抗血清选用日本生研。
1.2.2 PFGE分子分型 参照国家食源性疾病监测工作手册中沙门菌PFGE分子分型标准方法。先将菌悬液调至4.0~4.5麦氏浊度,制备胶块,后经XbaI限制性内切酶37 ℃ 酶切2 h;初始时间为2.16 s;终末时间为63.80 s,电泳时间19 h。取出胶块后马上放入Gelred染色液中震荡染色25 min,用凝胶成像仪读取图谱。经BioNumerics 7.6软件对PFGE成像电泳图谱结果进行聚类分析。聚类分析算法采用非加权算术平均组对方法(UPGMA),每条带型间的相似度用Dice系数衡量,条带位置差异容许度为1.5%,优化值为1.5%,相似度100%认定为同一PFGE带型。
1.2.3 药物敏感性试验 采用微量肉汤稀释法测定最小抑菌浓度(MIC),实验用10类15种抗微生物药物包括氨苄西林(AMP)、氨苄西林/舒巴坦(AMS)、头孢西丁(CFX)、头孢唑啉(CFZ)、头孢他啶(CAZ)、头孢噻肟(CTX)、庆大霉素(GEN)、氯霉素(CHL)、亚胺培南(IMI)、四环素(TET)、阿奇霉素(AZI)、环丙沙星(CIP)、萘啶酸(NAL)、甲氧苄啶/磺胺甲恶唑(SXT)、多粘菌素E(CT)。将备检菌株经2次传代培养后,制作0.5麦氏浊度菌悬液,取60 μL加入含有12 mL无菌营养肉汤的加样槽中,充分混匀,然后用8通道微量移液器依次取100 μL稀释菌液加入到除阴性对照孔外的95孔药敏板中,阴性对照孔加无菌肉汤培养液100 μL,将接种后的药敏板放置36 ℃温箱16~18 h培养,实验结果参照2022版美国临床和实验室标准化委员会(CLSI)[7]制定的药敏试验执行标准进行判定。
2 结 果
2.1 血清型分布 2017-2021年从辽宁省食品样本中检出的89株沙门菌分离自肉与肉制品、水产品、食用菌及其制品、蔬菜及其制品、蛋与蛋制品、水果及其制品6大类食品,其中肉与肉制品检出率最高(7.9%),水产品检出率次之(1.9%),血清型也主要分布在肉与肉制品中,见表1。
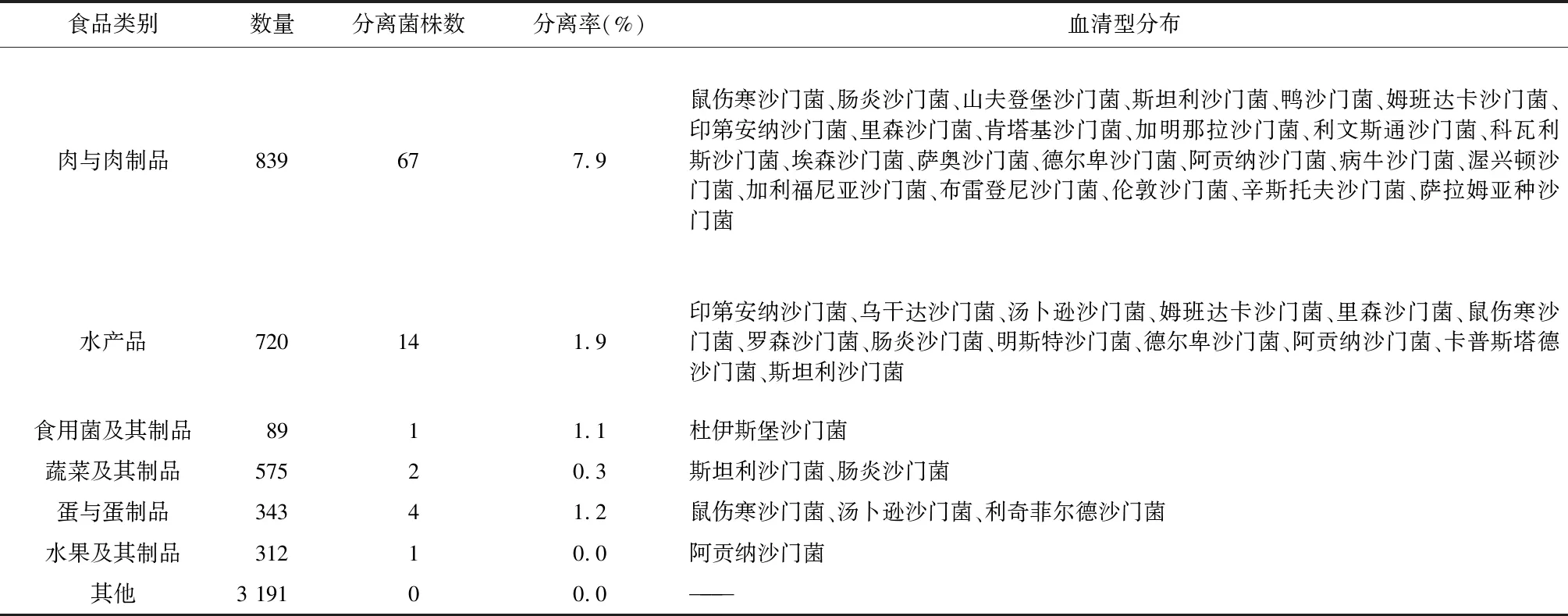
表1 食品中沙门菌检出率及血清型分布Tab.1 Detection rate and serotype distribution of Salmonella in food
本研究中89株沙门菌共检测到8个血清群、包含32种血清型。其中D群肠炎沙门菌检出率略高为23.6%(21/89),其次为肯塔基沙门菌为16.8%(15/89),其它血清型菌株均低于10%。见表2。
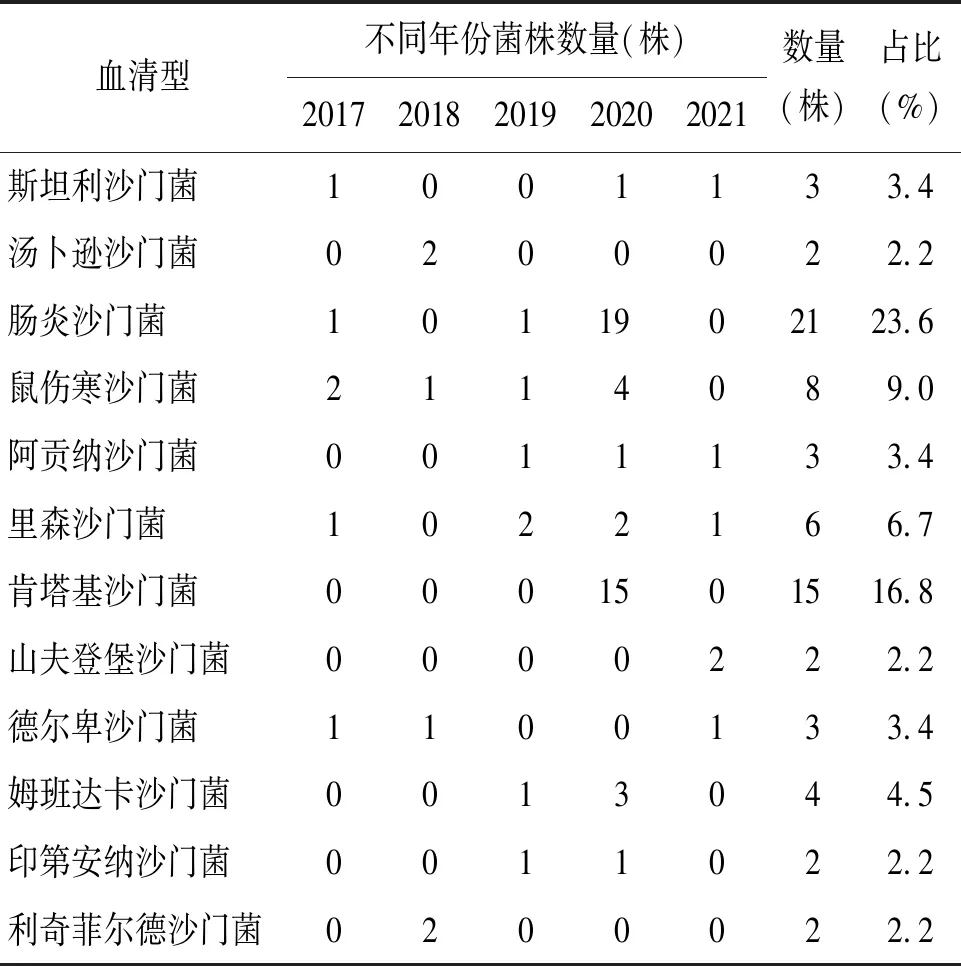
表2 89株沙门菌的血清型分布特征Tab.2 Serotype distribution of 89 Salmonella isolates
2.2 PFGE分子分型 89株沙门菌经XbaⅠ酶切后,得到带型不一的PFGE图谱,见图1。根据电泳产生条带的数量和位置的不同进行聚类分析,共发现81种带型(把菌株间100%相似度判定为同一PFGE带型),各带型包含菌株数1~4株,相似度为47.4%~100%。同一血清型出现相差较远的PFGE带型,如鼠伤寒沙门菌、斯坦利沙门菌。部分里森沙门菌、肯塔基沙门菌、肠炎沙门菌均出现成簇现象。

图1 89株沙门菌的脉冲场凝胶电泳分型聚类分析结果Fig.1 PFGE patterns of 89 Salmonella isolates
2.3 抗生素敏感性实验结果 对89株沙门菌进行15种抗微生物药物耐药实验,结果显示,沙门菌对萘啶酸(NAL)的耐药率最高,为52.8%(47/89),其主要来自于鸡肉产品90.9%(30/33)。对四环素(TET)的耐药率次之为37.1%(33/89),对氨苄西林(AMP)和头孢唑林(CFZ)耐药率均为24.7%(22/89)。有28株沙门菌对所有测试药物均敏感(见表3)。有39株沙门菌分离株耐3类及3类以上药物,共产生35种耐药谱,多重耐药率为43.8%(39/89),其中12株沙门菌分离株具4种药物抗性,占比13.5%(12/89);4株沙门菌分离株具12种药物抗性占4.5%(4/89),见表4。

表3 89株沙门菌对不同药物的敏感性Tab.3 Antibiotic susceptibility of 89 Salmonella isolates
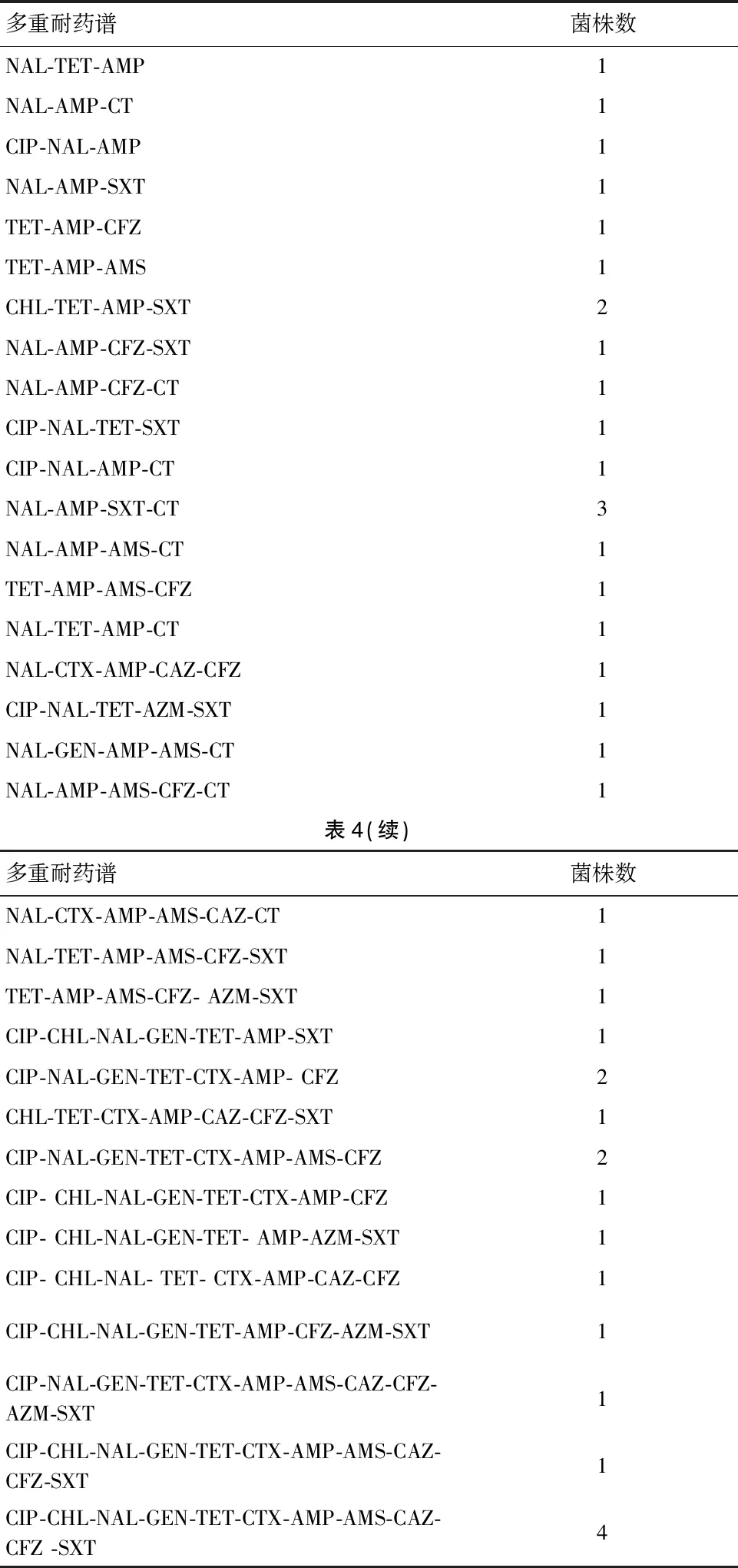
表4 沙门菌耐药谱分布菌株数Tab.4 Distribution of drug-resistant Salmonella strains
本研究89株沙门菌耐药结果显示,血清型与耐药性存在一定关联。姆班达卡沙门菌、阿贡纳沙门菌对抗生素均敏感;里森沙门菌对四环素100%(6/6)耐药,肠炎沙门菌对萘啶酸95%(19/20)耐药。检出的15株肯塔基沙门菌多重耐药谱4重到12重,其中对7种及7种以上抗生素耐药占86.7%(13/15),耐药状况最为严重。
不同食品来源菌株的耐药情况有所不同,肉及肉制品耐一种以上药物为70%(49/70),水产品耐一种以上药物为42.8%(6/15),蔬菜及其制品耐一种以上药物为25%(1/4), 耐药结果显示, 肉及肉制品耐药率较高、水产品次之。
3 讨 论
本研究中经血清鉴定分析,89株沙门菌共分8个血清群、总计32个血清型,结果显示,食品中沙门菌血清型呈现多态性分布。其中以D群肠炎沙门菌为优势血清型,占比23.6%(21/89),且大部分于2020年分离得到。据报道,李欣等[8],吴春敏等[9]研究的食品和患者中的沙门菌血清型分布特征基本一致,均以肠炎沙门菌为主,本研究与耿英芝等[10]报道的2016-2020年辽宁省食源性疾病监测结果相比较,沙门菌食品分离株与患者分离株血清型流行特征也一致,均以肠炎沙门菌为主。但是,相较于病源性分离株检出的13种血清型,本次食品分离株检出32种血清型,可见食品中血清型更为多样化,了解辽宁省食品中沙门菌血清分布特征,有助于食源性疾病的防控工作。
沙门菌血清型的鉴定工作繁琐,具有局限性,需要借助PFGE分子分型方法进一步研究沙门菌相同血清型间的基因同源性。PFGE一直被广泛用于食源性疾病暴发溯源工作中,是当前分子流行病学应用的“金标准”[11],本研究显示,与肠炎沙门菌较一致,部分血清型的沙门菌存在成簇现象,如肯塔基沙门菌、里森沙门菌,可见相同血清型的沙门菌之间PFGE带型相似度较高,这与娄静等[12]、姚素霞等[13]研究结果较一致。通过使用分子生物学技术和血清型鉴定分析,可较好用于疾病暴发溯源工作,为疾病防控提供科学依据。
本研究选取10类15种抗生素进行耐药试验,结果显示,整体耐药率为68.5%,菌株均有不同程度耐药,某些菌株还存在多重耐药问题,说明辽宁省地区食品中沙门菌耐药情况不容乐观。其中萘啶酸耐药率最高为52.8%(47/89)、四环素耐药次之为37.1%(33/89),这与广州市2016-2018食品中的沙门菌对氨苄西林耐药率为56.3%耐药结果有所不同[14],但与胡豫杰等研究的2016年我国26个省沙门菌耐药情况结果相吻合[15]。沙门菌感染临床推荐用药为喹诺酮类和三代头孢类,但本研究中对一代喹诺酮类耐药为52.8%(47/89),三代喹诺酮类耐药率为21.3%(19/89),中介率也达34.8%(31/89),对三代头孢类耐药率为11.2%(10/89)和16.8%(15/89),提示本地区临床用药慎重选用喹诺酮类药物。最敏感药物为亚胺培南,耐药率为0,这与多地区研究结果相似[15-16],分析原因可能与其在体内稳定性差,很少用于养殖业有关。本研究所采鸡肉食品中萘啶酸耐药率高达90.9%(30/33),多重耐药情况十分严重,其中检出的4株12种抗生素耐药也均来自鸡肉分割品,多重耐药率为66.7%(22/33),可见本省禽类饲养行业存在不合理使用抗生素情况;多粘菌素已在2018年被禁止用于动物饲料添加剂,但本次研究中多粘菌素耐药率为20.2%(18/89),提示我省还要加强对饲料添加剂的监管。
沙门菌有2 500多种血清型,不同血清型的沙门菌对抗生素的耐药谱不同,本研究89株沙门菌中检出的15株肯塔基沙门菌对抗生素多重耐药最为严重,经综合抗生素耐药情况,如本地区发生肯塔基沙门菌引起的食源性疾病临床可应用头孢西丁及亚胺培南抗生素进行治疗。本文中20株肠炎沙门菌19株对萘啶酸耐药,耐药率90.5%(19/21),对氨苄西林耐药率也高达61.9%(13/21),同广州市报道相符[17],推测为一代喹诺酮类和青霉素类的广泛使用对细菌产生选择压力的结果。提示本地区应合理、规范使用抗生素,避免细菌耐药的产生。
综上所述,2017-2021年辽宁省检出食品中沙门菌呈现出多种血清型,多种PFGE型及多种耐药谱,高度散发状态。尤其耐药问题不容乐观应引起各部门高度重视,需从生禽牲畜饲料添加的源头抓起,守护好人民食品健康。同时进一步充实PFGE生物库数据,为因沙门菌引起的疾病暴发流行提供科学依据。
利益冲突:无

