2011—2021年福建省即食食品中单增李斯特菌的监测及菌株特征分析
林慧琳,叶玲清,叶海梅,黄智瑜,陈伟伟,,郑奎城,
单增李斯特菌(Listeriamonocytogenes,Lm)为革兰阳性、兼性厌氧、G+C 含量低的无芽胞杆菌,是一种重要的人兽共患病原菌[1]。该菌广泛存在于自然环境、各类食品中,对恶劣环境具有较强抵抗力,具有嗜冷、嗜盐性,可污染食品加工、运输、储存等多个环节[2-3]。Lm致病力与其携带的毒力基因密切相关,在Lm感染人体的一系列过程中均涉及毒力基因的调控,这些毒力基因主要分布在毒力岛 1(LIPI-1:prfA、plcA、hly、mpl、actA、plcB)、毒力岛 2 (LIPI-2:inlA、inlB、inlC到inlH)及调控基因iap;少量分布在毒力岛 3(LIPI-3:llsA、llsG、llsH、llsX等)、及毒力岛 4(LIPI-4:ptsA等)[4]。此外,Lm致病力还与抗生素的敏感性有关,虽耐药情况不像其他食源性病原菌(如金黄色葡萄球菌)那样严重,但近年有加重趋势,有必要不断监测Lm药物敏感性[5]。
当人体食入被Lm污染的食物时可能会引起李斯特菌病,严重时会导致流产、死胎、脑膜炎及败血症,病死率高达20%~30%;易感人群主要为新生儿、孕妇、65 岁以上的老年人等免疫力低下的人[6-8]。研究表明李斯特菌病的暴发和散发病例主要与即食食品有关[9]:如2017年1月到2018年7月[10],南非暴发了世界上最大的李斯特菌病事件,共确诊 1 060 例、216 人死亡,食品污染源为即食加工熟肉制品。尽管我国GB29921-2021、GB31607-2021等相关标准要求熟肉制品、乳制品等不得检出Lm,但从各地开展的食品监测来看,即食食品中存在Lm污染的现象仍不乏存在。随着即食产品多样化、规模化生产及人们生活方式、饮食习惯的改变,即食食品带来的Lm感染风险日趋严峻,因此对该菌进行监测具有重要的公共卫生学意义。本文对2011—2021年福建省即食食品中Lm污染监测数据及其分离株特征进行分析,旨在了解污染状况、菌株毒力基因携带情况、耐药及分子特征,并为相关部门采取防控措施提供科学依据。
1 材料与方法
1.1 材 料
1.1.1 样品采集 综合考虑福建省地域分布、国家食品安全风险监测计划要求等因素,2011—2021年在福建省9 个监测地区的区县、农村及城市,按照多级分层随机抽样方法,在多类地点均无菌采集16类,共计8 166 份即食食品,其中福州市、莆田市、泉州市、厦门市、漳州市、三明市、南平市、龙岩市、宁德市分别采集1 350、1 010、736、739、635、917、947、984、848份,并及时送检。
1.1.2 菌株来源 2011—2021年福建省采集的8 166份即食食品中检测出、并经保存、增菌复活成功的83株Lm,其中26株分离自寿司、19株分离自中式凉拌菜、6株分离自熟制米面制品、3株分离自盒饭及热菜、21株分离自熟肉制品、6株分离自生食水产品、1株分离自非发酵豆制品、及1株分离自其他类别。Lm参考菌株(ATCC 19115)作为阳性对照菌株进行实验质量控制。
1.1.3 主要仪器与试剂 李氏增菌肉汤LB(LB1,LB2)、血琼脂平板和鼠李糖、木糖生化管(北京陆桥);李斯特菌显色培养基(法国科玛嘉); VITEK生物鉴定板(法国生物梅里埃);DNA 提取试剂盒(北京天根);PCR引物(上海生工生物工程合成);PCR扩增仪(美国ABI);水平电泳槽(美国Bio-Rad);Gel Doc XR+凝胶成像系统(美国Bio-Rad);革兰阳性菌96孔药敏检测板(珠海美华),所有试剂均在有效期内。
1.2 方 法
1.2.1 单增李斯特菌检验 所采集样品按GB 4789. 30《食品安全国家标准 食品微生物学检验 单核细胞增生李斯特氏菌检验》中的方法进行检测Lm。
1.2.2 DNA模板提取 将-80 ℃保存的Lm与参考菌株接种于脑心浸液肉汤中,37 ℃过夜培养,培养物按照DNA提取试剂盒要求进行模板提取。
1.2.3 毒力基因检测 选择Lm的13个毒力基因进行PCR扩增,分别为prfA、mpl、plcA、hly、plcB、iap、actA、inlA、inlB、inlC、inlJ、llsX、ptsA,引物合成参照文献[11-16], PCR扩增产物经1.0%琼脂糖凝胶电泳,100V 30 min,Gel red染色后使用凝胶成像系统观察扩增结果。
1.2.4 药物敏感性检测 采用美国临床和实验室标准协会(CLSI)推荐的微量肉汤稀释法,结合临床用药和研究需要,共选择15种抗生素,使用商品化药敏板进行药敏检测,每次试验均采用 ATCC29213作为质控菌株,药敏结果参照CLSI 相关解释标准进行判定。
1.2.5 血清学分型 根据Doumith M等[17]建立的多重PCR方法,对活化成功的83株Lm分离株进行血清学分型。
1.2.6 多位点序列分型(MLST) 根据法国巴斯德研究所提供的用于Lm的MLST方法(https://bigsdb.pasteur.fr/listeria/primers-used/),将PCR产物送至上海生工生物技术服务公司进行双向测序,将测序序列与数据库进行比对,确定每个管家基因的等位基因号,abcZ-bglA-cat-dapE-dat-ldh-lhkA7 个等位基因号的组合即为该菌株的ST型,并按照abcZ-bglA-cat-dapE-dat-ldh-lhkA顺序拼接好每株菌的序列,利用MEGA软件进行聚类,构建进化树。
1.2.7 统计分析 使用SPSS 23.0软件进行统计分析,率的比较采用χ2检验或Fisher确切概率法,P<0.05差异具有统计学意义。
2 结 果
2.1 即食食品中Lm检出情况 2011—2021年共采集16类即食食品,以寿司的检出率最高为6.26%,其次是中式凉拌菜、熟肉制品,分别为5.6%、1.87%。16类即食食品的Lm检出率差异具有统计学意义(χ2=217.68,P<0.01),见表1。

表1 不同类别即食食品中单增李斯特菌检出情况Tab.1 Detection of Listeria monocytogenes in various categories of ready-to-eat foods
2.2 毒力基因检出情况 对83株菌株进行13种毒力基因检测,毒力基因prfA、mpl、plcA、hly、iap、actA、inlA、inlB、inlC、inlJ的检出率均为100%,plcB、llsX、ptsA检出率分别为55.42%、16.87%、22.89%。83株Lm菌株中携带10种(缺失plcB-llsX-ptsA)、11种(缺失llsX-ptsA)、12种(仅缺失ptsA)毒力基因的比例分别为100%(83/83)、55.42%(46/83)、1.20%(1/83),见表2。

表2 83株单增李斯特菌实验结果信息Tab.2 Experimental results for 83 Listeria monocytogenes isolates
2.3 药敏试验结果
2.3.1 总体耐药特征 对83株菌株进行药敏试验,菌株头孢西丁(FOX)的耐药率最高为100%,其次是苯唑西林(OXA)、四环素(TET)、红霉素(ERY),分别为15.66%、13.25%、10.84%;对克林霉素(CLI)、环丙沙星(CIP)、达托霉素(DAP)耐药的菌株也均有出现,此外,还出现对克林霉素、环丙沙星、红霉素、氯霉素(CHL)中介的菌株,其中对克林霉素的中介率达67.47%。但所有菌株均对氨苄西林(AMP)、青霉素(PEN)、万古霉素(VAN)、复方新诺明(T/SUL)、庆大霉素(GEN)、亚胺培南(IPM)、红霉素/克林霉素(ERY/CLI)敏感,见表3。
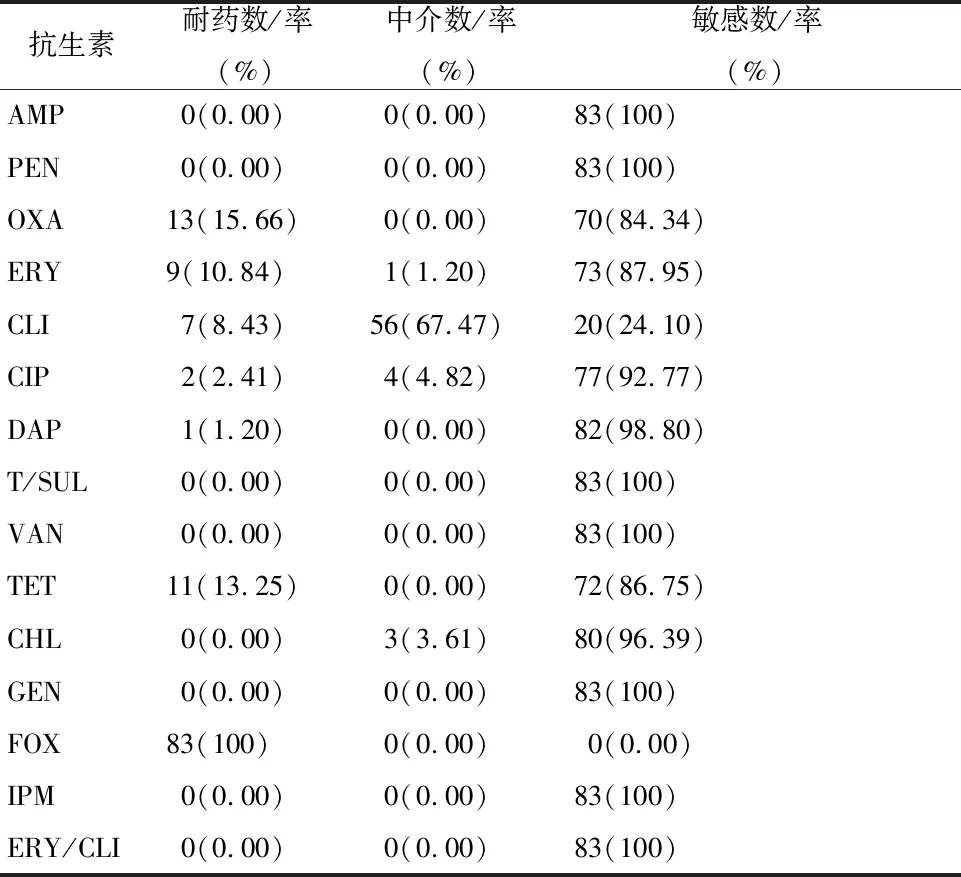
表3 83株单增李斯特菌总体耐药情况Tab.3 Overall resistance of 83 Listeria monocytogenes isolates
2.3.2 总体耐药谱 对2种及以上抗菌药物耐药的菌株有28株,耐药率为33.73%(28/83),其中多重耐药率为13.25%(11/83);耐药谱以耐2种且以耐OXA-FOX最常见;此外,在1份熟肉制品、1份熟制米面制品、2份寿司样品中检出四重耐药株,耐药谱均为OXA-ERY-TET-FOX,见表2。
2.4 血清学分型结果 83株Lm分离株被分为4种血清型,分别为1/2a(40株,48%)、1/2b(33株,40%)、1/2c(6株,7%)、4b(4株,5%)型,其中以1/2a 和1/2b型为优势血清型,见表2。
2.5 MLST基因分型结果 对83株Lm进行MLST基因分型,共鉴定出16种序列型(ST)。以ST87为优势型别,其次是ST8,ST101,分别占比24.10%(20/83)、15.66%(13/83)、12.05%(10/83),并发现一个新的ST型待提交数据库审核。ST型与血清型之间对应关系密切,除ST9对应1/2c、1/2b型外,其余ST型均只对应一种血清型。
7个管家基因中,不超过 1 个等位基因编号不同的2株Lm被认为属于同一个克隆群(clonal complexes,CCs)[18]。此次分型将菌株分为14个CC群,大部分CC群与ST型一一对应,以CC87、CC8、CC101分布广泛,分别对应ST87、ST8,ST101(表4),83株Lm聚类结果见图1。

注:从左到右依次为菌株编号、样品类别、菌株分离地区(FZ:福州;PT:莆田;QZ:泉州;XM:厦门;ZZ:漳州;NP:南平;LY:龙岩;SM:三明;ND:宁德)、分离年份、血清型、ST型、CC群 ▲:新ST型。图1 83株单增李斯特菌最小进化树圈Fig.1 Minimal evolutionary circle of 83 Listeria monocytogenes isolates
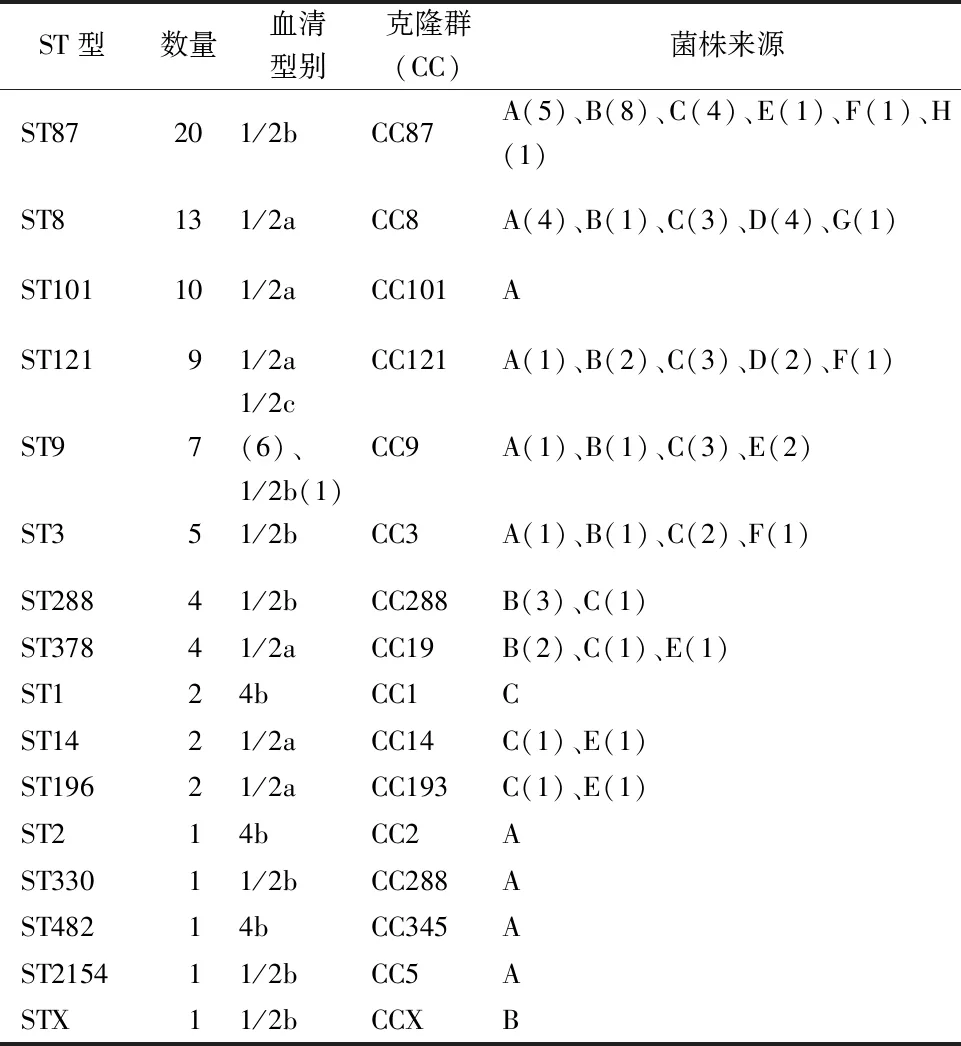
表4 83株单增李斯特菌血清型、ST型和CC群分布Tab.4 Distribution of 83 Listeria monocytogenes serotypes, ST and CC groups
3 讨 论
Lm是一种重要的食源性病原体,目前仍对全球公共卫生构成重要威胁。本研究合计采集8 166份即食食品,共检出102株Lm,污染率为1.25%,与河南省[19]的结果接近(1.34%),低于Chen Y等[20]对我国21个省份部分即食食品的采样报道(10.8%);也低于国外Koskar J等[21]对爱沙尼亚即食食品的监测结果(3.6%),这可能与本次监测的即食食品类别较多有关,其中焙烤及油炸类食品、乳与乳制品、生食果蔬及制品等类别未检出Lm,故整体检出率较上述地区低,也可能与每个地区卫生条件或地理位置的差异有关。此次研究表明,福建省部分市售即食食品存在较严重的Lm污染,尤其以寿司(6.26%),凉拌菜(5.26%)污染率高,主要因为这类冷加工即食食品一般不经过高温处理,而Lm的生长温度范围宽,对低温有较强的耐受性,即使在冷藏条件下也能生长;其次熟肉制品的污染率也较高,这与盛放熟肉的器具多为开放或半开放式,极易造成加工后二次污染有关[22],提示日后应加强对上述食品的监管力度,从源头上进行污染控制,同时应加强健康教育,使消费者,尤其是高危人群,尽可能食用加热过的食物。
Lm为一种胞内寄生菌,其所致的感染涵盖4个过程:黏附与侵袭、逃离吞噬体、宿主细胞内增殖、细胞间传播。在这一系列过程中,毒力基因的存在、表达起到重要的调控作用,缺失将导致其致病性的消失或下降[23]。其中hly、plcA、plcB毒力基因共同作用使液泡膜裂解,Lm得以逃离吞噬体进入细胞质;llsX(LIPI-3) 则能够增强Lm溶血与细胞毒活性,并在感染过程中改变宿主微生物群;LIPI-4增强Lm的神经和胎盘向性[20],通过检测llsX和LIPI-4基因片段(ptsA)可用来识别具有潜在高毒性的Lm分离株[16]。本次研究显示福建省即食食品中Lm分离株的LIPI-1、LIPI-2携带率较高,毒力基因缺失现象并不严重,仅有部分分离株缺失plcB,而有研究[24]表明缺失plcB基因不影响Lm的体外生长,可认为此次分离株具有潜在致病性。此外,在中式凉拌菜、寿司、熟肉制品中检出llsX、ptsA基因,提示上述即食食品会对消费者健康构成威胁,食用会增加李斯特菌病的感染风险,应引起相关部门关注。
目前,临床上治疗人类李斯特菌病的首选方案为氨苄西林或青霉素单独使用或与庆大霉素等氨基糖苷类药物联合使用。本研究对即食食品中的83株Lm进行药敏试验,所有分离株均对头孢西丁天然耐药,这一结果与刘洋等[25]报道江西熟肉制品的耐药情况一致。除头孢西丁外,仍有28株Lm对其他抗菌药物存在耐药,耐药率为33.73%,高于闫韶飞等[5]报道的中国23个省市的即食食品Lm分离株药敏结果(11.53%)、也高于郑雅雯等[26]的结果(21.7%)。耐药株主要对苯唑西林、四环素、红霉素、氯霉素、环丙沙星耐药,这与涂文君等[27]报道重庆市鸡肉中Lm分离株对四环素、红霉素、氯霉素、环丙沙星敏感性较高相反,与赵悦等[28]报道的较为一致。其中,对四环素耐药(13.25%,仅次于苯唑西林)的菌株中约一半是熟肉制品,可能与近年来动物饲料中出现四环素添加使用有关[29]。但未出现对李斯特菌病一线治疗药物耐药的现象,故暂不影响临床的首选治疗。尽管如此,仍在4份熟肉制品、3份寿司、3份中式凉拌菜、1份熟制米面制品检出包含多种耐药谱的多重耐药株与1株达托霉素耐药株,这印证了近年来国内外食品分离株耐药谱逐渐变宽[30],也表明上述类别食品中的Lm分离株耐药情况不容乐观。
多重PCR将Lm的血清型分为1/2a群(1/2a,3a)、1/2b群(1/2b,3b,7)、1/2c群(1/2c,3c)、4b群(4b,4d,e),其中3a、3b、7、3c、4d、e较为罕见,因此Lm的血清型可分为1/2a、1/2b、1/2c及4b型。本次Lm分离株包含上述4种血清型,以1/2a(40株)、1/2b型(33株)为主,此外还检测到 4株4b型,而这3种正是散发及暴发李斯特菌病的常见血清型,尤其在欧洲和北美,1/2a 血清型与李斯特菌病的暴发更频繁地联系在一起[31]。但血清学分型对Lm分辨能力过低,MLST 是在测序的基础上为研究菌群基因结构而设计的一种高分辨率分型技术,其结果能够用于构建系统发育树,确定菌株间的关系,且可在不同实验室间进行比较,因此一定程度上满足了Lm流行病学研究发展的要求[32]。本次研究首次在福建省使用MLST分型对Lm进行研究,83株Lm分为14个CC群、16个ST型,其中包含一个新的ST型。Wang Y等[33]对2000—2008年分离自中国12个省市的各类食品来源212株Lm进行分析,得到优势型ST9、ST8和ST87;章乐怡等[23]对温州市2007—2017年97株各类食品与病例Lm分离株进行分析,得到优势型别ST87、ST121和ST9;Wu S等[34]在2012—2014年对24个城市采集并分离到的80份即食食品进行分型,得到ST8、ST1、ST87为优势型别;成梦雅等[35]对上海市2013-2014年86株食源性Lm分型,得到优势型别ST8、ST155、ST87,优势CC群CC8、CC155和CC87;李薇薇等[36]对2017年中国239株即食食品Lm分离株进行分析,得到CC8、CC101和CC87为优势CC群,对应ST8、ST101和ST87;康立超等[30]对2013—2019 年新疆各类食品63株Lm进行分型,得到ST8、ST9、ST121、ST87 为优势型,CC8、CC9、CC1和CC121为优势CC群;可见本研究得到的优势CC群CC87、CC8、CC101,优势型别ST87、ST8,ST101与全国范围流行的相符,并与李薇薇等[36]的结果一致。本研究聚类结果显示,相同采样点不同年份、相同年份不同采样点来源的菌株聚在一起、出现相同型别菌株,如本次福州2014—2017年均检出ST87;此外,相同时间、同一采样点、相同或者不同类别食品也出现相同型别菌株。提示上述型别在不同年份持续存在,加之食品的流通,使得同一型别流行不同地区,但是否存在持续污染、交叉污染有待进一步结合生产环节、加工环节、零售市场等各个环节的流行病学资料进行研究[37]。值得注意的是毒力基因ptsA阳性的菌株均为ST87,2重及以上耐药株也以ST87、ST8、ST121、ST101为优势型别,而Lu B等[38]对大陆2008—2019年29个医院的李斯特菌病病例分析,发现ST87最常见,其次是ST1、ST8;Tsai YH等[39]对台湾2014—2019年收集的411例李斯特菌病病例分析,也发现ST87最常见;此外,ST8对应的CC8是2011—2013年瑞士李斯特菌病病人分离株的主要克隆群[40]。可见福建省即食食品中Lm对应ST型分离株具有潜在的暴发流行风险, 尤其应加强ST87的监测,而ST87菌株大多分布在本次研究的高风险食品类别寿司、中式凉拌菜及熟肉制品中,更进一步表明应加强对这3类食品的管控。
综上所述,寿司、中式凉拌菜及熟肉制品中的Lm检出率较高,分离株具有潜在致病性、感染风险,且耐药情况不容乐观,相关部门应切实加强对即食食品中Lm的监管,尤其是上述高风险类别食品,加大监管力度及规范抗生素的合理使用。
利益冲突:无

