中华鳖Dkkl1 基因的分子特征及对外源性激素处理的响应
汪泳昌,祝骏贤,李建松,陈 辰,纪利芹,洪孝友,刘晓莉,王亚坤,吴聪聪,余汶君,罗来福,陈海港,魏成清,朱新平,张俊杰,李 伟
1.新疆农业大学 生命科学学院,新疆 乌鲁木齐 830052
2.中国水产科学研究院珠江水产研究所/农业农村部热带亚热带水产资源利用与养殖重点实验室,广东 广州 510380
3.惠州市财兴实业有限公司,广东 惠州 516000
Dkkl1 (Dickkopf-like 1) 是Dickkopf (DKK) 基因家族中的一员,属于分泌型糖蛋白,最初是在非洲爪蟾 (Xenopus laevis) 中被鉴定为胚胎头部诱导剂和Wingless (Wnt) 拮抗剂[1]。已有研究证明Dkkl1 可以在脊椎动物的多种细胞类型中抑制Wnt 诱导的β-catenin 的稳定性[2-3]。在小鼠 (Mus musculus) 中,Dkkl1 由单个基因编码,其表达首先在2 细胞期和4 细胞期中检测到[4],在胚胎第15 天时,Dkkl1基因在发育中的骨骼和眼睛中表达,但在性腺原基中不表达。然而在成年小鼠中,Dkkl1基因的表达只限于睾丸,Dkkl1mRNA 在发育中的精母细胞中丰富表达,首先在发育中的顶体中表达,然后在成熟精子的顶体中积累[5]。不仅如此,Dkkl1 还是一种N-糖基化蛋白,在精母细胞成熟过程中参与精子合成[6],它标志着发育中的精母细胞和精子细胞,通过靶向敲除Dkkl1基因,小鼠胚胎正常发育,形成可育后代[7]。但是,Dkkl1基因的缺失会导致精子体外受精能力严重受损,而这种作用在体内受精中似乎得到了某种因素的补偿。此外,Dkkl1基因还与人 (Homosapiens)的弱精子症[8]和不育症[9]密切相关。上述研究表明,Dkkl1基因在哺乳动物睾丸发育和精子发生过程中扮演着十分重要的角色,但是目前关于Dkkl1基因在龟鳖类动物中的研究还鲜有报道。
爬行纲在物种进化过程中具有特殊的进化位置,是第一批真正摆脱水环境依赖而登陆的脊椎动物,也是羊膜动物中最早的一种,既能进化为哺乳类,又能演化为鸟类,在动物学研究中占有举足轻重的地位[10]。中华鳖 (Pelodiscussinensis) 隶属于爬行纲、龟鳖目、鳖科、中华鳖属,是我国淡水特种养殖中的重要品种,因其独特的营养价值[11]和药用价值[12]而深受市场青睐,直接经济价值超过百亿。随着年龄的增长,中华鳖睾丸发育呈现出不同的形态特征,大致可分为4 个时期:精原细胞期、精母细胞期、精子细胞期和精子期。1 冬龄雄性中华鳖精巢中的细胞分散,曲细精管内主要由精原细胞组成;2 冬龄曲细精管中的生精上皮除了有精原细胞外,初级精母细胞也逐渐分化形成;3 冬龄精巢已具备各种类型的精细胞,曲细精管腔内出现大量精子[13-14]。中华鳖的睾丸发育和精子发生受多基因的调控,例如:L i 等[15]发现中华鳖中Hmgb2基因的表达呈现睾丸特异性,主要存在于圆形精子细胞和精子中,证实其在中华鳖的精巢发育和精子生成过程中具有重要功能;Lei 等[16]发现Spats1是一个雄性表达特异的基因,其主要存在于中华鳖的初级精母细胞、次级精母细胞和精子中,与中华鳖的精子发生和释放密切相关;Zhou 等[17]使用RNA 干扰技术成功敲除Amh基因,证明其在促进中华鳖的睾丸发育和精子发生方面具有必要和充分的作用。然而,除了关键基因之外,外源性激素也可以在一定程度上调控睾丸发育和精子发生[18-19],且在不同发育时期发挥着不同的作用[20]。例如:意大利壁蜥 (Podarcis sicula) 在高浓度17β-雌二醇 (E2) 和低浓度甲基睾酮 (MT)中会阻滞精子发生[21],而在低浓度E2和高浓度MT 中可诱导精子发生的恢复[22]。锯盖鱼 (Centropomusundecimalis)在15 和30 mg·kg–1的MT 下可刺激睾丸的发育和生长并加速精子发生[23];产后15~30 d 的大鼠暴露于E2下会延迟精子发生[24]。然而,近年有关Dkkl1基因的研究十分匮乏,且现有的研究还远不足以阐明中华鳖精子发生的背后机制。因此本研究克隆了中华鳖Dkkl1基因的cDNA 序列,对其序列特征进行详细分析,探索其在不同体组织和不同时期性腺中的表达模式,以及其对外源性激素 [E2和17α-甲基睾酮 (17α-MT)] 处理的响应,为深入探讨Dkkl1基因在中华鳖睾丸发育和精子发生中的功能研究提供基础数据。
1 材料与方法
1.1 实验材料的收集
本研究所用中华鳖采购自广东省惠州市财兴实业有限公司,选取1、2、3 冬龄健康中华鳖,麻醉后放血。取3 冬龄中华鳖的心脏、肝脏、脾脏、肾脏、脑、肌肉、卵巢和1、2、3 冬龄的精巢组织于无酶冻存管中,并将其迅速放入液氮中速冻,于-80 ℃超低温冰箱保存,每种组织均取3 个生物重复。
1.2 总RNA 提取及cDNA 第一链合成
使用Trizol 法提取中华鳖各组织的总RNA,提取RNA 的浓度和质量由NanoQTM核酸检测仪和1% (w) 琼脂糖凝胶电泳检测。使用HiScript®III RT SuperMix for qPCR(+gDNA wiper) 反转录试剂盒 (Vazyme,中国) 去除基因组DNA 污染,合成cDNA 第一链。
1.3 中华鳖Dkkl1 cDNA 的克隆
参考NCBI GenBank 公布的中华鳖Dkkl1基因序列信息 (XM_014572465) 设计引物Dkkl1-F/Dkkl1-R (表1),以3 冬龄中华鳖精巢cDNA 为模板,将Dkkl1基因的开放阅读框 (Open reading frame,ORF) 区域进行扩增,并使用1%琼脂糖凝胶电泳对PCR 产物进行检测。目的片段使用Gel Extraction Kit (Omega,中国) 胶回收试剂盒进行回收,连接至pMD19-T (TaKaRa,中国) 载体上,将连接产物转化至DH5α 感受态细胞 (TaKaRa,中国) 中。最后,从转化后的细胞中筛选出阳性克隆,并送至广州天一辉远基因科技有限公司进行测序。
1.4 Dkkl1 基因的生物信息学分析
使用ExPASy (https://web.expasy.org/translate/) 在线网站预测开放阅读框[25],采用DNAMAN 软件进行氨基酸序列的翻译和同源性比较[26]、ClustalW (BioEdit) 软件进行氨基酸序列的多重比对[27-28],通过ProtParam 分析Dkkl1 蛋白的理化性质[29]和SOPMA 分析Dkkl1 蛋白二级结构[30],利用SWISS-MODLE 同源建模构建Dkkl1 蛋白质三级结构[31]。
1.5 组织表达分析
运用Primer 软件设计实时荧光定量PCR (RT-qPCR) 所需引物Dkkl1-qF/Dkkl1-qR,同时选择中华鳖的Ef1α基因作为内参基因[32](表1)。以中华鳖不同组织的cDNA 作为模板,利用Applied Biosystems StepOnePlus Real-Time PCR Systems (Applied Biosystems,新加坡)对其进行实时荧光定量PCR 分析。反应体系为20 μL,其中2×iTaq Universal SYBR Green (BIO-RAD,美国) 10 μL,引物Dkkl1-qF/Dkkl1-qR 各0.5 μL,cDNA 模板2 μL,双蒸水 (ddH2O) 7 μL。半定量分析使用与RT-qPCR 相同的特异性引物 (Dkkl1-qF/Dkkl1-qR),采用各组织的cDNA 作为模板进行普通PCR (RT-PCR) 扩增。扩增产物通过1%琼脂糖凝胶分离并进行拍照 (GenoSens2200,中国)。
1.6 成体雄性中华鳖外源性激素处理
选取体表无伤、活跃的3 冬龄雄性中华鳖33 只,其中30 只平均分为2 组 (E2处理组和17α-MT 处理组),从腿部肌肉注射E2和17α-MT,质量浓度为50 μg·μL-1,剂量为10 mg·kg-1[16];另外3 只注射等剂量的溶剂作为空白对照组,分别于激素处理后第6、第12、第24、第48 小时和第7 天随机采集3 只雄性性腺,置于液氮中进行总RNA 提取和实时荧光定量PCR 分析。
1.7 数据分析
使用2-ΔCt法于第6、第12、第24、第48 小时计算目的基因的相对表达量[15],每个实验至少独立重复3 次,所有数据均以“平均值±标准误”表示。采用SPSS 20.0 软件进行单因素方差分析,P<0.05 表示具有显著性差异。
2 结果
2.1 中华鳖Dkkl1 基因克隆结果及其编码蛋白氨基酸序列分析
克隆获得的中华鳖Dkkl1cDNA 序列长为823 bp,其中3' 非编码区 (UTR) 长67 bp,5' UTR 长90 bp,ORF 长666 bp,共编码222 个氨基酸(图1)。中华鳖Dkkl1 蛋白的相对分子质量为24.924 77 kD,理论等电点为10.8,不稳定系数为58.71,脂溶系数为84.91,总平均亲水系数为-0.418,表明Dkkl1 蛋白是一种稳定性较差、亲水性较强的碱性蛋白质。其二级结构主要由α-螺旋、β-折叠、无规则卷曲和延伸链组成,其中α-螺旋占33.78%,β-折叠占5.86%,无规则卷曲占46.85%,延伸链占13.51%,三级结构主要以α-螺旋和无规则卷曲为主。氨基酸序列同源性比对结果显示:其与中华草龟(Chinemysreevesii)的相似性较高 (81%),与棱皮龟 (Dermochelyscoriacea)的相似性较低(70%),与绿海龟(Cheloniamydas)、三趾箱龟(Terrapene carolinatriunguis)、巴西红耳龟(Trachemysscriptaelegans)、西部锦龟(Chinemyspictabellii) 的同源性分别为80%、79%、78%、78% (图2)。

图1 中华鳖 Dkkl1 基因核苷酸序列及其推导的氨基酸序列Fig.1 Nucleotide of P.sinensis Dkkl1 gene and its encoded protein sequence

图2 中华鳖与其他物种的 Dkkl1 氨基酸序列同源相似性比对注:所有的氨基酸序列来自于NCBI 数据库:巴西红耳龟,XM_034791724.1;绿海龟,XM_037888484.1;三趾箱龟,XM_026659251.1;中华草龟,XM_039510142.1;西部锦龟,XM_024113109.1;棱皮龟,XM_038381465.2。黑色阴影为氨基酸序列比对相同的位点,灰色阴影为相近位点。Fig.2 Homologous comparison of Dkkl1 amino acid sequence of P.sinensis with other speciesNote: All amino acid sequences come from NCBI database: T.scripta elegans,XM_034791724.1; C.mydas,XM_037888484.1;T.carolinatriunguis,XM_026659251.1; C.reevesiis,XM_039510142.1; C.picta bellii,XM_024113109.1; D.coriacea,XM_038381465.2.The black and gray shadows represent the same and similar sites,respectively.
2.2 中华鳖Dkkl1 基因的组织表达
RT-qPCR 结果显示,中华鳖Dkkl1mRNA 在3 冬龄成体精巢中极显著性高表达 (P<0.001),而在心脏、肝脏、脾脏、肾脏、脑、肌肉和卵巢中几乎不表达 (图3-a)。RTPCR 结果显示,该基因仅在3 冬龄中华鳖成体精巢组织中检测到目的条带,而在其他体组织中均未检测到 (图3-b)。
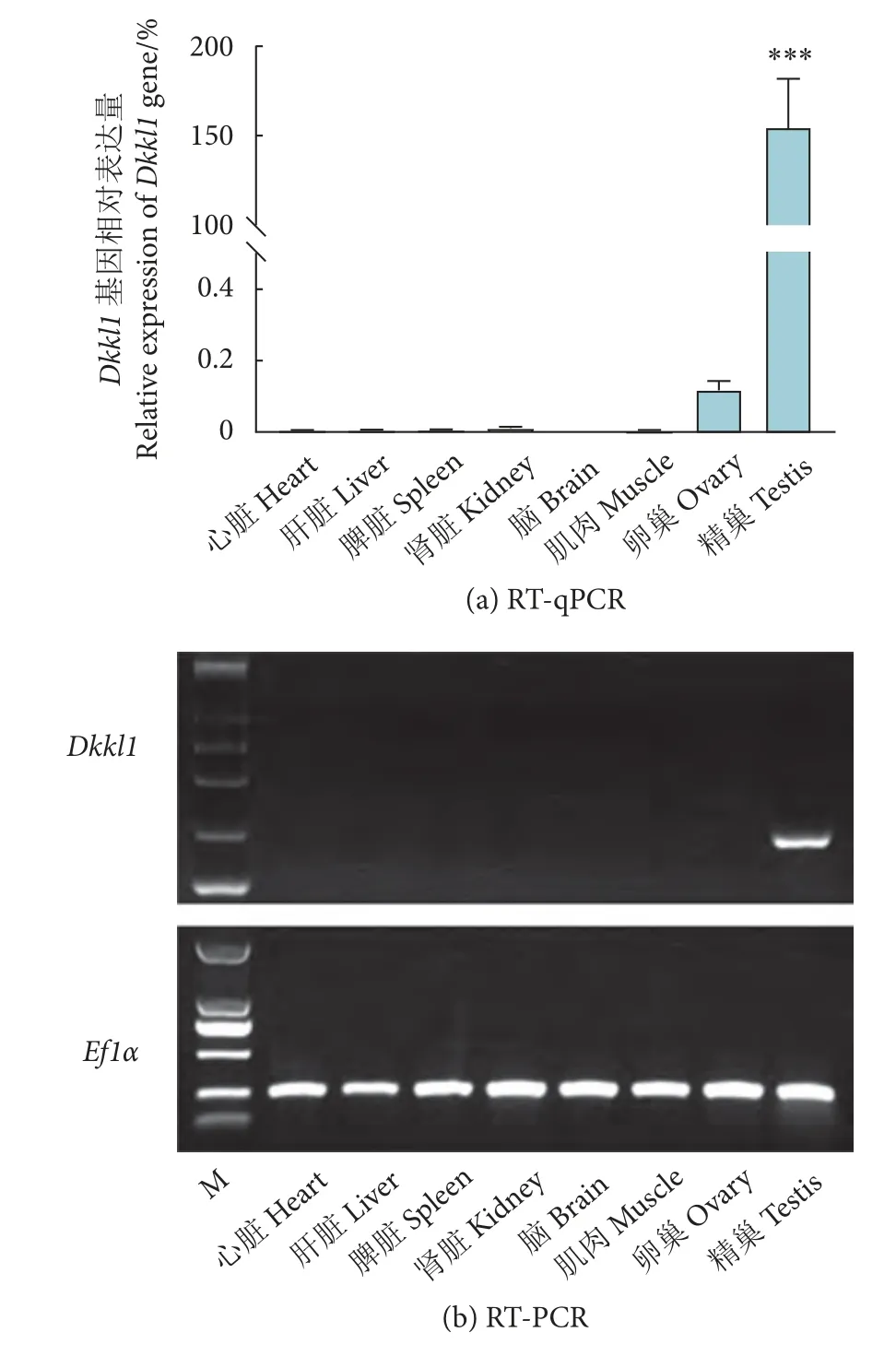
图3 中华鳖 Dkkl1 基因在 3 冬龄成体组织中的表达情况注:***.P<0.001;M.DL2000 Marker。Fig.3 Expression of Dkkl1 gene in tissues of 3-winter-age adult P.sinensisNote: ***.P<0.001; M.DL2000 Marker.
2.3 中华鳖不同发育时期精巢中Dkkl1 基因的表达变化
通过RT-qPCR 检测中华鳖Dkkl1基因在不同发育时期精巢中的表达变化。结果显示,随着中华鳖年龄的增长,其精巢中Dkkl1基因的表达量逐渐上升,并在3 冬龄时达到顶峰。此外,Dkkl1基因在2 冬龄和3 冬龄精巢中的表达量极显著高于1 冬龄 (P<0.001),而2 冬龄和3 冬龄精巢之间的表达差异不显著 (P>0.05) (图4)。
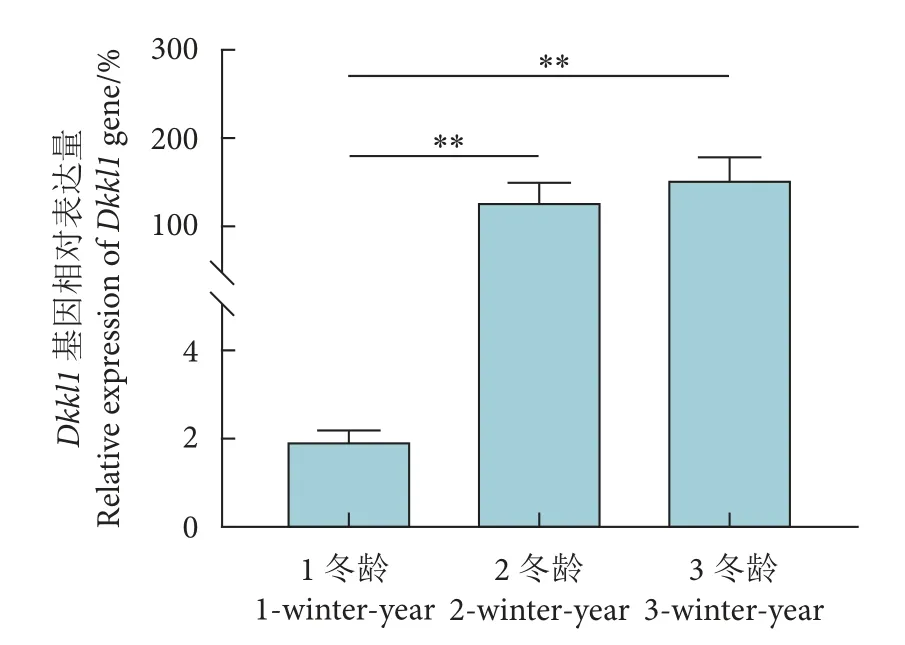
图4 中华鳖 Dkkl1 基因在不同发育时期精巢中的表达情况注:**.P<0.01表示差异极显著。Fig.4 Expression of P.sinensis Dkkl1 gene in different developmental periods of testisNote: **.P<0.01 represents very significant difference.
2.4 E2 和17α-MT 处理对中华鳖精巢Dkkl1 基因表达的影响
对雄性中华鳖进行E2和17α-MT 激素处理后,其精巢中Dkkl1基因的表达量显著降低 (P<0.05)。E2处理后,精巢中Dkkl1基因的表达量持续下降,至第48 小时几乎为0,但是在7 d 后得到部分恢复;17α-MT 处理后,精巢中Dkkl1基因的表达量同样受到显著性抑制 (P<0.05),在第48 小时达到最低值,但在第7 天显著上升 (P<0.05) (图5)。

图5 中华鳖精巢中 Dkkl1 基因对 17β-雌二醇和17α-甲基睾酮处理后的表达响应注:不同小写字母表示组间存在显著性差异(P<0.05)。Fig.5 Expression response of Dkkl1 gene in testis of P.sinensis to E2 and 17α-MT treatmentNote: Different lowercase letters represent significant differences between groups (P<0.05).
3 讨论
本实验通过克隆得到中华鳖Dkkl1基因的cDNA 序列,序列长823 bp,共编码222 个氨基酸,氨基酸序列比对和NJ 进化树结果表明其与爬行类亲缘关系最近。RTqPCR 和RT-PCR 结果显示Dkkl1mRNA 在精巢组织中高表达且极显著高于卵巢等其他组织 (P<0.001),表明Dkkl1基因表达在中华鳖中具有性别二态性和组织特异性。这与在小鼠和人类中发现的两性差异表达模式类似。Dkkl1基因的组织分布研究表明,Dkkl1mRNA 仅在睾丸中表达丰富,而在附睾和其他组织中几乎不表达。此外,人类基因芯片结果显示Dkkl1基因在成年男性睾丸中的杂交信号强度是胎儿睾丸的405.56 倍,对人体多个组织的RTPCR 分析表明,Dkkl1mRNA 仅在睾丸中表达,Western blot 分析也表明Dkkl1基因主要在人睾丸中表达[5]。综上所述,推测Dkkl1基因在中华鳖睾丸形成或功能维持上可能具有重要的调控作用。
同时,本实验发现,随着中华鳖年龄的增长,其精巢中Dkkl1基因的表达量逐渐上升,并在3 冬龄时达到顶峰,Dkkl1基因在中华鳖成体睾丸中的表达与其睾丸发育和精子发生的过程大致吻合。1 冬龄中华鳖的睾丸主要由精原细胞组成;2 冬龄时逐渐分化为初级精母细胞和次级精母细胞,并且在生精管中观察到少量精子;3 冬龄时已经完全性成熟,睾丸中产生大量成熟精子[33]。Dkkl1基因这种特殊的表达模式与睾丸发育成熟程度呈正相关,并且很可能参与了精子发生过程。因此,在生产实践中通过Dkkl1基因的相对表达量可预估中华鳖睾丸的发育成熟程度,这可为选育高繁殖力和优秀的雄性亲本提供新的生物指标。
精子发生是雌激素与雄激素共同调节的结果[34]。E2是一种天然的雌激素[35],17α-MT 是一种具有雄激素效应的内分泌干扰物[36],这两种物质已被广泛用于与睾丸发育和精子发生有关的功能研究[37-38]。本实验通过向雄性中华鳖注射外源性激素E2和17α-MT 后,发现两者均可显著抑制Dkkl1基因的表达。相比于17α-MT,E2对Dkkl1基因的抑制作用更强,在注射12 h 后,其表达量几乎为零。有研究表明,外源性雌激素可通过影响雌激素受体途径诱导精子发生障碍,并对精子的质量和受精潜力产生负面影响[39],低剂量的E2可延迟精子产生,而高剂量的E2则会完全抑制精子产生[40]。Dkkl1基因在精子发生过程中被定位在成熟的精子或精子的顶体中[4],同时还发现Dkkl1基因在小鼠胎盘发育和精子发生过程中表达,并且具有促进精子穿透透明带的能力,将其敲除后,小鼠体外受精能力显著降低[6]。因此,外源性激素E2处理可能是抑制Dkkl1基因表达的关键因素。雌、雄激素通过不同的受体途经影响精子发生,而雄激素大多是通过雄激素特异性受体AR 介导的[41]。本实验中,通过注射外源性激素17α-MT 导致Dkkl1基因的表达受到显著抑制。Dakhova 等[42]发现Dkkl1基因是睾酮产生的负调控因子,敲除Dkkl1基因导致类固醇生成酶基因Cyp11a和Cyp17表达量增加,使睾酮的合成局部上调。而注射外源性激素17α-MT 会导致生物体内睾酮水平瞬间升高[43],从而可能抑制中华鳖Dkkl1基因的转录,以响应体内睾酮水平的升高。
4 结论
本实验通过克隆得到中华鳖Dkkl1基因的cDNA 片段,对其进行生物学信息分析,发现中华鳖在进化关系上与爬行类动物相近。运用RT-PCR 和RT-qPCR 对Dkkl1基因在雌、雄中华鳖各组织和精巢不同发育时期的表达差异进行了分析,确定Dkkl1基因在3 冬龄成体精巢中显著高表达,并且随着年龄的增长其表达量逐渐升高。通过注射外源性激素E2和17α-MT,发现其可显著抑制Dkkl1基因在精巢中的表达。由以上结果可以推论,Dkkl1基因在中华鳖睾丸发育和成熟过程中起着重要作用,可能与精子发生密切相关,且可受外源性激素调控,这为今后龟鳖类动物睾丸发育及精子发生机制的研究拓展了新思路。

