硫酸铜、敌百虫、聚维酮碘对吉富罗非鱼的急性毒性及组织病理学研究
戴瑜来,王宇希,许宝青,戴杨鑫,林启存,蔡丽娟
杭州市农业科学研究院,浙江 杭州 310024
罗非鱼隶属于鲈形目、丽鱼科、罗非鱼属,是联合国粮农组织 (Food and Agriculture Organization of the United Nations,FAO) 向全世界推广养殖的优质鱼类之一。其中,吉富罗非鱼 (GIFT tilapia,Oreochromisniloticus) 因生长速度快、抗逆性强、出肉率高,深受水产从业者喜爱,是目前我国主要的罗非鱼养殖品种之一[1-3]。
随着罗非鱼养殖产业的不断发展,高密度、集约化养殖增加了罗非鱼疾病的发生率。湖病毒病[4]、链球菌病[5]、气单胞菌病[6]、柱状黄杆菌病[7]、黏孢子虫病[8]、上皮囊肿病[9]、黑斑病[10]、车轮虫病[11]等的不断发生,严重威胁着养殖罗非鱼的健康。然而,国内外针对罗非鱼 (尤其是苗种)药物敏感性的研究却鲜有报道,若按照药物的常用浓度给药存在较大风险。以不合理的浓度连续用药会引发新的问题,导致药物残留、病原菌耐药性增强并影响水产品安全性,甚至威胁到环境安全和人类健康[12]。
敌百虫、硫酸铜、聚维酮碘是目前水产养殖领域广泛使用的寄生虫药或水体杀菌消毒剂,其过量使用可导致水产动物组织发生不利改变[13-15]。目前有关敌百虫、硫酸铜、聚维酮碘对罗非鱼组织病理学的毒害作用报道较少。组织病理学研究可直观发现急性药物中毒过程中鱼体的组织形态学变化,了解药物对鱼体的主要损伤部位,有助于分析药物的毒害作用[16]。罗非鱼组织病理学的进一步改变会导致鱼体行为异常,出现临床症状。为了解水产上常用药物敌百虫、硫酸铜、聚维酮碘的合理给药剂量及安全性,评估其对吉富罗非鱼的毒害作用,本研究以吉富罗非鱼为试验对象,从组织-细胞水平分析药物对试验鱼的急性毒性、药物暴露下鱼的行为变化和组织病理学,探究科学的给药剂量,旨在提高药物疗效,减少药物浪费和环境污染。
1 材料与方法
1.1 实验动物
本试验所用吉富罗非鱼采自杭州市农业科学研究院水产研究所,全长 (4.00±0.31) cm、体长(3.10±0.37) cm、体质量 (0.89±0.22) g。随机挑选体格健康、大小均匀、体表无损的吉富罗非鱼作为试验对象。试验前,将幼鱼暂养于实验室的玻璃缸中,暂养时间为2 周,正常投饲,待其适应实验室环境后开始试验。
1.2 实验药品
硫酸铜 (CuSO4·5H2O,纯度99.0%,国药集团化学试剂有限公司);敌百虫 (w≥90%,南通江山农业化工股份有限公司);聚维酮碘 (w≥99%,国药集团化学试剂有限公司)。
1.3 急性毒性试验条件
试验在规格为长96.5 cm×宽47.5 cm×高49.0 cm 的玻璃缸中进行,每缸水体150 L,试验用水为经存放并曝气处理24 h 的自来水,每缸投放实验鱼30 尾,各备有一个充气头,试验时pH 为7.58~7.83、溶解氧为7.35~8.16 mg∙L-1、水温为22.5~24.5 ℃,光照采用自然光。
1.4 急性毒性试验方法
本研究采用静态急性毒性试验法[17]。试验前通过预试验确定试验浓度范围,试验设置5 个浓度梯度 (I—V,表1),浓度梯度按照等对数间距设置,同时设2 个平行组及1 个对照组 (对照组为不含药物的曝气自来水)。试验药物需先配成高浓度的母液,再按要求泼洒添加,药液均为现配现用。用药后前8 h 内连续观察鱼的中毒症状和死亡情况,8 h 后按用药开始的第24、第48 和第96 小时记录鱼的死亡数目,期间及时捞除死亡个体 (以丧失游泳能力,触碰无反应为准)。试验前24 h 作停饲处理,且以对照组死鱼不超过5%为本试验进行的必要条件。
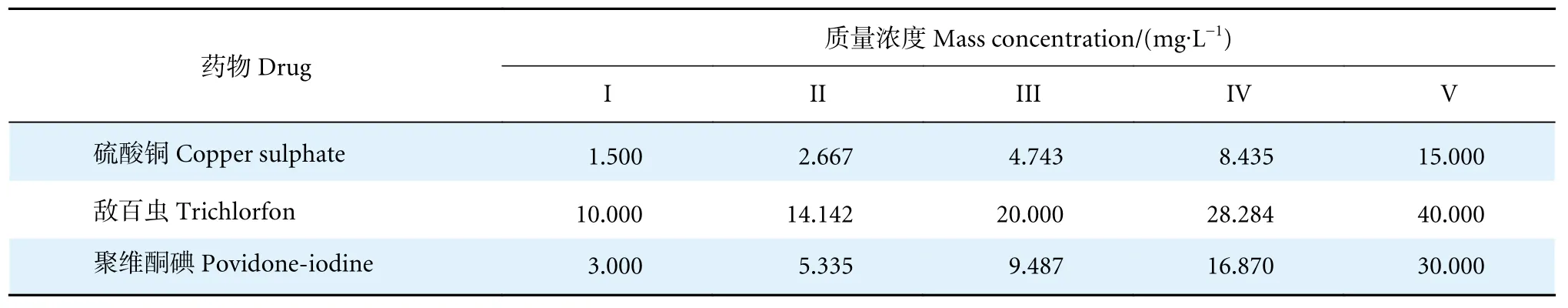
表1 用药浓度Table 1 Concentrations of test drugs
1.5 组织病理学观察
进行急性毒性试验48 h 后,分别从每种药物的试验组 (含2 个平行组,选取活力差或濒临死亡的试验鱼) 和对照组各取3 尾鱼样用于组织病理学分析。
光镜观察:用MS-222 麻醉后,进行活体解剖,分别取对照组和试验组 (暴露于表1 药物浓度IV) 的鳃、肝脏、肾脏、脑组织,经1×PBS 漂洗后,Bouin 氏液固定,常规脱水,石蜡包埋切片,HE 染色,在OLYMPUS 显微镜下观察并拍照保存。
透射电镜观察:按照常规方法进行制作,将对照组和试验组 (暴露于表1 的药物浓度IV) 的鳃、肝、肾、脑组织于活体状态迅速取下,1×PBS 漂洗后分割成小于1 mm3的小块,经戊二醛-锇酸双固定,4 ℃冰箱保存,乙醇脱水,环氧树脂Epon812 包埋,RMC-XL 超薄机超薄切片,醋酸双氧铀-柠檬酸铅双染法染色,用日立7650 型透射电镜观察并拍照保存。
1.6 半致死浓度和安全浓度的计算
根据第24、第48 和第96 小时不同药物、浓度条件下受试鱼的死亡率,采用改进寇氏法[18],计算上述时间的半致死浓度 (LC50)和安全浓度 (SC):
式中:CLC50为半致死浓度,CLC50的95%置信区间= lg-1(lgCLC50±1.96SE·lgCLC50);Xmax为试验组最大剂量的对数;a为相邻组浓度对数之差;SE为标准误差;pi为各组的死亡率;∑pi为各组死亡率的总和;n为每组动物数;CS为安全浓度,根据24和48 h 的LC50求得。
1.7 数据处理
记录每组试验鱼的死亡数量,取平均值后换算成死亡率,用Microsoft Excel 2010 软件进行处理,计算出24、48、96 h 的半致死浓度及安全浓度。
2 结果
2.1 硫酸铜对吉富罗非鱼生态行为的影响
将硫酸铜母液按浓度要求稀释后泼洒进入装有吉富罗非鱼鱼苗的玻璃缸中,各缸中的鱼起初未见明显反应,高浓度组 (8.435 和15 mg∙L-1) 有6.67%的鱼出现体表黏液增多现象;试验进行6 h后,最高浓度组 (15 mg∙L-1) 有鱼出现中毒症状,鱼体侧翻游动,时而乱窜、时而沉底,对外部刺激不敏感;12 h 后最高浓度组开始出现死亡,死鱼体表和鱼鳃发白且有黏液附着,其余无殊。硫酸铜对吉富罗非鱼的24、48 和96 h 的LC50分别为13.715、10.351 和5.896 mg∙L-1,SC 为1.769 mg∙L-1(表2)。

表2 硫酸铜对吉富罗非鱼的毒性试验结果Table 2 Toxicity test results of copper sulfate on GIFT tilapia
2.2 敌百虫对吉富罗非鱼生态行为的影响
敌百虫母液按浓度要求稀释后泼洒进入装有吉富罗非鱼鱼苗的玻璃缸后,其初始情况与硫酸铜组差异不大,在实验进行8 h 后才出现中毒症状,鱼中毒后浮于水面窜游,侧翻游动,平衡能力减弱,有2.22%的鱼出现抽搐现象;10 h 后,最高浓度组 (40 mg∙L-1) 开始出现死鱼,身体僵直,体色变黑,鳃盖和口部张开;72 h 后,可见高浓度组(28.284 和40 mg∙L-1) 有将近10%的鱼出现畸形游动现象,表现为脊椎弯曲。敌百虫对吉富罗非鱼的24、48 和96 h 的LC50分别为43.036、25.887和16.689 mg∙L-1,SC 为2.810 mg∙L-1(表3)。
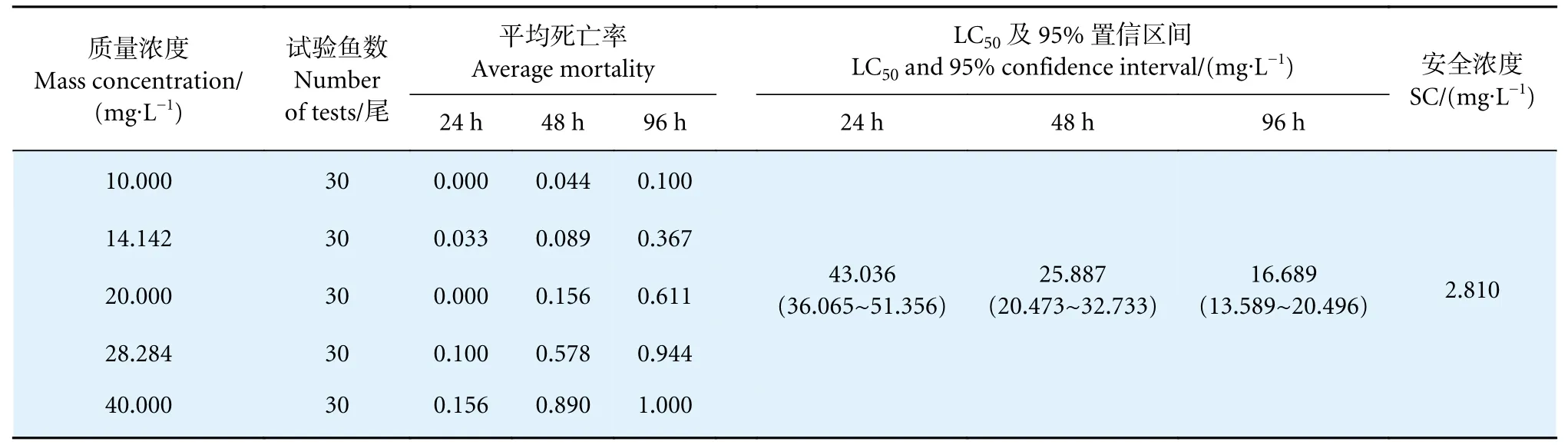
表3 敌百虫对吉富罗非鱼的毒性试验结果Table 3 Toxicity test results of trichlorfon on GIFT tilapia
2.3 聚维酮碘对吉富罗非鱼生态行为的影响
将聚维酮碘母液按浓度要求泼洒进入玻璃缸中,其初始情况较敌百虫、硫酸铜组差异较大,在实验进行45 min 后,最高浓度组 (30 mg∙L-1) 开始出现中毒症状,表现出群体浮头现象,有将近30%的鱼沉底或旋转乱窜;1 h 后,最高浓度组开始出现死鱼,鱼鳃发紫,体表无明显症状。聚维酮碘对吉富罗非鱼的24、48 和96 h 的LC50分别为10.509、9.301 和8.674 mg∙L-1,SC 为2.190 mg∙L-1(表4)。
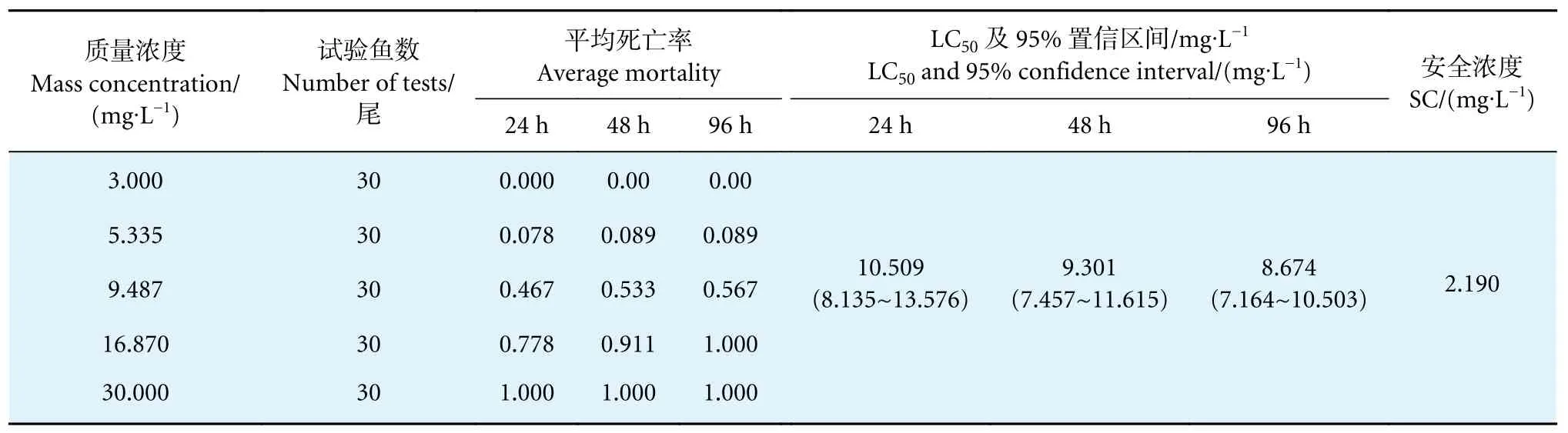
表4 聚维酮碘对吉富罗非鱼的毒性试验结果Table 4 Toxicity test results of povidone-iodine on GIFT tilapia
2.4 组织病理学结果
药物影响下吉富罗非鱼鳃组织的变化见图1,与对照组 (图1-a) 相比,8.435 mg∙L-1硫酸铜处理组鳃组织损害明显,鳃丝轮廓模糊不清,上皮细胞肿胀 (图1-b);28.284 mg∙L-1敌百虫处理组鳃组织间隙变大,鳃丝及组织破坏严重 (图1-c);16.870 mg∙L-1聚维酮碘处理组鳃丝萎缩,上皮组织增生(图1-d)。
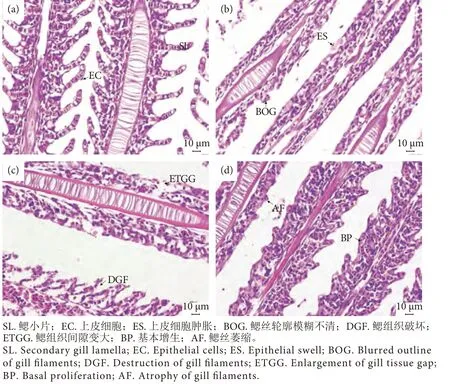
图1 不同药物作用下鳃组织的变化注:a.对照组;b.8.435 mg∙L-1 硫酸铜处理组;c.28.284 mg∙L-1 敌百虫处理组;d.16.870 mg∙L-1 聚维酮碘处理组。Fig.1 Changes of gill by different drugsNote: a.Control group; b.8.435 mg∙L-1 copper sulfate treatment; c.28.284 mg∙L-1 trichlorfon treatment; d.16.870 mg∙L-1 povidone-iodine treatment.
药物影响下吉富罗非鱼肝组织的变化见图2,与对照组 (图2-a) 相比,8.435 mg∙L-1硫酸铜处理组肝组织间空隙变大,细胞核萎缩 (图2-b);28.284 mg∙L-1敌百虫处理组出现大量无核肝细胞,且组织间结构呈不规则形态 (图2-c);16.870 mg∙L-1聚维酮碘处理组肝组织空泡化且存在充血现象 (图2-d)。

图2 不同药物作用下肝组织的变化注:a.对照组;b.8.435 mg∙L-1 硫酸铜处理组;c.28.284 mg∙L-1 敌百虫处理组;d.16.870 mg∙L-1 聚维酮碘处理组。Fig.2 Changes of liver by different drugsNote: a.Control group; b.8.435 mg∙L-1 copper sulfate treatment; c.28.284 mg∙L-1 trichlorfon treatment; d.16.870 mg∙L-1 povidone-iodine treatment.
药物对吉富罗非鱼脑组织的影响见图3,与对照组 (图3-a) 相比,8.435 mg∙L-1硫酸铜处理组中可见脑组织神经纤维出现轻微破损,细胞出现破裂现象 (图3-b);28.284 mg∙L-1敌百虫处理组脑组织神经纤维破损及细胞破裂明显 (图3-c);16.870 mg∙L-1聚维酮碘处理组除神经纤维有轻微破损外,未见其他明显变化 (图3-d)。

图3 不同药物作用下脑组织的变化注:a.对照组;b.8.435 mg∙L-1 硫酸铜处理组;c.28.284 mg∙L-1 敌百虫处理组;d.16.870 mg∙L-1 聚维酮碘处理组。Fig.3 Changes of brain by different drugsNote: a.Control group; b.8.435 mg∙L-1 copper sulfate treatment; c.28.284 mg∙L-1 trichlorfon treatment; d.16.870 mg∙L-1 povidone-iodine treatment.
药物对吉富罗非鱼肾组织影响见图4,与对照组(图4-a) 相比,8.435 mg∙L-1硫酸铜处理组中组织间隙变大,肾小管坏死 (图4-b);28.284 mg∙L-1敌百虫处理组中可见结构排列松散,肾间质出血现象(图4-c);16.870 mg∙L-1聚维酮碘处理组中除结构排列松散外,未见其他明显差异 (图4-d)。

图4 不同药物作用下肾组织的变化注:a.对照组;b.8.435 mg∙L-1 硫酸铜处理组;c.28.284 mg∙L-1 敌百虫处理组;d.16.870 mg∙L-1 聚维酮碘处理组。Fig.4 Changes of kidney by different drugsNote: a.Control group; b.8.435 mg∙L-1 copper sulfate treatment; c.28.284 mg∙L-1 trichlorfon treatment; d.16.870 mg∙L-1 povidone-iodine treatment.
透射电镜下,药物对吉富罗非鱼鳃组织影响见图5,与对照组 (图5-a) 相比,8.435 mg∙L-1硫酸铜处理组鳃组织出现空泡化,组织间间隙变大 (图5-b);28.284 mg∙L-1敌百虫处理组中细胞边界不清,细胞发生凋亡 (图5-c);16.870 mg∙L-1聚维酮碘处理组中线粒体数增多,线粒体双层膜结构不完整(图5-d)。
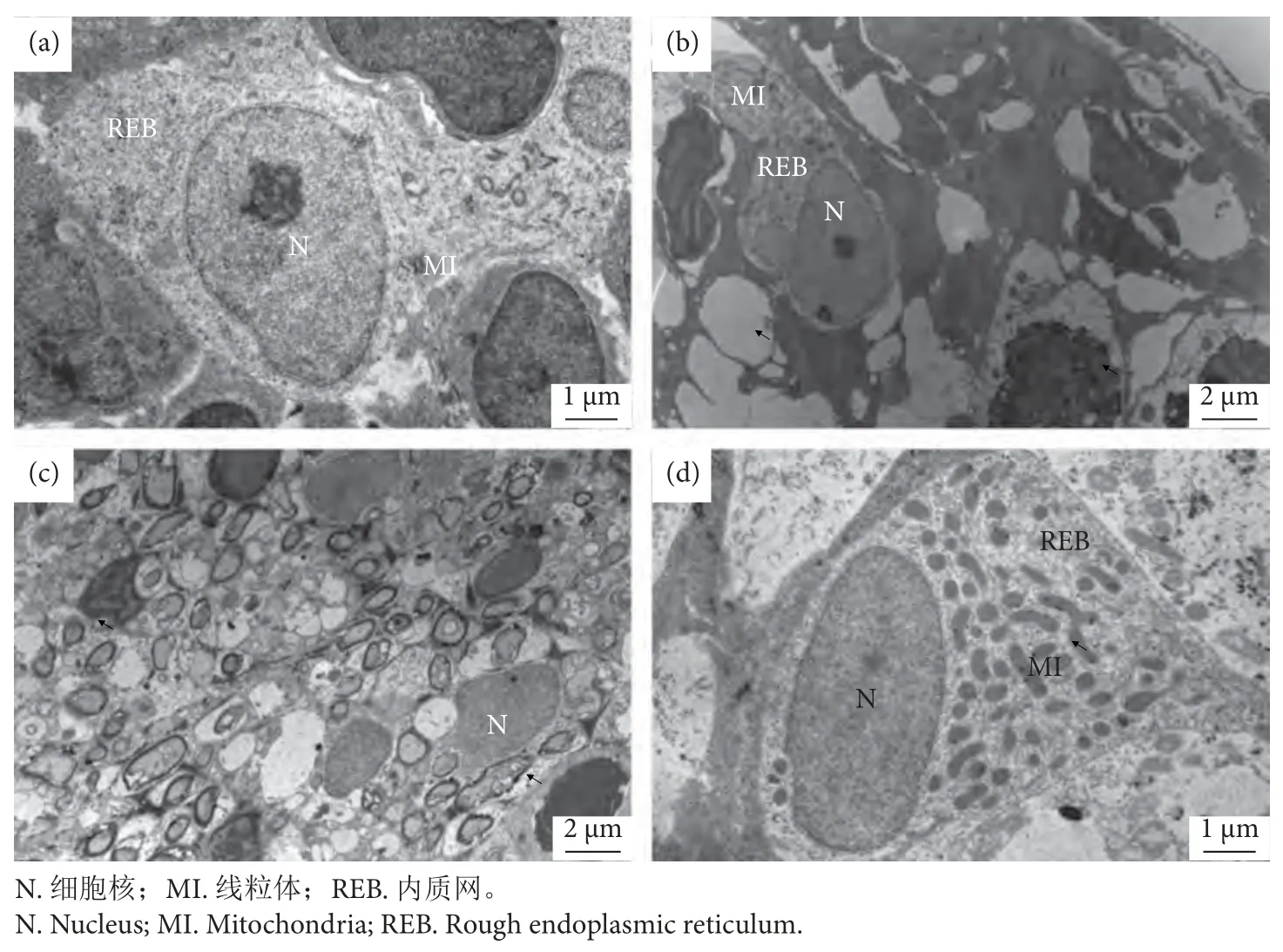
图5 不同药物作用下鳃组织的变化 (透射电镜)注:a.对照组 (15 000×);b.8.435 mg∙L-1 硫酸铜处理组 (8 000×);c.28.284 mg∙L-1 敌百虫处理组 (8 000×);d.16.870 mg∙L-1聚维酮碘处理组 (15 000×)。Fig.5 Changes of gill by different drugs (TEM)Note: a.Control group (15 000×); b.8.435 mg∙L-1 copper sulfate treatment (8 000×); c.28.284 mg∙L-1 trichlorfon treatment (8 000×);d.16.870 mg∙L-1 povidone-iodine treatment (15 000×).
透射电镜下,药物对吉富罗非鱼肝组织的影响见图6,与对照组 (图6-a) 相比,8.435 mg∙L-1硫酸铜处理组肝组织空泡化,细胞核固缩 (图6-b);28.284 mg∙L-1敌百虫处理组线粒体肿胀,嵴断裂,并呈空泡化 (图6-c);16.870 mg∙L-1聚维酮碘处理组中细胞出现凋亡现象,有髓样小体出现 (图6-d)。

图6 不同药物作用下肝组织的变化 (透射电镜)注:a.对照组 (8 000×);b.8.435 mg∙L-1 硫酸铜处理组 (7 000×);c.28.284 mg∙L-1 敌百虫处理组 (25 000×);d.16.870 mg∙L-1聚维酮碘处理组 (10 000×)。Fig.6 Changes of liver by different drugs (TEM)Note:a.Control group (8 000×); b.8.435 mg∙L-1 copper sulfate treatment (7 000×); c.28.284 mg∙L-1 trichlorfon treatment (25 000×); d.16.870 mg∙L-1 povidone-iodine treatment (10 000×).
透射电镜下,药物对吉富罗非鱼脑组织的影响见图7,与对照组 (图7-a) 相比,8.435 mg∙L-1硫酸铜处理组可见细胞边界不清,细胞发生凋亡 (图7-b);28.284 mg∙L-1敌百虫处理组细胞核固缩 (图7-c);16.870 mg∙L-1聚维酮碘处理组有明显变化 (图7-d)。
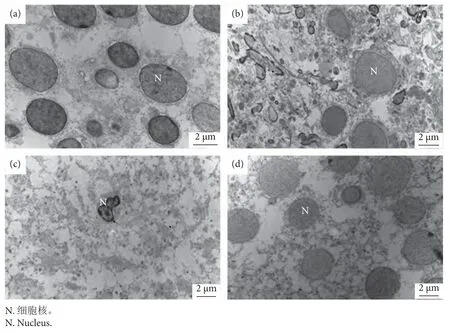
图7 不同药物作用下脑组织的变化 (透射电镜)注:a.对照组 (10 000×);b.8.435 mg∙L-1 硫酸铜处理组 (8 000×);c.28.284 mg∙L-1 敌百虫处理组 (8 000×);d.16.870 mg∙L-1聚维酮碘处理组 (8 000×)。Fig.7 Changes of brain by different drugs (TEM)Note: a.Control group (10 000×); b.8.435 mg∙L-1 copper sulfate treatment (8 000×); c.28.284 mg∙L-1 trichlorfon treatment (8 000×);d.16.870 mg∙L-1 povidone-iodine treatment (8 000×).
透射电镜下,药物对吉富罗非鱼肾组织的影响见图8,与对照组 (图8-a)相比,8.435 mg∙L-1硫酸铜处理组中组织间间隙变大,核膜破损 (图8-b);28.284 mg∙L-1敌百虫处理组中除线粒体形态变化外,未见其他明显差异 (图8-c);16.870 mg∙L-1聚维酮碘处理组中除线粒体肿胀、形态变化外,未见其他明显差异 (图8-d)。
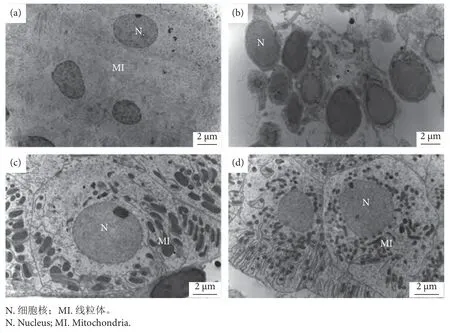
图8 不同药物作用下肾组织的变化 (投射电镜)注:a.对照组 (8 000×);b.8.435 mg∙L-1 硫酸铜处理组 (8 000×);c.28.284 mg∙L-1 敌百虫处理组 (10 000×);d.16.870 mg∙L-1 聚维酮碘处理组 (10 000×)。Fig.8 Changes of kidney by different drugs (TEM)Note: a.Control group (8 000×); b.8.435 mg∙L-1 copper sulfate treatment (8 000×); c.28.284 mg∙L-1 trichlorfon treatment (10 000×);d.16.870 mg∙L-1 povidone-iodine treatment (10 000×).
3 讨论
3.1 3 种渔药引起的组织病理学变化
硫酸铜作为水产养殖水体中铜离子 (Cu2+) 的来源之一,通过在生物体内蓄积,当其含量达到一定浓度时,会引起一系列中毒反应,如行为异常、组织病变或可能造成死亡[19-20]。本研究中,高浓度硫酸铜会引起吉富罗非鱼鱼苗侧翻、乱窜、沉底等急性中毒现象,且造成一系列的组织病理变化,最终导致死亡。有研究表明鱼鳃是吸收Cu2+的主要部位,Cu2+进入鱼体后通过生化反应和血液运输至机体其他部位,造成各组织损伤[21]。Jooyandeh 等[22]发现,15 mg∙L-1硫酸铜能引起草鱼 (Ctenopharyn-godonidella) 鳃组织发生包括板层坏死、增生、板层粘连、出血、鳃板棒状等组织病理学变化;胡亚东[23]将暗纹东方鲀 (Takifuguobscurus) 暴露于含100 μg∙L-1Cu2+的环境中,造成其鳃丝畸形,出现动脉瘤和坏死,肝脏细胞核固缩和炎性损伤、坏死;马莉芳[24]研究水体Cu2+对黄河鲤 (Cyprinus carpio) 的毒性时发现,2.51 mg∙L-1的Cu2+会导致黄河鲤鳃丝肿胀、肝细胞坏死、肾小管上皮细胞变形崩解。
敌百虫是乙酰胆碱酯酶的有效抑制剂,已发现对众多水生生物有毒害作用[25]。有研究表明,鱼类可经食道、呼吸系统及皮肤接触吸收过量的敌百虫而导致中毒[26];长期接触低浓度的敌百虫也会抑制鱼体内胆碱脂酶的活性,导致其行为、代谢和激素变化,损害肝、肾及体内细胞的遗传物质[27-28]。本研究中的吉富罗非鱼鱼苗暴露在敌百虫环境下,出现多种异常行为,组织结构也发生诸多不利变化。已有研究发现,尼罗罗非鱼 (O.niloticus) 暴露于0.5 mg∙L-1敌百虫环境下会造成异常游泳行为和不良生理反应[28];敌百虫暴露会造成鲤神经毒性、肝脏脂质过氧化并改变头部肾脏和脾脏结构[29];敌百虫可诱导异育银鲫 (Carassiusauratusgibelio) 肝细胞凋亡,导致线粒体空泡化、细胞质丢失和核固缩[13,30];均与本研究结果基本一致。此外,长期接触敌百虫可破坏鲤肠道免疫功能,引起肠道炎症,造成肠道损伤[31]。
目前,国内外关于聚维酮碘对鱼类组织病理学的研究相对较少。Hedayati 等[15]研究发现,聚维酮碘高于5 mg∙L-1时可造成鲤的鳃丝弯曲、继发性黏连、出血,肝细胞破坏、凋亡,聚维酮碘对鳃的损伤程度要大于肝脏,与本研究结果相似。
3.2 3 种渔药的用药注意事项
硫酸铜在生产上主要用于杀灭中华鳋 (Sinergasilus)、车轮虫 (Trichodina)、斜管虫 (Chilodonella)、舌杯虫 (Apiosomaspp.)、水网藻 (Hydrodictyaceae)、青苔 (Chlorella) 等。本研究中硫酸铜用药的结果明显高于尼罗罗非鱼[规格 (3.3±0.3) cm、(1.5±0.2) g,96 h 的LC50为1.093 mg∙L-1][32],但远低于同为鲈形目的攀鲈 [Anabastestudineus,规格(7.9±0.4) cm、(7.8±1.6) g,SC 为7.010 mg∙L-1][33]。然而,较硫酸铜的常用浓度 (表5),其对本研究规格的吉富罗非鱼而言是一种较为安全的药物。

表5 3 种药物常用质量浓度与安全浓度对比Table 5 Comparison of common mass concentration and safe concentrations of three drugs
敌百虫是一种广谱性有机磷类杀虫剂,主要用于杀灭体表的中华鳋、鱼鲺(Argulussp.)、锚头鳋(Lernaea)、指环虫 (Dactylogyridae)、三代虫 (Gyrodactylus) 等。本实验敌百虫用药的结果远大于奥尼罗非鱼 (O.niloticus♀×O.aureus♂,规格2.8~3.0 cm、0.48~0.50 g,96 h 的LC50为1.57 mg∙L-1,SC 为0.157 mg∙L-1)[26]和同目的黑鲷 [Sparusmacrocephlus,规格(13.0±0.4) g,96 h LC50为0.54 mg∙L-1,SC 为0.14 mg∙L-1][34]、梭鲈 (Luciopercaluciopeica,规格2.9~3.4 cm、0.25 g,96 h LC50为2.13 mg∙L-1,SC为0.213 mg∙L-1)[35]。较表5 的常用浓度,敌百虫对于本研究规格的吉富罗非鱼也较安全。
聚维酮碘是聚乙烯吡咯烷酮与碘的络合物,对大部分细菌、真菌、霉菌孢子及部分病毒均有一定的杀灭作用。试验中聚维酮碘用药的结果极接近于不同规格的吉富罗非鱼[规格(10.12±0.83) cm、(17.14±1.77) g,96 h 的LC50为7.95 mg∙L-1][36],低于同为鲈形目的蓝点笛鲷 [Lutjanusrivulatus,规格(2.45±0.10) cm、(0.425±0.010) g,SC 为2.842 9 mg∙L-1][37]和梭鱼 [Planilizahaematocheila,规格(4.22±0.87) cm、(1.23±0.28) g,SC 为4.7 mg∙L-1][38],其安全浓度高于常用浓度 (表5),因此,聚维酮碘对于本研究规格吉富罗非鱼可按常用剂量安全使用。
本研究表明,硫酸铜、敌百虫、聚维酮碘对于本实验规格的吉富罗非鱼均为较为安全的药物。然而,从组织病理学研究发现,在高浓度药物暴露下,鱼的组织 (细胞器) 均有不同程度的损害,且可能造成不可逆后果,从而影响鱼的生长、发育,或直接导致死亡。此外,药物的使用还需结合养殖动物所处的养殖周期及环境,不同养殖周期的水产动物对药物的敏感度有较大差别,尤其在特殊时期(如苗种期、脱壳期等) 使用药物更需谨慎。实际生产中,所用药物会受到温度、pH、光照、溶解氧、有机物、各种水生生物等诸多因素的影响[20,42],如敌百虫在碱性环境下会转化为敌敌畏,毒性大大增强。因此,在药物使用过程中应充分了解其理化特性和使用方法,避免过量或过久的持续使用,进而造成不可逆的组织损伤。
——以硫酸铜饱和溶液析出晶体的计算为例

