基于转录组学探讨酸枣仁皂苷A 改善阿尔茨海默病小鼠认知功能障碍的机制
王 翠,肖洪贺,闻彩名,赵宇萌,田 雨,刘 月,杨静娴
1. 大连市中心医院 神经内科,辽宁 大连 116089
2. 辽宁中医药大学药学院,辽宁 大连 116620
阿尔茨海默病(Alzheimer disease,AD)是一种与衰老相关的渐进性中枢神经系统退行性疾病,主要临床表现为进行性认知功能障碍、学习记忆能力减退、日常生活能力逐渐丧失等。其典型病理特征为神经元之间β 淀粉样蛋白(amyloid β-protein,Aβ)沉积形成老年斑、神经元内Tau 蛋白过度磷酸化形成神经原纤维缠结(neurofibrillary tangle,NFT),以及由此引发的弥漫性炎性坏死病灶和神经元大量死亡。目前关于AD 的发病机制尚未清楚,但Aβ 聚集被公认为是其核心机制,具有神经毒性的Aβ42聚集形成不溶性淀粉样斑块,激活胶质细胞产生神经毒性介质和炎症因子,进而促使神经细胞内斑块形成,最终损害局部神经元[1-5]。此外,慢性炎症性疾病如动脉粥样硬化、肥胖/代谢综合征、2 型糖尿病和重度抑郁等都是AD 发生发展的危险因素[6]。AD的发病机制非常复杂,目前对其理解还很局限,因此从不同角度开展对AD 发病机制和治疗的研究已成为本领域的热点。
中医学认为心藏神、肝藏魂、脾藏意、肾藏精,AD 与五脏中心、肝、脾、肾的功能失调密切相关,因此中医临床上常以养心安神、补肾填精、益气健脾、平肝开窍来治疗AD[7-8]。酸枣仁有养肝宁心、安神生津的功效,是《中国药典》收载的治疗失眠最常用的单味中药。研究表明,AD 患者中有25%~40%伴有睡眠结构改变[9],睡眠障碍可加速Aβ 沉积,影响脑内微环境,干扰海马神经干细胞活性而抑制神经再生,从而加重AD 的病理进程[10-12]。酸枣仁皂苷A(jujuboside A,JuA)是酸枣仁Ziziphi SpinosaeSemen中含量最高的一种皂苷成分,除具有镇静催眠、抗焦虑、抗抑郁等作用外,还有抗氧化、抗炎、抗凋亡和神经保护等多种生物活性[13]。本课题组前期研究及他人研究均已发现,JuA 可抑制AD 小鼠脑内炎症反应与氧化应激损伤,促进Aβ清除,减轻脑组织损伤[14-15],并激活内源神经干细胞促进海马神经再生[16]。以上研究表明JuA 具备治疗AD 的潜力,但其相关作用机制尚不十分清楚。本研究以淀粉样前体蛋白(amyloid precursor protein,APP)/早老蛋白1(pesenilin 1,PS1)双转基因小鼠作为 AD 模型,采用转录组学测序(transcriptome sequencing,RNA-Seq)技术结合生物信息学方法,分析JuA 治疗AD 的潜在靶基因及相关信号通路,并予以实验验证,以阐明JuA 治疗AD的分子机制。
1 材料
1.1 动物
野生型C57BL/6 小鼠10 只,7 月龄SPF 级APP/PS1 双转基因小鼠50 只,购自江苏华创信诺医药科技有限公司,合格证号SCXK(苏)2020-0009,动物使用许可证号SYXK(辽)2019-0004,动物实验伦理批准号YN2022-039-56。动物适应性喂养1周,自由进食进水,室温20~25 ℃,相对湿度40%~60%,每日12 h 光照维持,昼夜循环。
1.2 药品与试剂
JuA(质量分数为99.78%,批号22032904)购自成都普菲德生物科技有限公司;盐酸多奈哌齐片(安理申,国药准字H20050978,批号2203026)由卫材(中国)药业有限公司生产;尼氏(Nissl)染色液(批号C0117)购自碧云天生物技术研究所;苏木素-伊红(HE)染色试剂盒(批号D006-1-2)购自南京建成生物工程研究所;组织冰冻切片OCT 包埋剂(批号4583)购自美国Sakura 公司;TRIzol 试剂(批号T101100)购自上海美吉生物医药科技有限公司公司;三氯甲烷(批号0706106)购自上海申博化工有限公司;异丙醇(批号20170901)购自天津市风船化学试剂科技有限公司;RNA 逆转录试剂盒(批号G592)购自英国Abcam 公司;qRT-PCR检测试剂盒(批号31598800)购自瑞士Roche 公司;RNA 6000 Nano kit 检测试剂盒(批号5067-1511)购自美国Agilent 公司;葡萄糖激酶(glucokinase,Gck)抗体(批号sc-17819)购自圣克鲁斯生物技术有限公司;HRP 标记的山羊抗兔IgG 二抗(批号bs-40295G-HRP)购自北京博奥森生物技术有限公司;GAPDH 抗体(批号WL01114)购自万类生物科技有限公司。
1.3 仪器
Ti-s 型倒置荧光显微镜及成像系统(日本尼康公司);HM 525NX 型冰冻切片(美国Thermo Fisher Scientific 公司);MS-1 型水迷宫分析系统(成都仪器厂);Illumina HiSeq 6000 型测序仪(美国Illumina公司);DW-86L386 型超低温冰箱(青岛海尔集团);5424R 型低温离心机(德国Eppendorf 公司);CFXconnect qRT-PCR 仪、Power Pac Universal Power Supply 型通用电泳仪、Trans-Blot SD 半干式蛋白转膜仪(美国Bio-Rad 公司);5200Multi 型凝胶成像仪(上海天能公司)。
2 方法
2.1 动物分组与给药
APP/PS1 双转基因小鼠50 只,按体质量随机分为模型组及JuA 低、中、高剂量组和盐酸多奈哌齐组,每组10 只;另取野生型C57BL/6 小鼠10 只作为对照组。依据文献报道[13,17]和本课题组前期研究结果,将JuA 的给药剂量确定为5、10、20 mg/kg(ip 给药),1 次/d,连续21 d;模型组和对照组ip等体积生理盐水;多奈哌齐组按人与小鼠等效剂量换算为0.65 mg/kg(ig 给药),1 次/d,连续21 d。
2.2 Morris 水迷宫实验
连续给药21 d 后,采用Morris 水迷宫实验检测各组小鼠的学习记忆能力。前5 d 为定位航行实验,第6 天为空间探索实验。①定向航行实验:将小鼠随机面朝池壁放入水中,其游泳轨迹图由拍摄系统自动采集、分析,将游泳路程和找到平台并在其上停留15 s 所需时间定义为逃避潜伏期,每天以4 次训练中潜伏期的平均值作为当日成绩,评估小鼠的学习能力;②空间探索实验:第6 天撤去平台,选择原平台的对侧作为入水点,记录小鼠在60 s 内穿越原平台的次数、在原平台所在象限停留时间百分比及第1 次穿越平台前的游泳距离,评估小鼠的记忆能力。
2.3 脑组织样本处理与Nissl 染色
水迷宫实验结束后,小鼠ip 4%水合氯醛麻醉,心脏灌流后取脑,冰冻包埋、−80 ℃速冻,用冰冻切片进行连续冠状切片(10 μm)。将脑切片用4%多聚甲醛固定10 min 后,放入Nissl 染液中,待尼氏体清晰后终止反应;再依次经70%、100%乙醇脱水30 s,二甲苯透化5 min,中性树胶封片,显微镜下观察皮层、海马尼氏体的数量。
2.4 HE 染色
将脑片用4%多聚甲醛固定10 min 后,置于50 ℃的苏木素中5 min,流水洗去残余液体后置于分化液中10~20 s,用润洗2 次;放入0.5%氨水中反蓝10 s,ddH2O 再次润洗;放入伊红染液中3~5 s,ddH2O润洗2 次;用不同浓度乙醇进行梯度脱水后,二甲苯透化5 min,中性树脂胶封片,在显微镜下观察皮层和海马组织形态变化。
2.5 总RNA 提取与RNA-Seq 分析
取对照组、模型组与JuA 高剂量组小鼠各3 只,切取脑内海马组织,委托上海派森诺生物科技有限公司进行RNA 提取与RNA-Seq 测序。将脑组织切成小块,用TRIzol 裂解液低温提取总RNA,质检合格后通过带有Oligo(dT)的磁珠富集具有polyA的mRNA,以片段化的mRNA 为模板合成双链cDNA,随后对cDNA 进行末端修复、加A 尾并连接测序接头;通过AMPure XP beads 筛选cDNA,PCR 扩增后,再对PCR 产物进行纯化处理,最终获得cDNA 文库。采用Illumina HiSeq 6000 型测序仪进行测序分析[18-19]。
2.6 基因本体(gene ontology,GO)功能和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析
对转录组测序的原始数据(raw data)进行过滤,筛选得到高质量数据信息;用DESeq v1.20.0 软件研究各组之间的差异表达基因,将条件设置为差异倍数|log2FC|>1,显著性P<0.05,对9 个样品的mRNA 进行差异表达基因的筛选。为了掌握差异基因所参与的生物学过程、分子功能和细胞组分,使用GO 数据库对所获得基因进行富集分析;再用KEGG 进行代谢通路的富集分析,从而获取关键通路信息,并通过R 语言将相关信息进行可视化分析[18-19]。
2.7 qRT-PCR 检测基因表达
用TRIzol 提取海马组织总RNA,检测其浓度和完整性后按试剂盒说明逆转录成 cDNA,以GAPDH 为内参基因,定量检测目的基因表达水平。引物序列见表1。PCR 反应条件:95 ℃、3 min,95 ℃、15 s,60 ℃、1 min,40 个循环;反应完毕使用2−ΔΔCt法计算基因的相对表达量,以对筛选出的关键基因表达情况进行验证。

表1 引物序列Table 1 Primer sequences
2.8 Western blotting 检测蛋白表达
提取各组小鼠海马组织总蛋白,采用BCA 法测定蛋白浓度;将待测蛋白液上样到10% SDSPAGE 凝胶电泳上进行分离,然后转移至PVDF 膜上,用5%脱脂牛奶封闭2 h 后,加入Gck 一抗,4 ℃孵育过夜;次日,用TBST 洗膜3 次,每次15 min,孵育二抗,TBST 洗膜3 次,每次15 min,ECL化学发光试剂盒显色,凝胶成像仪拍照,用Image J软件分析图像灰度值,以GAPDH 作为内参,计算相应蛋白表达量。
2.9 统计学分析
用GraphPad Prism 5.0 软件进行数据分析,水迷宫实验中的逃避潜伏期数据采用重复测量双因素方差分析(Two-way ANOVA);多组间比较采用单因素方差分析(One-way ANOVA),两组间比较采用双尾学生检验(Two-tailed Students’ test)。细胞计数采用Image J 软件定量分析。
3 结果
3.1 JuA 提高AD 小鼠的学习和记忆能力
定位航行实验结果表明(图1-A、B),通过训练后各组小鼠的逃避潜伏期呈逐日下降趋势。与对照组比较,模型组小鼠从第2 天起逃避潜伏期明显延长(P<0.01);经低、中、高3 个剂量组的JuA治疗后,逃避潜伏期均有不同程度缩短(P<0.05、0.01),且随给药剂量的增大作用逐渐增强,其中高剂量组的作用与阳性对照药多奈哌齐组相近。空间探索实验结果显示(图1-C~F),各组小鼠游泳速度无明显差异;与对照组比较,模型组小鼠到达原有平台的游泳距离明显增加(P<0.01),穿越平台次数和在目标象限停留时间百分比均显著降低(P<0.01),说明模型组小鼠记忆能力明显下降;与模型组比较,JuA 各剂量组小鼠到达原平台的游泳距离均明显缩短(P<0.05、0.01),穿越平台次数和停留在目标象限时间百分比明显增多(P<0.01),其中JuA 高剂量组效果最佳。以上结果表明,JuA 能显著改善AD 小鼠的学习和记忆能力,其高剂量组作用最佳。
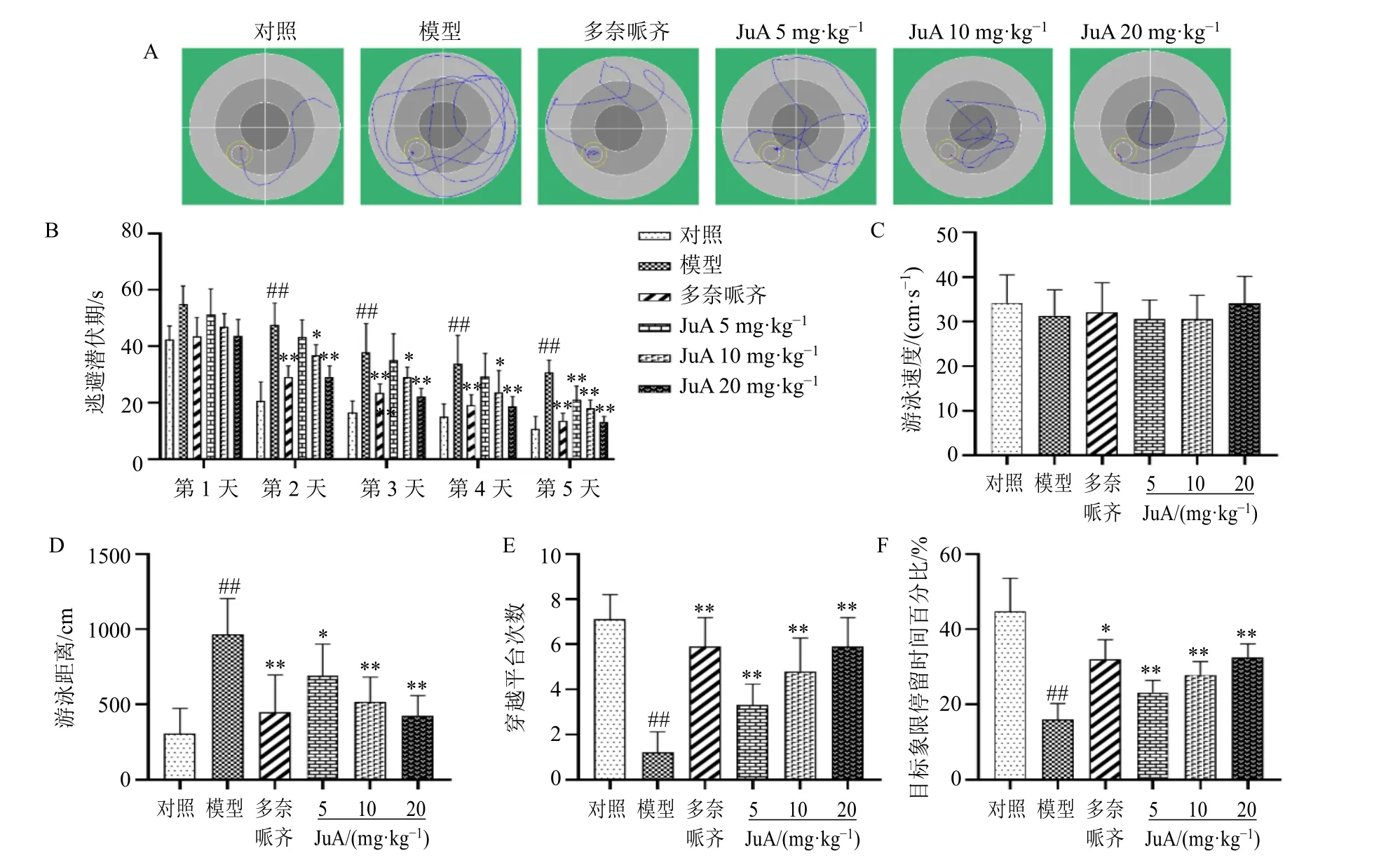
图1 JuA 对AD 小鼠学习和记忆能力的影响 (±s, n = 10)Fig. 1 Effect of JuA on learning and memory abilities of AD mice (±s, n = 10)
3.2 JuA 减轻AD 小鼠海马与皮层的病理损伤
将小鼠脑切片进行HE 染色后,置于显微镜下观察分析。如图2 所示,对照组皮层、海马CA3 和DG 区的神经细胞层次清晰、排列整齐、数量多;模型组神经细胞排列松散、数量减少、形态不规则,细胞核皱缩明显,提示模型组神经细胞明显受损;而与模型组比较,JuA 高剂量组神经细胞层次较为清晰,数量增多,胞质丰富,胞核均匀,细胞核固缩明显减轻,说明JuA 治疗后明显减轻了AD 小鼠脑组织的病理损伤。

图2 JuA 对AD 小鼠皮层和海马病理损伤和尼氏体数量的影响 (×10)Fig. 2 Effect of JuA on pathological injury and number of Nissl bodies in cortex and hippocampus of mice (× 10)
Nissl 染色结果显示,模型组小鼠皮层、海马区的尼氏体数量均较对照组明显减少(P<0.01);而JuA 高剂量组小鼠的上述区域尼氏体数量显著多于模型组(P<0.01),说明JuA 对AD 小鼠的脑组织具有明显保护作用,显著减轻了AD 病变对脑内神经元的损伤。
3.3 RNA-Seq 分析
3.3.1 测序数据质量评估 在所建立的测序文库中,9 组样本碱基质量超过Q20的比例在98.13%以上,超过Q30的比例在94.64%以上(表2),表明测序结果较好。
表2 各组样本cDNA 文库测序数据质量评估Table 2 Quality evaluation of cDNA library sequencing data for each group of samples
3.3.2 差异表达基因分析 用DESeq v1.20.0 软件对RNA-Seq 得到的基因数据进行差异表达分析,以|log2FC|>1、P<0.05 为条件进行筛选。结果显示,与对照组比较,模型组中共有341 个差异表达基因,其中上调218 个,下调123 个;与模型组比较,JuA高剂量组中差异表达基因共有94 个,其中上调66个,下调28 个(图3)。进一步分析发现,模型组的5 个差异基因在JuA 干预后表达趋势被逆转(表3),包括Gck、白细胞介素-1 受体关联激酶3(interleukin-1 receptor associated kinase 3,Irak3)、间皮素(mesothelin,Msln)、人角蛋白(human keratin,krt80)等基因,说明JuA 治疗AD 的机制与调控这些基因表达有关。其中Gck 是葡萄糖代谢的关键限速酶,其基因突变可引起2 型糖尿病,从而增加AD 的患病风险或加重AD 病理进展。本结果显示JuA 可逆转AD 小鼠Gck 的降低趋势,使其表达明显升高(P<0.05),提示干预葡萄糖代谢可能是JuA 治疗AD 的重要机制之一。

图3 差异表达基因分析Fig. 3 Analysis of differentially expressed genes

表3 JuA 对AD 小鼠差异基因表达的影响Table 3 Effect of JuA on differential gene expressions in AD mice
3.4 GO 功能富集分析
为进一步明确AD 病变及JuA 治疗AD 所涉及基因的生物学功能变化,本研究对模型组相较于对照组选出的341 个差异基因、JuA 高剂量组相较于模型组的94 个差异基因进行GO 功能富集分析,主要包括生物学过程(biological process,BP)、细胞组分(cellular component,CC)和分子功能(molecular function,MF)富集分析,并设置P<0.05 为筛选标准。结果显示,模型组vs对照组的差异基因功能主要集中在细胞分泌调节、离子通道、分泌颗粒、肽激素结合与受体活性等(图4);而JuA 高剂量组vs模型组的差异基因功能主要富集在离子转运、细胞骨架与胞质膜、核受体活性等方面(图5)。

图4 模型组与对照组比较差异基因GO 功能富集分析Fig. 4 GO function analysis of differential genes between model group and control group
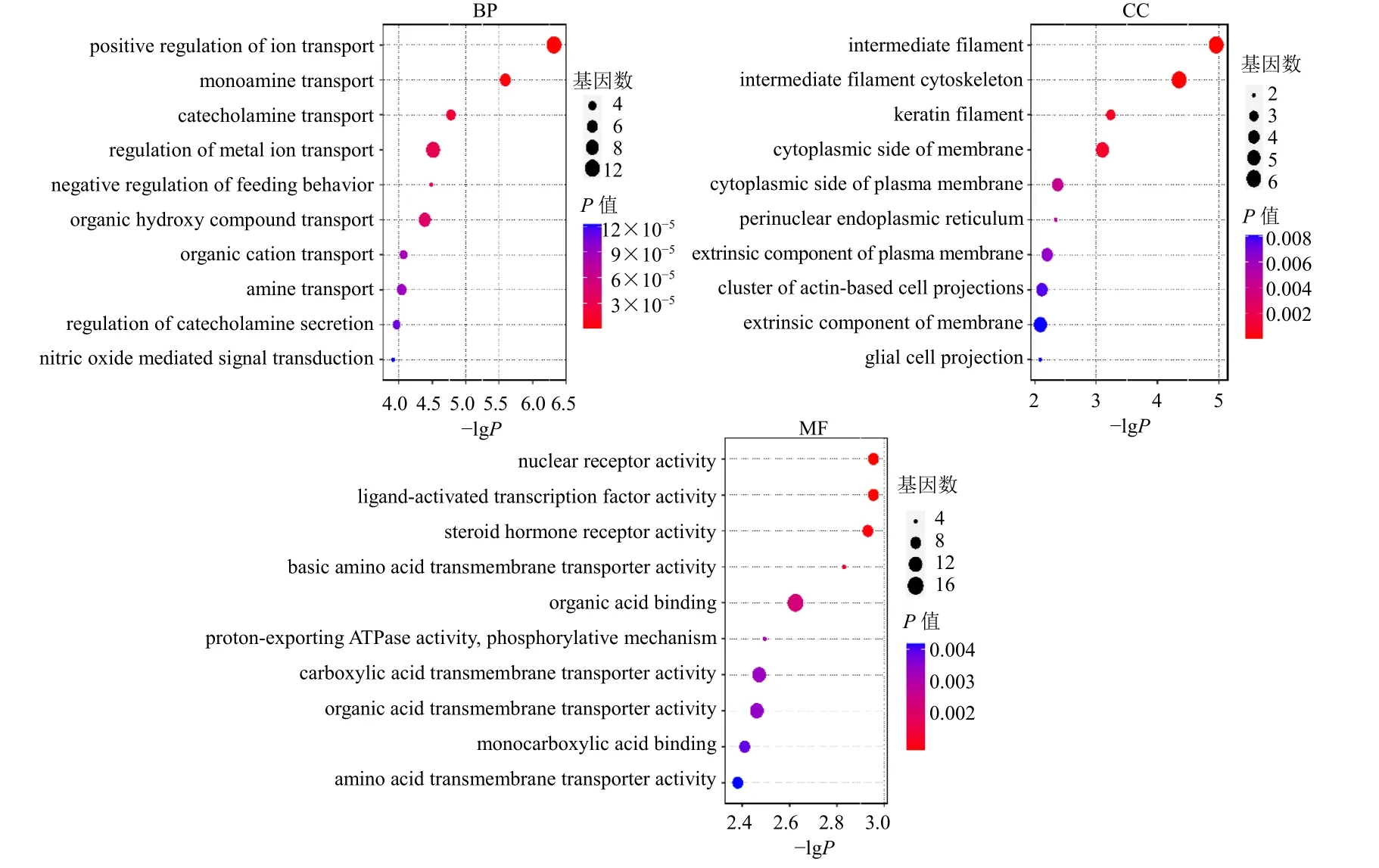
图5 JuA 高剂量组与模型组比较差异基因GO 功能富集分析Fig. 5 GO function analysis of differential genes between JuA high-dose group and model group
3.5 KEGG 通路富集分析
利用KEGG 数据库对模型组vs对照组、JuA 高剂量组vs模型组的差异表达基因进行功能注释分类、通路富集分析,设置P<0.05 为筛选标准,以基因比率(gene ratio)进行排序。如图6 所示,模型组vs对照组的341 个差异表达基因主要富集的途径有钙离子信号通路、环磷酸腺苷(cyclic adenosine 3′,5′-monophosphate,cAMP)信号通路、2 型糖尿病等,说明以上通路与AD 发病密切相关;对JuA 高剂量组vs模型组的94 个差异基因进行富集分析,发现主要涉及2 型糖尿病、细胞黏附因子、白细胞介素-17(interleukin-17,IL-17)信号通路和转化生长因子-β(transforming growth factor-β,TGFβ)信号通路上,说明JuA 的抗AD 作用可能与调控糖尿病和炎症相关通路有关。

图6 差异基因的KEGG 富集分析气泡图Fig. 6 Diagram of KEGG enrichment analysis of differential genes
再以模型组vs对照组、JuA 高剂量组vs模型组共同调节的信号通路进行比对分析,共筛选出88条通路,以基因比率(gene Ratio)进行排序,对排名前10 的通路进行核心富集基因分析。结果显示,与JuA 治疗AD 相关性最高的通路是催乳素信号通路、青少年成熟期糖尿病、脂肪消化吸收、2 型糖尿病、细胞黏附因子、IL-17 信号通路、TGF-β 信号通路等。脂肪与糖代谢的紊乱、炎症免疫反应等正是AD 发生发展的危险因素[6],JuA 可通过干预这些危险因素防治AD。在这些信号通路中Gck 基因高频出现(表4),JuA 逆转了模型组Gck 的降低,使其表达明显升高(表3),提示上调Gck 活性维持葡萄糖稳态,可能是JuA 发挥抗AD 作用的重要机制之一。
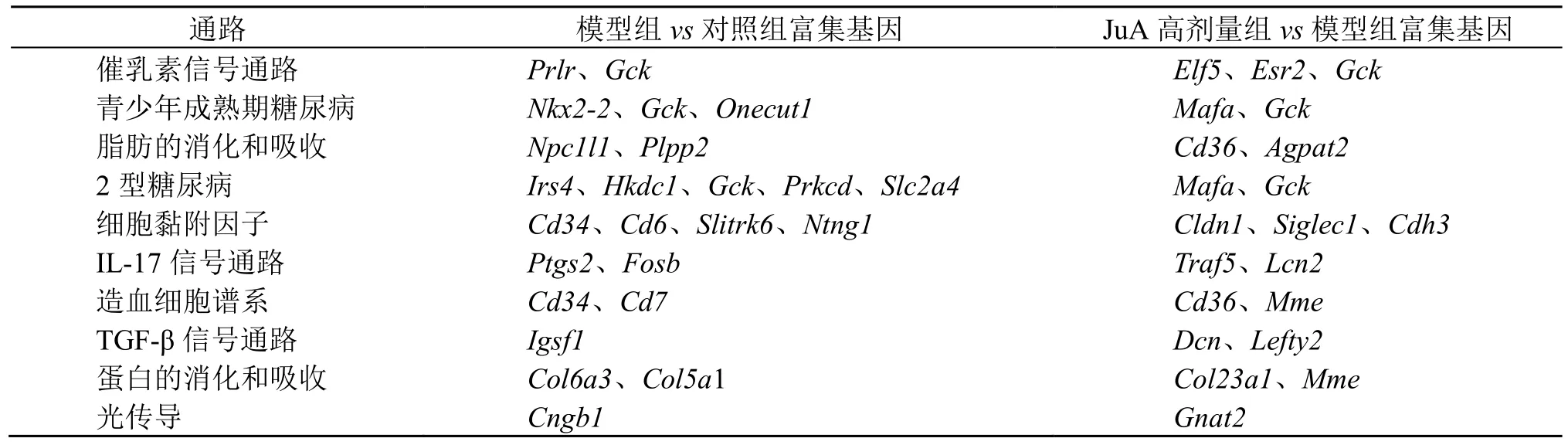
表4 共同调节的通路与核心富集基因Table 4 Co-regulated pathways and core enrichment genes
3.6 JuA 上调APP/PS1 小鼠脑内Gck 基因与蛋白的表达
为进一步验证上述筛选结果,采用qRT-PCR 与Western blotting 对小鼠脑内Gck基因与蛋白表达水平进行实验验证。如图7 所示,与对照组比较,模型组小鼠脑内GckmRNA 和蛋白表达水平均明显降低(P<0.01);与模型组比较,JuA 高剂量组GckmRNA 和蛋白表达水平均显著升高(P<0.05),与RNA-Seq 分析结果一致,说明JuA 治疗AD 的机制与上调Gck基因与蛋白的表达有关。

图7 JuA 对AD 小鼠脑组织Gck mRNA 和蛋白表达的影响 (±s, n = 3)Fig. 7 Effect of JuA on Gck mRNA and protein expressions in brain tissue of AD mice (±s, n = 3)
4 讨论
本实验采用的APP/PS-1 双转基因小鼠,表达嵌合的APP 和PS-1,能很好地模拟人类AD 脑内的病理变化,已被广泛应用于AD、淀粉样斑块形成等相关疾病的研究[20-21]。水迷宫实验检测结果表明,7 月龄APP/PS1 双转基因小鼠的学习与记忆能力已明显低于对照组,而JuA 能剂量相关性提高小鼠的学习记忆能力,其高剂量组作用最佳,与阳性对照药多奈哌齐相当。HE、Nissl 染色结果显示,模型小鼠海马与皮层神经细胞数量减少、形态不规则,核皱缩明显,尼氏体数量减少,说明神经元已明显受损;而经JuA 治疗后神经元与尼氏体数量明显增加,细胞层次较为清晰,胞质丰富,核固缩减轻,说明JuA 明显减轻了AD 小鼠脑组织的病理损伤。以上结果说明JuA能有效保护脑组织,显著改善AD小鼠认知功能的障碍。
为了进一步探讨JuA 干预AD 的分子机制,治疗结束后分别取对照组、模型组和JuA 高剂量组小鼠的海马组织进行RNA-Seq 分析。RNA-Seq 是近年发展起来的新一代高通量基因测序技术,能全面快速地获得目标组织或器官所有转录本序列信息,从整体水平研究基因功能及结构,揭示特定的生物学过程以及疾病发生过程中的分子机制[18-19]。本研究测序分析结果显示,与对照组比较,模型组中共有341 个差异表达基因;与模型组比较,JuA 高剂量组有94 个差异基因,模型组的部分差异基因在JuA 干预后表达趋势被逆转,说明JuA 可通过调控这些基因的表达治疗AD。为明确AD 病变及JuA治疗后所涉及基因的生物学功能变化,对模型组筛选出的341 个差异基因和JuA 高剂量组的94 个差异基因进行GO 富集分析,结果显示,模型组差异基因的功能主要集中在细胞分泌调节、离子通道、肽激素结合与受体活性等;而JuA 治疗组的差异基因功能主要富集在离子转运、细胞骨架与胞质膜、核受体活性等方面。对上述差异基因进行KEGG 信号通路富集分析,结果显示,模型组涉及到钙离子信号通路、cAMP 信号通路、2 型糖尿病等;而JuA组涉及2 型糖尿病、脂肪消化吸收、细胞黏附因子、IL-17 和TGF-β 信号通路等,说明JuA 抗AD 的作用可能与调控代谢紊乱和炎症反应有关。
AD 的发病机制十分复杂,其发生发展通常与慢性炎症相关疾病如动脉粥样硬化、肥胖/代谢综合征和2 型糖尿病等有关,这些疾病的产生是建立在衰老过程中促炎细胞被激活引起的全身慢性炎症基础之上[6]。炎症反应的激活可导致血脑屏障通透性增加,小胶质细胞和星形胶质细胞活化,触发淀粉样蛋白斑块和神经原纤维缠结的形成,从而导致突触丧失和神经退行性病变[6,22-23]。目前关于血清各炎症因子与AD 发病之间的关系尚未十分明确,但已有研究报道,多种促炎因子如IL-1、IL-2、IL-6、IL-8、IL-17、肿瘤坏死因子-α 等与抗炎因子IL-4、IL-10、IL-37 和TGF-β1 等的表达失衡导致的慢性炎症,是引起AD 的重要因素[6]。细胞黏附分子L1 是表达于神经细胞质膜上的跨膜蛋白,参与神经元之间的相互识别和连接,在AD 海马组织中能有效促进Aβ 斑块的清除[24]。TGF-β 超家族具有神经保护功能,可从多方面拮抗AD 病理改变,如TGF-β1 能促进Aβ 的清除、改善Tau 病理、调节海马神经发生和突触可塑性等,从而改善AD 认知功能[25]。
本研究以模型组vs对照组、JuA 高剂量组vs模型组共同调节的信号通路进行比对分析,共筛选出88 条通路,对排名前10 的通路进行核心富集基因分析,结果显示,与JuA 治疗AD 相关性最高的通路是青少年成熟期糖尿病、脂肪消化吸收、2 型糖尿病、细胞黏附因子、IL-17 信号通路和TGF-β 信号通路,说明JuA 可通过调控代谢紊乱和炎症反应减轻AD 病理损伤,抑制AD 的发生发展。
糖尿病是促进AD 发生发展的危险因素之一。糖尿病患者脑葡萄糖代谢异常、胰岛素抵抗、晚期糖基化终末产物和炎性小体等加剧了脑内免疫炎症反应和氧化应激损伤,促进了淀粉样斑块和神经原纤维缠结的形成,从而加重了AD 的病理损伤[26-27];鉴于糖尿病与AD 之间的联系和目前缺乏有效治疗AD 的药物,越来越多的研究集中于用抗糖尿病药物控制或逆转AD[28],其中新型降糖药Gck 激动剂的研发起了广泛注意。Gck 是葡萄糖代谢过程中第1 个限速酶,能灵敏识别葡萄糖水平改变,适时调控胰岛素及胰高血糖素分泌并促进葡萄糖磷酸化,从而保持葡萄糖的稳态,故Gck 激动剂有望成为全新抗2 型糖尿病药物,并对AD 的防治带来新的希望[29-30]。本研究差异基因分析结果显示,JuA 干预了AD 小鼠脑内Gck、Irak3和Msln等基因,其中Gck在模型组小鼠脑内显著降低,而JuA治疗后Gck表达明显升高,说明Gck 可能是JuA 治疗AD 的重要靶点之一;在与JuA 治疗AD 相关性最高的前10条通路中,Gck 基因高频出现,说明上调葡萄糖激酶活性维持葡萄糖稳态可能是JuA 发挥抗AD 作用的机制之一;经qRT-PCR 与Western blotting 实验验证,表明JuA 组GckmRNA 与蛋白表达均显著高于模型组,结果与RNA-Seq 分析一致。其他差异基因未在这些通路中高频出现,且与AD 的相关性目前尚不十分清楚,故有待于下一步进行验证。
综上,JuA 能明显减轻AD 小鼠脑组织病理损伤,提高小鼠学习和记忆能力,其作用机制可能与调控炎症反应与代谢紊乱有关,其中上调GckmRNA 与蛋白表达,维持血糖平衡可能是JuA 治疗AD 的重要机制之一。
利益冲突所有作者均声明不存在利益冲突

