UPLC-Q-TOF-MS/MS 联和GNPS 技术对山茱萸及其炮制品的化学成分差异研究
向 俊,范 倩,陈雪冰,徐 婷,汪玉梅,王 倩*,张翠仙*
1. 广州中医药大学第二附属医院, 广东 广州 510120
2. 广东一方制药有限公司, 广东 佛山 528244
3. 广州中医药大学中药学院, 广东 广州 510006
山茱萸CorniFructus为山茱萸科植物山茱萸CornusofficinalisSieb. et Zucc.的干燥成熟果肉,产于山西、陕西、甘肃、江苏、浙江等省,在朝鲜、日本也有分布[1]。山茱萸首载于《神农本草经》:“山茱萸味酸平,主心下邪气、逐寒湿痹,去三虫,久服轻身”[2]。山茱萸为我国传统的名贵滋补中药材[3-4],性微温,味酸涩,为收敛性强壮药,有补肝益肾,收涩固脱之功效,用于治疗肾脏虚寒,高血压,头晕耳鸣,月经过多等疾病;其主要含有环烯醚萜类、鞣质类、黄酮类、芳香酚酸类及三萜类等多种化学成分;现代研究表明山茱萸具有补肝益肾、降糖、抗氧化、神经保护等多种药理作用。现代《中药炮制学》中将山茱萸的炮制方法归于“蒸法”,常见方法有清蒸、酒蒸、盐蒸等,目前临床主要为酒萸肉,而广东等地区为使药更易入肾,临床上常用盐制品[5-7]。文献调研表明山茱萸及其炮制品物质基础相对薄弱[4,8]。全球分子网络(global natural product social molecular networking,GNPS)是基于质谱技术建立的“可视性”分子网络[9-11]。通过天然物的二级质谱特征可将具有相似二级质谱信息的分子聚在一起,形成分子笼。GNPS 中不同母离子、分子笼形状、尺寸和Node 颜色意味着不同的化合物簇。同时由于强大质谱库的存在,可以快捷、可视、简便的用于指导天然物分离,尤其是在结构新颖化合物的发现中具有明显优势。因此本研究首先采用UPLC-Q-TOF-MS/MS 结合GNPS 分子网络技术对山茱萸水提物进行全成分分析,并采用多元统计方法对山茱萸及其炮制品的差异性成分进行分析,以期从整体的角度探究山茱萸及其不同炮制品间差异成分,为山茱萸临床合理利用提供技术指导。
1 仪器与试药
1.1 仪器
Triple-TOFTM 5600+型三重四级杆飞行时间质谱(美国AB SCIEX 公司,配日本岛津LC-30AD超高压效液相色谱仪、日本 Shimadzu 公司SIL-30AC 自动进样器);Milli-Q 超纯水系统(美国Millipore 公司);卢湘仪DD-5M 低速离心机(上海卢湘仪离心机仪器有限公司);煎煮锅(广州文新电器有限公司);Sartorius 赛多利斯十万分之一天平(季尔国际贸易有限公司)。
1.2 试剂与试药
除LC-MS 用甲醇和乙腈(均为色谱级,德国默克股份有限公司),甲酸(质谱级,美国Fluka 公司)外其余试剂皆为分析纯(购于天津市大茂化学试剂厂)。对照品马钱苷(批号RP181112)、獐牙菜苷(批号RP180506)、莫诺苷(批号RP181024)、熊果酸(批号 RP190115)、没食子酸(批号RP190162)、芦丁(批号RP190213)和槲皮素(批号RP190602)均购自于成都麦德生股份有限公司,各对照品质量分数均大于98%。
山茱萸(Cor,批号190401211、181103291、180200361)、盐制山茱萸(Ycor,批号190504271、190201811、190401251)和酒萸肉(Jcor,批号180507117、180200971、190405171)均购自康美药业股份有限公司,经广州中医药大学中药学院黄海波副教授鉴定为山茱萸科植物山茱萸C.officinalisSieb. et Zucc.的干燥成熟果肉。按《中国药典》2020 年版和2011年版《广东省中药饮片炮制规范》检验均合格,样品保存在广州中医药大学中药学院海洋天然物实验室。
2 方法
2.1 溶液的制备
2.1.1 供试品溶液的制备 分别取山茱萸及其炮制品饮片各30.0 g,精密称定。分别加入1 L 纯净水浸泡30 min,水煮2 h 制成水煎液,趁热滤过,药渣采用此方法再煎煮1 次后,合并2 次滤液,离心(4000 r/min、15 min),上清滤液浓缩至约300 mL后加3 倍95%乙醇沉糖,于4 ℃冰箱静置24 h,离心(4000 r/min、15 min),上清液在50 ℃减压浓缩至粘稠状态,氮气吹干仪吹干部分溶剂,得稠浸膏。取浸膏适量,用80%甲醇水配制成质量浓度约为50 mg/mL 的样品溶液,摇匀,用0.22 μm 微孔滤膜滤过,即得供试品溶液。
2.1.2 对照品溶液的制备 取马钱苷、獐牙菜苷、莫诺苷、熊果酸、没食子酸、芦丁和槲皮素对照品适量,加80%甲醇制成各成分均含0.02 mg/mL 的混合溶液,作为对照品溶液。
2.2 分析条件
2.2.1 色谱条件 ACE C18色谱柱(150 mm×2.1 mm,3 μm,广州菲罗门科学仪器有限公司),体积流量0.4 mL/min,PDA 全波长扫描,柱温30 ℃,进样量2 μL。以乙腈为流动相A,0.1%甲酸水为流动相B,梯度洗脱:0~5 min,5% A;5~15 min,5%~10% A;15~18 min,10% A;18~25 min,10%~15% A;25~30 min,15% A;30~38 min,15%~20% A;38~41 min,20%~25% A;41~42 min,25% A;42~50 min,25%~50% A;50~55 min,50%~70% A;55~60 min,70%~85% A;60~62 min,85%~90% A;62~65 min,90% A。
2.2.2 质谱条件 电喷雾离子化源(ESI),采用正、负离子扫描模式(用亮氨酸脑啡肽作校正液,进行实时校正)。离子喷雾电压(ISVE):+5500/−5500 V;涡轮喷雾温度(TEM):550 ℃;气帘气压力(GUR):241.3 kPa;雾化气(Gas1):379.2 kPa;辅助气(Gas2):379.2 kPa;解簇电位(DP):±100 V;碰撞能量(CE):±30 eV;碰撞能散布(CES):15 eV;离子释放延迟(IRD):67 V;离子释放宽度(IRW):25 V;IDA 设置响应值超过100 cps 的8 个最高峰进行二级质谱扫描,子离子扫描范围m/z100~1200。
2.3 化学数据库分析
使用Peak ViewTM软件(版本1.2,AB Sciex)对山茱萸中复杂化合物进行定性鉴别。首先,通过检索相关文献和化学数据库网站(CNKI、Chemspider、Web of Science、PubMeb 和SciFinder等),建立山茱萸化合物数据库[4],包括名称、分子式和化学结构文件。然后,将数据库导入到Peak ViewTM软件的XIC Manager模块对目标化合物进行峰提取和匹配。提取的参数设置如下:XIC 强度(XIC intensity)>50 counts,S/N>10,同位素差异度(isotope ratio % difference)<20,质量误差(mass error)<1×10−5)。经计算筛选后,软件将各化合物的实测数据与软件理论的数据进行匹配,将匹配度大于75%且质谱碎片裂解过程合理的结果作为山茱萸最终鉴定出来的化合物。
2.4 GNPS 网络的建立
按“2.2”项下检测条件进样,获得正、负离子模式下山茱萸样品及混合对照品溶液的UPLC-Q-TOF-MS/MS 二级质谱文件,通过 MS Convert 软件转换后利用FileZilla FTP Client 连接器导入GNPS 平台(http://gnps.ucsd.edu),分别建立正负离子模式下的山茱萸GNPS 网络,并与混合对照品和谱库中的数据进行匹配;数据分析在Cytoscape 3.6.1 软件中进行。
2.5 色谱峰提取、校正、归一化
UPLC-Q-TOF-MS/MS 采集的原始质谱数据利用Maker View 1.2 软件(AB SCIEX 公司,美国)进行分识别、匹配、分对齐、滤噪等预处理。具体步骤如下:将原始质谱数据导入Maker View 1.2 软件后,首先进行参数设置,峰识别参数选择;最小保留时间0.01 min,最大小保留时间115 min,最小质荷比宽度5 scans,噪波阀值100。峰对齐参数设置:保留时间差0.2 min,质荷比容差1×10−5。滤噪参数选择:去除少于6 个样本中出现的峰,最大峰数目8000 经处理后可得到峰表,峰表主要显示化合物的保留时间和m/z等信息,里面有大量缺失值,产生的主要原因:不存在该峰、峰存在但其检验值过小以致于不能被正确识别、未在80%以上的同组样本中出现,故需对其按“80%”原则剔除,再进行峰面积的归一化处理,即完成对数据的标准化预处理。
2.6 主成分分析和多元统计分析
利用SIMCA-P 14.0 软件对原始峰表数据进行多元统计分析,数据经过Parato 变换后,首先采用主成分分析(principal component analysis,PCA)对山茱萸组、酒茱萸组、盐制山茱萸组构建PCA 模型,通过初步观察各样品的聚集情况,直观地表达山茱萸及其不同炮制品之间的化学组成分差异;随后选择偏最小二乘判别分析(partial least squares discriminant analysis,PLS-DA)进行有监督的数据分析,进一步通过S-plot、PLS-DA 模型中变量的变量权重值(VIP值,即反应离子贡献度)大于1.5 为临界值寻找山茱萸与其不同炮制品的潜在差异化学成分。
3 结果与分析
按“2.2”项下检测条件进样,获得UPLC-QTOF-MS/MS 正、负离子模式下山茱萸样品TIC 图(图1)。通过与对照品比对、数据库匹配分析、相关参考文献,对山茱萸主要成分进行快速表征,共鉴定或推断117 种成分(表1):44 个环烯醚萜类成分(24 个环戊烷环烯醚萜类、12 个裂环型环烯醚萜类、8 个环烯醚萜二聚体)、2 个三萜类成分、22 个鞣质类成分、19 个黄酮及其苷类成分、21 个芳香酸类成分和9 个其他类成分。其中12 个为山茱萸中首次鉴定到的化合物(9 个为潜在新成分)。

图1 山茱萸水提物UPLC-Q-TOF-MS/MS 正 (A)、负 (B) 总离子流图Fig. 1 Positive (A), negative (B) total ion flow chromatograms of water extract of Corni Fructus by UPLC-Q-TOF-MS/MS

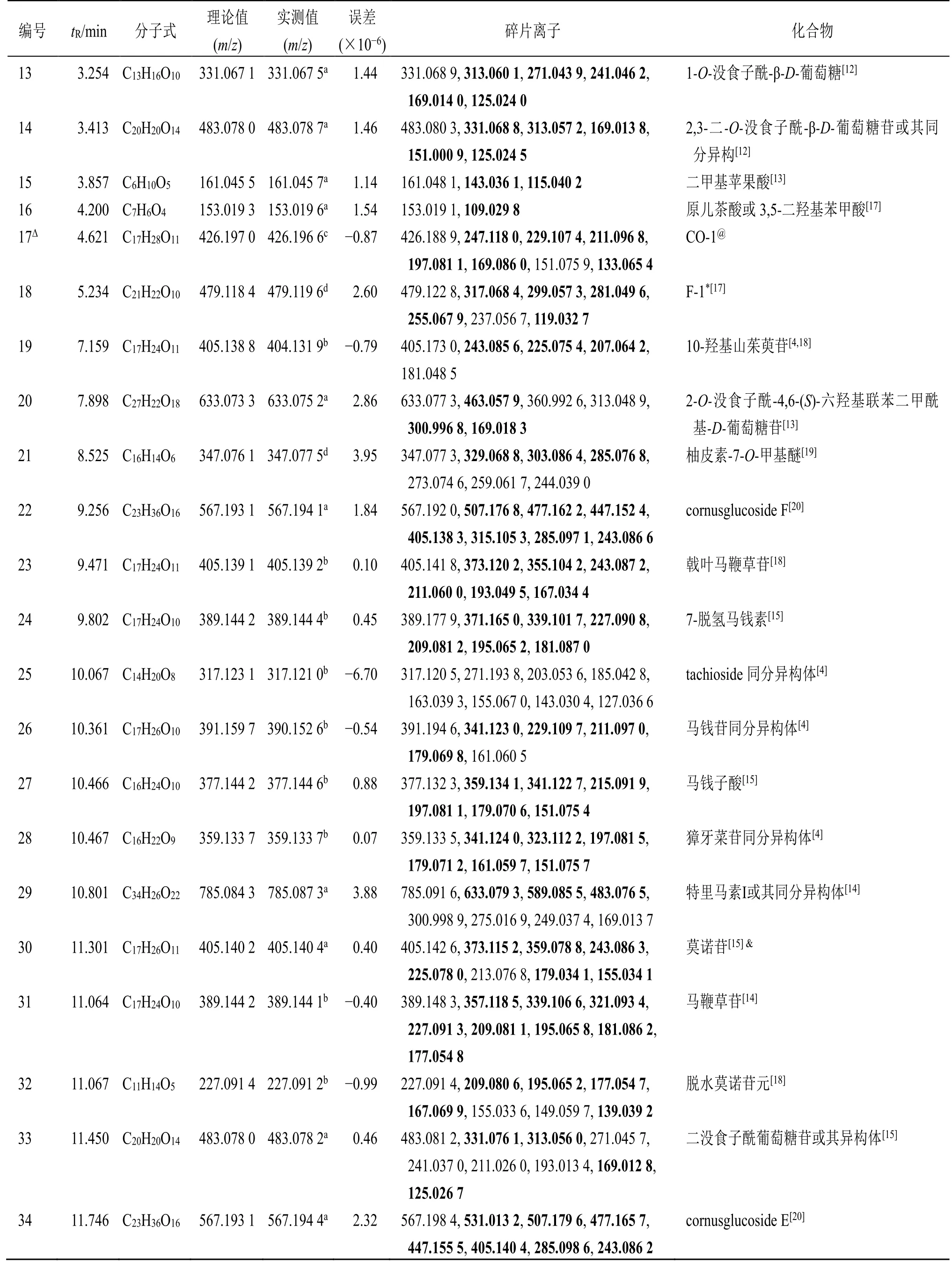
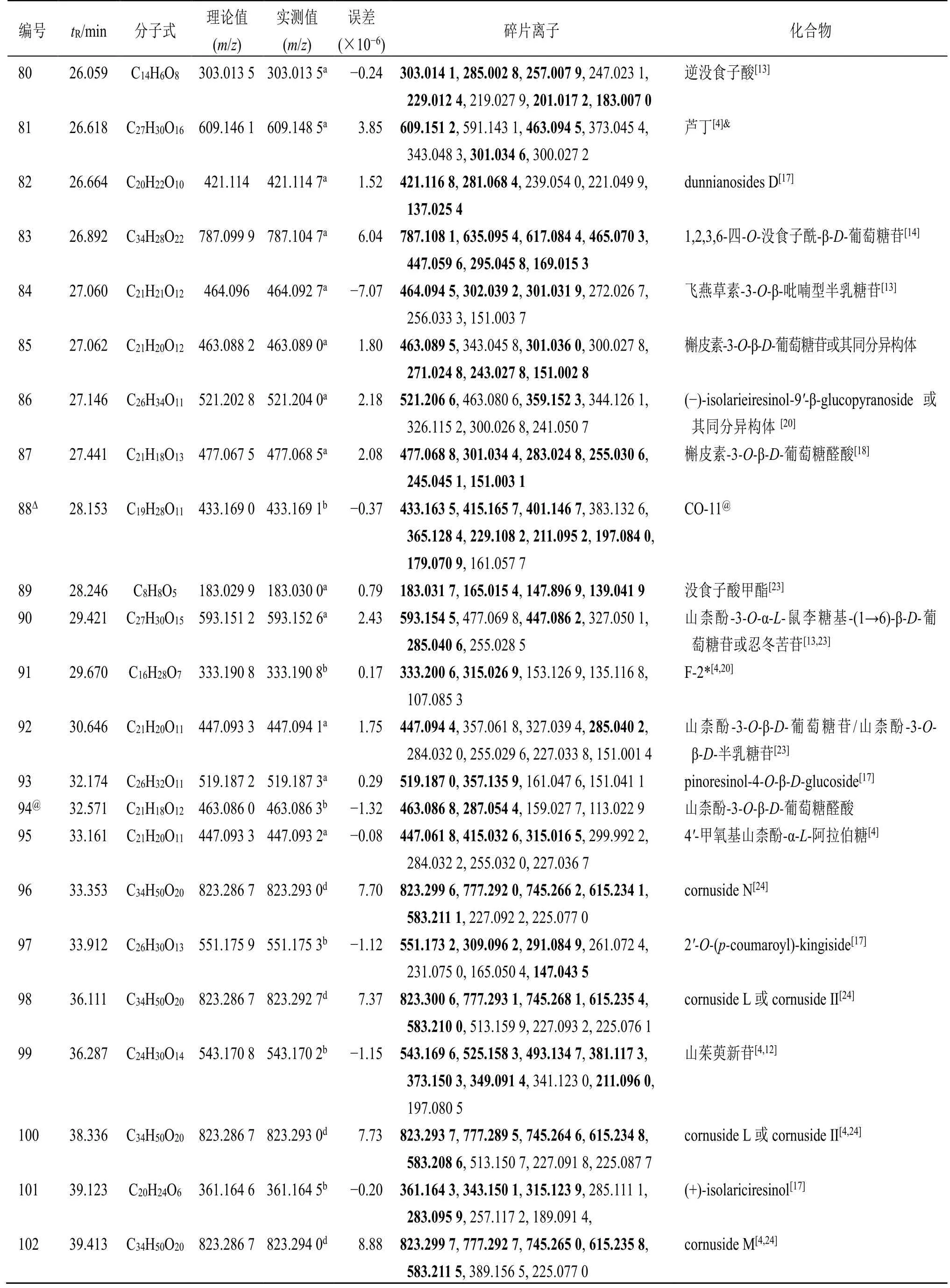
表1 基于UPLC-Q-TOF-MS/MS 和GNPS 鉴定的山茱萸中成分离子信息Table 1 Characterization of component ion information of Corni Fructus by UPLC-Q-TOF-MS/MS and GNPS
续表1

续表1

续表1
续表1

续表1
3.1 利用UPLC-Q-TOF-MS/MS 技术对山茱萸化学成分的分析
3.1.1 环烯醚萜类化合物 此类物质是山茱萸茱萸中含量最高的成分类群,为其主要活性成分。结构类型涉及环戊烷型环烯醚萜(代表结构马钱苷)、裂环环烯醚萜(代表结构莫诺苷)和环烯醚萜二聚体(代表结构cornuside O)3 类,其大部分与糖相连形成环烯醚萜苷[4]。通过质谱分析,在山茱萸水提物中共鉴别37 个已知的环烯醚萜类(表1):17 种环戊烷型环烯醚萜、12 种裂环环烯醚萜及8 种环烯醚萜二聚体。此类成分在正离子模式下响应较好。在正离子模式检测下,峰61 给出了m/z391.160 1 [M+H]+的分子离子峰,二级质谱图(图2)中可观察到碎片离子m/z373.146 8 [M+H-H2O]+、359.132 0 [M+H-CH3OH]+、341.122 7 [M+H-CH3OH-H2O]+、229.106 7 [M+H-Glc]+、211.095 9 [M+H-Glc-H2O]+、197.080 9 [M+H-Glc-CH3OH]+、179.069 6[M+H-Glc-CH3OH-H2O]+和151.074 8 [M+H-Glc-CH3OH-CO]+,其保留时间和裂解方式均与马钱苷对照品一致,且质谱裂解方式与文献报道一致[25],推测峰61 为马钱苷。同样根据马钱苷裂解规律及文献数据的对比[15,25],系列该类型的化合物被鉴定(19、23、24、26、27、31、52、39、40、46、51、67、69、71、75),见表1。

图2 马钱苷的二级质谱图及裂解规律图Fig. 2 MS2 spectrum and proposed fragmentation pathways of loganin
对于裂环环烯醚萜的结构鉴定,在负离子模式检测下,峰30 给出了m/z405.142 6 [M-H]−的准分子离子峰,其主要的裂解是丢失侧链的葡萄糖残基、H2O 和CH3OH 分子。其次是结构中不稳定的半缩醛结构开环回醛式,然后脱去1 分子CO。二级质谱图中,其主要的碎片离子有m/z373.115 2 [MH-CH3OH]−、243.086 3 [M-H-Glc]−、225.078 0[M+H-Glc-H2O]−、193.051 0 [M-H-Glc-CH3OH-H2O]−、155.034 1 [M-H-Glc-CH3OH-2CO]−,其保留时间和裂解方式均与莫诺苷对照品一致,且质谱裂解方式与文献报道一致[25],确认峰30 为莫诺苷,其裂解规律如图3 所示。类似地,通过莫诺苷裂解规律及文献数据的对比[25],系列此类型化合物均被鉴定(22、28、32、34、37、41、54、59、65、99、97),见表1。环烯醚萜二聚体类化合物为环戊烷型环烯醚萜和裂环环烯醚萜通过单键连接在一起而形成的环烯醚萜类化合物。在负离子模式检测下,峰104 在负离子模式检测下给出了m/z823.228 9 [M+HCOO]−的分子离子峰,二级质谱图可观察到碎片离子m/z777.293 1 [M +HHCOOH]−、615.235 5 [M+H-HCOOH-Glc]−、453.173 6 [M+H-HCOOH-2Glc]−等,和它的4个同分异构体不同的是它具有连续丢失2 个葡萄糖的特征性离子,通过对比参考文献数据[4,24],推测峰104 为cornuside O。同系列化合物也均被确定(96、98、100、102、105、109 和110),见表1。

图3 莫诺苷的二级质谱图及裂解规律图Fig. 3 MS2 spectrum and proposed fragmentation pathways of morroniside
3.1.2 黄酮类化合物 通过数据库分析,在山茱萸提取物中共检测到14 个黄酮类已知化合物。对于黄酮及其苷类化合物的裂解,先是失去连在环上的取代基如羟基、甲氧基、糖基;随后是C 环的开裂或者重排。C 环的开裂一般产生A−和B−离子,C 环的重排涉及CO(m/z28)、HCO(m/z29)、CO2(m/z44)等的丢失。其中从中性丢失的小分子,可以推断其连在环上的取代基。C 环的开裂产生的离子对于母核的推断具有重要的意义。如峰107 在负离子模式检测下显示了m/z301.035 6 [M-H]−的准分子离子峰,其主要的碎片离子有m/z273.041 4 [MH-CO]−、257.045 2 [M-H-CO2]−、229.050 9 [MH-CO2-CO]−、151.004 3、121.030 3,其中m/z151.004 3 是由RDA1,3A−裂解产生的碎片离子,m/z121.030 3 是由RDA1,3B−丢失1 分子CO 得到的碎片离子,其保留时间和二级裂解碎片均与槲皮素对照品一致,峰107 被鉴定为槲皮素。类似地,通过槲皮素和芦丁的裂解规律及文献数据的对比[18],其他黄酮类化合物18、21、53、81、84、85、87、90、92、95、103、112 和114 均被鉴定(表1)。
3.1.3 鞣质类化合物 在山茱萸水提物中共检测到22 个鞣质类化合物。对于没食子酰鞣质类的鉴定,其裂解规律为中性丢失没食子酰基(galloyl,152)、丢失整个葡萄糖基(162)及糖环的交叉环切除裂解(C2H4O2,60;C3H6O3,90)。在负离子模式下,峰6 在负离子模式下准分子离子峰为m/z361.076 9 [M-H]−,其主要二级信息有m/z343.067 5[M-H-H2O]−、325.054 9 [M-H-2H2O]−、m/z301.057 1 [M-H-60]−、271.044 7 [M-H-90]−、241.035 0 [M-H-120]−、211.023 1 [M-H-150]−、169.013 5、125.024 6,其二级碎片主要是由于糖链的断裂或者丢失整个糖基产生的。m/z301.057 1、271.044 7、241.035 0、211.023 1 均是由于糖链不同位置处的断裂,分别丢失中性碎片C2H4O2(m/z60)、C3H6O3(m/z90)、C4H8O4(m/z120)和C5H10O5(m/z150)产生。m/z169.013 5 和125.024 6 则是由母离子相继丢失整个景天庚酮糖和CO2得到的。根据以上碎片离子信息及参考文献数据[26],推测峰6为7-O-没食子酰-D-景天庚酮糖。类似地,通过7-O-没食子酰景天庚酮糖的裂解规律及文献数据的对比[21,26],同系列鞣质类化合物4、9、13、14、20、33、36、38、44、47、49、62、68、83 均被鉴定;29、63、66、78 与48 均为特里马素Ⅰ或其同分异构体;同样地化合物11、20 和50 也依次被鉴定(表1)。
3.1.4 芳香酚酸类化合物 此类化合物含有较多的酚羟基和羧基,裂解时易失去H2O、CO、CO2及HCOOH 等基团。在山茱萸水提物中共检测到22个有机酸类化合物。峰7 在正离子模式下出现m/z171.028 7 [M+H]+的准分子离子峰。其二级碎片主要有m/z153.017 0 [M+H-H2O]+、135.009 4 [M+H-2H2O]+、125.026 0 [M+H-HCOOH]+、109.028 8[M+H-H2O-CO2]+和107.013 4 [M+H-2H2OCO]+,通过与对照品保留时间及二级碎片的比对,可确定峰7 为没食子酸。类似地,通过没食子酸的裂解规律及文献数据的对比[20],系列芳香酚酸类化合物1~3、5、12、15、16、25、35、42、56、58、60、64、74、80、82、86、89、93 和101 均被鉴定(表1)。
3.1.5 三萜类化合物 三萜类化合物是山茱萸的有效成分之一,在山茱萸样品中共鉴定了2 个三萜化合物(116 和117),见表1。峰117 在正离子模式下显示了m/z457.364 4 [M+H]+的准分子离子峰,主要的碎片离子有m/z439.357 8 [M+HH2O]+、411.362 1 [M+H-HCOOH]+和393.355 0[M+H-HCOOH-H2O]+,其主要的裂解先是丢失侧链的H2O 分子和HCOOH。然后是结构当中的C环容易进行RDA 裂解,把母核分为A、B 环和C、D 环。而碎片离子m/z203.178 0 [M+H-C14H22]+和191.179 6 [M+H-Glc-C15H22]+是由RDA 裂解产生。其保留时间和裂解方式均与熊果酸对照品一致,且质谱裂解方式与文献报道一致[12],确认峰117为熊果酸。
3.1.6 其他类化合物 其他类成分包括甾体类、生物碱类和糖类等。在山茱萸提取物中共检测到9 个其他类化合物。在负离子模式下,峰8 的准分子离子峰为m/z125.025 6 [M-H]−,经软件计算其分子式为C6H6O3,其主要的碎片离子为m/z107.016 4[M-H-H2O]−,通过参考文献的比对[14],推测峰8为5-羟甲基糠醛。峰111 准分子离子峰为m/z597.217 4 [M +HCOO]−,对应的分子式为C27H36O12,主要的碎片离子为m/z551.217 4、389.162 3、227.107 7。其中m/z551.217 4 是由母离子丢失HCOOH 产生的,m/z389.162 3、227.107 7则是由母离子相继丢失2 分子葡萄糖残基产生的。根据参考文献报道[17],推测峰111为cornucadinoside D。同样地系列化合物还有91(异构体)、106、108和113 也被鉴定。而79、115 则为生物碱。
3.2 通过GNPS 对山茱萸水提物中环烯醚萜和黄酮类化合物的鉴定
基于MS/MS 光谱的相似性,正、负离子模式下的山茱萸水煎煮液样品和山茱萸混合标准品的可视化 GNPS 分子网络分别被建立(正离子:https://gnps.ucsd.edu/ProteoSAFe/status.jsp?task=523 dd234cc4e457cbe293ccc7570a655;负离子:https://gnps.ucsd.edu/ProteoSAFe/status.jsp?task=63d7ee40b 7ae480a98ef4a9cbe4844fc)。在正离子模式下的GNPS 分子网络里,分析了2 个主要的分子笼。通过分子笼Node 点信息、对照品及质谱数据,推测鉴定了12 个化合物:9 个为潜在的新化合物(结构涉及7 个环烯醚萜类和2 个黄酮类)和3 个首次在山茱萸属植物中鉴定的黄酮类成分(图4),在负离子模式下山茱萸的GNPS 分子网络里,暂未挖掘分析到新的化合物。主要对此12 个成分进行描述。

图4 山茱萸中12 个首次鉴定化合物的化学结构 (*为9 个潜在新结构)Fig. 4 Chemical structure of 12 compounds firstly identified from Corni Fructus (* means potential new structures)
在正离子模式下分子笼I 的相对分子质量在m/z331.103~798.338,主要结构类型为环烯醚萜类化合物(图5-A)。其中节点408.187 [M+NH4]+经LC-MS 与对照品的保留时间及二级碎片信息鉴定马钱苷。同时节点m/z377.144 [M+H]+和m/z394.171 [M+NH4]+为马钱子酸(峰27),节点m/z507.171 [M+H]+和m/z524.197 [M+NH4]+为山茱萸新苷Ⅲ或山茱萸新苷Ⅳ(峰75)。以节点m/z493.155 和m/z426.197 的鉴定为例,节点m/z493.155 与m/z507.171 相关联,且比m/z507.171 低14,推测其可能比m/z507.171 少1 个-CH2基团。并且m/z493.155 节点二级质谱图中出现m/z493.268 6 [M+H]+的准分子离子峰,分子式为C20H28O14,其主要的二级碎片有m/z475.147 5 [M+H-H2O]+、457.132 8 [M+H-2H2O]+、439.124 9[M+H-3H2O]+、359.135 1 [M+H-C4H6O5]+、197.081 5 [M+H-C4H6O5-Glc]+、179.070 1 [M+H-C4H6O5-Glc-H2O]+(图5-B),与m/z507.17 1的二级裂解相似,但由于未发现与脱去CH3OH 相关的 [M+H-CH3OH]+、[M+H-CH3OH-H2O]+、[M+H-CH3OH-H2O-CO]+等碎片离子,说明其C-4 位连接“-COOH”取代基,而非“-COOCH3”取代基,推测节点m/z493.155 为CO-2(峰43),经过SciFinder 查找验证,该化合物为山茱萸属植物中潜在新化合物。节点m/z426.197 与m/z377.144(马钱子酸)相关联,表明它们在结构上类似。节点m/z426.197 相对分子质量和m/z377.144 相差32,而且节点m/z426.197 产生的准分子离子峰为426.188 9 [M+NH4]+,其二级碎片有m/z409.170 0[M+NH4-NH3]+、247.118 0 [M+NH4-NH3-Glc]+、229.107 4 [M+NH4-NH3-Glc-H2O]+、211.096 8 [M+NH4-NH3-Glc-2H2O]+、197.081 1[M+NH4-NH3-Glc-H2O-CH3OH]+、169.086 0[M+NH4-NH3-Glc-H2O-CH3OH-CO]+、151.075 9 [M+NH4-NH3-Glc-2H2O-CH3OHCO]+、133.065 4 [M+NH4-NH3-Glc-3H2OCH3OH-CO]+,二级碎片显示有3 个中性水分子的丢失,及CH3OH 和CO 的相继丢失,基于质谱数据分析及与之关联的参考化合物m/z377.144(马钱子酸),推测节点m/z426.197 化合物为CO-1(峰17),经过SciFinder 查找验证,为山茱萸属植物中潜在的新化合物。此外,其他一系列未知离子m/z522.18、475.215、523.165、489.16、433.169 也聚集在同一个分子笼内,表明这些离子与马钱苷具有相同的母核,同时结合它们的二级碎片,推断分别为CO-3、CO-4、CO-5、CO-6、CO-11,经过SciFinder查找验证,均为山茱萸属植物中潜在的新化合物。

图5 山茱萸的分子网络图和二级质谱图Fig. 5 GNPS and MS2 spectrum of Corni Fructus
分子笼II 主要由黄酮及鞣质类化合物构成(图5-C)。其中节点m/z611.16 经LC-MS 与对照品的保留时间及二级碎片信息鉴定为芦丁。以芦丁作为参考物质鉴定其他离子的化学结构。节点m/z597.144、479.081、611.124 均和节点m/z611.16(峰81 即芦丁)相关联,具有相同的二级碎片离子m/z303,表明m/z597.144、479.081、611.124 这3 个化合物和m/z611.16(芦丁)具有相同的槲皮素苷元。其中节点m/z597.144 产生的准分子离子峰为m/z597.143 9 [M+H]+,其主要的二级碎片为m/z465.100 8 [M+H-Ara]+、447.0868 [M+H-Ara-H2O]+、303.049 4 [M+H-Ara-Glc]+,可见m/z303.049 4 [M+H-Ara-Glc]+是母离子相继丢失阿拉伯糖和葡萄糖的产生的,因此结合关联对照品m/z611.16(芦丁)及二级碎片信息,节点m/z597.144被鉴定为槲皮素-3-O-β-D-葡萄糖-α-L-阿拉伯糖(峰76 即CO-9),经过SciFinder 查找验证,该化合物为山茱萸植物中首次鉴定到。同理,节点m/z479.081 的主要二级碎片m/z303.049 0 [M+HGlu]+是由于母离子丢失1 分子葡萄糖醛酸(Glu,176)产生的。而节点m/z611.123 的分子离子峰为m/z611.122 9 [M+H]+,分子式为C26H26O17,其主要二级碎片为m/z479.081 6 [M+H-Ara]+、303.049 8[M+H-Ara-Glu]+,对比m/z611.16(峰81 即芦丁)及其二级碎片信息,因此节点m/z479.081 和节点m/z611.124 分别鉴定为槲皮素-3-O-β-D-葡萄糖醛酸(峰87)和槲皮素-3-O-β-D-葡萄糖醛酸-α-L-阿拉伯糖(峰77 即CO-10),经过SciFinder 查找验证,后者为山茱萸属植物中潜在的新化合物。类似地,节点m/z627.154 和m/z611.16(芦丁)也相关联,它产生的准分子离子峰为627.151 8 [M+H]+,其二级碎片为m/z481.095 0 [M+H-Rha]+、319.044 1 [M+H-Rha-Glc]+,它和m/z611.16(芦丁)丢失相同的中性碎片片段 [-Rha-Glc],但是具有不同的苷元母核,节点m/z627.154 的主要二级碎片离子为m/z319.044 1,表明其苷元为杨梅素,因此节点m/z627.154 被鉴定为杨梅素-3-O-β-D-葡萄糖-α-L-鼠李糖(峰73 即CO-8),经过SciFinder查找验证,该化合物为山茱萸属植物中潜在的新化合物。同理,节点m/z495.076、479.081、463.086相关联,它们丢失相同的中性碎片片段葡萄糖醛酸,但具有不同的苷元母核。其中节点m/z479.081 前面已经描述,为已知化合物槲皮素-3-O-β-D-葡萄糖醛酸。节点m/z495.076 的二级质谱图中形成了m/z319.045 6 的基峰,表明其苷元为杨梅素;节点m/z463.086 的二级质谱图中形成了m/z287.054 4 的基峰表明其苷元为山柰酚,结合其二级碎片信息,节点m/z495.076、463.086 分别被鉴定为杨梅素-3-Oβ-D-葡萄糖醛酸(峰72 即CO-7)、山柰酚-3-O-β-D-葡萄糖醛酸(峰94 即CO-12),经过SciFinder 查找验证,两者均为山茱萸属植物中首次鉴定到。
3.3 山茱萸及其不同炮制品差异性分析结果
3.3.1 山茱萸及其不同炮制品之间差异化学成分的筛选与鉴定 根据“2.2”项下的检测条件,对山茱萸及其不同炮制品的临床水煎煮液的供试品溶液测样分析。经过预处理后的数据矩阵进行一系列的多元统计分析,采用正离子模式山茱萸及其炮制品样本进行PCA 模式识别,得到PCA 的得分图(图6-A)。利用PCA 模型生成得分散点图可知,山茱萸、盐制山茱萸和酒萸肉分别集中于2 个不同的区域,且在主成分t[1]方向有明显区分,表明山茱萸炮制前后在化学成分种类及含量上差异明显。

图6 山茱萸及其炮制品的PCA (A) 和PLS-DA (B) 的得分图及PLS-DA 的载荷图 (C) 和VIP 图 (D)Fig. 6 PCA score chart (A), PLS-DA score chart (B), PLS-DA loading plot (C), and VIP plot of PLS-DA (D) of Corni Fructus and its processed products
PCA 通过对样本整体水平的评估,在一个低维空间内用最少的成分数量描述最大的变异量,既可反映数据的原始状态,又反映组内和组间差异。而PLS-DA 是基于降维的多维向量分析方法,可预设分类,尽量去除未控制变量对数据分析的影响,二者相互补充。PLS-DA 得分图显示生山茱萸、酒萸肉和盐制山茱萸能够较好的分离,各自聚类(图6-B~D)。同时模型参数显示为R2X=0.858,R2Y=0.92,Q2=0.763,说明模型的拟合准确性及模型的内部验证预测能力较好;采用200 次置换检验对模型进行验证。结果显示R2和Q2回归线与左边纵轴相交(R2-intercept=0.575;Q2-intercept=−0.189),Q2在y轴上的截距小于0,说明模型没有过拟合。PLS-DA 的VIP 得分图见图6-D。本研究选择VIP值大于1.5 的变量作为差异变量。正离子模式下共筛选出226 个变量。通过精确质量数测定与MS/MS分析,并与文献报道相比较,及与对照品保留行为及质谱数据进行比对,共鉴定出32 个差异性成分(表2),分别为14 个环烯醚萜类化合物、9 个芳香酚酸类化合物、2 个鞣质类成分、3 个黄酮类化合物和4 个其他类成分。

表2 山茱萸及其炮制品的32 个化学标记物 (VIP>1.5)Table 2 32 chemical markers from Corni Fructus and its processed products (VIP > 1.5)
3.3.2 主要差异性成分在山茱萸及其不同炮制品的相对含量 在上述差异化合物中,经过查阅相关文献,目前文献报道[27-28]比较多的山茱萸药效成分主要有莫诺苷、马钱苷、7-O-没食子酰-D-景天庚酮糖、5-羟甲基糠醛、獐牙菜苷、没食子酸、咖啡酰酸单甲酯、逆没食子酸。其中补肝益肾的主要活性成分为马钱苷[27]、莫诺苷[28]、7-O-没食子酰-D-景天庚酮糖[29]、5-羟甲基糠醛[30]和逆没食子酸[31]。研究表明与中药功能属性密切相关的化学物质,作为反映中药安全性和有效性的标示性物质进行质量控制更为合适。因此本研究通过不同样品中差异成分在质谱检测中的响应度(即强度)来初步计算衡量差异性成分的相对含量,着重分析与山茱萸功能属性密切相关的差异性化合物在不同炮制品中的相对含量(图7)。

图7 山茱萸及其炮制品典型化学标记物的相对含量Fig. 7 Relative contents of typically chemical markers of Corni Fructus and its processed products
可以看出,经过炮制后,5-羟甲基糠醛、没食子酸和逆没食子酸的含量都显著增加,其中5-羟甲基糠醛具有非常明显的保肝益肾作用,逆没食子酸具有抗糖尿病、保护肝肾功能的功效[31],这可能跟山茱萸炮制后温补肝肾的作用增强有关,临床主要用于滋补方剂。经炮制后7-O-没食子酰-D-景天庚酮糖、莫诺苷、苹果酸含量显著降低,可能与炮制过程促进它们分解有关。其中莫诺苷具有抗休克与固虚脱的作用,苹果酸抗血栓作用,所以这成分的变化可能对其炮制后敛汗固脱作用减弱有关。对于獐牙菜苷和马钱苷,酒制品含量相比于生品略微降低了,但盐制品比生品略增加,可能是因为盐制条件有助于提高它们的溶解度。由此可见,上述山茱萸主要差异性活性成分含量变化可能是炮制过程中不同山茱萸炮制品药效改变的物质基础。
4 讨论
本研究采用UPLC-Q-TOF-MS/MS 技术结合GNPS 分子网络技术系统地分析了山茱萸水煎液的化学成分,鉴定了117 个化合物,其中12 个首次从山茱萸中分析得到,进一步明确了山茱萸临床应用的化学物质基础。同时采用UPLC-Q-TOF/MS 结合多元统计分析方法对山茱萸、酒制山茱萸和盐制山茱萸进行差异物分析,筛选了32 个化学差异物。此研究不仅丰富了山茱萸化学物质基础,还初步明确了山茱萸炮制后药效成分改变的物质基础,为后续药效物质基础研究提供详实的物质基础。
利益冲突所有作者均声明不存在利益冲突

