红景天苷对Lewis 肺癌小鼠恶性胸腔积液生成的影响
凡 瑾,王松海,刘 楠,陈 捷*
(1.陕西中医药大学,陕西 咸阳 712046;2.陕西省中医医院肿瘤科,西安 710002)
肺癌(lung cancer)是世界上最常见的癌症之一,也是导致癌症相关死亡的主要原因,每年估计有2 200 万新发病例和179 万例死亡,在我国发病率及死亡率亦居首位[1]。恶性胸腔积液(malignant pleural effusion,MPE)指胸膜原发或继发的恶性肿瘤,在所有癌症患者中发病率高达15%,且随癌症患病率的上升和预期寿命的延长而增加,其中肺癌和乳腺癌占所有恶性胸腔积液的50%~65%[2-3],常引起呼吸困难、咳嗽等症状。由于肺癌并发MPE 多为晚期肿瘤患者,机体状态差,临床多以支持治疗为主,整体疗效较差。
近年来,中医药疗法在肿瘤治疗中发挥着巨大的作用,红景天是景天科红景天属植物,具有益气扶正、滋阴养血、清燥润肺等功效,红景天苷(salidroside,Sal)是其主要活性成分,研究发现Sal 具有抗氧化、抗疲劳、抗肿瘤、抑制肿瘤血管新生等多重作用[4-8]。本课题组通过临床观察发现大株红景天注射液对临床MPE 患者恶性胸水的产生具有明显的抑制作用,具体的机制可能与局部胸水中血管内皮生长因子(vascular endothelial growth factor,VEGF)的抑制有关,导致胸膜血管生成减少,血管通透性降低,从而抑制MPE 的产生。因此本次研究通过小鼠肺癌胸膜转移MPE模型,同时给予Sal 或Sal 联合顺铂胸腔注射并检测其相关指标变化,为Sal 的临床应用提供实验依据。
1 材料与方法
1.1 实验动物 实验小鼠购自第四军医大学实验动物中心,60 只C57BL/6 小鼠,雌雄各半,鼠龄8 周,体质量20 g,饲养在SPF 级环境下。
1.2 实验药物 Sal (HPLC 法检测纯度>98%,CAS:82373-94-2),购自四川维克奇生物科技有限公司; 注射用顺铂(冻干型)(齐鲁制药有限公司,批号:1K0574B02)。实验经过动物伦理委员会审查,伦理审查编号:[(2021)动物伦审第(01)号]。
1.3 主要试剂 小鼠Lewis 肺癌瘤株GFP-LLC 细胞,上海研生实业有限公司提供。DMEM 培养基、胎牛血清购自Gibco 公司。兔抗大鼠VEGF 抗体(一抗)购自abcam(ab150375)公司, Beta-actin 抗体(一抗)购自abcam(ab8227)公司, 辣根过氧化物酶标记的山羊抗兔IgG 的抗体(二抗)购自北京中杉(ZB-20301)公司。人肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)购自武汉赛培生物(批号:SP10205);低氧诱导因子-1α(hypoxia inducible factor--1α, HIF--1α)购自苏州卡尔文生物科技有限公司(批号:E20181118A)。
1.4 细胞培养 GFP-LLC 细胞系培养于小牛血清的高糖DMEM 培养基中(100 IU/mL 青霉素、100 IU/mL链霉素)CO25%,37℃的孵箱里培养。每3日传代1次,取长势良好对数期的细胞进行下一步操作,通过细胞板计数将细胞制成浓度为每毫升5.0×106个的细胞混悬液。
1.5 小鼠模型制备及分组 实验动物选择小鼠,将GFP-LLC 细胞制成浓度约每毫升2.5×106个(用PBS调整浓度)的混悬液。首先,将小鼠胸前区皮肤用碘伏进行消毒;其次,将制备好的LLC 细胞悬液用1 mL 注射器吸取并注入小鼠右侧腋中线的胸腔中,约平第6 肋间隙,每只小鼠接种约0.2 mL 的细胞悬液。注射14 d 后CT 检查表明建模成功。
选取40 只小鼠,每组8 只,进行如下处理。l)正常组:正常未加任何实验C57BL/6 小鼠,胸腔注射0.9% NaCl 0.4 mL,每日1 次;2)模型组:在造模成功的基础上,胸腔注射0.9% NaCl 0.4 mL,每日1 次;3)Sal 组:在造模成功的基础上,皮下注射Sal(Sal 50 mg/kg),每日1 次;4)化疗组(DDP 组):在造模成功的基础上,胸腔注射顺铂5 mg/kg,隔3 日1 次;5)Sal+DDP 组: 在造模成功的基础上,给予红景天苷每日1 次和顺铂隔 3 日 1 次(Sal 50 mg/kg +5 mg/kg)。 连续给药2 周。第 15 天,颈椎脱臼法处死后立即解剖取材备用。
1.6 观察指标 MPE 体积测量及相关样本的收集:实验处理结束后用乙醚麻醉各组小鼠,将小鼠仰卧位在解剖板上固定,小鼠胸部皮肤碘伏消毒,依次切开小鼠胸壁、胸膜等结构,记录各组小鼠胸水性状,并用 1 mL 注射器收集胸水,后测量每只小鼠的胸水量。
MPE 样本的处理:将各组收集的小鼠胸水分别放于1.5 mL 的EP 管里,再加入3.8%的抗凝剂枸椽酸钠,抗凝剂的量约为胸水的1/9,并快速放入冰中冷冻。再放在4℃离心机中以2 500 rpm 离心10 min,取上清,并保存于-70 ℃冰箱。收集胸膜、肺、纵隔肿瘤组织,4%甲醛固定,-80 ℃保存的标本备用。
生存周期计算:实验结束后统计21 d 内各组小鼠存活情况,计算每组小鼠生存周期。
胸壁转移瘤计数:由2 名实验者分别独立的在解剖显微镜下观察各组MPE 小鼠模型胸壁上癌瘤个数,如果转移瘤融合成团块则计为1个,后求其平均个数。
转移瘤重测量:由2 名实验者分别独立在解剖显微镜下完整剥离各组MPE 小鼠胸壁上的转移瘤,在称重记录后快速将标本放在液氮中冻存备用。
通过酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)检测MPE 中HIF-1α、TNF 蛋白的表达水平;实时荧光定量逆转录PCR 技术(real-time reverse transcription-PCR,Real-time RT-PCR)、蛋白质印迹法(Western blot,WB)检测胸水中VEGF 的表达水平。
1.7 统计学方法 采用SPSS 15.0软件进行数据分析,定量资料取3 个独立实验的平均值,用均数±标准差(±s)表示,单因素方差分析(ANOVA)进行统计分析。检测各组平均值之间的差异使用Dunnett' s 检验。P<0.05 认为差异具有统计学意义。
2 结果
2.1 各组MPE 小鼠生存时间比较 与模型组比较,Sal 组、DDP 组生存时间虽有延长,但差异无统计学意义(P>0.05),而Sal+DDP 联合组生存时间明显延长,且差异有统计学意义(P< 0.01),见表1 。
表1 各组MPE 小鼠生存时间比较(± s,n = 8)

表1 各组MPE 小鼠生存时间比较(± s,n = 8)
注:与模型组比较,## P <0.01
组别 生存期/d 生命延长率/%正常组 >21模型组 10.50±1.93 Sal 组 14.13±1.64 34.57 DDP 组 12.63±1.60 20.29 Sal+DDP 组 18.38±0.74## 75.05
2.2 各组MPE 小鼠胸腔积液体积、胸壁转移瘤个数及转移瘤质量的比较 经治疗后,与模型组比较,各组小鼠MPE 积液体积,胸壁转移瘤数目,转移瘤质量均有所减轻,且差异有统计学意义 (P<0.01),见表2。
表2 各组MPE 小鼠胸腔积液、胸壁转移瘤个数及转移瘤质量的比较(± s,n = 8)

表2 各组MPE 小鼠胸腔积液、胸壁转移瘤个数及转移瘤质量的比较(± s,n = 8)
注:与模型组比较,## P <0.01
组别 胸腔积液/μL 转移瘤个数/个 转移瘤质量 /mg正常组 0 0 0模型组 1 168±146 9.6±1.6 930.4±53.1 Sal 组 493±36## 5.2±0.7## 489.3±88.6##DDP 组 784±63## 4.7±0.7## 272.5±59.3##Sal+DDP 组 380±54## 3.6±1.1## 194.1±40.8##
2.3 各组MPE 小鼠血清中TNF-α、HIF-1α 水平比较 经治疗,与模型组比较,实验组各组外周血中TNF-α 水平升高,HIF-1α 水平降低,且差异有统计学意义(P< 0.05),见表3。
表3 各组MPE 小鼠血清中TNF-α、HIF-1α 水平比较(± s,n = 8)
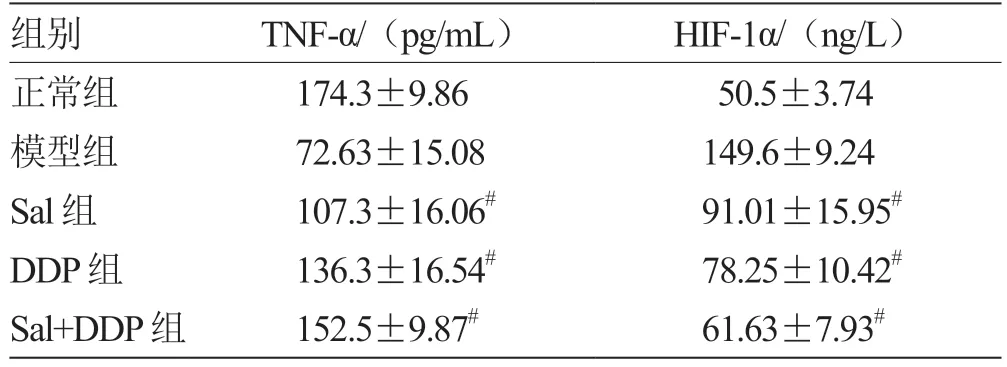
表3 各组MPE 小鼠血清中TNF-α、HIF-1α 水平比较(± s,n = 8)
注:与模型组比较,# P <0.05
组别 TNF-α/(pg/mL) HIF-1α/(ng/L)正常组 174.3±9.86 50.5±3.74模型组 72.63±15.08 149.6±9.24 Sal 组 107.3±16.06# 91.01±15.95#DDP 组 136.3±16.54# 78.25±10.42#Sal+DDP 组 152.5±9.87# 61.63±7.93#
2.4 各组MPE 小鼠胸腔积液中VEGF 蛋白表达情况 通过Western blot 检测,胸腔积液中VEGF 蛋白表达情况,见图1。通过Real-time RT-PCR 检测,与模型组比较,各组胸腔积液中VEGF mRNA 水平显著降低,差异有统计学意义,其中DDP 组、Sal+DDP 组下降更明显(P< 0.01),见表4。
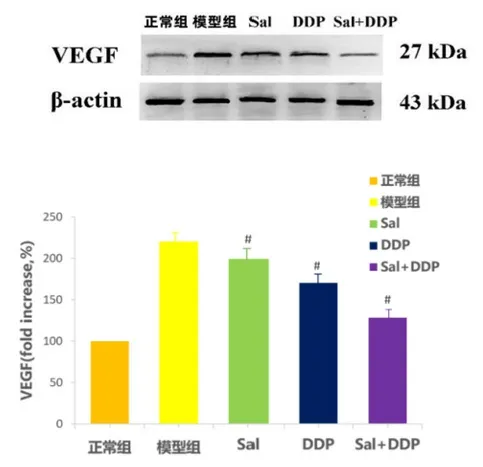
图1 各组MPE 小鼠胸腔积液中VEGF 蛋白表达情况(n = 8)
表4 Real-time RT-PCR 法检测各组MPE 小鼠胸水中VEGF mRNA 相对表达量(± s,n = 8) μg/mL

表4 Real-time RT-PCR 法检测各组MPE 小鼠胸水中VEGF mRNA 相对表达量(± s,n = 8) μg/mL
注:与模型组比较,# P <0.05,## P <0.01
组别 VEGF mRNA正常组 100±0模型组 220.30±16.94 Sal 组 199.40±17.70#DDP 组 170.50±20.42##Sal+DDP 组 128.10±10.38##
3 讨论
MPE 是原发性胸膜肿瘤或肿瘤转移至胸膜最常见的临床症状,引起MPE 最常见的肿瘤包括:肺癌、乳腺癌、卵巢癌、淋巴瘤等[9-10]。近年来由于恶性肿瘤的发病率逐渐升高,MPE 的发生率也有逐渐上升的趋势。目前MPE 发病机制已由单一因素转向多因素共同致病,除了淋巴回流障碍,近年来研究表明,MPE 的形成还包括胸膜腔过表达血管活性因子导致的血管新生和血管通透性增高,肿瘤细胞与免疫细胞在胸膜腔局部相互作用形成利于MPE 生成的免疫微环境等学说[11]。MPE 具有增长速度快、量大、血性居多、难以控制的特点,常伴有乏力、胸痛、呼吸困难等症状,临床局部胸腔穿刺抽吸治疗后易反复发作,生存周期较差,1、3、6 个月病死率分别为50%、60%、82%,其中位生存期仅为3 ~12 个月[12]。目前,MPE 治疗方法虽然较多,比如胸膜固定术、导管引流术、胸腔灌注术,但总体有效率低,生存质量差,难以达到彻底治愈的目的[13-16]。因此,如何有效的缓解MPE 引起的相关临床症状并防止积液再次积聚是本病目前治疗的主要目标。中医药作为传统医学,在肿瘤晚期治疗方面具有创伤小、并发症少、不良反应轻的治疗特点,因此在MPE 的治疗中应用越发广泛。
红景天苷作为红景天的主要活性成分,不仅具有抗疲劳、抗氧化、抗衰老等生理调节作用,还具有抗炎、抗肿瘤、抗辐射作用,在心血管及呼吸系统疾病中应用广泛[17-18]。前期课题组通过临床观察发现静脉滴注红景天苷联合顺铂胸腔灌注可以抑制MPE 的产生,但是对于红景天苷如何抑制胸水产生,是否与减轻肿瘤血管通透性有关尚不明确。因此本次研究,拟从动物实验角度研究Sal 抑制MPE 产生的可能机制。
研究结果发现,与模型组比较,小鼠MPE 体积、胸壁转移瘤个数,转移瘤重量在Sal 组、DDP 组和Sal+DDP 组均较模型组明显减少,且联合组小鼠生存周期明显延长,说明Sal 和DDP 对MPE 和肿瘤生长均具有一定抑制作用(P<0.05)。且Sal+DDP 联合治疗后,小鼠MPE 体积、胸壁转移瘤个数、转移瘤重量和生存期的改善情况较Sal 组、DDP 组更加明显,提示Sal 在抑制MPE 生成、抗肿瘤等方面可与顺铂产生协同作用。
VEGF 是促进肿瘤血管生成的重要因子,对于肿瘤的发生、发展及预后都有重要意义。目前已知VEGF 调节血管通透性的作用是组胺的50 000 倍。有研究表明,VEGF 引起MPE 的产生可能与VEGF 增加小静脉、微静脉通透性,使得纤维蛋白、血浆蛋白外渗导致血管内外渗透压的失衡有关[19]。随着肿瘤的进展,肿瘤体积不断增大,对于氧气的需求也必然增加,而肿瘤细胞内相对杂乱无序的病理性新生血管不能满足肿瘤生长所需的氧气,从而使得肿瘤内长期处于低氧乏氧状态,低氧状态又进一步刺激肿瘤细胞,使其通过旁分泌的方式大量分泌HIF-1α,而HIF-1α 可以刺激肿瘤细胞分泌VEGF-A,VEGF-A 可以与血管内皮细胞上的VEGFR-2 受体结合,诱导MPE 的产生[20]。实验结果表明,与模型组比较,Sal 组、DDP 组和Sal+DDP组小鼠HIF-1α 明显下降,VEGF 水平较模型组显著降低,联合组下降水平更加显著(P<0.01),其可能与HIF-1α-VEGF 分子通路抑制相关。
TNF 是一种主要由淋巴细胞产生的核转录因子,正常生理下主要参与机体炎症反应、免疫调控、诱导细胞凋亡等[21]。TNF 主要分为TNF-α 和TNF-β 两类,TNF-α 是目前临床发现最强的抗肿瘤细胞活性因子,具有协同巨噬细胞活性以及其他免疫细胞活性的作用,从而提高机体杀灭肿瘤细胞的能力。TNF-α 还可以直接诱导肿瘤血管内皮细胞凋亡、直接损伤血管内皮,导致血管内皮完整性损坏,血栓形成,阻止肿瘤血供,最终导致肿瘤坏死凋亡[22]。通过ELISA 检测TNF-α 水平,我们发现与模型组比较,Sal 组、DDP 组和Sal+DDP组小鼠TNF-α水平明显上升,而MPE体积、转移瘤数量及重量明显减少,这可能与抗肿瘤活性因子TNF-α 的激活密切相关。
综上所述,中药Sal 单用或Sal 联合顺铂均可抑制MPE 的产生,减少胸壁转移瘤个数及重量,延长小鼠生存时间,且联合应用时作用更显著,其产生作用的机制可能与HIF-1α-VEGF 分子通路抑制及抗肿瘤活性因子TNF-α 的激活相关,为临床使用红景天制剂抑制MPE 的产生提供了一定的实验依据。但由于本实验设计的局限性,后续应深入研究不同浓度Sal、联用VEGF 激动剂或TNF-α 抑制剂对MPE 小鼠的影响。

