奶牛养殖场环境中耐药基因blaNDM的分布和传播特性分析
马 妍,陈帅印,丁 冬,王 亚,朱静媛
1)郑州大学公共卫生学院环境卫生学教研室 郑州 450001 2)郑州大学公共卫生学院流行病学教研室 郑州 450001
近些年来,细菌的耐药性对人类健康产生严重威胁[1]。集约化养殖场因为动物养殖密度大、抗生素使用管理不规范,加上微生物分布密度高、营养条件充沛,使得抗生素抗性基因的水平转移更为容易,从而成为热点环境之一[2]。大约75%的抗生素会在动物养殖过程中随着动物尿液和粪便排出体外,然后通过排放废水、施用粪肥等途径进入自然环境,造成环境污染[3-5]。养殖场中残留的抗生素会加速耐药细菌和抗生素抗性基因的产生,可以通过粪口途径或呼吸道吸入影响人类的健康[6]。随着细菌耐药形势日趋严峻,人们逐渐意识到环境、动物和人类的关系密不可分[7]。强调多学科、多部门之间相互协作与交流的“同一健康”理念,是解决抗生素抗性的一个新策略[8]。
自2008年首次报道blaNDM-1基因以来,全球50多个国家和地区陆续分离出blaNDM阳性菌株[9]。目前,blaNDM基因是全球流行最广的碳青霉烯类耐药基因,可以随着优势克隆株快速传播,并赋予细菌对几乎所有β-内酰胺类抗生素的抗性[10-11]。动物源blaNDM阳性菌株已有报道[12-13],但是有关养殖场环境中blaNDM的分布尚不明确。本研究基于“同一健康”理念,同时考虑环境、动物及人群三大要素,分析了奶牛养殖场中blaNDM基因的分布情况,并对携带blaNDM基因的大肠杆菌的耐药情况进行调查,为养殖场的动物治疗指导用药提供科学依据,也为防止耐药基因的进一步传播提供科学参考。
1 材料与方法
1.1 研究样本2019年10月至2020年11月,从河南省焦作市某地2个奶牛养殖场共采集152份样本,其中气溶胶3份、牛鼻拭子40份(犊牛14份,育成牛10份,成年母牛16份)、牛粪便67份、工人咽拭子23份(一线工人10份,非一线工人13份)、工人粪便19份。
1.2 主要试剂LB肉汤购自上海生工生物工程有限公司; 琼脂粉、MH琼脂培养基、MH肉汤购自德国Sigma公司;麦康凯琼脂购自青岛海博生物科技有限公司;2×Taq PCR Master Mix试剂盒购自康为世纪生物科技有限公司;DNA Marker、琼脂糖、GoldenViewTM核酸染料购自北京博迈德基因技术有限公司;美罗培南(MER)、利福平及二甲基亚砜购自北京索莱宝生物科技有限公司;药敏纸片购自杭州滨和微生物试剂有限公司;引物合成及PCR产物测序由北京六合华大基因科技有限公司完成。
1.3 耐药基因blaNDM的检测使用QIAamp DNA Mini试剂盒(北京博迈德基因技术有限公司)提取牛鼻拭子、工人咽拭子及气溶胶样本中总DNA,使用天根粪便基因组DNA提取试剂盒提取粪便样本中总DNA。根据先前文献[14]的引物序列对样本中blaNDM基因进行检测。单个PCR反应在25 μL[2×Taq PCR Master Mix 12.5 μL,上下游引物(10 μmol/L)各1 μL,ddH2O 8.5 μL,DNA模板2 μL]的体系中进行。PCR反应条件:94 ℃预变性5 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸60 s,32个循环;最后72 ℃延伸 5 min。PCR产物经20 g/L琼脂糖凝胶电泳进行鉴定,在紫外凝胶成像仪中观察目的基因条带。
1.4 blaNDM阳性细菌的分离与鉴定取1 g粪便样本加到5 mL的无菌生理盐水中,涡旋混匀后静置5 min,取上清液接种于含2 mg/L的MER的琼脂培养基上,37 ℃孵育24 h后挑取单菌落检测blaNDM基因。纯化培养的blaNDM阳性细菌,通过革兰染色和细菌微量生化反应管进行初步鉴定。通过煮沸法提取细菌DNA,对16S rDNA(27F:5’-AGAGTTT GATCCTGGCTCAG-3’,1 492R:5’-CTCCAATCCG GACTACGACG-3’)进行PCR扩增,产物送北京六合华大基因科技有限公司进行测序,通过在线BLAST比对确定细菌种属。
1.5 系统进化群分群和多位点序列分型(multilocus sequence typing,MLST)试验参照文献[15],扩增分离出的blaNDM阳性大肠杆菌chuA、yjaA和Tsp E4.C2基因(引物序列见表1),按照分群标准将大肠杆菌进行系统进化群分群。以细菌DNA为模板,利用EnteroBase数据库中报道的大肠杆菌多位点序列分型的引物,扩增7个管家基因adk、fumC、gyrB、icd、mdh、purA和recA(引物序列见表1)。PCR扩增产物送至北京六合华大基因技术有限公司进行双向测序,利用DNAMAN软件对序列进行拼接和修正,然后将拼接的序列提交至网站(https://enterobase.warwick.ac.uk)中获得管家基因的序列号,根据等位基因,确定每株菌的ST型别,最后利用Mega X软件构建大肠杆菌ST型系统发育树。
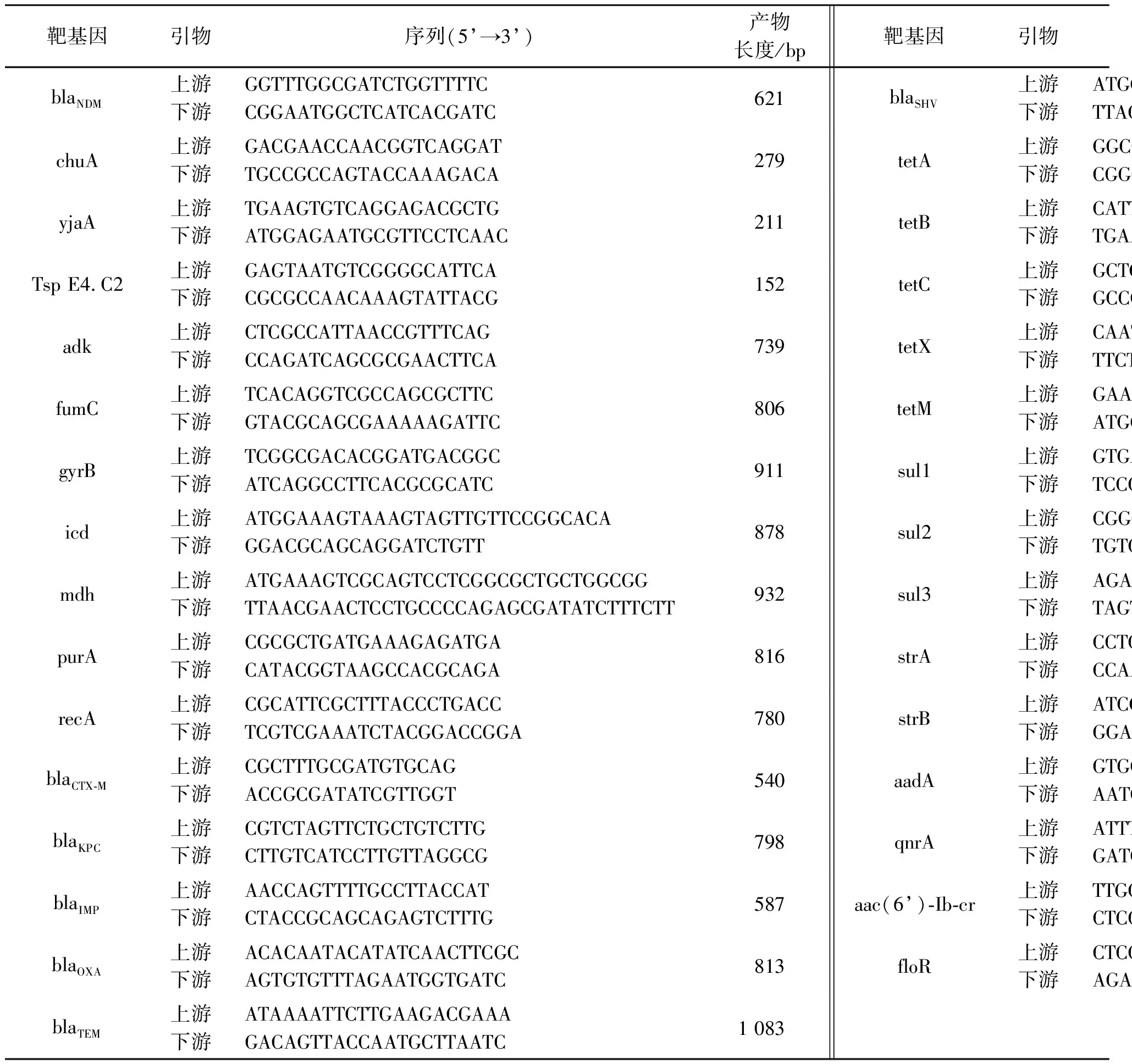
表1 引物序列及产物长度
1.6 耐药表型和耐药基因的检测采用药敏纸片法检测blaNDM阳性大肠杆菌对头孢他啶(CAZ)、头孢曲松(CTR)、头孢噻肟(CTX)、氨苄西林/舒巴坦(SAM)、氨曲南(ATM)、亚胺培南(IPM)、MER、庆大霉素(GEN)、 阿米卡星(AK)、环丙沙星(CIP)、诺氟沙星(NOR)、氯霉素(C)、复方新诺明(SXT)、米诺环素(MIN)、强力霉素(DO)和四环素(TE)等16种常用抗生素的敏感性。 实验操作如下:①挑取单个菌落于MH肉汤中培养,至OD600 nm约为1时将菌液稀释10倍。②取100 μL稀释好的菌液均匀涂抹在MH琼脂培养基上,用无菌镊子将药敏纸片贴于MH平板。③贴好药敏纸片的平板在 37 ℃下培养16~18 h后使用游标卡尺测量抑菌环大小。根据美国临床实验室标准协会2020年标准进行细菌的耐药表型鉴定,大肠埃希菌ATCC25922作为实验中的质控菌株。
实验选择常见的耐药基因(引物序列见表1)进行检测,包括超广谱β-内酰胺酶耐药基因(blaCTX-M)、碳青霉烯类耐药基因(blaKPC、blaIMP和blaOXA)、非ESBL基因(blaTEM和blaSHV)、四环素耐药基因(tetA、tetB、tetC、tetX和tetM)、磺胺类耐药基因(sul1、sul2和sul3)、链霉素/壮观霉素耐药基因(strA、strB和aadA)、氟喹诺酮类耐药基因[qnrA和aac(6’)-Ib-cr]和氟苯尼考耐药基因(floR)。 煮沸法获得细菌的DNA为模板,采用PCR方法检测blaNDM阳性大肠杆菌的上述各类耐药基因。使用20 g/L琼脂糖凝胶和GoldenViewTM核酸染料进行琼脂糖凝胶电泳,在紫外凝胶成像仪下观察目的基因的表达情况。
1.7 接合试验和质粒稳定性试验使用肉汤接合法验证blaNDM基因的转移,以blaNDM阳性大肠杆菌作为供体菌、大肠杆菌EC600作为受体菌进行接合试验。用新鲜无菌的LB肉汤分别将过夜培养的供、受体菌株的细菌悬液按1∶100(体积比)稀释,再将稀释后的供、受体菌株按1∶2(体积比)的比例混合,加到5 mL新鲜无菌的LB肉汤中37 ℃振荡培养4 h。用含2 mg/L MER和200 mg/L利福平的麦康凯琼脂培养基筛选blaNDM阳性接合子,通过PCR和Sanger测序验证接合子中blaNDM基因。使用微量肉汤稀释法检测MER对供、受体菌株及其接合子的最低抑菌浓度(MIC)。大肠杆菌ATCC25922为实验质控菌株。
根据之前的研究[16],将携带blaNDM基因的大肠杆菌及其接合子在无抗生素的LB肉汤中传代培养,每12 h取500 μL细菌悬液接种到新的LB肉汤中,记为1代,同时将50 μL细菌悬液涂布于麦康凯琼脂培养基,观察是否混入其他细菌。从麦康凯琼脂上随机抽取10个菌落,使用煮沸法提取细菌DNA,检测blaNDM基因,测定blaNDM阳性率。
1.8 统计学处理采用SPSS 21.0进行数据处理,应用χ2检验或Fisher精确概率法进行组间blaNDM基因检出率的比较,检验水准α=0.05。
2 结果
2.1 blaNDM基因的分布
2.1.1不同类型样本中blaNDM基因的分布 见表2。由表2可知,养殖场152份样本中共有54份携带blaNDM基因,样本总阳性率为35.5%。不同类型样本中blaNDM基因的阳性率差异无统计学意义(P=0.123)。

表2 不同类型样本中blaNDM基因的分布* 例(%)
2.1.2不同生长阶段动物鼻拭子中blaNDM基因的分布 见表3。由表3可知,blaNDM基因只在育成牛和成年母牛中有发现,在犊牛中未发现(P<0.001)。组间比较发现blaNDM基因在成年母牛的检出率要高于犊牛。

表3 不同生长阶段动物鼻拭子中blaNDM基因的分布* 例(%)
2.1.3一线与非一线工人咽拭子中blaNDM基因的分布 一线工人咽拭子blaNDM基因阳性检出率(60.0%,6/10)与非一线工人(53.8%,7/13)相比差异无统计学意义(P>0.999)。
2.1.4blaNDM阳性细菌的分离鉴定 工人和动物粪便中分离的大肠杆菌为blaNDM基因的主要细菌宿主。从粪便样本中一共分离出23株blaNDM阳性细菌,包括17株blaNDM-5阳性大肠杆菌(73.9%)、4株blaNDM-1阳性不动杆菌((17.4%)、1株blaNDM-5阳性粪肠球菌(4.4%)和1株blaNDM-5阳性芽孢杆菌(4.4%)。
2.2 系统进化群分群及MLST结果17株blaNDM-5阳性大肠杆菌属于系统发育群A群和B1群,其中B1群是优势群,占88.2%(15/17)(表4)。根据MLST结果,17株大肠杆菌属于3个ST型(ST48型和2个新ST型)。2个新的ST型编号为STn-1和STn-2,其中15株大肠杆菌为STn-1,另外2种ST型各有1株(表4)。17株blaNDM-5阳性大肠杆菌分为两个大分支,其中EC11单独一支,另外16株blaNDM-5阳性大肠杆菌为一支。不同分支之间的相互距离较近(图1)。
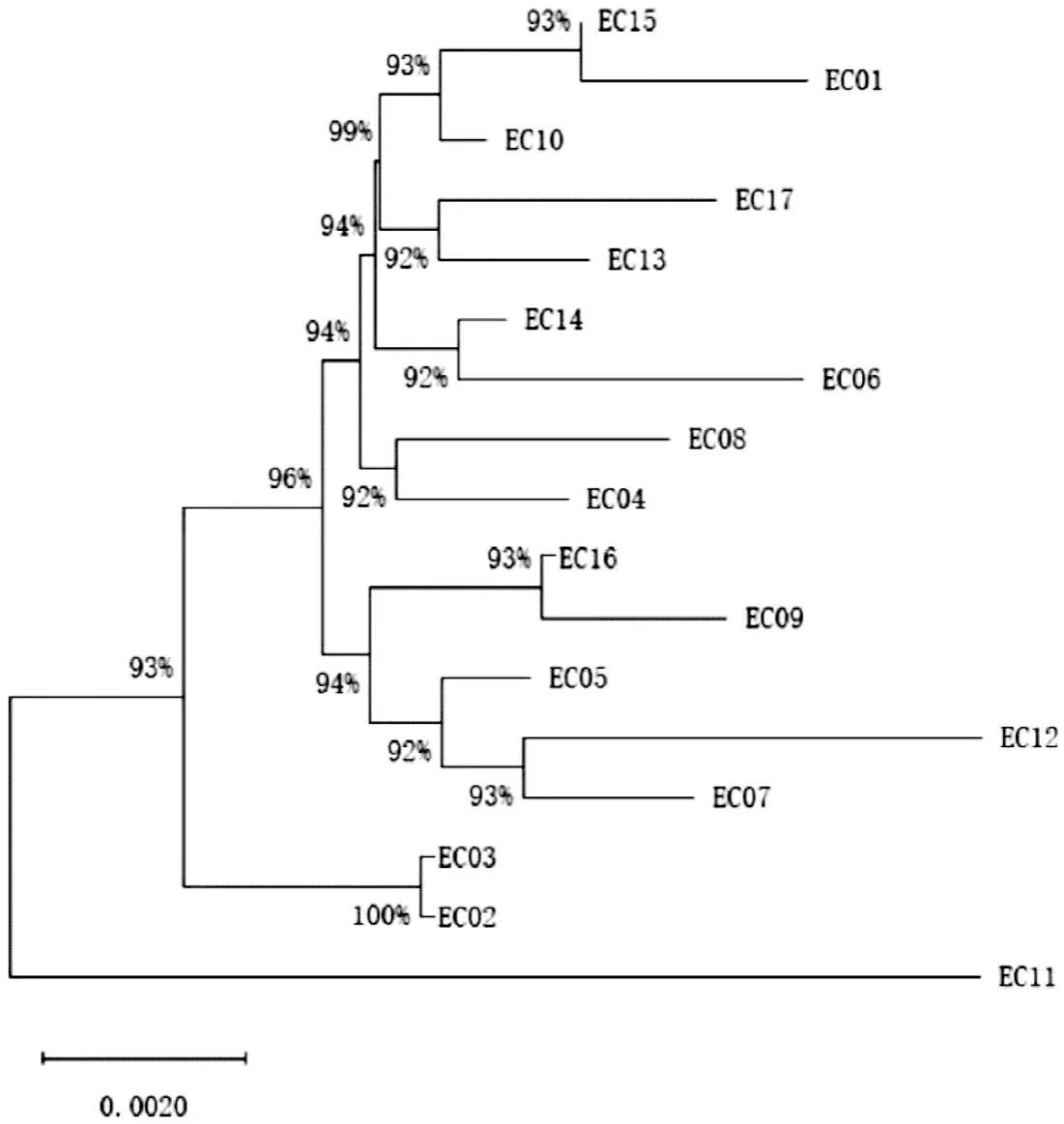
图1 17株大肠杆菌的系统进化树

表4 大肠杆菌信息、系统进化群、ST型及耐药表型
2.3 耐药表型和耐药基因的检测分离的blaNDM-5阳性大肠杆菌存在多重耐药。17株携带blaNDM-5基因的大肠杆菌对CAZ、CTR、CTX、IPM、MER、SAM、GEN、CIP、C、SXT和TE的耐药率最高,为100.0%;对NOR、DO和ATM的耐药率分别为94.1%(16/17)、88.2%(15/17)和5.9%(1/17);对AK、MIN高度敏感,耐药率为0。详见表4。
8类20种耐药基因的检测结果见图2。由图2可知,17株blaNDM-5阳性大肠杆菌中检出了8类15种耐药基因,其中 11种耐药基因的检出率在80%以上,包括blaCTX-M(100.0%)、blaTEM(100.0%)、blaSHV(94.1%)、tetA(94.1%)、tetB(94.1%)、sul1(88.2%)、 sul3(94.1%)、strA(94.1%)、strB(100.0%)、aadA(100.0%)和floR(100.0%)。耐药基因blaOXA、tetM、sul2和aac(6’)-Ib-cr 的检出率分别为5.9%、5.9%、58.8%和5.9%。

灰色代表基因存在,白色代表基因缺失
2.4 接合实验和质粒稳定性17株大肠杆菌质粒上携带的blaNDM基因全部通过接合试验成功转移至受体菌株EC600中(图3)。虽然接合子对于MER的MIC值较供体菌株降低,但与受体菌株相比,对MER的MIC值提高了4~16倍(表5)。供体菌和接合子经过无抗生素的LB肉汤中连续培养36代以后,质粒仍能在野生菌和受体细菌中稳定存在。

图3 部分接合子blaNDM基因的琼脂糖凝胶电泳图

表5 供体菌和接合子对于MER MIC值的变化
3 讨论
本研究从养殖场的饲养环境、动物和工人中都检测到了blaNDM基因,说明blaNDM基因在养殖场中普遍分布,并且blaNDM基因可能在环境、动物和人群之间相互传播。本研究的养殖场blaNDM基因样本总阳性率为35.5%,远高于在中国其他地区的肠道标本中blaNDM基因总阳性率(0.41%)[17],说明本研究的养殖场中耐药基因的污染不容乐观,需要加强管理和控制养殖场抗生素的使用。本研究结果显示blaNDM基因在养殖场中不同类型样本中的分布差异无统计学意义,这可能与所有样本来源于同一场地和动物开放式养殖的方式有关。blaNDM基因在成年母牛的检出率高于犊牛。相关研究[18]发现,学生在养殖场中经过3个月的职业暴露后会影响其肠道微生物组,与养殖场工人体内的耐药细菌和抗生素抗性基因广泛共享,说明养殖场的暴露时长可能是影响抗生素抗性基因检出率的重要原因之一。一线工人与非一线工人blaNDM基因的分布差异无统计学意义,可能与选择的养殖场采用开放式牛舍进行养殖,通风性好,一线与非一线工人的宿舍位于养殖场内,养殖场工作人员在养殖场的工作时间普遍超过3个月等原因有关。大肠杆菌为blaNDM基因的主要细菌宿主,这与其他报道相似[19]。
大肠杆菌的致病性与其系统进化群密切相关,A群和B1群是条件致病菌[20]。本研究中分离出的17株blaNDM-5阳性大肠杆菌分布于A群和B1群,为条件致病性菌。MLST可以在一定程度上反映细菌的生物学进化,ST分型可能与耐药基因有关[21]。本研究MLST分析结果表明17株大肠杆菌属于3个ST型(ST48、STn-1和STn-2),与其他地区[22]报道的大肠杆菌的流行ST型不同:在山东的奶牛粪便中分离的171株大肠杆菌中发现8种ST型,包括ST58、ST5、ST23、ST661、ST1146、ST172、ST155和ST3096。
本研究结果显示分离出的大肠杆菌均为多重耐药菌株,对头孢类、碳青霉烯类、氟喹诺酮类、磺胺类药物的耐药率均在90%以上,可能与养殖场长期使用抗生素有关。同一类药物中,细菌对不同的药物的敏感性不同,例如同属氨基糖苷类的GEN(100.0%)和AK(0%)的耐药率相差悬殊,可能与养殖场长期使用单一抗菌药物有关,这与梁圆等[23]在犊牛源的大肠杆菌的耐药结果相似。本研究从17株大肠杆菌中检测出15种耐药基因,其中11种耐药基因的检出率超过80%,耐药表型与耐药基因的检测结果基本符合。从养殖场动物和人体粪便样本中分离出的6株blaNDM-5阳性大肠杆菌具有相似的耐药表型、耐药基因和 ST 序列类型,且同源性较高,提示在养殖场动物和工人中可能存在交叉感染。接合试验和质粒稳定性试验结果表明,不同ST型大肠杆菌的blaNDM-5基因可以通过质粒的接合试验转移至受体菌中进行表达,并且携带blaNDM-5的质粒可以在宿主细菌中稳定存在。
综上所述,blaNDM基因在养殖场中流行率较高,且携带blaNDM-5基因的大肠杆菌多重耐药情况严重。因此,应加强养殖场blaNDM基因及blaNDM阳性菌株耐药性的监测,采取合理的措施减少耐药基因的传播。 虽然目前关于抗生素抗性基因的检测常使用粪便样本,但检测咽拭子和鼻拭子样本对于养殖场耐药基因的防控具有一定的指导意义。抗生素的抗性基因可能会通过气溶胶这一环境介质影响养殖场工人和动物口咽部耐药基因的定植,对人类及动物的健康产生一定的影响[24]。
本研究也存在一定的局限,如研究的样本量相对较少且不均衡,可能会导致一定的偏倚,无法真实反映养殖场环境中blaNDM的分布情况;对携带blaNDM基因的菌株仅仅研究了其分型和耐药表型。后期课题组将通过细菌全基因组测序进一步分析该基因的遗传环境;进一步进行大样本研究,并进行相关的纵向研究,以评估长时间在养殖场环境中暴露对工人的暴露风险。

