多房棘球蚴原头节感染后阻断PD-1对巨噬细胞吞噬功能的影响
张 涛,张耀刚,杨紫晗,沈银红,马艳艳
泡型包虫病(Alveolar echinococcosis,AE)是由多房棘球蚴幼虫感染引起的容易被忽视的人兽共患寄生虫病。青藏高原地区是泡型包虫病的高发区,青藏高原包虫病平均检出率是非青藏高原地区的10倍[1-2]。近年来研究发现,多房棘球蚴能在具有免疫能力的宿主体内长期存活并大量繁殖,从而使其实现免疫耐受[3-7],但其具体机制尚不明确。负性协同刺激分子程序性死亡分子1 (programmed death 1,PD-1)通过抑制或下调T细胞活化和IL10等细胞因子的产生增强机体对病原体的耐受,从而引起免疫抑制[8-9]。本研究通过多房棘球蚴原头节(Protoscoleces,PSCs) 感染阻断PD-1分析其对巨噬细胞吞噬功能的影响,明确PD-1在泡型包虫病患者中免疫耐受的作用,为进一步揭示多房棘球蚴致宿主免疫耐受的机制提供依据。
1 材料与方法
1.1 临床组织样本收集 根据术后AE患者肝脏组织的病灶定位,选取小于病灶周围0.5 cm处肝脏组织为病灶近旁肝脏组织 (close liver tissue from the lesion,CLT);同时采集超过病灶2 cm以上的肝脏组织为病灶远端肝脏组织(distant liver tissue from the lesion,DLT)。收集病灶近旁肝脏组织和病灶远端肝脏组织置于10%的中性甲醛中固定过夜,用于病理切片。该研究通过青海大学附属医院伦理批准(P-SL-2019033),并在中国人类遗传资源备案。所有AE患者均签署知情同意书。
1.2 细胞系 RAW264.7细胞购自中国科学院上海细胞库,培养在含有10%FBS 的DMEM培养基中,置于37 ℃,5%的CO2培养箱中。
1.3 主要试剂及仪器 DMEM购自Gibco公司,胎牛血清购自上海达特希尔生物科技有限公司,信迪利单克隆抗体购自信达生物制药有限公司,CD68抗体购自美国Novus biologicals公司,PD-1抗体和CD47抗体购自武汉三鹰生物技术有限公司。细胞成像微孔板检测为美国伯腾公司产品,全景组织细胞定量分析系统为奥地利公司产品。
1.4 多房棘球蚴原头节的分离与培养 将成功感染多房棘球蚴的长爪沙鼠异氟烷麻醉后,固定于解剖台上,腹部毛发碘伏消毒后,取正中切口,充分暴露腹腔内的多房棘球蚴病灶,无菌剪刀和止血钳钝性分离病灶与腹腔之间的黏连,将病灶摘除放置无菌培养皿中,PBS反复冲洗直至无血液残留。用无菌刀片将病灶剁碎后经80目和300目的筛网过滤后,加入含有20%FBS,5‰青霉素/链霉素的DMEM培养基中制成多房棘球蚴原头节混悬液。抽取10 μL的混悬液置于显微镜下进行观察,存活的原头节可活动,原头节活力大于85%为制备成功。
1.5 细胞分组 巨噬细胞与PSCs按照1∶500的比例进行共培养,共培养时间分别为24 h、48 h和72 h。分组为:对照组、共培养24 h组、共培养48 h组、共培养72 h组。并给予1.5 mg/mL的信迪利单克隆抗体处理巨噬细胞后与PSCs共培养。
1.6 巨噬细胞吞噬实验 将巨噬细胞与PSCs共培养在6孔板中,按照每1×105个巨噬细胞与2 000个PSCs共培养24 h、48 h和72 h后,每孔中加入1×106个带EGFP标记的大肠杆菌(MOI=10∶1),37 ℃孵育1 h。弃掉培养基,PBS洗涤3次去除胞外的大肠杆菌。每孔中加入500 μL的DAPI,室温孵育15 min,PBS洗涤5次后,每孔中加入500 μL的PBS,Biotek Cytation5拍照。使用Gen5 Image Prime 3.05软件进行分析。
1.7 免疫组织化学染色法 肝脏切片依次经过二甲苯、无水乙醇、95%酒精、80%酒精、蒸馏水的脱蜡和水化,3%双氧水去除内源性过氧化物酶,柠檬酸和柠檬酸钠缓冲液抗原修复,5%BSA 孵育。配置CD68抗体(1∶200, Novus biologicals)稀释液,滴加抗体稀释液覆盖切片组织,4 ℃过夜。滴加二抗稀释液,室温孵育1 h。依次滴加DAB显色液和苏木素染料,自来水冲洗,梯度酒精脱水,二甲苯透明,中性树胶封片。
1.8 Western blot RIPA裂解液提取总蛋白,配置上样体系 (样本蛋白总量为10 mg,上样体积为15 μL),沸水浴煮蛋白8 min。上样体系加入至凝胶胶孔中,恒流60 mA,电泳约1.5 h,结束电泳。将“三明治”放入转膜槽中,倒满转膜缓冲液,将转膜槽置于冰中,恒流 180 mA转膜 2.5 h。10%脱脂奶粉室温封闭。PBST洗膜后,加入PD-1 (1∶1 000, Proteintech) 和CD47 (1∶1 000, Proteintech) 抗体稀释液4 ℃孵育过夜。PBST洗膜后,二抗孵育;滴加适量的ECL工作液在膜上,拍照保存。
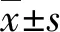
2 结 果
2.1 巨噬细胞在AE患者肝脏组织中的分布 通过免疫组织化学使用CD68标记巨噬细胞分析巨噬细胞在AE患者肝脏组织CLT和DLT中的分布,结果见图1。AE患者术后肝脏组织中CLT中的巨噬细胞明显高于DLT(t=188.0,P<0.001),提示巨噬细胞在AE患者病灶近旁肝脏组织带大量聚集。
注:A.CD68标记AE患者手术切除肝脏组织的巨噬细胞;B.TissueGnosticsStrataQuest V7.1软件识别病灶近旁肝脏组织、远端病灶肝脏组织,并统计各部分中CD68阳性细胞数的分析结果; 两独立样本比较采用t检验,双侧,***P<0.001。
2.2 多房棘球蚴原头节感染抑制巨噬细胞的吞噬功能 通过巨噬细胞吞噬EGFP大肠杆菌来分析其吞噬作用,结果下图2。PSCs感染巨噬细胞,发现共培养24 h(q=7.765,P<0.001)、48 h(q=13.61,P<0.001)和72 h(q=16.03,P<0.001)大肠杆菌的荧光强度降低,且随着共培养时间增加大肠杆菌强度逐渐降低,以上结果提示PSCs感染巨噬细胞后导致其吞噬大肠杆菌的能力减弱。
2.3 多房棘球蚴原头节感染促进CD47和PD-1的表达 采用Western blotting方法分析对照组、PSCs与巨噬细胞共培养组组不同时间点巨噬细胞CD47和PD-1蛋白的表达情况,结果见图3。PSCs感染后巨噬细胞CD47和PD-1的表达增加,且随着共培养时间增加其表达增加。
2.4 多房棘球蚴原头节感染给予信迪利单抗处理后恢复巨噬细胞的吞噬功能 给予1.5 mg/mL信迪利单克隆抗体阻断PD-1,评估PSCs巨噬细胞的吞噬功能的改变,结果见图4。研究发现单独给予信迪利单克隆抗体与对照组相比巨噬细胞中大肠杆菌的平均荧光强度无统计学差异(q=4.159,P=0.131),给予信迪利单克隆抗体处理后再给予PSCs共培养与单独给予PSCs相比巨噬细胞中大肠杆菌的平均荧光强度强度增加(q=40.63,P<0.05),提示给予信迪利单克隆抗体可恢复巨噬细胞的吞噬功能。
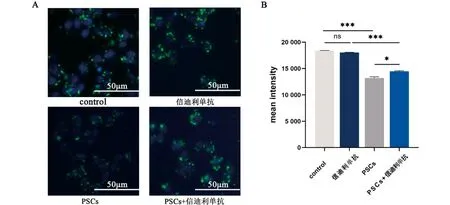
注:A.阻断PD-1后PSCs与巨噬细胞共培养后,巨噬细胞吞噬大肠杆菌;B.大肠杆菌的平均荧光强度;采用单因素方差分析,*P<0.05,**P<0.01,***P<0.001)。
3 讨 论
泡型包虫病是一种被忽视的人兽共患疾病,也是一种全球性公共卫生问题。AE主要分布于北半球,尤其是中国、俄罗斯、北美,其中中国青藏高原地区泡型包虫病的发病率占全球AE发病率的91%[10]。由于病灶组织在宿主体内呈浸润性生长,没有及时治疗的患者10年病死率可达94%,故又称之为“虫癌”[11-12]。目前,AE的致病机制尚不清楚,本研究通过探索PD-1在多房棘球蚴感染对巨噬细胞吞噬作用的影响,从而为新的免疫治疗提供依据。
当病原体感染后,巨噬细胞摄取病原体,病原体被困在吞噬体中,然后与溶酶体融合,在酶和过氧化物的作用下消灭病原体。既往研究发现细粒棘球蚴和其囊液能抑制巨噬细胞的吞噬作用。我们的研究发现巨噬细胞在泡型包虫病患者病灶近旁肝脏组织大量聚集,但PSCs感染后抑制巨噬细胞的吞噬功能。巨噬细胞对肿瘤细胞的吞噬作用受多种“吃我”(促吞噬)和“别吃我”(抗吞噬)信号的调节。“别吃我”信号通路(包括CD47-SIRPα、CD24-Siglec-10、MHC-1(B2M)-LILRB1和PD-L1-PD-1) 通过与吞噬细胞上的受体相互作用来保护肿瘤细胞不被吞噬[13]。CD47作为一种免疫检查点,通过与SIRPα结合可以将磷酸酶SHP-1招募至巨噬细胞的吞噬突触,抑制肌球蛋白IIa的聚集,从而抑制巨噬细胞的吞噬作用[14]。PD-1/PD-L1免疫检查点作为肿瘤细胞免疫逃避的机制之一,PD1通过与其配体PD-L1和PD-L2结合,抑制T细胞的活化和效应T细胞功能,从而抑制T细胞杀灭肿瘤细胞,最终导致肿瘤细胞的免疫逃逸[15]。血吸虫感染的小鼠模型中发现,Toll样受体2 (Toll-like receptor2,TLR2)通过诱导PD-L2高表达,PD-L2与PD-1结合后,可抑制T细胞免疫应答[8]。杜氏利什曼原虫感染过程中阻断PDL-1可防止T细胞耗尽,抑制自噬,并促进杜氏利什曼原虫的清除[16]。我们的研究同样发现PSCs感染后促进巨噬细胞PD-1和CD47的表达,信迪利单抗阻断PD-1后可恢复PSCs感染的巨噬细胞的吞噬功能。因此,本研究发现PSCs感染后通过增加PD-1和CD47的表达,抑制巨噬细胞吞噬功能,引起免疫抑制,从而促进疾病进展。
综上所述,PSCs感染通过促进巨噬细胞PD-1和CD47的表达,抑制巨噬细胞吞噬功能;阻断PD-1后可恢复巨噬细胞的功能。然而有关PD-1在PSCs感染中免疫耐受中所发挥的作用还需通过体内实验进一步加以验证,从而为泡型包虫病的治疗提供依据。
利益冲突:无

