亚洲系与非洲系寨卡病毒株对神经胶质细胞感染性及稳定性差异研究
于玉凤,何振瑞,乔绍俊,范秀玲,王 珊,王 建
寨卡病毒(Zika virus,ZIKV),是一种蚊媒传播的、有包膜、单股正链的RNA病毒,与登革病毒(Dengue virus,DENV)、黄病毒(Yellow virus,YFV)、西尼罗病毒(West Nile Virus,WNV)、日本脑炎病毒(Japanese encephalitis virus,JEV))等同属于黄病毒科黄病毒属病毒。1947年,科学家首次在寨卡森林恒河猴体内分离得到[1]。2007年以前,ZIKV只零星感染人类,而从2007年开始,出现ZIKV暴发感染。截止2017年3月份,全球约80多个国家或部落报道了ZIKV的蚊媒传播感染[1]。ZIKV基因组只有一个开放阅读框,其编码区的长度约为10.8 kb,依次编码3种结构蛋白(衣壳蛋白,capsid protein,C;膜蛋白及其前体membrane protein and its precursor membrane,M/PrM;包膜蛋白,envelope protein,E蛋白)和7 种非结构蛋白(nonstructural proteins,即NS1、NS2A、NS2B、NS3、NS4A、NS4B、NS5)[2]。遗传进化分析显示,ZIKV在1947年至2007年间通过病毒RNA的多次核苷酸改变快速进化,尤其是在“流行沉默期”,最终进化为ZIKV的两大谱系:非洲系以及亚洲系(包括美洲系)[3]。
ZIKV感染人类,通常情况下只引起低热、斑丘疹、关节疼痛、结膜炎等症状,但其感染孕妇,会导致胎儿脑部先天性发育畸形,产生小头症[4-6],WHO将ZIKV列为国际关注的突发公共卫生事件。Sutarjono B从146篇研究ZIKV感染人脑类器官的文献中筛选出13篇进行分析,发现非洲系和亚洲系的ZIKV均增强细胞的凋亡,引起人脑类器官体积变小[7]。Cugola等报道由亚洲系ZIKV引起的细胞凋亡率高于非洲系ZIKV[8],而Gabriel E等研究发现非洲系ZIKV比亚洲系ZIKV更易诱导细胞的凋亡[9]。但只有来自巴西、波多黎各和法属波利尼西亚属于亚洲系的ZIKV被证实可引起人类胎儿小头症[10]。不同谱系间ZIKV核酸的相似性约为88.8%,氨基酸的相似性约为97%[11],其中的差异可能对ZIKV的毒力有较大影响。此外,1947年至2007年,60年的进化可能提升了病毒对神经细胞的感染性和对外界环境的稳定耐受性,使其更易感染人类,并快速传播,但目前缺乏相关的研究。
本研究将选择ZIKV亚洲系SZ01和非洲系MR766病毒株,通过比较分析其在不同温度对神经胶质细胞的感染性及自身增殖能力、游离状态对高温和反复冻融的耐受性,比较两株病毒的感染性和稳定性差异,最终为不同谱系致病性差异提供理论依据。
1 材料与方法
1.1 细胞与病毒 BHK21、Vero、U251、T98G细胞使用DMEM培养基(含10% 胎牛血清、氨苄青霉素和链霉素)在37 ℃、5% CO2条件下培养,待其在T75培养瓶中长成单层,使用EDTA-胰酶消化后用于后续实验。U87细胞使用MEM培养基(含10% 胎牛血清、氨苄青霉素和链霉素)在37 ℃、5% CO2条件下培养,待其在T75培养瓶中长满即可用于后续实验。Vero、BHK21细胞由复旦大学姜世勃教授课题组馈赠;U87、T98G、U251细胞购买自上海中乔新舟生物科技有限公司。SZ01 (GenBank号: KU866423),2016年在由萨摩亚返回深圳的病人身上分离获得[12];MR766 (#VR1838) 购买自ATCC,1947年由乌干达恒河猴体内分离获得[13]。
1.2 病毒培养 待Vero细胞长成单层后,吸掉细胞培养液,将ZIKV接种于细胞培养瓶中,每瓶T75 200 μL病毒/10 mL病毒稀释液(DMEM培养基),在37 ℃、5% CO2条件下吸附1.5 h,随后吸弃病毒稀释液,加入20 mL病毒维持液(含2%胎牛血清的DMEM培养基),每日观察细胞,约感染5 d左右,细胞出现明显病变,收取上清进行病毒空斑实验以测定病毒滴度。
1.3 CCK8实验 首先将生长状态良好的U251、U87或T98G细胞铺96孔板,每孔1×104个,37 ℃、5% CO2培养箱培养24 h。然后使用含2%FBS的DMEM或MEM培养基稀释MR766及SZ01,使其最终的感染浓度为1、0.1、0.01 MOI。随后吸弃细胞培养上清,每孔加入上述稀释后的病毒液100 μL,每个浓度设置6个复孔。每块96孔板设置无病毒感染组,即含细胞但无病毒,每孔加入2%FBS的DMEM或MEM培养基100 μL;同时,每块96孔板设置空白组,即无细胞无病毒,用于后续细胞成活率计算。待病毒与细胞孵育1.5 h后,将病毒液吸弃,每孔加入2%FBS的DMEM或MEM培养基100 μL。将500 μL CCK8溶液加入10 mL无血清DMEM或MEM培养基中颠倒混匀。统一于感染48 h、72 h后,小心吸弃96孔板中的培养基,将CCK8反应液加入96孔板中,每孔100 μL。37 ℃、5% CO2条件下培养2 h后,使用酶标仪测定各孔的OD450吸光度值。计算不同滴度病毒对细胞毒性的影响,计算公式为:细胞成活率=(病毒孔-空白孔)×100%/(无病毒孔-空白孔)。
1.4 病毒空斑实验 将生长状态良好的BHK21细胞铺12孔板,每孔2×105个,约16~24 h后在镜下观察,若无细胞生长空隙,则开始病毒滴度的测定。首先将病毒样品进行倍比稀释,每个稀释度设置3个复孔,每孔加入0.5 mL含病毒的稀释液。待病毒与细胞吸附2 h 后,将病毒上清液吸弃,加入已预热的含有1%低熔点琼脂糖和2% FBS的DMEM 培养基1 mL。待琼脂糖凝固后,倒置放于37 ℃、5% CO2培养箱中培养5 d左右,在灯光下看到细胞噬斑时,加入含有1% 结晶紫的4%多聚甲醛固定细胞过夜。随后每孔加入适量自来水浸泡约15 min,弃去孔中琼脂糖,即可进行空斑计数。
1.5 ZIKV RNA拷贝数检测 为检测病毒上清中ZIKV RNA拷贝数,使用TIANamp病毒RNA抽提试剂盒(天根生物)抽提病毒RNA。随后使用One Step PrimeScriptTMRT-PCR Kit (Takara Bio)和QuantStudio 5 PCR仪(ABI)检测病毒拷贝数。引物序列如下:
ZIKV-E-F-Taq (5′-GGTCAGCGTCCTCTCT-AATAAACG-3′),
ZIKV-E-R-Taq (5′-GCACCCTAGTGTCCA-CTTTTTCC-3′),
探针(5′-6-FAM-AGCCATGACCGACACCACACCGT-BHQ1-3′)。
标准品为含ZIKV E蛋白的质粒。
1.6 病毒游离状态在不同温度下的稳定性检测 为检测游离状态的ZIKV在37 ℃和40 ℃下的稳定性,首先分别将1 mL SZ01和MR766病毒液分别在37 ℃和40 ℃条件下放置0.5 h、1 h、2 h、3 h、6 h、12 h,放置时间结束后将病毒转移-80 ℃待用。使用1.5中qRT-PCR法检测残留病毒基因组;使用1.4中病毒空斑实验法检测残留病毒感染性颗粒。
1.7 病毒在不同温度下感染性检测 为检测ZIKV在不同温度下感染性,分别使用0.1 MOI 的SZ01、MR766感染细胞U87,使用0.5 MOI的SZ01、MR766分别感染细胞T98G,设置温度为37 ℃和40 ℃,以模拟正常和发烧人体温。在感染12 h、24 h、48 h、72 h、96 h后,收集病毒感染上清,通过1.4所述病毒空斑实验检测病毒的增殖情况;分别于48 h、72 h使用显微镜观察细胞的病变情况。
1.8 病毒对反复冻融的耐受检测 为检测反复冻融对病毒感染性的影响,设置扩增后未解冻病毒为0次冻融。随后取病毒液室温放置30 min,待其完全解冻后设置为1次冻融,将其分装为200 μL每管,分装4管;将分装后病毒液放置-80 ℃,2 h后,取3管,室温放置30 min,设置为2次冻融;重复此操作,至获得反复冻融4次的病毒液。随后使用病毒空斑实验检测经过不同冻融次数后病毒液,设置0次冻融病毒液具有100%感染性。
1.9 统计学方法 本文主要比较单一时间点或单一因素处理后,SZ01组与MR766组之间是否存在统计学差异,因此选择单因素分析统计方法。根据是否满足方差齐性和正态性决定使用未配对两尾t-test或非参数曼-惠特尼秩和检验(Mann-Whitney test)。数据使用 SPSS 13.0 软件或GraphPad Prism 5.0 软件进行统计分析。*,P<0.05; **,P<0.01;***,P<0.001,P<0.05为差异有统计学意义。
2 结 果
2.1 SZ01对星形神经胶质细胞的感染性强于MR766 为比较两株病毒对神经胶质细胞感染性的差异,分别使用1、0.1、0.01MOI 的SZ01和MR766感染人星形神经胶质细胞U251、U87和人胶质母细胞瘤细胞T98G。随后分别于感染48 h、72 h通过CCK8法检测细胞活性。如图1A 和1B所示,SZ01感染U251或U87 细胞后,其与MR766相比,显著降低细胞的活性,SZ01导致的细胞活性降低较MR766更为快速、明显。由图1C可知,SZ01和MR766感染T98G细胞后,当病毒MOI为1时,SZ01比MR766可更显著地降低细胞活性,但在MOI为0.1或0.01时则无此效果,甚至在72 h出现MR766更显著降低细胞活性的现象,但整体上细胞活性维持在85%以上。综上,SZ01对星形神经胶质细胞U87和U251的感染性强于MR766,在高感染滴度(MOI为1)时,SZ01对T98G细胞的感染性强于MR766。
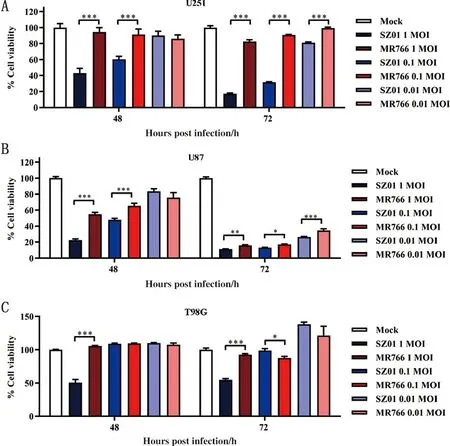
注:A. CCK8法检测两株ZIKV感染星形胶质细胞U251结果(n=6);B.CCK8法检测两株ZIKV感染星形胶质细胞U87结果(n=6);C. CCK8法检测两株ZIKV感染人胶质母细胞瘤细胞T98G结果(n=6)。
2.2 游离SZ01对温度耐受能力高于MR766 为分析游离ZIKV在37 ℃及40 ℃的热稳定性,分别将SZ01和MR766在37 ℃及40 ℃孵育0.5 h、1 h、2 h、3 h、6 h、12 h,随后收集病毒,使用qRT-PCR和病毒空斑实验分别检测残留病毒基因组和残留病毒感染性。结果如图2所示,在37 ℃及40 ℃孵育6 h或12 h后,病毒残留基因组处于较高值,但病毒的残留感染性却快速下降。在37 ℃孵育6 h及12 h后,MR766病毒的残留基因组和感染性均显著低于SZ01(图2A和图2C)。在40 ℃孵育2 h 后,MR766的残留基因组和感染性均显著低于SZ01(图2B和图2D)。综上,ZIKV对40 ℃的耐受低于37 ℃;SZ01对40 ℃的耐受能力高于MR766。

注:A/B.qRT-PCR法检测两株ZIKV对37 ℃及40 V的耐受能力(n=3);C/D.病毒空斑实验检测两株ZIKV对37 ℃及40 ℃的耐受能力(n=3)。
2.3 ZIKV可耐受40 ℃高温在神经胶质细胞内增殖 由图2可知,游离状态下的ZIKV在40 ℃下孵育3 h后,病毒感染性明显降低。那么,在40 ℃下,ZIKV能否感染神经胶质细胞并在其中增殖呢?为回答上述问题,我们使用SZ01、MR766分别在37 ℃和40 ℃下感染星形神经胶质细胞U87(0.1 MOI)和神经胶质母细胞瘤细胞T98G(0.5 MOI),随后分别于12 h、24 h、48 h、72 h、96 h收集病毒感染上清,通过病毒空斑实验,检测病毒的增殖情况;分别于48 h、72 h使用显微镜观察细胞的病变情况。结果如图3A和3B可知,SZ01在37 ℃和40 ℃下诱导的细胞病变均强于MR766,SZ01感染细胞组出现更多的变圆、悬浮细胞。两株病毒在40 ℃温度下的增殖均明显低于37 ℃(图3C和图3D)。由图3C可知,在U87细胞中,不同感染温度下,SZ01的增殖速度均快于MR766,优先到达感染峰值。由图3D可知,在T98G细胞中,SZ01在37 ℃和40 ℃下的增殖速度也均快于MR766。此外,T98G细胞对温度的耐受较弱,40 ℃下培养72 h后,各组细胞的形态均发生明显变化。综上,ZIKV可耐受40 ℃高温在神经胶质细胞内增殖,且SZ01的增殖速度快于MR766。

注:A/B.显微镜观察两株ZIKV在不同温度感染U87/T98G细胞介导的细胞病变(×200);C/D.病毒空斑实验检测两株ZIKV在不同温度感染U87/T98G细胞后病毒的增殖情况(n=3)。
2.4 SZ01对于病毒反复冻融的耐受性高于MR766 为分析SZ01与MR766对反复冻融耐受的差异性,我们分别对SZ01与MR766病毒株冻融1、2、3、4次,随后通过病毒空斑实验,检测反复冻融对两株病毒的影响。结果如图4所示,随着病毒冻融次数的增加,两株病毒的感染性均出现了降低现象,其中MR766降低更为明显。在冻融第3次、第4次时,MR766的残留感染性显著低于SZ01。综上,SZ01对于病毒反复冻融的耐受性高于MR766。
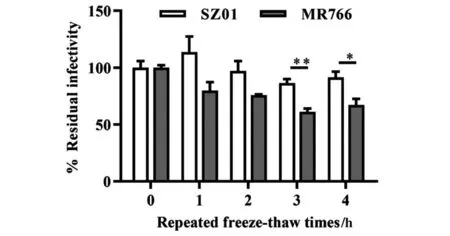
图4 SZ01对反复冻融的耐受性高于MR766(n=3))
3 讨 论
本研究首先比较了两个不同谱系ZIKV病毒株SZ01和MR766对神经胶质细胞U251、U87及胶质母细胞瘤细胞T98G的感染性。结果显示,SZ01对两株星形胶质细胞的感染性均强于MR766(图1A和1B)。但是在T98G中,只有在高感染滴度(MOI为1)情况下,SZ01的感染性强于MR766,在本研究中的其他情况下,即使感染时间超72 h,T98G细胞依然维持85%以上活性(图1C)。研究表明酪氨酸蛋白激酶受体AXL的表达量与ZIKV的感染呈正相关,而星形胶质细胞作为脑中枢神经系统含量最多的细胞大量表达AXL[14]。AXL是否为ZIKV的受体目前存在争议[14-15],但较为明确的是AXL通过下调干扰素信号通路促进ZIKV感染[14]。U251与U87细胞AXL的表达水平高于T98G[14],这或许是ZIKV对T98G感染性低于U251与U87的原因。
由于ZIKV第一宿主蚊子特殊的免疫系统,ZIKV可在蚊子体内持续性感染但不致病[16],符合虫媒病毒特点。令人意外的是,ZIKV在其动物模型,如小鼠、豚鼠、猪、非人灵长类中均出现持续性感染[17-21]。ZIKV感染孕妇,可在出生胎儿体内检测到ZIKV RNA[22]。ZIKV在胎盘和大脑中的持续感染或致婴儿小头畸形[23-25]。ZIKV可在男性生殖系统中持续存在长达6个月[26],导致睾丸和生育能力受损[27-28],在其他组织中也存在持续性感染。ZIKV在全血中持续存在长达73.5 d,在血细胞中持续存在长达95.4 d[29]。此外,ZIKV与其他黄病毒的不同之处,还在于其不仅可以通过蚊虫叮咬传播,还可以通过性传播、母婴传播、输血及血液制品传播[30-31]。上述现象提示,ZIKV在人体37 ℃温度处于感染细胞或游离状态下均较为稳定,甚至在人体处于发烧状态(40 ℃)时仍具有存活能力。因此,在本研究中选择37 ℃和40 ℃分别研究了ZIKV亚洲系SZ01与非洲系MR766在游离状态(图2)及感染细胞状态(图3)下的稳定性。结果显示,SZ01在37 ℃、40 ℃游离状态时的稳定性均高于MR766,在37 ℃下放置12 h后,SZ01残留12.4%的感染性,而MR766为4.7%;在40 ℃下放置3 h后,SZ01仍残留14.7%感染性,而MR766则仅剩余0.63%。病毒感染进入细胞的时间小于2 h,3 h足够其进行下一轮细胞的感染。那么在40 ℃,ZIKV是否具有扩增能力呢?我们在U87和T98G神经胶质细胞(图3)中观察到,虽然病毒在40 ℃的感染性比37 ℃的感染性明显下降,但其依然可感染细胞并进行扩增。此外,成熟的ZIKV病毒颗粒与DENV病毒颗粒类似,二十面体,球形,直径约为50 nm,以180对M-E蛋白二聚体覆盖于病毒表面,但是比DENV2/4表面蛋白排布更加紧密,上述原因或可解释其为何能够耐受40 ℃高温,以及在极性环境如精液、尿液、唾液中存活[32-34]。
综上,亚洲系SZ01对星形神经胶质细胞的感染性强于非洲系MR766。在游离状态或感染细胞状态,亚洲系SZ01对40 ℃高温的耐受能力均高于非洲系MR766。同时,亚洲系SZ01对于病毒反复冻融的耐受性高于非洲系MR766(图4)。ZIKV暴发后,迅速在全球80多个国家或部落流行[35],造成小头畸形婴儿出生比例上升[36],或与亚洲系ZIKV经过长达60多年的进化,其感染性与稳定性显著提升有关。后期选择亚洲系SZ01及非洲系MR766病毒株,通过比较分析其主要病毒蛋白及关键motif或氨基酸位点,阐明蛋白位点突变如何调控ZIKV感染性与稳定性,以及ZIKV蛋白如何参与调控小头症基因表达,对于明确亚洲系ZIKV的致病机制具有重要作用。
利益冲突:无

