灭活的新型结核病疫苗菌株(B/R菌株)对小鼠T淋巴细胞免疫记忆的影响
丰启盈,邓喜玲,张 杰,董江涛,柳小玲,梁 粟,王 菊,张 辉,吴江东,章 乐,吴 芳,张万江
结核病(Tuberculosis, TB),是结核分枝杆菌(MycobacteriumTuberculosis, Mtb)作为病原体所引起的机体慢性传染性疾病[1],是影响人类健康和导致死亡的主要疾病之一。2022年全球结核病报告显示,受COVID-19流行的影响,结核病确诊人数在2017年至2019年大幅增长后,2020年患病人数显著减少,但这一改变在2021年再次扭转,全球预估有1 060万人患病,与2020年患病人数相比增加4.5%[2]。目前世界范围内唯一获准应用的结核病预防性疫苗——卡介苗(Bacillus Calmette-Guerin, BCG),其问世已超百年,近年来越来越多的研究对其保护效力提出质疑。虽然BCG对新生儿结核与儿童重症结核病具有较好且长时间的预防作用[3],但对于潜伏性肺结核与成人肺结核,BCG的保护作用并不稳定[4],且BCG缺失了与结核病致病高度相关的RD1和RD2区域编码的相关抗原[5]。加之耐药结核与HIV感染等因素对结核病流行的影响,BCG的保护效用已无法满足现今结核病防治的严峻形势,研制出更为有效的新型结核病疫苗,已然是重要方向。
目前,根据研究平台的不同,可将正在研制的结核病疫苗分为两大类:分枝杆菌全菌衍生疫苗与亚单位疫苗[6-7]。全菌疫苗因包含更为完整的抗原成分,可能比亚单位疫苗具有更优的免疫原性,但其中活菌疫苗的安全性需要更为广泛和长期的研究与评估[8]。相比之下,灭活疫苗的安全性更为可靠,且利于保存与运输。分枝杆菌灭活疫苗始终在结核疫苗发展史上拥有一席之地,如RUTI与MIP两款疫苗已在临床试验中展示出良好效果[9]。
本课题组前期成功构建并选育的新型结核病疫苗菌株B/R菌株[10],是以BCG菌株与H37Ra菌株为亲本菌株,利用原生质体与电穿孔技术融合而成的结核杆菌融合菌株。目前已完成安全性[11]、生物特性与遗传性状[12]方面的研究,并以实验证实该菌株在免疫小鼠后,可建立较高水平免疫记忆与短期保护效力[13]。为进一步探索B/R菌株灭活后建立小鼠免疫记忆的能力,研究灭活B/R菌株作为结核病疫苗的可能性,本研究以灭活B/R菌株为实验对象,探讨其对小鼠T淋巴细胞免疫记忆的影响。
1 材料与方法
1.1 材料
1.1.1 菌株种属 BCG菌株购自中国食品药品检定研究院,B/R菌株由本实验室构建并保存。
1.1.2 实验动物雌性 C57BL/6小鼠,6~8周龄,购自新疆医科大学实验动物中心,于石河子大学医学院实验动物中心集中饲养。小鼠适应性饲养1周无异常后,开展实验。所有研究方法依照国家实验动物学会的有关要求进行开展,实验方案已通过石河子大学动物实验伦理委员会批准。
1.1.3 主要试剂 1640培养基购自Thermo Fisher公司;胎牛血清购自Hyclone公司;小鼠脾脏淋巴细胞分离液购自北京索莱宝生物科技有限公司;Anti-MouseCD4-PE、Anti-Mouse CD8a-PE、Anti-Mouse CD44-PE Cy5.5与Anti-Mouse CD62L-FITC购自Cell Signaling Technology公司。
1.2 方法
1.2.1 菌株处理与灭活 将保存在-80 ℃冰箱的BCG菌株与B/R菌株取出,置于生物安全柜中自然解冻至常温。将BCG菌株与B/R菌株分别接种至新制的改良罗氏培养基斜面上,置于37 ℃隔水式恒温培养箱中培养,传代3次后选择生长状态良好的菌株用于实验。取适量菌株充分研磨,而后以PBS进行稀释,期间利用细菌比浊仪检测悬液浓度,将各菌株悬液浓度调整为1×107cfu/mL。将制备完成的悬液置于干式恒温仪中,在100 ℃,30 min条件下[14],制备灭活的菌株悬液。
1.2.2 动物分组与疫苗免疫 将小鼠随机分为PBS组、BCG组、B/R组与灭活B/R组,每组9只。取各实验组菌株0.1 mL悬液(即1.0×106cfu),通过背部皮下注射,以单次免疫的接种方案分别免疫各组小鼠,PBS组注射0.1 mL PBS作为阴性对照。
1.2.3 分离小鼠脾脏淋巴细胞 在免疫小鼠后第9周、第12周与15周,无菌条件下取各组小鼠脾脏,制备脾脏单细胞悬液。小心吸取单细胞悬液于淋巴细胞分离液上,注意保持液面界限清晰。室温条件下,悬液以水平转子800 g离心,20 min。缓慢吸取第2层环状乳白色液体层,至无菌的15 mL离心管中,向其中加入10 mL的细胞洗涤液,250 g离心10 min。弃上清,加入PBS重悬细胞,250 g离心10 min,2次。1 mL PBS重悬细胞,细胞计数后将细胞浓度调整为1×107个/mL。
1.2.4 流式细胞技术检测 免疫后淋巴细胞的分型及数量比例分别取各组100 μL细胞悬液至标记好的1.5 mL离心管中,按照实验设计分别加入CD4、CD8a、CD44与CD62L荧光标记抗体,4 ℃,避光孵育30 min。孵育完成后,向管中加入1 mL PBS,4 ℃,300 g离心5 min,弃上清,重复2次。最后加入500 μL PBS重悬细胞,准备流式上机检测。检测时设置空白管与抗体单标管,用以调节相关参数。实验遵从以下设门原则:设置P1门用于淋巴细胞分选,设置P2门用于分选CD4+、CD8+细胞,通过检测CD62L,CD44的表达情况,区分中央型T淋巴细胞TCM(CD62L高表达,CD44高表达)与效应型T淋巴细胞TEM(CD62L低表达,CD44高表达)细胞数量水平。
1.2.5 流式细胞技术检测 免疫后经PPD刺激淋巴细胞的分型及数量比例提取各实验分组的小鼠脾脏淋巴细胞,置于24孔培养板中,单孔置入细胞数为5×106个。向每孔内分别加入20 μL anti-CD28mcAb工作液和终浓度为10 μg/mL的结核菌素纯蛋白衍生物(PPD),再添加RPMI-1640完全培养基至1 mL。细胞培养箱中37 ℃,5% CO2中培养72 h后,收集各组脾脏淋巴细胞,4 ℃,300 g,离心5 min,弃上清,加入100 μL PBS重悬细胞。后续抗体孵育、上机操作与设门原则同上所述。
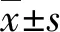
2 结 果
2.1 免疫后各组小鼠CD4+TCM与TEM细胞水平 流式细胞技术检测结果显示,免疫小鼠后第9周、第12周与第15周,在CD4+T细胞分型中,各实验组TCM(F9周=13.2,F12周=15.97,F15周=15.4,P<0.05)和TEM(F9周=28.15,F12周=13.6,F15周=7.435,P<0.05)细胞比例均显著高于PBS组(图1),这与前期的研究结果相符。B/R组、灭活B/R组与BCG组相比,在免疫后不同时间点检测出CD4+TCM细胞比例差距较小。灭活B/R组仅在第12周时CD4+TEM细胞比例高于BCG组与B/R组,但差异无统计学意义。各实验组免疫小鼠后不同时间CD4+TCM和TEM细胞占比均保持在较高水平, BCG组、B/R组与灭活B/R组组间差异无统计学意义。
2.2 免疫后各组小鼠CD8+TCM与TEM细胞水平 对于CD8+T细胞而言,在免疫后不同时间点,各实验组CD8+TCM(F9周=8.924,F12周=5.524,F15周=6.574,P<0.05)和TEM(F9周=6.13,F12周=20.15,F15周=9.268,P<0.05)细胞比例均显著高于PBS组(图2)。在第9周、第15周与第12周时,各实验组CD8+TCM和TEM细胞占比差异较小,两组间比较差异无统计学意义。灭活B/R组仅在第15周时,CD8+TCM细胞比例稍高于BCG组,但此时差异无统计学意义。
2.3 免疫后经PPD刺激各组小鼠CD4+TCM与TEM细胞水平 免疫第9周、第12周与第15周后再经特异性抗原PPD刺激,灭活B/R组、B/R组与BCG组较PBS组相比CD4+TCM(F9w=9.659,F12周=9.326,F15周=39.88,P<0.05)与TEM(F9周=11.2,F12周=6.936,F15周=11.93,P<0.05)细胞比例高出的差异均有统计学意义(图3)。除12周时CD4+TCM外,灭活B/R组在其余各时间点的CD4+TCM与TEM细胞比例均高于BCG组,但差异均无统计学意义。总体而言,在以上3个时间点免疫小鼠后再经PPD刺激,BCG组、B/R组与灭活B/R组3者间CD4+TCM与TEM的差异,均无统计学意义。
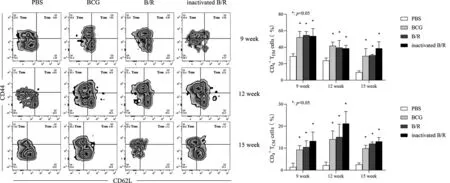
图3 免疫后不同时间点再经刺激,各组小鼠淋巴细胞CD4+ TCM与TEM水平)
2.4 免疫后经PPD刺激各组小鼠CD8+TCM与TEM细胞水平 免疫第9周、第12周与第15周后再经特异性抗原刺激,BCG组、B/R组与灭活B/R组与PBS组相比,CD8+TCM(F9周=7.242,F12周=67.71,F15周=138.8,P<0.05)和TEM(F9周=9.295,F12周=10.86,F15周=38.47,P<0.05)差异均有统计学意义(图4)。值得注意的是,在第15周时,灭活B/R组与B/R组的CD8+TCM(q灭活B/R=12.24,qB/R=12.61,P<0.05)与TEM(q灭活B/R=7.191,qB/R=4.997,P<0.05)细胞比例均显著高于BCG组。第9与12周,各实验组间CD8+TCM与TEM水平差异无统计学意义。第15周时,灭活B/R组与B/R组间CD8+TCM与TEM水平差异无统计学意义。
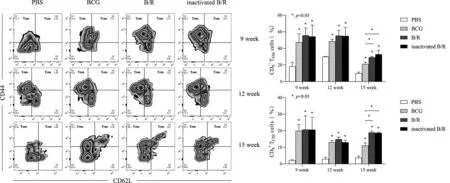
图4 免疫后不同时间点再经刺激,各组小鼠淋巴细胞CD8+ TCM与TEM水平)
3 讨 论
了解预防疾病或初始感染所需的免疫反应,是开发有效疫苗的关键[15]。结核病的发病机制是一个复杂的过程,涉及宿主免疫系统和细胞因子间的相互作用。首先,固有免疫在抵抗MTB感染中发挥着重要作用[16-17]。巨噬细胞作为首道防线,只有在数量众多且干预及时的情况下才能控制MTB的感染[18],否则将会沦为MTB胞内寄生的庇护所。当感染蔓延至淋巴结,适应性免疫启动。体液适应性免疫在结核病中的作用具有不确定性[19-20],机体抵抗MTB的感染由细胞免疫起决定性作用。依据表面抗原的不同,T细胞被分为CD4+与CD8+两大亚群。由于CD4+T细胞耗竭,HIV患者感染结核病的风险是单独感染结核病的15~20倍[21],这足以证明CD4+T细胞在结核病免疫中的关键作用。以往一般认为CD8+T细胞在控制MTB的感染中没有作用,但这是不正确的。CD8+T细胞通过组织相容性复合物Ⅰ类分子识别MTB感染,并产生多种细胞因子参与免疫反应。事实上,BCG对CD8+T 细胞的诱导不足被认为是其保护效果较差的主要原因之一[22]。
机体应对慢性感染性疾病时,免疫记忆由经抗原初次刺激后产生的记忆性T细胞主导,该细胞具有自我更新能力可持续存在,再次受到同一抗原入侵时即刻发动[23-24]。记忆性T细胞可分为TCM和TEM两类细胞,前者长期存在于机体内,参与免疫应答过程,后者生存时间较短但具有更强的免疫原性。再次接触相同抗原时,增殖能力较强的TCM可迅速分化为效用T淋巴细胞与TEM,TEM可快速启动免疫应答。本实验中,在未经刺激的小鼠脾脏淋巴细胞CD4+T细胞流式结果中,灭活B/R组与B/R组间CD4+TCM、TEM的水平差异没有统计学意义。结果显示,免疫小鼠后第9周、第12周与第15周,灭活B/R组、B/R组与BCG组CD4+TCM和TEM细胞数量差异不大且差异在各时间点内均无统计学意义。总体来看,灭活B/R菌株与B/R菌株诱导小鼠产生CD4+TCM和TEM的效力与BCG菌株相当,这与前期研究结果并不一致。本次实验中B/R菌株未展现出在检测后期CD4+TEM显著高于BCG菌株的结果,各实验组菌株所诱导产生的CD4+TEM,均保持在较高水平。
能否诱导T淋巴细胞在机体内的特异性免疫应答是评价结核病疫苗的首要标准[17],其具体表现为机体的免疫记忆水平。免疫记忆指再次感染相同抗原,引起较初次感染更为快速且强烈的免疫应答[25]。在本研究中,免疫小鼠后第9周、第12周与第15周,分离淋巴细胞经体外PPD刺激,灭活B/R组、B/R组与BCG组所产生CD4+和CD8+的TCM和TEM均显著高于PBS组,证明灭活B/R组、B/R组与BCG组一致,均可诱导免疫记忆在二次应答中产生免疫保护反应。无论是CD4+或CD8+的TCM和TEM,在以上3个时间点内,各实验组间差异均无统计学意义,表明灭活B/R菌株诱导细胞免疫的能力与B/R、BCG菌株基本相当,热灭活未对B/R组的免疫原性造成损害。免疫后第15周,灭活B/R与B/R菌株可诱导与BCG相比更高水平的CD8+TCM和TEM,这与先前的研究一致[26]。有研究认为,BCG在诱导TEM上的不足是其保护效力随年龄增长而减弱的原因[27-28],这提示灭活B/R与B/R菌株拥有较BCG更具优势的免疫保护期限。
灭活疫苗在各类疾病的预防中应用广泛,热灭活在其他病原体上已有较多成功应用。在一定限度内,热灭活一般不影响灭活产品的免疫原性[29-30]。本研究中灭活B/R菌株诱导免疫记忆的能力与B/R菌株相当,在研究后期甚至表现出优于BCG菌株的效力。综上所述,我们证明了热灭活不影响B/R菌株对小鼠T淋巴细胞免疫记忆的诱导,灭活B/R菌株可以促进高水平免疫记忆细胞的产生,并在保护期限方面可能更具优势。
利益冲突:无

