蛋白激酶D在人类冠状病毒229E复制中的作用及机制研究
韩慧娟,刘 欢,赵志军
人类冠状病毒(human coronavirus,HCoV)可以引起轻微的普通感冒以及严重的呼吸系统疾病,是影响呼吸道健康的重要病因之一,也是我国儿童最常见的呼吸道疾病的主要病因[1-2]。目前已经发现3种高致病性人类冠状病毒,分别是严重急性呼吸综合征冠状病毒(SARS-associated coronavirus,SARS-CoV)、中东呼吸综合征冠状病毒(Middle east respiratory syndrome coronavirus,MERS-CoV)和严重急性呼吸综合征冠状病毒2(Severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)[3-4]。然而,在人群中传播最广泛的4种常见人类冠状病毒分别是属于α冠状病毒的HCOV-229E(human coronavirus 229E)和HCOV-NL63(human coronavirus NL63)和属于β冠状病毒的HCOV-HKU1(human coronavirus HKU1)和HCOV-OC43(human coronavirus OC43),这些病毒通常引起人类自限性的轻度上呼吸道感染,约占普通感冒病例的1/3[5-7]。近年来研究发现,高尔基体在人类冠状病毒复制周期中起到关键作用[8-9],主要作用是通过反式高尔基体网络(trans-Golgi network,TGN)将含有包膜病毒颗粒的囊泡转运到细胞膜表面,通过胞吐的方式释放成熟病毒,然而,参与调控这一转运过程的关键分子和机制尚不清楚。
蛋白激酶D (Protein kinase D,PKD)是由 PKD1、PKD2 和 PKD3组成的丝氨酸/苏氨酸蛋白激酶,主要定位于细胞质、细胞核、高尔基复合体和质膜。在上皮细胞中,3种PKD亚型主要定位于反式高尔基体上[10]。细胞水平和动物模型的研究证明PKD参与多种疾病的发生与发展,包括癌症、代谢紊乱、心脏病、中枢神经系统紊乱、炎症性疾病和免疫失调等[11]。研究发现PKD抑制剂能够显著抑制多种癌症细胞的生长和增殖,并对其他疾病的进展也显示出较强的抑制作用[12]。尽管已有研究证实PKD参与细胞免疫应答,但在人类冠状病毒感染过程中的PKD功能仍知之甚少。因此,本研究以参与调控TGN的关键分子PKD为切入点,侧重分析PKD在人类冠状病毒229E复制过程中的作用及其生物学意义。
1 材料与方法
1.1 细胞和病毒 MRC-5(医学研究委员会细胞株5,货号CCL-171)细胞和Vero-E6(非洲绿猴肾,货号CRL-1586)细胞购买自ATCC公司。MRC-5细胞和Vero-E6在含10% 胎牛血清(HyClone,货号SH30071.03IH30-45)的改良DMEM培养基(Sigma-Aldrich,货号D0822)于37 ℃和5% CO2的培养箱中生长。
HCoV-229E由美国罗切斯特大学医学中心免疫系Stephen Dewhurst博士提供。实验用HCoV-229E在MRC-5细胞中扩增收集,并在MRC-5细胞上检测病毒滴度以确定感染复数(multiplicity of infection,MOI)值。在HCoV感染实验中,不同的时间和MOI值的HCoV-229E用来感染细胞,病毒在常温孵育1 h后,放置在37 ℃下孵育进行细胞感染。
1.2 RNAi转染 MRC-5细胞用靶向人蛋白PKD3(siPKD3,thermofisher,货号AM51331)转染24 h,使用Si-Control(thermofisher,货号AM4611)作为非靶向对照。Lipofectamine 2000(Invitrogen,Carlsbad,CA,货号12566014)在Opti-MEM无血清培养基(Invitrogen,货号31985062)中以3∶1 Si-RNA进行转染。在细胞达到70%融合度时,细胞以MOI值为10的HCoV-229E预感染24 h,用Si-RNA转染以敲低PKD3,收集细胞和病毒上清液用于测定。
1.3Prkd3过表达 在细胞达到70%融合度时,加入1 MOI的对照腺病毒(Ad-control)或Prkd3腺病毒(Ad-Prkd3)(signagen,货号SL100971)转染 MRC-5 细胞24 h,接下来进行下一步实验处理。
1.4 PKD抑制剂处理和PI4KⅢβ抑制剂处理细胞 CRT0066101,购买自Tocris,纯度为99.9%。PI4KIIIβ抑制剂(BQR695,货号CAS 1513879-21-4)购买自MedKoo,纯度为99.9%。为了测定抑制剂对病毒复制的影响,MRC-5细胞中加入的HCoV-229E MOI值为10;室温下孵育1 h;然后用PBS洗涤以去除未结合的病毒; 用浓度梯度增高的剂量依赖性CRT0066101,BQR695或对照在37 ℃下处理细胞24 h。感染/复制结束时,收集细胞和上清液,并在4 ℃下以10 000 ×g离心5 min以除去细胞碎片,使用含有HCoV-229E的上清液进行TCID50滴度测定。细胞在感染/复制期结束时于RLT缓冲液中进行裂解收集总RNA,通过实时荧光PCR分析mRNA含量。
1.5 活细胞PIP2检测 活细胞PI(4,5)P2检测试剂盒(货号D0400G)购自Montana Molecular,分离细胞并在完全培养基中重悬细胞,将 20 μL传感器BacMam储备液与 0.6 μL 500 mmol/L SB(丁酸钠储备溶液)和 24.4 μL完全培养基混合以制备转导溶液。将细胞和转导混合物混匀,在96孔板上于室温下孵育30 min,后在培养箱中孵育24 h,然后通过自动荧光板读数器测量荧光强度。
1.6 细胞活力测定 CCK8检测试剂盒(货号HY-K0301)购自MCE, 通过平行实验于96孔板中进行活力测定,其中用CRT0066101处理未感染的MRC-5细胞和Vero-E6细胞。在处理结束前3 h,将10 μL CCK8溶液加入细胞中。将细胞于37 ℃下孵育4 h后,用酶标仪测量细胞活力。
1.7 病毒终点滴度测定(TCID50) 将MRC-5细胞或Vero-E6细胞在96孔板中用含2%FBS的DMEM培养基孵育,病毒连续稀释8个稀释度,重复6次,孵育3~5 d。根据Karber法计算每个孔中存在CPE的数量进行病毒滴度评估。
1.8 免疫荧光染色 细胞在室温下用4%多聚甲醛固定15 min,使用0.25% 的Triton X-100处理15 min。PBS清洗3遍,加10%牛血清白蛋白孵育30 min。随后,将细胞与指定的一抗mouse PI(4,5)P2(PI(4,5)P22C11) (Santa Cruz,货号sc-53412), rabbit Anti-TGN46 antibody (Abcom,货号Ab50595), HCoV-229E Human Coronavirus Spike RBD Antibody (R&D,货号MAB10938), and mouse anti-P230 (fishersci,货号BDB611280) 一起在冷藏室孵育过夜,然后与适当的Alexa Fluor偶联二抗(thermofisher)孵育1.5 h。最后用4′, 6-二脒基-2-苯基吲哚(DAPI,thermofisher,货号D1306)对细胞进行染色以可视化DNA。在共聚焦显微镜(Olympus FV1000)下观察细胞,并获得图像,使用ImageJ软件分析图像。
1.9 蛋白质印迹 收集HCoV-229E感染的细胞后,在含有蛋白酶(Sigma-Aldrich,货号A32963)的冰细胞裂解缓冲液中裂解细胞,并将其用5X上样缓冲液(thermofishe,货号A32963)煮沸10 min。将蛋白质上样到10% Bis-Tris SDS-PAGE凝胶上,然后转移到聚偏二氟乙烯膜上。在室温下将膜封闭在5%牛血清白蛋白中1 h。将一抗(PKD1抗体, PKD2抗体, PKD3抗体和Tubulin抗体,均购自Cell signaling, 货号2052,8188,5655和2144S)在4 ℃孵育过夜,二抗在室温下孵育1.5 h,然后加入ECL试剂(Bio-Rad,货号1705060S)并在imgaeDoc(Bio-Rad)上收集数据。
1.10 实时荧光定量PCR 从细胞中提取总RNA,PBS洗涤细胞,用含有β-巯基乙醇(Sigma,货号19-1335)的RLT缓冲液(Qiagen,货号74104)以1∶100稀释度裂解。mRNA提取利用RNeasymini试剂盒(Qiagen,货号74104)进行。使用Omniscript RT 试剂盒(Qiagen,货号205113)在 37 ℃下逆转录 1 μg的 mRNA后进行 cDNA 的合成。CFX-96实时荧光定量PCR检测系统(Bio-Rad,Hercules,CA,USA)与iQ SYBR绿色超级混合物(Bio-Rad,货号1725150)在94 ℃条件下进行聚合酶链反应(qPCR)10 min,40 次循环,94 ℃持续 15 s,58 ℃持续 30 s,72 ℃持续 30 s;并在 72 ℃下最终伸长15 min。使用引物对目标mRNA的水平进行定量,如下所示:HumanPrkd1上游引物5′- ACC CTT GGC TAC AGG ACT AT-3′, HumanPrkd1下游引物 5′- CCA CCT CAG GTC ATC ACT TTC-3′; HumanPrkd2上游引物5′- AGG GTT GGG TGG TTC ATT AC-3′, HumanPrkd2下游引物5′- TAT CTG TTG GTC GTG TTG TTC T-3′ ; HumanPrkd3上游引物5′- TGT TCC CTG CAA CTG TTT CTG-3′, HumanPrkd3下游引物5′- CTC TCT CGT GTG AGG CCA ATC-3′; Human Gapdh上游引物5′- GGT GAA GGT CGG TGT GAA CG-3′, Human Gapdh下游引物5′- CTC GCT CCT GGA AGA TGG TG-3′; HCoV- 229E 上游引物5′- TTC CGA CGT GCT CGA ACT TT-3′, HCoV- 229E 下游引物5′- CCA ACA CGG TTG TGA CAG TGA-3′, 18S rRNA 上游引物5′- CGC CGC TAG AGG TG A AAT TCT-3′, 18S rRNA 下游引物5′- CAT TCT TGG CAA ATG CTT TCG-3′。将每个基因的水平归一化至18S rRNA或Gapdh的水平进行定量,并使用DNA扩增产生的标准曲线计算目的基因的确切拷贝数。
2 结 果
2.1 PKD家族成员在HCoV-229E感染过程中的表达 将MRC-5细胞以MOI值为10的HCoV-229E感染7 d,并在感染后的每天收集细胞样品,通过qPCR分析检测病毒的mRNA表达水平,结果显示,HCoV-229E的病毒感染量在第4 d达到峰值(图1 A)。同时, 与未感染组相比,Prkd1,Prkd2和Prkd3的表达水平均增加(图1 B),Western blot结果显示PKD1, PKD2和 PKD3的蛋白表达水平也显著升高(图1 C)。这些结果表明PKD家族成员参与HCoV-229E的复制过程。
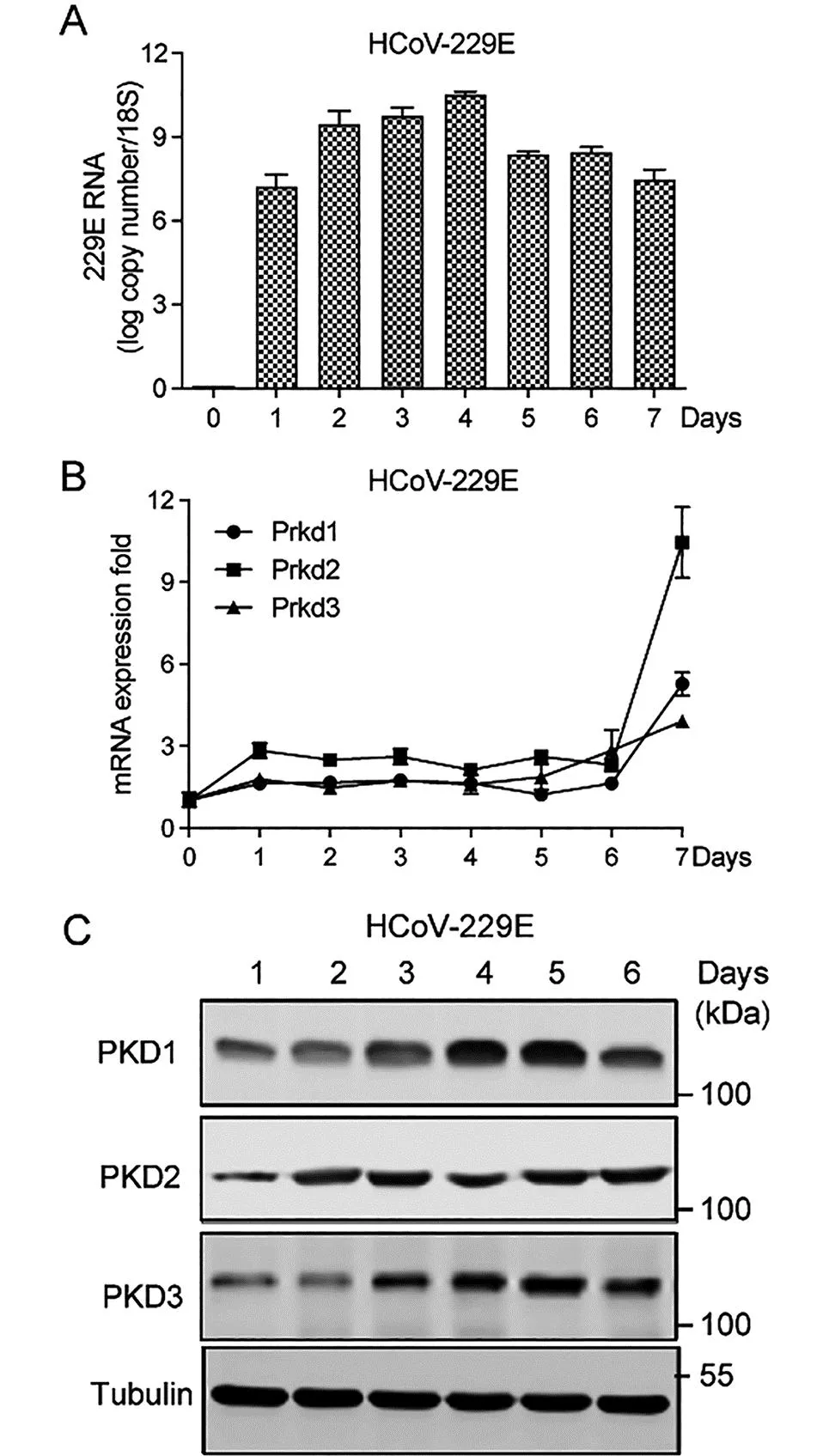
注:A. qPCR检测10MOI HCoV-229E感染MRC-5细胞过程中的mRNA水平;B和C. MOI值为10的HCoV-229E感染MRC-5细胞,共培养7 d,每天收集细胞并制备细胞提取物,qPCR检测PKD家族的RNA水平(B), Western blot检测PKD1, PKD2和 PKD3的蛋白表达水平(C),每组实验均独立重复3次。
2.2Prkd3敲除或过表达对HCoV-229E复制的影响 使用Si-RNA敲低Prkd3的表达,qPCR检测结果表明Prkd3的表达水平下降了80%,而Prkd1和Prkd2的水平没有显著性改变(图2 A)。Prkd3敲低的MRC-5细胞感染10 MOI HCoV-229E 48 h后,与对照组相比,HCoV-229E的mRNA表达量和滴度显著降低(t表达量=8.999,P<0.001;t滴度=6.920,P<0.001)(图2 B 和图2 C)。在Prkd3过表达组,qPCR检测结果显示Prkd3表达增加了约4倍,而Prkd1和Prkd2水平没有显著性改变(图2 D),且HCoV-229E的mRNA表达量和滴度水平显著增加(t表达量=6.630,P<0.001;t滴度=5.794,P<0.001)(图2 E 和图2 F)。这些结果表明PKD3参与调节HCoV-229E在细胞内的复制。
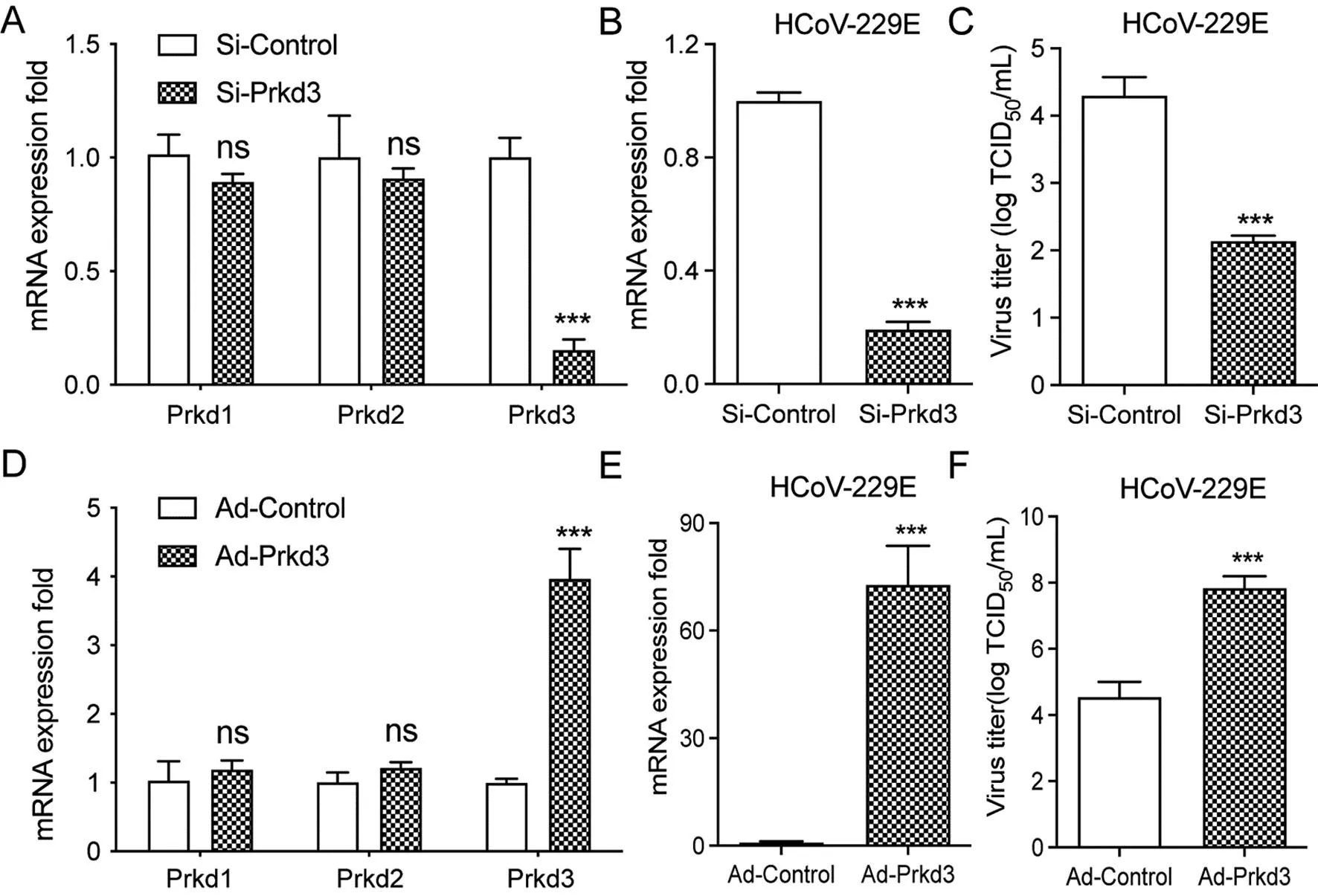
注:A. MRC-5细胞进行Si-Prkd3或Si-Control的转染处理,转染后48 h提取RNA,qPCR定量Prkd1,Prkd2和Prkd3的mRNA水平;B和C. Si-Prkd3或Si-Control的转染MRC-5细胞48 h,感染10 MOI HCoV-229E,qPCR(B)和TCID50实验(C)测定测定病毒的mRNA和滴度;D. MRC-5细胞以1 MOI Ad-Prkd3或Ad-Control的转染处理,转染后48 h提取mRNA,qPCR定量Prkd1,Prkd2和Prkd3的mRNA水平;E和F. 1 MOI Ad-Prkd3或Ad-Control转染48 h,MRC-5细胞感染10 MOI HCoV-229E,qPCR(E)和TCID50实验(F)测定病毒的mRNA和滴度。每组实验均独立重复3次,结果以表示,*P<0.05,**P<0.01,***P<0.001。
2.3 PKD抑制剂CRT0066101在HCoV-229E复制过程中的作用 采用不同浓度(0,3,6,9,12,15 μmol/L)的CRT0066101处理MRC-5 细胞24 h,通过CCK8试剂盒检测细胞活性,结果显示,当CRT0066101浓度超过9.0 μmol/L时,出现了明显的细胞毒性,而浓度在3.0 μmol/L以下对细胞活性没有明显影响(图3 A)。以不同浓度(0,1,3,6 μmol/L)的CRT0066101处理10 MOI HCoV-229E感染的MRC-5 细胞72 h,通过qPCR和TCID50检测病毒mRNA表达量和滴度水平,结果显示,与对照组相比,3.0 μmol/L CRT0066101处理的MRC-5 细胞,HCoV-229E复制水平显著下降(t=6.931,P<0.001;t=4.055,P<0.01)(图3 B 和图3 C)。此外,免疫荧光染色结果显示在HCoV-229E感染的MRC-5细胞中,HCoV-229E-RBD的表达水平显著升高,TGN发生裂变,在CRT0066101处理组中,HCoV-229ERBD的表达水平显著降低,TGN明显聚合(图3 D)。这些结果表明PKD抑制剂能够有效减少HCoV-229E的复制和表达,且可能通过影响TGN裂变导致的。

注:A. 不同浓度梯度的CRT0066101处理MRC-5细胞,孵育24 h,并通过CCK8测定细胞活力;B和C. MRC-5细胞感染10 MOI HCoV-229E后,与不同浓度梯度的CRT0066101孵育72 h,qPCR(B)和TCID50实验(C)测定病毒的mRNA和滴度,D. 对10 MOI HCoV-229E感染的MRC-5细胞进行3.0 μmol/L CRT0066101处理,采用抗TGN46抗体和抗229E-RBD抗体进行免疫荧光染色,共聚焦显微镜下,比例尺为20 μm,每组实验均独立重复3次,结果以表示,*P<0.05,**P<0.01,***P<0.001。
2.4 PKD通过PI4KIIIβ调控TGN的裂变参与的HCoV-229E复制 为了进一步研究PKD是否通过调控TGN结构影响病毒复制,将10 MOI HCoV-229E感染MRC-5细胞1 h后加入3.0 μmol/L CRT0066101培养48 h,免疫荧光染色结果显示,在病毒感染的对照组细胞中,TGN膜结构发生裂变,形成囊泡,然而在 CRT0066101处理后,TGN结构恢复正常,与空白对照组形态几乎一致(图4A)。已有研究表明,PKD通过磷酸化底物磷脂酰肌醇 4-激酶 IIIβ(PI4KIIIβ)将磷酸肌醇(PI)磷酸化为磷脂酰肌醇4-磷酸(PI4P),在磷脂酰肌醇5-激酶(PI4P5K)的磷酸化作用下生成磷脂酰肌醇4,5-二磷酸[PI(4,5)P2],进而参与维持TGN的结构稳定[13]。为了明确这一信号通路是否参与PKD调控的HCoV-229E复制,采用siRNA敲低Prkd3的表达,检测活细胞中PI(4,5)P2的生成,结果表明,与对照组相比,Prkd3的降低显著抑制了PI(4,5)P2的表达水平(t=7.394,P<0.001)(图4 B)。免疫荧光染色和活细胞PI(4,5)P2检测结果显示3.0 μmol/L CRT0066101处理的MRC-5细胞24 h的PI(4,5)P2的表达水平显著降低(t=5.968,P<0.01)(图4 C和图4D)。采用1.0 μmol/L PI4KIIIβ抑制剂(BQR695)处理MRC-5细胞24 h后,与对照组相比,细胞中的PI(4,5)P2表达水平降低(图4E),值得注意的是,1.0 μmol/L BQR695挽救了Prkd3过表达导致的PI(4,5)P2表达升高(t=6.671,P<0.01)(图4 F),免疫荧光结果显示1.0 μmol/L BQR695处理10 MOI HCoV-229E感染的MRC-5 细胞24 h后,与对照组相比,TGN明显聚合在一起(图4 G),1.0 μmol/L的BQR695处理10 MOI HCoV-229E感染的MRC-5细胞72 h后,免疫荧光染色表明BQR-695处理的MRC-5细胞中HCoV-229ERBD的表达水平显著降低(图4 H),不同浓度的BQR-695处理10 MOI HCoV-229E感染的MRC-5 细胞72 h后,通过qPCR和TCID50检测HCoV-229E的mRNA表达量和滴度水平,与对照组相比,0.1 μmol/L BQR-695处理的MRC-5 细胞中HCoV-229E的mRNA表达量和滴度水平显著下降(t表达量=5.151,P<0.001;t滴度=7.744,P<0.001)(图4 I 和J)。这些结果表明PKD通过调控PI4KIIIβ参与的PI(4,5)P2生成和TGN裂变,从而影响了HCoV-229E的复制。

注:A. 10 MOI HCoV-229E感染的MRC-5细胞在3.0 μmol/L CRT0066101处理48 h,使用抗P230抗体和抗TGN46抗体进行免疫荧光染色,共聚焦显微镜下观察TGN结构变化;B. 采用Si-Prkd3或Si-Control 转染MRC-5细胞24 h,通过活细胞PI(4,5)P2法定量PI(4,5)P2水平;C和D. 10 MOI HCoV-229E感染MRC-5细胞后经3.0 μmol/L CRT0066101处理24 h,使用抗PI(4,5)P2抗体和抗TGN46抗体进行免疫荧光染色(C),共聚焦显微镜下观察PI(4,5)P2和TGN结构变化,活细胞PI(4,5)P2测定法(D)定量PI(4,5)P2表达水平。E. 1.0 μmol/L BQR695处理HCoV-229E感染的MRC-5细胞24 h,通过活细胞PI(4,5)P2测定法测量PI(4,5)P2水平。F. 活细胞PI(4,5)P2测定法测量1.0 μmol/L BQR695处理Ad-Prkd3转染的MRC-5细胞的PI(4,5)P2水平。G. 1.0 μmol/L BQR695处理10 MOI HCoV-229E感染的MRC-5细胞72 h,使用P230抗体和抗TGN46抗体进行免疫染色,分析TGN结构。H. 1.0 μmol/L BQR-695处理10 MOI HCoV-229E感染的MRC-5细胞72 h,使用抗TGN46抗体和抗229E-RBD抗体进行免疫染色,并分析HCoV-229E含量。I和J:MRC-5细胞感染10 MOI HCoV-229E,并与不同浓度梯度的BQR-695孵育72 h。通过qPCR(I)和TCID50实验(J)测定mRNA表达量和滴度水平。比例尺为20 μm,每组实验均独立重复3次,结果以表示,*P<0.05,**P<0.01,***P<0.001。
2.5 CRT0066101对HCoV-229E在Vero-E6细胞中的复制影响 基于CRT0066101在MRC-5细胞中对HCoV-229E复制和表达具有显著抑制效果,进一步验证CRT0066101在其他类型细胞中的作用。细胞活性检测结果显示,CRT0066101浓度低于3.0 μmol/L下对Vero-E6细胞没有细胞毒性作用。在10 MOI HCoV-229E感染的Vero-E6细胞中使用不同浓度(0,1,3 μmol/L)的CRT0066101处理72 h后,qPCR和TCID50检测病毒mRNA表达量和滴度水平。与对照组相比,3.0 μmol/L CRT0066101处理的Vero-E6细胞中的HCoV-229E的mRNA表达量(t=7.480,P<0.001)和滴度水平(t=7.228,P<0.01)显著下降。这些结果表明CRT0066101在Vero-E6细胞中也能够抑制HCoV-229E的复制。
3 讨 论
蛋白激酶D在调节高尔基体膜裂变和融合,反式高尔基体网络到质膜的囊泡转运以及维持脂质稳态方面起着重要作用[14-15]。然而,PKD与人类冠状病毒复制是否相关尚不完全清楚。本研究分析了PKD在HCoV-229E感染MRC-5细胞和Vero-E6细胞中的生物学作用,明确了PKD在HCoV-229E感染过程中显著升高。与PKD1和PKD2相比,PKD3表达量的变化在HCoV-229E感染阶段发挥重要作用。RNAi干扰敲低PKD3的表达和PKD抑制剂CRT0066101抑制PKD活性显著降低HCoV-229E的mRNA表达和病毒滴度,表明PKD参与HCoV-229E的复制过程,机制上,PKD通过调控PI4KIIIβ影响TGN裂变参与HCoV-229E的复制。
本研究评估了PKD抑制剂CRT0066101在抑制HCoV-229E复制中的有效性。已有研究表明CRT0066101对多种病毒具有抗病毒活性,包括人类鼻病毒[16]、甲型流感病毒[17]、单纯疱疹病毒1[14]和丙型肝炎病毒[18]。动物模型研究也表明,在80 mg/kg的剂量给药情况下,CRT0066101具有良好的细胞耐受性[19]。本研究结果表明,3 μmol/L的CRT0066101在HCoV-229E感染的MRC-5细胞中的病毒抑制作用最显著。值得注意的是,细胞活力测定的CRT0066101有效浓度远低于细胞毒性剂量。这表明CRT0066101可以有效阻断病毒mRNA复制和释放,这是病毒复制周期中至关重要的晚期事件。本研究结果提示进一步使用动物模型评估CRT0066101的抗HCoV-229E复制作用值得研究。
本研究探索了PKD抑制剂阻断冠状病毒复制的潜在机制。研究表明,磷脂酰肌醇4-激酶 IIIβ(Phosphatidylinositol 4-kinase III beta,PI4KIIIβ)是高尔基体复合体结构的重要成分,也是PKD的底物之一[20]。PKD磷酸化PI4KIIIβ可以激活其脂质激酶活性并增强囊泡运输[21]。PI4KIIIβ将磷酸肌醇(Phosphates Isositol,PI)转化为磷脂酰肌醇4-磷酸(Phosphatidylinositol 4-phosphate,PI4P),后者在高尔基体膜定位中起到重要作用[13]。PI4P经过磷脂酰肌醇5-激酶(Phosphatidylinositol 5-kinase,PI4P5K)的磷酸化转化为磷脂酰肌醇4,5-二磷酸(Phosphatidylinositol 4,5-bisphosphate,PI(4,5)P2)[22]。因此,测定PI(4,5)P2水平可间接反映PI4KIIIβ的激活情况。本研究发现,PI4KIIIβ抑制剂(BQR695)挽救PKD3过表达导致的PI(4,5)P2升高,表明PI4KIIIβ参与PKD调控的PI(4,5)P2的生成,这与先前观察到的PKD调节PI4KIIIβ激活的结果一致[13]。Grazia Martina等[23]已经证实PI4KIIIβ的抑制剂抑制SARS-CoV-2的复制,这提示本研究的分子机制的合理性。
已有研究表明,PI4KIIIβ对于几种小RNA病毒的RNA复制至关重要[24-25]。PI4KIIIβ是SARS-CoV刺突蛋白进入细胞的必需分子,它不会影响病毒在SARS-CoV S-ACE2结合或病毒内化阶段,而是在病毒融合之前或融合时发挥作用,表明PI4KIIIβ调控SARS-CoV进入宿主细胞[26]。本研究结果表明,BQR695抑制PI4KIIIβ的活性能够阻断高尔基体裂变和囊泡运输,且显著降低HCoV-229E的mRNA复制和病毒滴度。这些数据表明,细胞膜和高尔基体之间的脂质循环对冠状病毒的复制起到重要作用。最近的一项研究表明,宿主脂质激酶PI4KIIIβ的抑制剂可以在低至微摩尔浓度下阻断SARS-CoV-2的复制[23]。但是,PI4KIIIβ能否抑制SARS-CoV-2的复制的机制仍需进一步研究。
综上所述,本研究证实PKD作为一种新的宿主因子,通过调控PI4KIIIβ在冠状病毒复制中发挥关键作用,并影响冠状病毒感染细胞中的高尔基体的裂变和囊泡形成。本研究不仅加深了对PKD/PI4KIIIβ通路调控冠状病毒复制机制的理解,也通过体外试验证明了PKD抑制剂和PI4KIIIβ抑制剂显著抑制人类冠状病毒的作用,为研发广谱抗病毒药物以应对冠状病毒感染提供了基础。
(致谢:本研究项目在美国罗彻斯特大学医学中心Zheng-gen Jin教授实验室完成。)
利益冲突:无

