血清组织蛋白酶K、解聚蛋白样金属蛋白酶-7与慢性心力衰竭患者心室重构和预后的关系
梁卫章 石建平 柴丽娜 韩爱子
(邯郸市中心医院心内科,河北 邯郸 056000)
慢性心力衰竭(chronic heart failure,CHF)是继发于多种心脏疾病的心脏结构和/或功能障碍,以进行性泵衰竭和液体积聚为特征。尽管目前临床对心力衰竭的治疗已取得了一定的进展,但仍不能抑制心功能的进行性恶化[1]。心室重构是指心脏结构和功能在炎症、神经激素介质和室壁应力增加等各种刺激下出现的代偿性心脏结构改变过程。随着时间的推移,持续心室重构会导致心脏功能逐渐恶化,进而导致心力衰竭,甚至心源性休克和死亡[2]。组织蛋白酶K(cathepsin K,Cat-K)是一种半胱氨酸蛋白酶,与心肌梗死、心肌肥厚等心血管疾病有关,是血管重塑的主要胶原酶之一[3]。解聚蛋白样金属蛋白酶-7(a disintegrin and metalloproteinase with thrombospondin motifs 7,ADAMTS-7)是具有血小板反应蛋白基序的解聚蛋白样金属蛋白酶家族成员,可降解细胞外基质(extracellular matrix,ECM),参与血管重塑[4]。急性心肌梗死患者血浆ADAMTS-7水平升高,且与急性心肌梗死后心力衰竭患者心室结构改变有关[4]。因此,Cat-K、ADAMTS-7可能与CHF病情进展有关。本研究拟探讨Cat-K、ADAMTS-7与CHF患者心室重构和预后的关系,旨在为CHF的临床诊治提供参考。
1 材料和方法
1.1 研究对象
选取2018年2月-2020年6月邯郸市中心医院CHF患者195例(CHF组),其中男111例、女84例,年龄(60.78±7.43)岁,纳入标准:1)具有典型的心力衰竭症状(肺啰音、下肢水肿、心脏杂音、颈静脉充盈等),胸部X线检查提示心脏扩大、肺淤血,心电图提示QRS波形异常,超声心动图提示心脏结构和功能异常,B型钠尿肽(B-type natriuretic peptide,BNP)>35 ng/L或氨基末端B型钠尿肽原(N-terminal pro-B-type natriuretic peptide,NT-proBNP)>125 ng/L,符合《中国心力衰竭诊断和治疗指南2018》[5]中的诊断标准;2)射血分数正常的心力衰竭[左心室射血分数(left ventricular ejection fraction,LVEF)≥50%];3)纽约心脏协会(New York Heart Association,NYHA)[6]分级为Ⅱ~Ⅳ级。排除标准:1)心包积液、缩窄性心包炎、肝硬化腹水;2)支气管哮喘;3)合并高血压、免疫性疾病、急性感染和慢性感染;4)有心脏手术史、先天性心脏病或先天性主动脉狭窄;5)患精神类疾病;6)随访失访。另选取邯郸市中心医院健康体检者101名(对照组),排除器质性或功能性心脏疾病、高血压等系统疾病。2个组之间年龄、性别差异均无统计学意义(P>0.05)。本研究经邯郸市中心医院伦理委员会批准(2018H-0107),患者及其家属均知情同意并签署同意书。
1.2 方法
1.2.1 实验室指标检测
收集所有研究对象的一般资料[性别、年龄、体重指数(body mass index,BMI)、吸烟史、饮酒史、基础疾病(糖尿病、高脂血症)史等]。采集CHF患者入组当日、健康体检者体检当日清晨的静脉血,1 007×g离心分离血清,-20 ℃保存。采用ONETOUCH血糖仪(美国强生公司)和配套试纸条检测手指末梢随机血糖。采用AC6601糖化血红蛋白分析仪(江苏奥迪康公司)检测糖化血红蛋白(glycated hemoglobin A1c,HbA1c)水平。采用cobas e411全自动电化学发光免疫分析仪(瑞士罗氏公司)和配套试剂检测NT-proBNP、BNP水平,参考区间分别为0~125、0~35 ng/L。采用酶联免疫吸附试验检测血清Cat-K、ADAMTS-7水平,试剂盒购自上海通蔚公司,检测仪器为Multiskan FC酶标仪(美国ThermoFisher Scientific公司),Cat-K参考区间为5~30 pg/mL,ADAMTS-7参考区间为0~2.5 ng/mL。
1.2.2 超声心动图检查
采用Vivid E9心脏超声诊断仪(美国GE公司)进行检查,三维探头频率为1.5~3.5 MHz。采用改良双平面Simpson法检测LVEF,选取左心室长轴、心尖四腔、心尖五腔切面测量左心室舒张末期内径(left ventricular end-diastolic diameter,LVEDD)、左心室后壁厚度(left ventricular posterior wall thickness,LVPWT)、室间隔厚度(interventricular septum thickness,IVST),测量3个心动周期,取均值。计算左心室质量指数(left ventricular mass index,LVMI)。
1.3 随访
给予所有CHF患者常规利尿剂、醛固酮受体拮抗剂、肾素-血管紧张素系统抑制剂治疗和基础疾病的对症治疗。出院后采用电话回访或门诊复查随访12个月,统计随访期间终点事件[NYHA心功能分级恶化(较出院前NYHA心功能分级增加)、因心力衰竭再次入院或死亡]的发生情况。根据是否发生终点事件将患者分为预后良好组(132例)和预后不良组(63例)。
1.4 统计学方法
采用SPSS 25.0软件进行统计分析。呈正态分布的计量资料以±s表示,组间比较采用单因素方差分析,两两比较采用LSD-t检验,趋势检验采用两分类资料转换后的Cochran Armitage趋势分析。计数资料以例或率表示,组间比较采用χ2检验。采用Pearson相关分析评估各项指标之间的相关性。采用Logisitc回归分析评估CHF患者预后不良的危险因素。采用受试者工作特征(receiver operating characteristic,ROC)曲线评估Cat-K、ADAMTS-7判断CHF患者预后不良的效能。以P<0.05为差异有统计学意义。
2 结果
2.1 CHF组和对照组一般资料比较
CHF组吸烟史、饮酒史、基础疾病史均高于对照组(P<0.05),2个组之间BMI差异无统计学意义(P>0.05)。见表1。
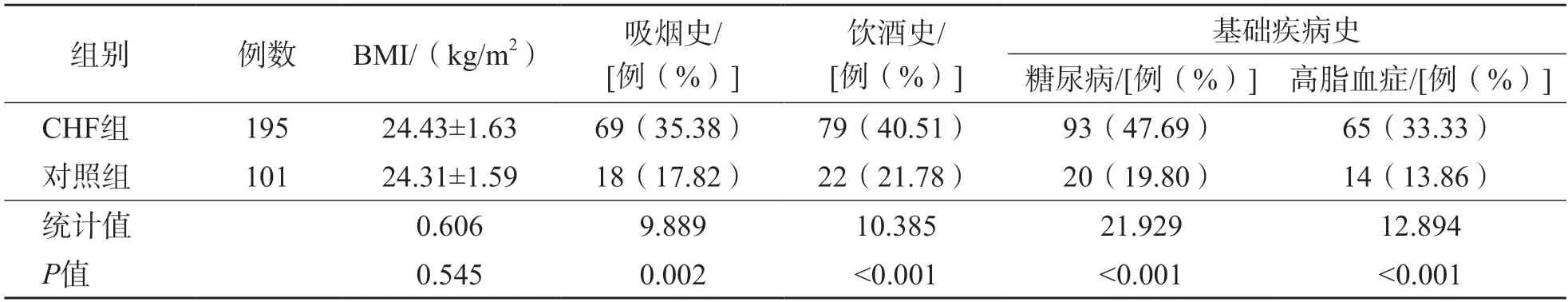
表1 CHF组和对照组一般资料比较
2.2 CHF组、对照组血清Cat-K、ADAMTS-7比较
CHF组血清Cat-K、ADAMTS-7高于对照组(P<0.05)。见表2。
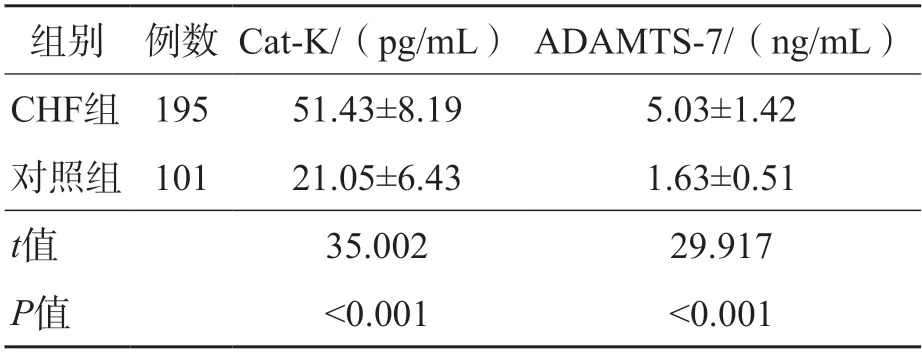
表2 CHF组、对照组血清Cat-K、ADAMTS-7比较
2.3 不同NYHA分级CHF患者血清Cat-K、ADAMTS-7、BNP、NT-proBNP水平和心室重构参数比较
NYHA Ⅳ级组血清Cat-K、ADAMTS-7、BNP、NT-proBNP、LVEDD、LVPWT、IVST、LVMI均高于NYHA Ⅲ级组和NYHA Ⅱ级组(P<0.05),LVEF低于NYHA Ⅲ级组和NYHA Ⅱ级组(P<0.05)。NYHA Ⅲ级组血清Cat-K、ADAMTS-7、BNP、NT-proBNP水平,LVEDD、LVPWT、IVST、LVMI高于NYHAⅡ级组(P<0.05),LVEF低于NYHA Ⅱ级组(P<0.05)。见表3。
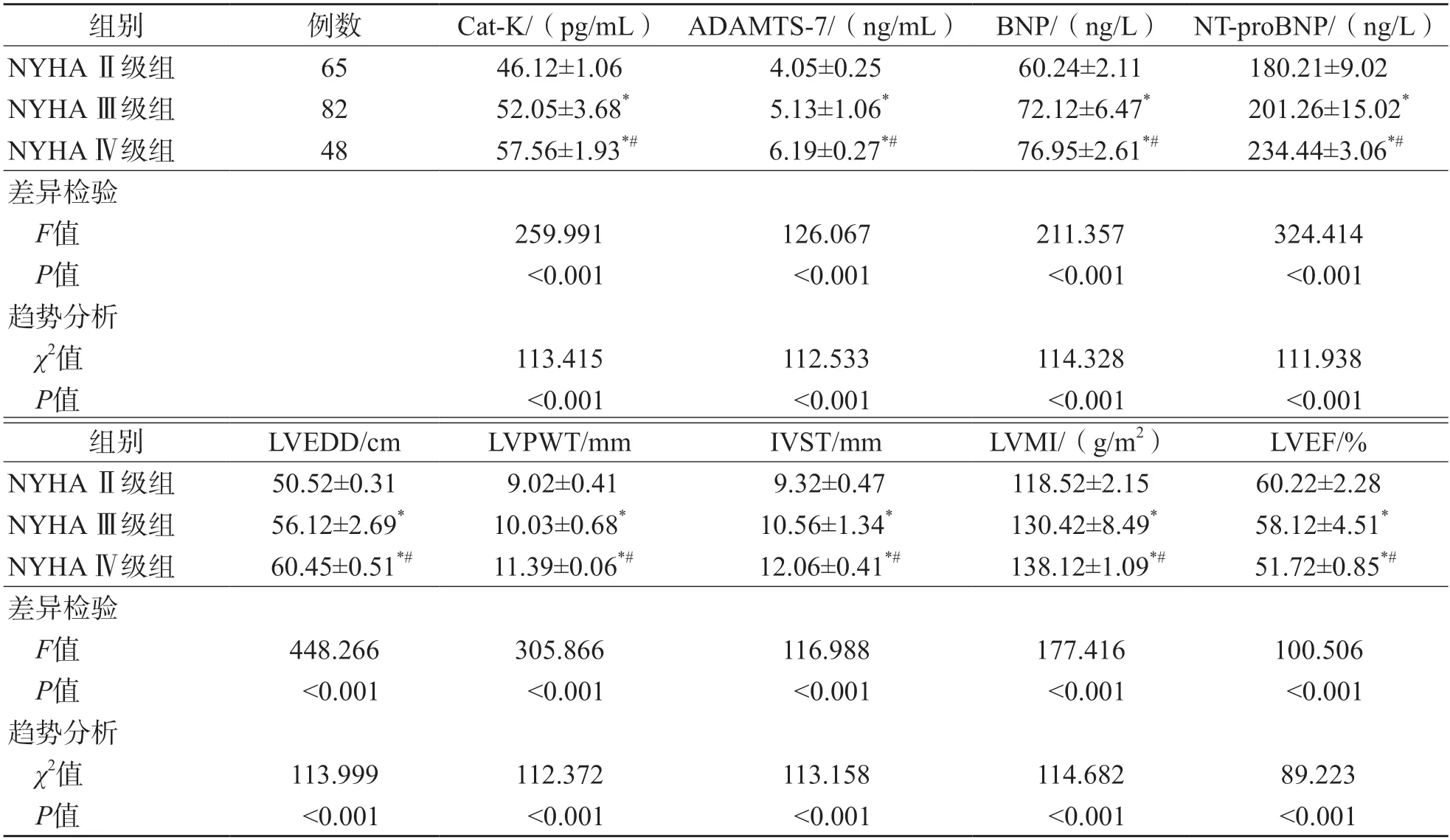
表3 不同NYHA分级CHF患者各项指标比较
2.4 Cat-K、ADAMTS-7与BNP、NT-proBNP、心室重构参数的相关性分析
Pearson相关分析结果显示,C a t-K、ADAMTS-7与BNP、NT-proBNP、LVEDD、LVPWT、IVST、LVMI 均呈正相关(P<0.05),与LVEF呈负相关(P<0.05)。见表4。
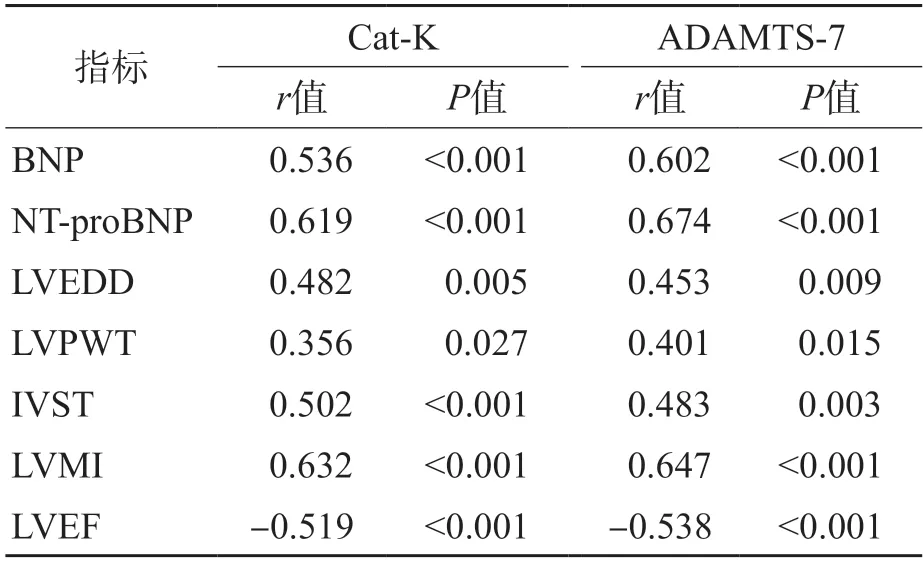
表4 Cat-K、ADAMTS-7与BNP、NT-proBNP、心室重构参数的相关系数
2.5 CHF患者预后不良的危险因素分析
以CHD患者出院12个月内终点事件发生情况为因变量(0=未发生,1=发生),以吸烟史(0=否,1=是)、饮酒史(0=否,1=是)、高脂血症(0=否,1=是)、糖尿病(0=否,1=是)、NYHA分级(0=Ⅱ级,1=Ⅲ~Ⅳ级)和年龄、随机血糖、HbA1c、Cat-K、ADAMTS-7、BNP、NT-proBNP、LVEDD、LVPWT、IVST、LVMI、LVEF为自变量(连续性变量原值代入),进行单因素Logistic回归分析,再将单因素回归中差异有统计学意义的变量纳入多因素Logistic回归分析,采用逐步后退法(α留=0.05,α退=1.0)进行分析。结果显示,NT-proBNP、NYHA分级、Cat-K、ADAMTS-7升高和LVEF降低均是CHF患者预后不良的危险因素[比值比(odds ratio,OR)值分别为1.057、1.772、1.075、1.335、0.903,95%可信区间(confidence interval,CI)分别为1.003~1.113、1.159~2.709、1.034~1.116、1.091~1.634、0.819~0.996]。见表5。
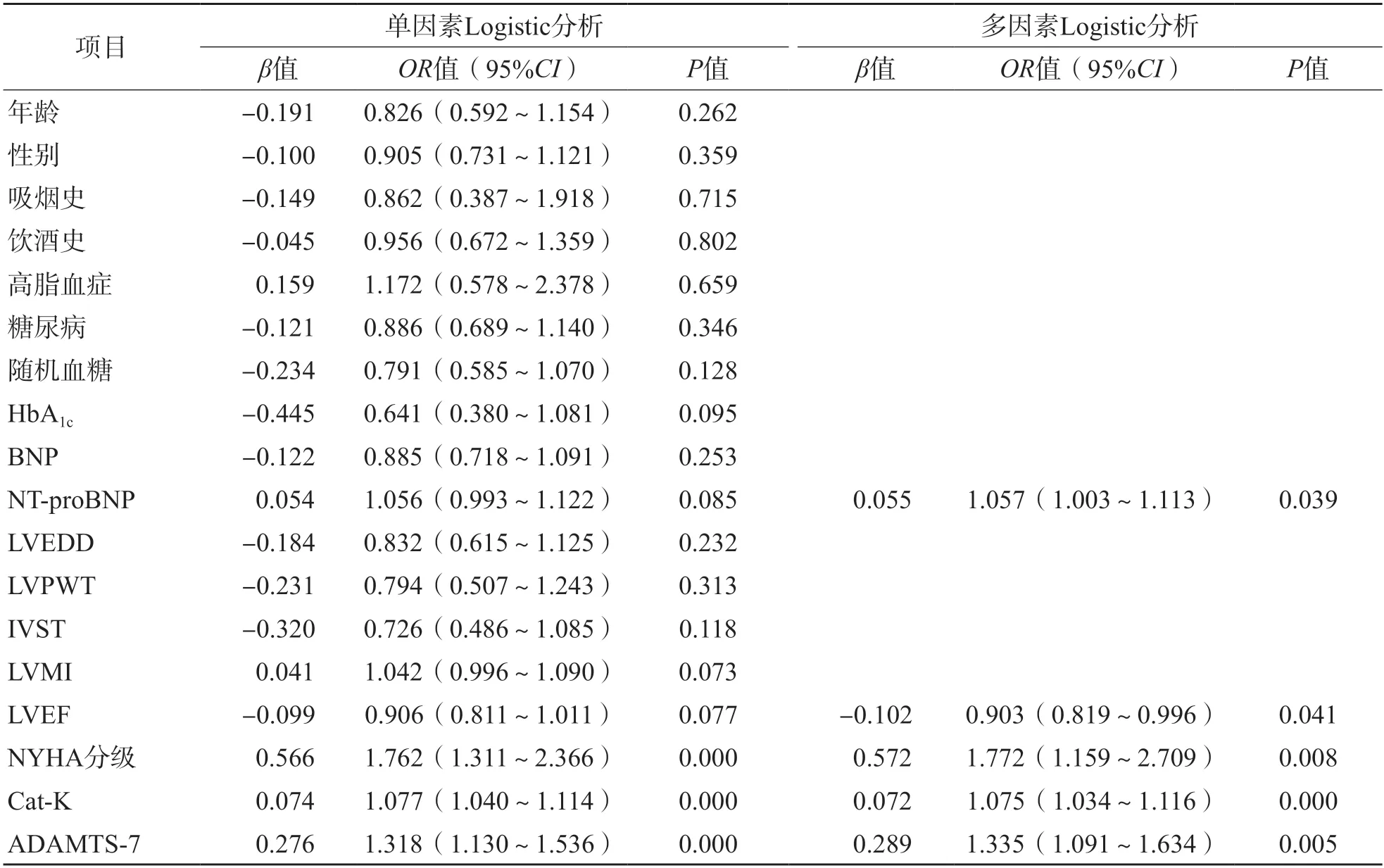
表5 CHF患者预后不良的危险因素分析
2.6 各项指标单项和联合检测判断CHF患者预后不良的效能
ROC曲线分析结果显示,NT-proBNP、LVEF、NYHA分级、Cat-K、ADAMTS-7单项检测判断C H F 患者预后不良的曲线下面积(area under curve,AUC)分别为0.729、0.704、0.803、0.720、0.688。根据L o g i s t i c 回归分析结果建立风险评估/预测模型:Ln(P/1-P)= 0.055×NT-proBNP-0.102×LVEF+0.572×NYHA分级+0.072×Cat-K+0.289×ADAMTS-7,以模型结果作为5项指标联合检测的虚拟概率量指标,结果显示,联合检测判断CHF患者预后不良的AUC为0.886。见表6、图1。
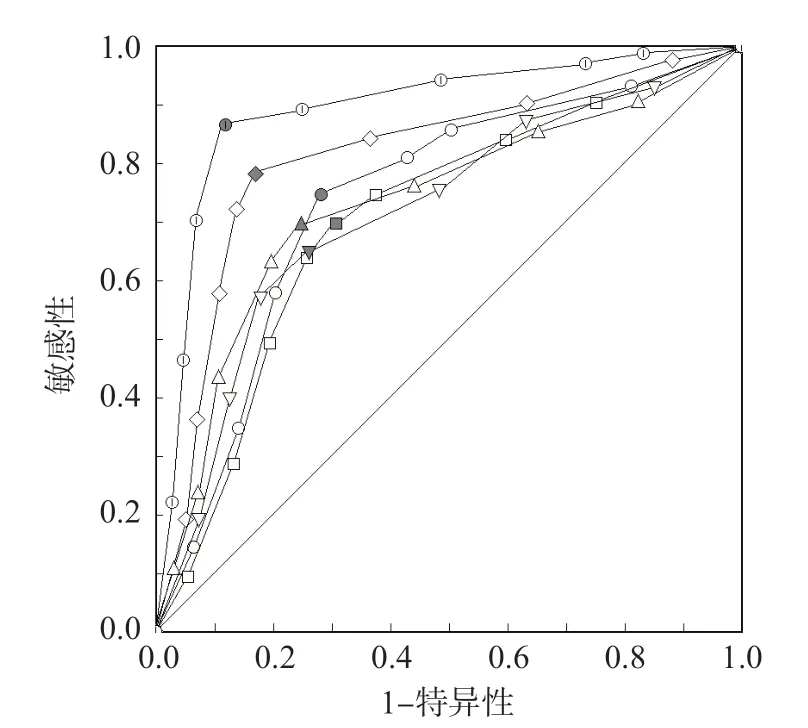
图1 各项指标判断CHF患者预后不良的ROC曲线
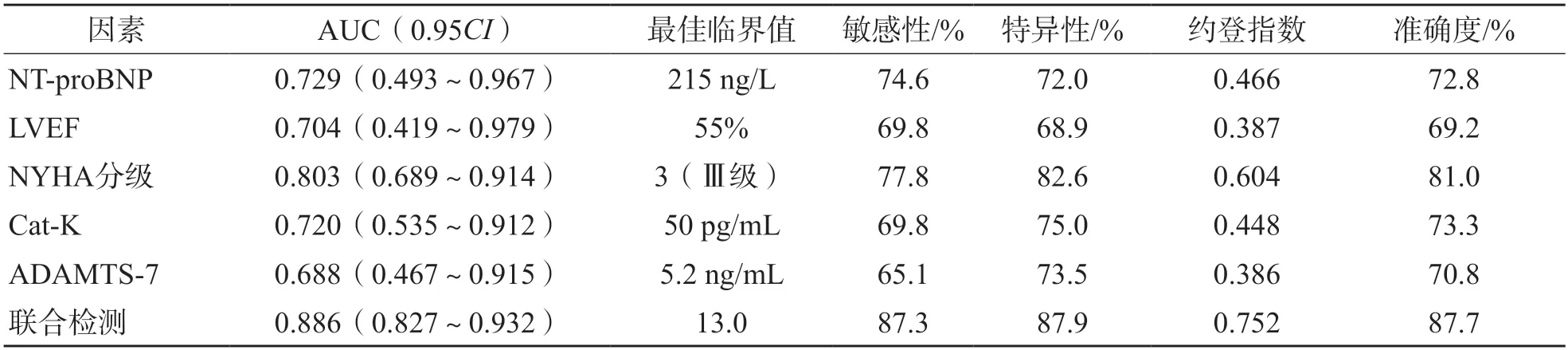
表6 Cat-K、ADAMTS-7判断CHF患者预后不良的ROC曲线参数
3 讨论
本研究结果显示,不同心功能CHF患者LVEDD、LVPWT、IVST、LVMI和LVEF存在显著差异性,表现为NYHA Ⅳ级组LVEDD、LVPWT、IVST、LVMI高于NYHA Ⅲ级组和NYHA Ⅱ级组,LVEF低于NYHA Ⅲ级组和NYHA Ⅱ级组,表明CHF患者存在不同程度心室重构,且随着心功能减退,重构程度有所深入。心室重构是CHF发生和进展的关键,涉及心肌细胞凋亡、心脏肥大和心肌纤维化等一系列复杂病理过程,随着心肌的进行性肥厚,心腔不断增大,导致收缩和/或舒张功能障碍,损害心脏功能,促进心血管事件发生,甚至死亡[7]。压力超负荷是心室重构的一个重要因素,高血压或腔室流出阻塞可引起心肌细胞肥大、ECM蛋白沉积和心肌纤维化[8]。ECM降解与心室重构的发生有关,压力超负荷、缺血性损伤等可激活心脏成纤维细胞基质合成程序,诱导肌成纤维细胞转化,刺激ECM蛋白合成,持续压力超负荷和缺血损伤可导致心室扩张性重塑和收缩功能障碍[9]。
组织蛋白酶具有参与调控蛋白质周转、激素或神经肽加工、生长因子表达等多种功能,其在高血压诱导的心力衰竭和心肌梗死患者中表达升高[10]。本研究结果显示,CHF组血清Cat-K水平高于对照组(P<0.05),且Cat-K与BNP、NT-proBNP、LVEDD、LVPWT、IVST、LVMI呈正相关(r值分别为0.536、0.619、0.482、0.356、0.502、0.632,P<0.05),与LVEF呈负相关(r=-0.519,P<0.05),说明Cat-K可能参与了CHF患者心室重构的过程。Cat-K是一种溶酶体半胱氨酸蛋白酶,具有很强的弹性蛋白酶和胶原酶特性,可介导细胞蛋白质周转、胶原蛋白降解和ECM重塑,在心肌肥厚、心力衰竭进展、肥胖和葡萄糖耐受不良调节中起着重要作用。Cat-K过度表达可触发心肌细胞肥大,Cat-K表达缺失可通过抑制哺乳动物雷帕霉素靶标和细胞外信号调节激酶通路减轻压力超负荷诱导的心脏肥大;Cat-K缺乏还可减弱年龄相关的心肌细胞凋亡和线粒体凋亡诱导因子核易位的增加,防止压力超负荷引起的心脏肥大和收缩功能障碍;Cat-K缺乏亦可逆转受损心肌细胞收缩力和钙离子调节失调,改善葡萄糖耐受不良和胰岛素介导的丝氨酸苏氨酸蛋白激酶(serine-threonine kinase,Akt)激活,进而抑制高脂饮食引起的心脏重量增加和心肌肥厚[11-13]。以上研究结果提示Cat-K过表达可能通过多种途径诱导心肌肥大,进而加重心室重构。
ADAMTS-7是解聚蛋白样金属蛋白酶成员之一,在心血管组织中表达丰富,在损伤、炎症刺激下表达上调,通过裂解其底物LTBP4促使ECM降解,降低心血管系统弹性,促进动脉粥样硬化,与冠状动脉疾病密切相关[14-15]。本研究结果显示,CHF组血清ADAMTS-7水平明显高于正常对照组(P<0.0 5),且ADAMTS-7水平与BNP、NT-proBNP、LVEDD、LVPWT、IVST、LVMI呈正相关(r值分别为0.602、0.674、0.453、0.401、0.483、0.647,P<0.05),与LVEF呈负相关(r=-0.538,P<0.001),表明ADAMTS-7可能参与了CHF心室重构过程。软骨寡聚基质蛋白(cartilage oligomeric matrix protein,COMP)是ECM的成分之一,其作用为桥接不同的ECM结构,维持ECM的完整性[16]。COMP降解可导致胶原蛋白分泌减少,连接蛋白43缺乏,心肌细胞凋亡和肌丝溶解,改变ECM成分,引起扩张型心肌病,ADAMTS-7存在COMP的结合位点,可降解成纤维细胞中的COMP[17-18]。由此可见,ADAMTS-7可能通过促进心脏成纤维细胞中的COMP降解改变ECM成分,从而促进CHF患者心室重构。本研究随访结果显示,Cat-K、ADAMTS-7与CHF患者出院后12个月内终点事件的发生有关,表明Cat-K、ADAMTS-7水平增高可能通过促进或加重心室重构,加快CHF进展,导致CHF不良结局的发生。本研究ROC曲线分析结果显示,Cat-K、ADAMTS-7判断CHF患者预后不良的AUC分别为0.720、0.688,可见Cat-K、ADAMTS-7在CHF患者预后评估中有一定的价值;NT-proBNP、LVEF、NYHA分级、Cat-K、ADAMTS-7联合检测判断CHF患者预后不良的AUC可达0.886,表明Cat-K、ADAMTS-7与其他指标联合可作为CHF患者预后评估较好的指标。
综上所述,血清Cat-K、ADAMTS-7水平升高与CHF患者心室重构和预后不良有关,联合检测Cat-K、ADAMTS-7可为CHF的病情评估和预后分析提供参考。

