微阵列芯片法和多同源基因序列测序在非结核分枝杆菌菌种鉴定中的差异
郭明日 李玉明 李 妍 孙海柏
(天津市海河医院 天津大学海河医院检验科 国家中医药管理局传染病重点研究室,天津 300350)
非结核分枝杆菌(non-tuberculousMycobacterium,NTM)可导致人类无症状和有症状的感染,迄今已分类、鉴定超过200个菌种,准确、快速地鉴定菌种及其型别,对于NTM感染的诊疗极为重要[1-3]。依据生长速度,NTM可分为缓慢生长群和快速生长群两大类。最常见的具有临床意义的缓慢生长群包括鸟分枝杆菌、胞内分枝杆菌、堪萨斯分枝杆菌、海洋分枝杆菌、马尔摩分枝杆菌、嗜血分枝杆菌和溃疡分枝杆菌,快速生长群包括脓肿分枝杆菌复合群(Mycobacteriumabscessuscomplex,MABC)、龟分枝杆菌、偶发分枝杆菌[4-5]。目前,常用的NTM菌种和型别鉴定技术主要为微阵列芯片、同源基因测序、基质辅助激光解吸电离飞行时间质谱、线性探针杂交等[6-9]。微阵列芯片技术仅能检测包括NTM在内的17种分枝杆菌,线性探针杂交技术也仅能检测20种常见的NTM和19种较少见的NTM。质谱技术可检测的菌种较多,但由于设备昂贵、数据库中的分枝杆菌菌种有限,且不同分枝杆菌培养物前处理方法差异较大,准确性受限[10-11]。同源基因测序是分枝杆菌菌种鉴定的“金标准”,常用的同源基因序列有16SrRNA、16S~ 23SrRNA基因间隔区(internal transcribed spacer,ITS)、RNA聚合酶亚基B(subunit of RNA polymerase B,rpoB)、热休克蛋白 65(heat shock protein 65,hsp65)[7]。MABC是常见的快速生长群菌种,也是天津地区常见的NTM菌种,采用同源基因序列测序可将其分为MABC脓肿亚种、MABC马赛亚种和MABCbolletii亚种[7,12-13]。本研究通过比较微阵列芯片技术和同源序列测序对170株NTM临床分离株鉴定结果的差异,为临床实验室选择合适的检测方法提供参考。本研究同时还采用3个同源基因序列联合测序分析对分离的MABC进行亚种鉴定,初步了解天津地区MBAC亚种分布,以期为临床精准诊疗MABC感染提供实验室依据。
1 材料和方法
1.1 菌株来源
收集天津市海河医院分枝杆菌菌株库2016-2019年保存的170株NTM菌株。
1.2 方法
1.2.1 复苏培养NTM菌株
将NTM菌株冻存管从-80 ℃冰箱取出,恢复至室温,取适量接种于罗氏固体培养管,于37 ℃培养箱中培养,定时观察菌落生长情况。
1.2.2 NTM微阵列芯片法检测
按照北京博奥生物集团公司分枝杆菌菌种鉴定试剂盒(DNA微阵列芯片法)说明书要求提取NTM菌株核酸,采用聚合酶链反应(polymerase chain reaction,PCR)进行检测,检测仪器为杭州博日科技有限公司TC-96PCR仪,扩增试剂购自北京索莱宝公司。PCR反应体系为20 μL,反应条件:37 ℃ 10 min;94 ℃预变性10 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸40 s,45个循环;94 ℃变性30 s,72 ℃延伸60 s,20个循环;72 ℃延伸7 min。配制杂交混合物,采用北京博奥生物集团公司BioMixerⅡ芯片杂交仪杂交2 h,转速为5 rpm;用LuxScan 10 K/B微陈列芯片扫描仪判读结果。
1.2.3 NTM同源序列测序
提取NTM菌株核酸后进行PCR扩增,PCR反应体系为25 μL,反应条件:95 ℃预变性5 min;95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸45 s,35个循环;72 ℃延伸5 min。扩增产物送苏州金唯智生物有限公司进行测序。参考文献[14]设计同源序列PCR扩增引物(表1)。
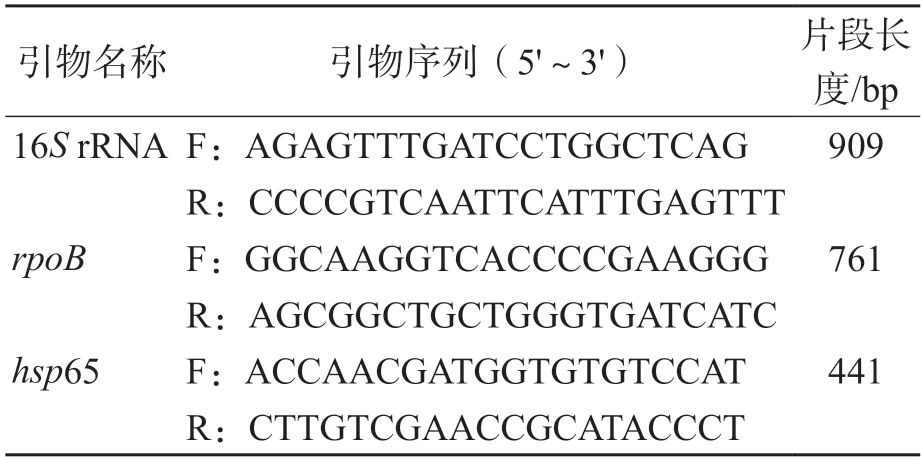
表1 PCR引物序列
测序得到的序列经BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)在线比对确定菌种类型。将同源序列联合分析结果作为最终鉴定结果,比较3个同源序列单独分析和联合分析的正确率;以同源序列联合分析结果为标准,比较微阵列芯片法菌种鉴定的正确率。
1.2.4 微阵列芯片法与同源序列测序菌种鉴定法样本周转时间(turn-around time,TAT)比较
比较微阵列芯片法和多同源序列测序法自医生申请检验项目到收到检验报告的时间。
2 结果
2.1 微阵列芯片法和同源序列测序菌种鉴定结果
微阵列芯片法共鉴定出8个NTM菌种,同源序列测序共鉴定出14个菌种。微阵列芯片法无法鉴定缓慢生长群的猿分枝杆菌、慢生黄分枝杆菌、副瘰疬分枝杆菌和快速生长群的龟分枝杆菌、马德里分枝杆菌、母牛分枝杆菌,多同源序列(16SrRNA、rpoB和hsp65)测序可鉴定出全部的菌种。以多同源序列测序结果为标准,微阵列芯片法鉴定到复合群的正确率为90.0%,16SrRNA、rpoB、hsp65单独和3个同源序列测序联合分析鉴定到复合群的正确率分别为93.5%、98.8%、99.4%和100.0%。见表2。
2.2 微阵列芯片法与多同源序列测序鉴定结果不一致菌种
以多同源序列测序结果作为参考,170株NTM菌株中,微阵列芯片法有153株鉴定结果与多同源序列测序结果一致,鉴定正确率为90.0%(153/170)。有17株未鉴定出或鉴定错误,见表3。
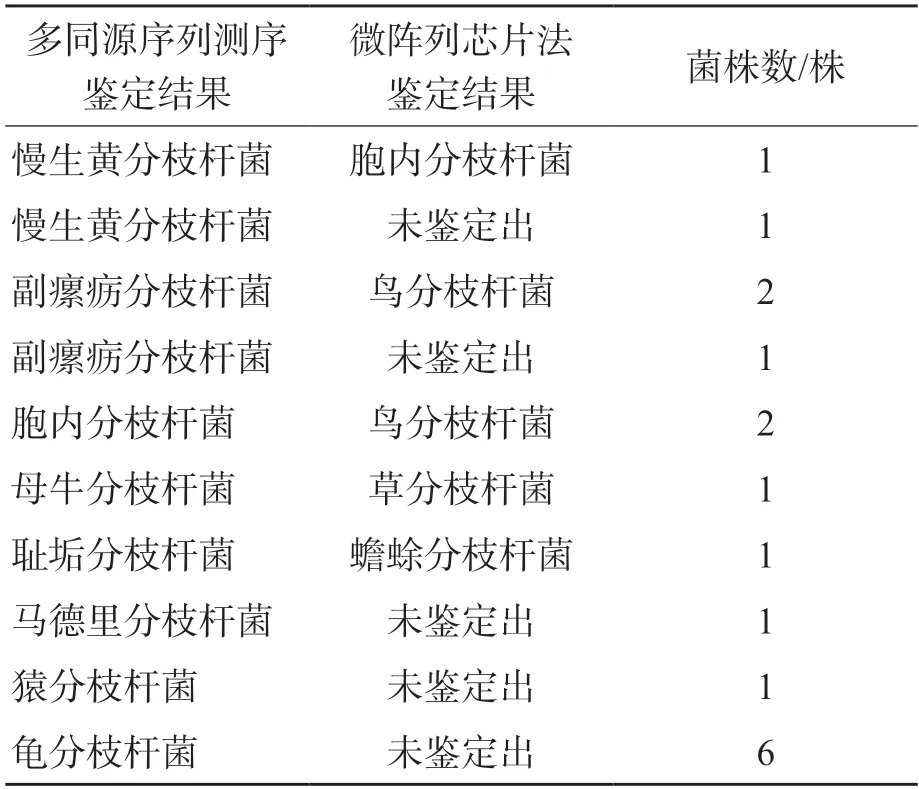
表3 微阵列芯片法与多同源序列测序鉴定结果不一致菌种
2.3 多同源序列测序龟/MABC亚种鉴定结果
将微阵列芯片法和16SrRNA测序鉴定为龟/MABC的53株菌株,采用同源序列(rpoB和hsp65)测序进行分析,结果显示,有53株NTMrpoB和hsp65鉴定结果一致,最终鉴定出龟分枝杆菌6株、MABC脓肿亚种25株、MABC马赛亚种20株、MABC bolletii亚种2株。
2.4 微阵列芯片法和多同源序列测序所需时间
微阵列芯片法鉴定单个样本的TAT至少需要8 h,170株NTM菌株全部鉴定需要2 d。多同源序列测序鉴定单个样本的TAT约需3 d,170株NTM菌株全部鉴定约需要5 d。
3 讨论
不同NTM菌种对抗菌药物的敏感性存在较大差异,且NTM感染患者全身中毒症状和临床表现与结核病相似,极易被误诊。不同NTM菌种感染和受累组织不同,所致NTM病临床表现各异,对于初次分离培养出的NTM菌株,在菌种未知的情况下,很难评估其临床价值[1,15]。准确、快速的NTM菌种鉴定对临床诊断、鉴别诊断NTM病与结核病至关重要。微阵列芯片法菌种鉴定基于分枝杆菌属16SrRNA编码基因高变区差异,设计针对17种分枝杆菌的特异性探针,通过提取菌株核酸、PCR扩增和探针杂交、激光共聚焦扫描确定菌种类型。17种分枝杆菌包括了常见的16种NTM菌种,但对于临床上较少见的NTM菌种则无法鉴定出。本研究170株NTM菌株中,有17株采用微阵列芯片法未鉴定出或鉴定错误,其中6株龟分枝杆菌、1株猿分枝杆菌、1株马德里分枝杆菌、1株副瘰疬分枝杆菌和1株慢生黄分枝杆菌因不在鉴定范围,故未鉴定出;2株胞内分枝杆菌被鉴定为鸟分枝杆菌,是由于2种分枝杆菌的16SrRNA高变区序列高度相近,设计的探针错误结合导致的。有研究发现,尽管鸟分枝杆菌与胞内分枝杆菌的区分具有流行病学意义,但未发现有重要的临床价值[15]。
同源序列测序分析是常用的细菌菌种鉴定方法,16SrRNA基因测序可用于大多数分枝杆菌菌种鉴定,对于部分采用16SrRNA基因测序无法鉴定或鉴定失败的NTM菌种,可考虑采用其他同源基因,如rpoB、hsp65,进行鉴定[16]。本研究4株较少见的分枝杆菌包括慢生黄分枝杆菌、副瘰疬分枝杆菌、猿分枝杆菌和马德里分枝杆菌,因不在微阵列芯片法检测范围,采用16SrRNA基因测序和rpoB、hsp65基因测序,均被准确鉴定出。另外,5株戈登分枝杆菌微阵列芯片法可鉴定出,但本研究所采用的16SrRNA基因测序引物却扩增、鉴定失败,考虑为设计的引物特异性问题,加做rpoB、hsp65基因测序后,均能被准确鉴定。本研究中,rpoB基因测序仅鉴定出2株耻垢分枝杆菌中的1株,有1株母牛分枝杆菌鉴定失败,其余168株NTM均能准确鉴定;hsp65基因测序对1株母牛分枝杆菌鉴定失败,可准确鉴定出其余169株NTM菌株。提示hsp65、rpoB基因测序用于分枝杆菌菌种鉴定优于16SrRNA。KIM等[16]采用16SrRNA、hsp65和rpoB测序后与GenBank数据库进行比对的方法,对109株NTM临床分离株进行菌种鉴定,发现单独使用3个基因序列可鉴定出的菌种分别占71.3%、86.8%和81.6%,而联合3个基因序列进行鉴定可将鉴定率提升至97.3%,证实了hsp65、rpoB对于NTM菌种的鉴别能力高于16SrRNA,多同源序列测序可明显提高NTM菌种的鉴定效能。
龟分枝杆菌与MABC的16SrRNA基因序列高度一致,无法单独采用16SrRNA测序进行鉴别[17]。本研究6株龟分枝杆菌中,采用微阵列芯片法和16SrRNA基因测序均无法与MABC进行区分,而采用16SrRNA联合rpoB、hsp65,不仅能鉴别龟分枝杆菌与MABC,还可对MABC的3个亚种进行区分;53株微阵列芯片法无法区分的龟/MABC经多同源序列测序分析后,鉴定出龟分枝杆菌6株、MABC脓肿亚种25株、MABC马赛亚种20株、MABCbolletii亚种2株。MABC中,脓肿亚种、马赛亚种、bolletii亚种所占比例分别为53.2%、42.6%、4.2%。目前尚未见有文献报道天津市MABC各亚种的分布情况,本研究结果填补了相关数据的空白。关于MABC各亚种的分布,不同国家、地区所报道的结果不一致。有文献报道脓肿亚种占71%~43%,马赛亚种占21%~56%,bolletii亚种占1%~18%[18]。由于MABC的3个亚种对以克拉霉素为代表的大环内酯类抗菌药物的治疗反应差异极大,脓肿亚种和bolletii亚种的erm(41)基因的T28型与克拉霉素诱导性耐药相关,而马赛亚种则不存在erm(41)基因相关的诱导性耐药[7]。因此,了解不同地区MABC亚种的分布,对于MABC感染的预防和治疗具有非常积极的作用。
微阵列芯片法在我国应用于分枝杆菌菌种鉴定已多年,16SrRNA测序是目前细菌菌种鉴定最常用的测序方法。然而,微阵列芯片法是针对16SrRNA多变区设计探针,可鉴定的分枝杆菌仅有17种,无法有效区分与分枝杆菌和MABC及其亚种等序列高度相近的菌种,此时联合使用16SrRNA、rpoB和hsp65测序,则可鉴定出绝大多数临床常见和少见的NTM菌种。在临床应用时,需要综合考虑微阵列芯片法和同源序列测序在TAT和准确性方面的差异。本研究结果显示,微阵列芯片法TAT约为8 h;同源序列测序TAT约为3 d,且目前一般临床实验室无法开展,需要外送。对于不同NTM菌种感染者,在选择2种方法时应基于临床、患者需求和实验室实际情况,微阵列芯片法无法区分的龟/MABC,采用同源序列测序准确鉴定对于临床用药方案的选择和调整至关重要。对于微阵列芯片法不能鉴定出的临床少见分枝杆菌,如本研究中同源序列测序鉴定出的副瘰疬分枝杆菌、母牛分枝杆菌、慢生黄分枝杆菌,建议及时采用同源序列测序进行补充性鉴定,以便临床明确诊断后及时参照诊疗指南选择、确定用药方案。
综上所述,NTM菌种、型别的鉴定在临床诊疗中极为重要。微阵列芯片法与多同源序列测序在NTM菌种鉴定方面各有优缺点,微阵列芯片法鉴定准确率基本能满足临床需求,TAT较短,但鉴定菌种范围有限;多同源序列测序TAT相对较长,但可鉴定出绝大多数NTM菌种及其亚种,是微阵列芯片法和其他一些菌种鉴定方法的有效补充,可为临床精准治疗提供实验室依据。
——紫 苏
——和田盘羊

