绿色化教育理念下学生创新能力培养的实践研究*
陈新峰 柳文敏 兰青
南阳师范学院化学与制药工程学院 河南南阳 473061
0 引言
《义务教育化学课程标准(2022 年版)》要求“引导学生‘做中学’‘用中学’‘创中学’,促进学生核心素养的发展”。高中化学课程标准把“科学探究与创新意识”作为化学学科的五大重要核心素养之一,所以说“创新教育”是当前中学化学教学的一个重要理念,开发课程资源,挖掘创新教育素材应是化学教育工作者重要的教学研究工作之一。我们知道,实验是化学学科的一个明显且重要的特征,实验设计特别是实验的绿色化设计涉及的因素比较多,很多时候还存在各条件相互制约、相互影响的情况,这就要求在对实验条件筛选、实验现象观察、实验数据分析的基础上不断地优选优化,才能确定最终的实验方案。在这个过程中,学生的创新精神、意识和能力等方面的素养才能得以逐步提升。
1 创新基础——观察能力的培养
在化学教学中,观察能力是指通过感觉器官获取化学反应中那些具有典型代表性的、能够反映化学世界本质特征的外部表象的能力,是准确把握实验本质、解决实验问题的基础。在实验绿色化教学中,要着重培养学生以下几个方面的观察能力。
1.1 观察的敏锐性
敏锐的观察力能够及时准确地捕捉那些稍纵即逝或者“观察目标以外”的化学现象。如FeSO4和NaOH 的反应,生成的Fe(OH)2沉淀刚开始是白色的,但很快就会转化为灰绿色,直至完全生成红褐色的Fe(OH)3沉淀,我们可以利用这些稍纵即逝的反应现象对学生进行观察敏锐度的培养。再如KClO3加热催化制取氧气时,产物是KCl 和O2,收集氧气的方法有向上排空气法和排水法两种,但排空气法收集的氧气总混有一股刺激性的味道,而排水法收集的氧气却不存在这种意料之外的情况,而这意外之处正是培养学生观察敏锐度的好素材,同时也为处理污染性气体提供了一种行之有效的解决方法。
1.2 观察的全面性
观察的全面性是指利用多种感官(视觉、嗅觉、触觉、听觉等)对物质的表象进行全方位的观察,以获取反映物质性质的实验现象和数据。例如在金属钠的教学过程中,当用小刀切开一小块金属钠时,学生可以观察到切面处明亮的金属光泽,但是切面处的明亮光泽很快就会暗淡下去,由此可以得出钠的硬度比较小且在空气中不稳定的性质。把小钠块放入盛水的烧杯中,并加入酚酞指示剂,可以看到钠块浮于水面之上,熔成一个光亮的小球,不停地快速游动并伴有小气泡生成,逐渐减小直至消失,同时酚酞试液变为红色;可以听到反应中的嘶嘶响声;手触烧杯外壁发热;等等。从而知道,钠与水剧烈反应生成气体和碱性物质,并伴有大量的放热现象。
再如在学习乙烯的C=C 双键不饱和性时,我们通常是用无水乙醇与浓硫酸为反应原料来制取乙烯,把乙烯通入酸性高锰酸钾和溴水溶液中,高锰酸钾和溴水溶液褪色现象非常明显。这时学生会把注意力大部分或全部都集中在获得的这一现象上,并以此验证和解释乙烯的不饱和性,而实验的另一个现象往往会被忽视,那就是混合溶液的变黑和生成的气体会带有一股刺激性的气味。事实上这股有刺激性气味是浓硫酸被还原所生成的SO2气体,它同样能使酸性高锰酸钾和溴水溶液褪色。假如说我们在实验过程中因操作温度不当生成的不是乙烯而是乙醚,那么因SO2的存在,同样也可以使酸性高锰酸钾和溴水溶液褪色。若把其通入品红溶液中,还会得出使品红溶液褪色的结论。这显然是错误的。因此在实验过程中要引导学生全面观察,先净化去除SO2,再进行相关实验,才能得出既正确而又准确的结论。教学过程中我们可以利用诸如此类的实例来培养学生全面观察实验的意识及能力。
1.3 观察的准确性
观察的准确性是科学实验的前提和根本,否则实验就会得出“伪科学”的结论。影响观察准确性的因素总的说来有主观(观察的态度与能力)和客观(干扰因素)两类。对观察准确性的要求不仅能培养学生严谨细致的观察态度,同时还可以培养学生消除干扰因素的能力。例如在铜与稀硝酸反应的实验中,常因试管中空气排除不完全而残留了部分氧气,致使生成的无色NO 部分被其氧化,转变为红棕色的NO2,不但污染了教室的空气,还会导致学生的误观察。为消除假象并无害化处理尾气,我们可以选取一个青霉素瓶和一套一次性输液管进行如图1 所示的实验改进:用夹子夹紧1、2 两处,把铜丝(铜片)放入瓶内,充满稀硝酸并盖紧瓶盖,倒置并固定在铁架台上,可以看到,随着反应的进行,瓶内由无色的稀硝酸溶液变为蓝色的硝酸铜溶液,并被无色气体(NO)排入输液器滴壶内,待瓶内稀硝酸即将流出完毕时,夹子夹紧3处,打开1处,瓶内无色的NO 气体随即转变为红棕色的NO2气体。此设计不但方便尾气处理,而且可以反复进行实验操作,便于学生多次观察。

图1 铜与稀硝酸反应实验改进装置
1.4 观察的深刻性
物质的性质往往包含多个方面,实验中会产生不同的反应现象,比如,有的反应剧烈甚至伴随着爆炸和声响,有的反应平缓甚至需要加压、加热以及催化等条件才能顺利完成,有些反应在形态、颜色等方面变化明显,有的较难观察到明显变化,而这些正是其本质属性的反映。但对于学生来说,实验现象的显现度不同,观察时引起注意的程度也不同,可能会导致一些反映深层次问题的实验现象被忽视,因此观察的深刻性也是培养观察能力的一个重要方面。比如NH3与HCl 气体的反应,在进行绿色化设计时,可以将它们分别用导管引入密封的玻璃容器中进行,生成白烟的实验现象非常明显,但是如果我们仔细观察,特别是反应刚开始时,会发现白烟在容器内的分布是不均匀的,而正是这个现象揭示着NH3与HCl 气体的深层问题,即虽然它们都是挥发性气体,但挥发的速度却不相同,也就是两种分子的运动速度不同,而这又与它们不同的分子质量有关。通过对这些现象的观察和思考,学生能够顺利理解这部分内容并使知识系统化。
2 创新性问题思维能力的培养
2.1 打破思维定式
思维定式有时候能帮助我们快速找到解决问题的办法,提高解决问题的速度和效率,却会固化我们的思维,让我们解决问题时囿于已有模式和方法,思路狭隘不开阔,甚至钻牛角尖。当遇到新事物、新现象,需要我们用创新性思维去解决问题时,容易进入思维的死胡同。化学实验中的思维定式主要表现在对实验原理理解的定式思维和对实验仪器、实验药品、实验操作方法选择的定式思维。思维定式不利于实验问题得到更好的解决,不利于学生创新性思维能力的发展。因此,在实验的绿色化设计中,要注意打破定式的阻碍,另辟蹊径解决问题。如对于有害实验尾气的处理,一般都采用能化学处理就化学处理,不能化学处理就物理收集的方法。打破这种定式,我们可以考虑先进行回收再利用,既消除污染又废物利用,一举两得。例如CO 还原CuO 的实验,尾气中的CO 不再点燃转换为CO2后释放到空气中,而是将其导引至酒精灯上进行燃烧,既可获取部分反应热源,又能够消除对实验室的气体污染[1],还可以对学生进行责任意识、环保意识和初步的可持续发展观教育。
2.2 思维的灵活性
思维灵活性是思维的重要品质之一,是指能够根据具体情况灵活改变解决问题的思路,当在某一方向上解决问题卡壳时,能够灵活地变换思考的角度,改变解决问题的方式方法去灵活地解决问题。例如教材中对电解质导电能力的教学内容编排,电解质的选择包含HCl 和NaCl 溶液,但通电时它们都会电解生成氯气而污染教室环境,我们可以选择不易发生电解的阴离子(如SO42-)物质来替代,用硫酸钠溶液代替氯化钠溶液、稀硫酸代替盐酸同样可以很好地达到教学效果,且避免了氯气的环境污染。
2.3 思维的发散性
发散思维是指对于一个待解问题,从不同的方向、不同的角度去思考并提出相应的解决方案的思维形式。它可以有效地训练学生思维的独特性、变通性和流畅性,破除认识事物的思维惰性,激发创新精神。如在SO2的褪色漂白、加热复色实验中,放出的SO2是一种污染性气体,我们知道,SO2这种污染性气体不仅常常产生于实验室,并且在工农业生产中也会大量地产生,污染着我们的大气环境,它是酸雨形成的重要因素之一,这对我们具有强烈的环境警示作用。这时可引导学生进行发散性思维,寻找能用于实验室的快捷、易操作的处置办法,比如物理收集、化学反应去除等。物理收集还可以选择不同的收集方法,化学去除可以选择与碱反应、与氧化性溶液(如KMnO4)反应等。通过对这些方法的可行性、操作性、SO2去除的有效性进行对比分析,进行异中选优最佳解决方案的选择。
3 创新性实验设计能力的培养
3.1 实验原理创新
在化学制备和合成反应中,可以通过实验原理创新,在反应物的筛选、副产物、原料杂质中的生成物、反应条件等方面实现绿色化处理。比如中学化学教材中利用电石制备乙炔的实验,由于电石中杂质的存在,会生成H2S、PH3、AsH3等有毒气体,虽然实验中设计了用CuSO4溶液进行除杂,但实际上去除并不完全,况且Cu2+属于重金属离子,也会污染环境。若改用电石与16%的NaOH 反应,实验表明效果比较理想[2]。再如以往实验室制备氧气时常常采用加热分解KMnO4或加热催化分解KClO3的方法,但是KMnO4加热制备氧气产率较低,不太符合绿色化实验的原子利用经济性原则,KClO3加热催化分解不但催化剂MnO2难以回收利用,而且反应过程中还会伴有副反应的发生,生成诸如氯气、二氧化氯等一些有毒有刺激性的气体。那么是否还有其他制备方法呢?这时教师可引导并提出几种可供选择的制备方法,如HgO、Na2O2、H2O2等为原料都可以有氧气的生成,但HgO 分解产生的Hg 是严重的污染物,而Na2O2价格贵成本高,H2O2分解的产物为氧气和水,价格又便宜产物又清洁,是最优选的实验室氧气获得的途径。还有我们前面提到用乙醇和浓硫酸制取乙烯,会有有毒气体SO2生成,并且干扰乙烯的褪色现象,这时我们可以从反应原理入手,乙醇反应生成乙烯,实际上是在催化剂H+作用下的分子内脱水反应,那么我们只要能够找到合适的H+提供者和脱水剂提供者即可取得相同的效果,像实验室常用的非氧化性强酸与五氧化二磷或焦磷酸就是比较好的替代方案。
3.2 实验方案创新
原理创新为方案创新提供了理论支撑,对于一个化学实验的绿色化方案设计,我们可以根据反应原理,引导学生对不同反应路线进行分析比较,从而筛选出原子利用率最高、污染最小的反应(合成)路线,以实现方案创新。如硝酸铜的制备方案可以有以下三种:
1) Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
2) 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO ↑+4H2O
3) 2Cu+O2=2CuO, CuO+2HNO3(浓)=Cu(NO3)2+H2O
通过有无污染物的生成、原子利用率的高低等条件判断可知,最后一个制备方案是最佳的选择。
3.3 实验操作装置创新
实验操作装置的创新优化是实验绿色化设计的重要途径之一,也是培养学生创新能力的又一重要途径。以下介绍几类有代表性的例子。
排液法收集气体。当遇到一些具有潜在污染性的实验而常用装置又不能很好地解决问题时,我们可以考虑进行操作装置的创新。例如排水法是常用的气体收集方法之一,其特点之一是容易观察气体收集的进度,能够掌控收集操作的时间和气体收集的多少。但对于易溶于水的污染性气体如氨气和氯化氢气体,排水法就解决不了这些问题,这时我们可以考虑把水换成其他液体(如CCl4),但CCl4又不能用手直接触,这就需要实验装置的创新和改造,比如图2 所示的装置就能很好地解决这一问题。
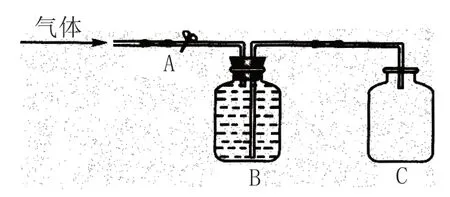
图2 自动排液集气装置
临时储气。在制取多份气体时,为了不使连续反应生成的气体在更换集气瓶时散入实验室内,我们可以给实验装置加装一个气体缓存装置,如在气体发生装置的气体导出管道中加装一个带有储气囊(也可以用气球代替)的三通玻璃管,靠近气体收集装置端再加装一截带止气夹橡胶管,利用气囊临时储气,避免气体外溢。
气体随用随制。我们平常所用的启普发生器的主要功能就是方便气体的随用随制,其操作原理是能够把反应物随时分隔开来,利用这一原理我们还可以把它改进。例如铜与硝酸制备NO 或NO2,我们选取细铜丝代替铜片,把铜丝的一端缠绕成团状伸入反应容器中,另一端通过橡皮塞穿出至反应容器外部,当要进行反应时,可通过外伸的铜丝把团状铜丝推入HNO3溶液中,当要停止反应时,将铜丝提拉出硝酸液面即可。原理如此,可扩展到其他相似的实验中,同时它还有一个不同于启普发生器的好处是可以应用于需要加热的一些反应。
实验的综合利用。学习浓硫酸性质时,通常都要证明它的脱水性和氧化性,反应时还会放出大量的刺激性气体污染学习环境。这时我们可以把“黑面包”实验改在烧瓶内进行,通过分液漏斗向烧瓶中的蔗糖滴加浓硫酸,反应生成的气体通过品红溶液(验证SO2的生成)和碱溶液处理,既证明了浓硫酸的脱水性、氧化性,又完美地处理了有毒尾气,提升了实验的综合效果。

