基于生物信息学和机器学习筛选溃疡性结肠炎特征基因及其靶向中药预测
梁家浩 张馨慧 王海
摘要:為确定溃疡性结肠炎(ulcerative colitis,UC)的潜在生物标志物,并预测其靶向中药,从GEO数据库下载包含人类UC和健康对照组织(GSE179285、GSE206285和GSE87466)的数据集,合并GSE179285和GSE206285数据集,通过limma R软件包筛选出UC与健康对照组织之间的差异表达基因(DEGs)。采用LASSO回归模型和支持向量机递归特征消除算法筛选出核心生物标志物。GSE87466数据集用作验证队列,受试者工作特征曲线用于评估诊断效能。利用CIBERSORT探讨UC中的免疫浸润特性,并进一步分析潜在生物标志物与不同免疫细胞之间的相关性。最后,在HERB数据库预测核心生物标志物靶向中药。共筛选出157个DEGs,其中102个基因上调,55个基因下调。功能富集分析显示,这些DEGs主要参与IL-17信号通路、TNF信号通路、类风湿关节炎、趋化因子信号通路、体液免疫反应、中性粒细胞趋化和迁移等。LOC389023、OLFM4、AQP8和CWH43被鉴定为UC的潜在生物标志物,且其诊断价值在GSE87466验证数据集中有显著意义。CIBERSORT免疫浸润分析显示,UC与健康对照组织的免疫浸润特征存在显著差异。UC组发现高水平的CD4+记忆活化T细胞、M1巨噬细胞和中性粒细胞,而健康对照组发现高水平的记忆B细胞、CD4+记忆静息T细胞、M2巨噬细胞和静息树突状细胞。在HERB数据库预测到淡豆豉、牡荆子、骨节草、酒、苦豆子、鹿茸和紫河车7味靶向中药。研究认为,LOC389023、OLFM4、AQP8和CWH43可能作为UC的诊断生物标志物;淡豆豉等7味靶向中药可能通过调节肺肠菌群、影响炎症通路、调节免疫等方面发挥对UC的治疗作用。
关键词:溃疡性结肠炎;生物信息学;机器学习;免疫浸润;核心基因;靶向中药
中图分类号:R285 文献标志码:A 文章编号:1002-4026(2023)06-0056-12
Exploringtrait genes and predicting the targeted Chinese medicine
for ulcerative colitis based on bioinformatics and machine learning
LIANG Jiahao1, ZHANG Xinhui 1, WANG Hai 1,2*
(1. First Clinical Medical College,Heilongjiang University of Chinese Medicine,Harbin 150040,China; 2. First Affiliated Hospital, Heilongjiang University of Chinese Medicine, Harbin 150040, China)
Abstract∶For the identification of potential biomarkers for ulcerative colitis (UC) and prediction of their targeted traditional Chinese medicines, datasets containing human UC and healthy control tissues (GSE179285, GSE206285, and GSE87466) were downloaded from the GEO database. The GSE179285 and GSE206285 datasets were merged, and the differentially expressed genes (DEGs) between UC and healthy control tissues were screened using the limma R package. The LASSO regression model and SVM-RFE (support vector machine recursive feature elimination) algorithm were used to identify core biomarkers. The GSE87466 dataset was used as a validation cohort, and the ROC (receiver operating characteristic) curve was used to evaluate the diagnostic performance. CIBERSORT was used to investigate the immune infiltration characteristics in UC, and the correlation between potential biomarkers and different immune cells was further analyzed. Subsequently, the targeted traditional Chinese medicinal herbs were predicted using the HERB database. In total, 157 DEGs were screened out, with 102 genes upregulated and 55 genes downregulated. Functional enrichment analysis showed that these DEGs were mainly involved in IL-17 and TNF signaling pathway, rheumatoid arthritis, chemokine signaling pathway, humoral immune response, neutrophil chemotaxis, neutrophil migration, etc. LOC389023, OLFM4, AQP8, and CWH43 were identified as potential biomarkers for UC, and their diagnostic values were significant in the GSE87466 validation dataset. CIBERSORT immune infiltrate analysis showed significant differences in immune infiltration characteristics between UC and healthy control tissues. High levels of CD4+ memory activated T cells, M1 macrophages, and neutrophils were found in the UC group, while high levels of memory B cells, CD4+ memory resting T cells, M2 macrophages, and resting dendritic cells were found in the healthy control group. Seven traditional Chinese medicinal herbs targeting core biomarkers, including Sojae Semen Praeparatum, Fructus Viticis Cannabifoliae, Herba Equiseti Palustris, Liquor, Sophora alopecuroides L., Cervi Cornu Pantotrichum, and Placenta Hominis, were predicted in the HERB database. The study suggested that LOC389023, OLFM4, AQP8, and CWH43 were identified as diagnostic biomarkers for UC, and the aforementioned seven targeted traditional Chinese medicinal herbs may play a therapeutic role in UC by regulating gut microbiota, affecting inflammation pathways, and modulating the immune system.
Key words∶ulcerative colitis; bioinformatics; machine learning; immune infiltration; core gene; targeted traditional Chinese medicine
溃疡性结肠炎(ulcerative colitis,UC)是一种以结肠慢性炎症为特征的复杂疾病,全球每年约有9万至10万UC患者,且发病率呈逐年上升趋势[1-2]。迄今为止,UC的潜在病因和发病机制尚不清楚,以至于限制了UC的早期诊断和治疗。UC不仅降低患者生活质量,也给社会带来巨大的医疗和经济负担[3]。因此,目前迫切需要深入了解UC的发病机制,从分子水平鉴定疾病进展的生物标志物,为UC的早期诊断提供新的思路。
医学界至今尚无根治UC的方法,临床上以缓解症状、提高患者生活质量为首要目标,以降低危重并发症和结直肠癌发生率为基本治疗原则[4]。中医药治疗UC方法多样且副作用较少[5],通过挖掘有效靶向中药,可为UC的中医临床治疗提供参考和方向。近年来,将微阵列技术、生物信息学分析和不同机器学习算法相结合,用于复杂疾病的生物标志物筛选、诊断预测和预后评估已成为各学科热点,计算生物学方法也为进一步的基础实验设计提供范围和依据[6-7]。
本研究利用生物信息学联合机器学习算法筛选出UC病理过程中潜在的生物标志物并对其诊断效能进行验证,通过核心基因预测靶向中药,根据药物性味归经拓展中医理论,同时挖掘疾病相关生物过程、信号通路以及远期并发症,探讨其免疫浸润机制。研究流程参见OSID科学数据与内容附图1。
1 资料与方法
1.1 数据集选取与注释
芯片数据来源于基因表达综合数据库GEO(https://www.ncbi.nlm.nih.gov/gds)中的GSE179285[8]、GSE206285[9]和GSE87466[10]数据集,共包含692个UC样本和70个健康对照样本。下载数据集探针矩阵和平台文件,根据平台文件信息,确定探针名称与基因名称的对应关系,将探针矩阵转化为基因矩阵。
1.2 数据合并与差异分析
将GSE179285和GSE206285两个数据集的基因表达矩阵进行合并作后续差异分析。引用R语言limma软件包,设定|log2FC|>1且矫正后P<0.05以获取差异表达基因(DEGs),引用ggplot2和pheatmap软件包进行火山图及热图绘制。
1.3 DEGs功能注释和富集分析
对1.2所得DEGs通过R语言clusterProfiler软件包进行基因本体论(gene ontology,GO)和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析,引用DOSE软件包进行疾病本体论(disease ontology,DO)富集分析。设定P<0.05为过滤阈值,筛选出具有统计学意义的生物过程(biological process,BP)、细胞组分(cellular component,CC)、分子功能(molecular function,MF)、信号通路以及相关疾病。采用基因集富集分析(gene set enrichment analysis,GSEA)方法,以从分子特征数据库(https://www.gsea-msigdb.org/gsea/msigdb)下載所得的c5.go.v7.4.symbols.gmt和c2.cp.kegg.v7.4.symbols.gmt基因集作参考,引用limma、org.Hs.eg.db、clusterProfiler和enrichplot软件包对合并芯片数据集中UC患者的校正基因表达矩阵进行富集分析,以获取活跃的生物功能和信号通路。
1.4 机器学习筛选核心基因
通过R语言glmnet软件包进行最小绝对值收敛和选择算子(LASSO)回归分析,引用e1071、kernlab和caret软件包进行支持向量机-递归特征消除(SVM-RFE)算法构建,最后引用Venn软件包将两种算法所识别得到的基因绘制维恩图,取交集作为核心基因。
1.5 核心基因验证及诊断价值分析
引用R语言limma和ggpubr软件包,使用独立数据集GSE87466对核心基因在UC和健康对照组之间的表达差异进行验证。引用pROC软件包建立受试者工作特征(receiver operating characteristic,ROC)曲线,计算ROC曲线下面积(area under curve,AUC),评估核心基因在合并数据集(GSE179285和GSE206285)及独立验证数据集(GSE87466)的诊断效能。
1.6 免疫浸润分析
引用R语言e1071软件包对合并芯片数据集的校正基因表达矩阵进行免疫细胞浸润分析,过滤免疫浸润结果。用CIBERSORT计算UC基因表达谱中22种免疫细胞的相对比例。引用corrplot和vioplot软件包绘制免疫细胞共表达热图和免疫浸润差异小提琴图。
1.7 核心基因与免疫细胞相关性分析
引用R语言limma、reshape2和ggpubr软件包,读取核心基因在合并芯片数据集校正基因表达矩阵中的表达量,采用Spearman等级相关分析探讨核心基因表达量与免疫细胞数量之间的相关性并绘制棒棒糖图。
1.8 UC靶向治疗中药预测
HERB(http://herb.ac.cn/)是集高通量实验数据和科研文献数据于一体的天然药物数据库平台[11]。将筛选所得核心基因依次输入HERB数据库,检索得到其靶向药物,通过查阅《中华本草》[12]和《中药大辞典》[13]筛选出相关中药,并对其性味归经绘制雷达图进行可视化总结。
1.9 统计学分析
所有统计学计算均采用R 4.2.1及相关软件包完成。q value为矫正后的P值,表示P值产生假阳性的概率。相关性采用Spearman等级相关分析。P<0.05为差异有统计学意义。
2 结果
2.1 UC相关DEGs识别
筛选出157个UC相关DEGs,其中上调基因102个,下调基因55个,见火山图(OSID科学数据与内容附图2),其中上调基因用红色表示,下调基因以蓝色表示。热图(见OSID科学数据与内容附图3)展示了疾病试验组与健康对照组样本中DEGs,颜色由红到蓝,表达量由高到低,分别展示30个上调和下调基因。
2.2 富集分析结果
GO富集分析筛选出BP条目218个、CC条目26个、MF条目61个,由OSID科学数据与内容附图4可知,BP主要涉及体液免疫反应、抗微生物体液反应、中性粒细胞趋化和迁移等;CC主要富集在含胶原的细胞外基质、胶原三聚体、分泌颗粒管腔和胞浆囊泡管腔等;MF主要包括CXCR趋化因子受体结合、趋化因子活性、趋化因子受体结合和细胞外基质结构组成等。由OSID科学数据与内容附图5可知,KEGG富集分析发现相关富集通路主要有IL-17信号通路、TNF信号通路、病毒蛋白与细胞因子及细胞因子受体的相互作用、类风湿关节炎和趋化因子信号通路等。DO富集分析得到447种疾病,如OSID科学数据与内容附图6所示,主要有间质性肺疾病、慢性阻塞性肺疾病、阻塞性肺疾病、肺纤维化和肠道疾病等。对UC樣本表达矩阵进行GSEA富集分析,由OSID科学数据与内容附图7(a)可知,活跃的GO富集条目有细胞外结构组织、体液免疫、细胞对干扰素-γ的反应、含胶原的细胞外基质、细胞外基质结构成分。如OSID科学数据与内容附图7(b)所示,活跃的KEGG富集通路有补体与凝血级联系统、细胞因子-细胞因子受体互作、ECM-受体互作、利什曼原虫感染、系统性红斑狼疮。
2.3 机器学习筛选核心基因
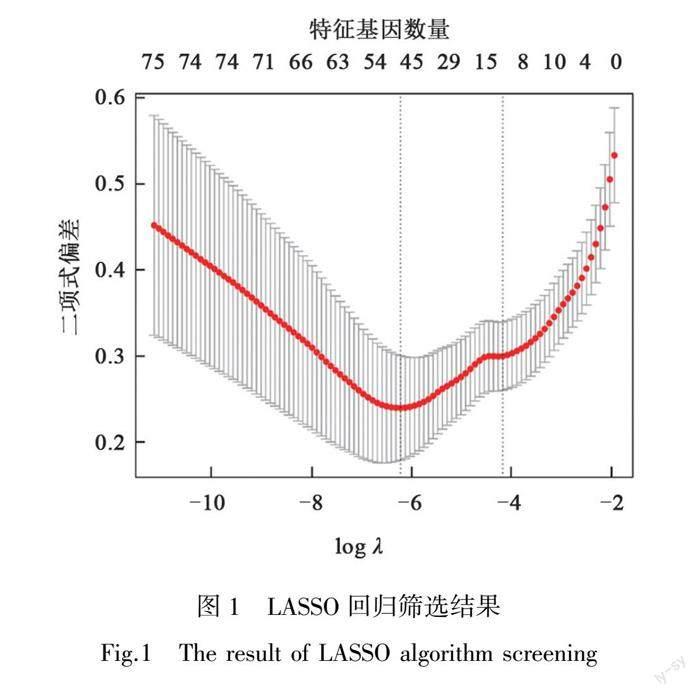
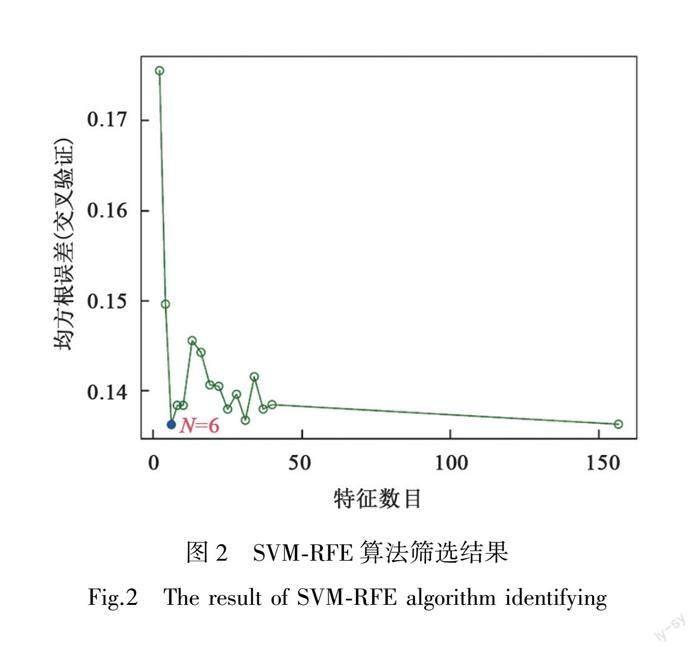
如图1~2所示,通过LASSO(least absolute shrinkage and selection operator)回归分析筛选得到特征基因51个,SVM-RFE算法筛选得到特征基因6个,将两种机器学习算法所得特征基因结果绘制维恩图(见OSID科学数据与内容附图8),取交集得到4个核心特征基因,分别为LOC389023、OLFM4、AQP8和CWH43。
2.4 核心基因和诊断能力验证
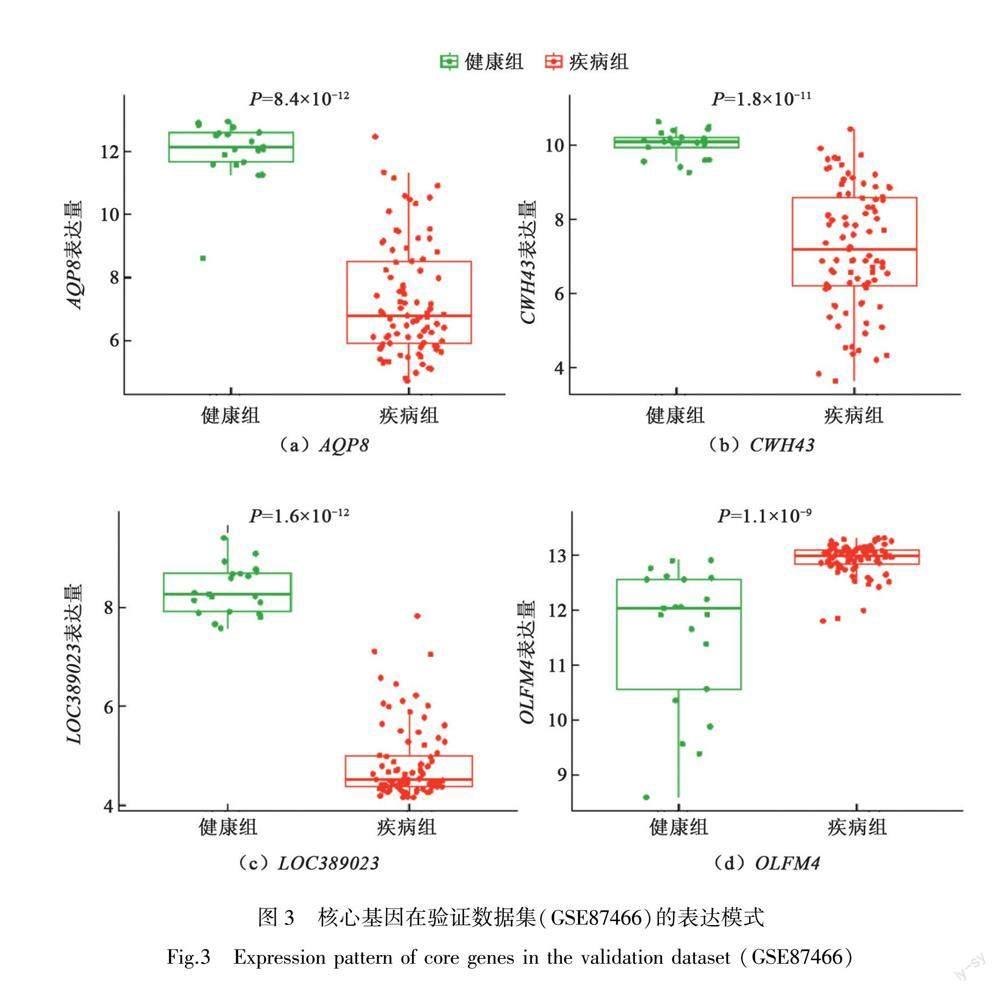
在外部独立数据集GSE87466中验证上述步骤得出的4个核心基因(LOC389023、OLFM4、AQP8和CWH43),结果表明(图3),相较于健康对照者,AQP8、CWH43和LOC389023在UC患者中的基因表达显著下调,而OLFM4则显著上调。后续诊断价值分析结果也表明,机器学习算法筛选出来的4个核心基因无论是在内部合并数据集(见图4)或是外部验证数据集(见图5)中,ROC曲线下面积AUC均大于0.7,对于区分健康对照者和UC患者具有较高诊断效能。
2.5 免疫浸润分析
由免疫细胞相关性分析结果(OSID科学数据与内容附图9)可知,活化肥大细胞与静息肥大细胞相互作用最显著且两者呈负相关(r=-0.59)。有7种免疫细胞在健康对照者和UC患者中的浸润差异显著(P值<0.05),相较于健康对照者,记忆B细胞、CD4+记忆静息T细胞、M2巨噬细胞和静息树突状细胞在UC患者中下调,而CD4+记忆活化T细胞、M1巨噬细胞和中性粒细胞则上调,见OSID科学数据与内容附图10。
2.6 核心基因与免疫细胞相关性分析
由OSID科学数据与内容附图11~14可知,4个核心基因LOC389023、OLFM4、AQP8和CWH43的表达量均与静息肥大细胞数目呈正相关,与活化肥大细胞数目呈负相关。
2.7 UC靶向治疗中药预测
在HERB数据库依次检索4个核心基因LOC389023、OLFM4、AQP8和CWH43,除LOC389023暂无相关药物数据,其余3个核心基因均能检索到相关靶向药物,通过《中华本草》和《中药大辞典》筛选整理得到核心基因靶向中药7味(表1),分别为淡豆豉、牡荆子、骨节草、酒、苦豆子、鹿茸和紫河车。对以上药物进行性味归经总结,并绘制雷达图进行可视化展示,由图6~7可知,靶向中药大多药性偏温,药味偏苦,归经入肺。
3 讨论与结论
UC作为一种病因尚未明确的炎症性肠道疾病,未经及时治疗可能会导致肠梗阻、肠穿孔等并发症,甚至癌变。迄今尚无有效的预防和治疗方法,在国际医学领域仍是一个亟待解决的难题。因此,对其发病机制及诊疗方案的研究显得尤为重要。
运用LASSO和SVM-RFE算法对157个DEGs进行筛选得到LOC389023、OLFM4、AQP8和CWH43四个UC核心生物标志物。LOC389023(也称作BC0329133)由位于人类2号染色体上的DPP10-AS1转录而来。Shulha等[14]研究发现,LOC389023作为一种新型顺式反义RNA,在胎儿和成人前额叶皮质提取的核RNA组分中高度富集,其在人体中通过顺式作用招募PRC2等转录抑制因子来抑制正义转录物DPP10的表达。Allen等[15]研究发现DPP10通过切割细胞因子和趋化因子的末端二肽来调节炎症。DPP10水平的改变可以调节肺上皮细胞的炎症反应[16]。由此推测,LOC389023在UC病理过程中可能通过抑制DPP10的表达来参与炎症调节。嗅觉介导素4(OLFM4)是一种促进细胞黏附的细胞外基质糖蛋白,最初从人成髓细胞克隆而来[17],其编码蛋白是促进肿瘤生长的抗凋亡因子。相关研究表明,OLFM4在人小肠和结肠的隐窝基柱状细胞中高表达[18]。作为IL-22诱导的肿瘤干性基因,OLFM4在原发硬化性胆管炎相关UC中的表达量明显升高[19]。脂多糖(LPS)诱导巨噬细胞炎症反应[20],实验研究发现,在经过LPS处理的Raw264.7细胞中,OLFM4和DPP10的mRNA表达显著上调[21]。此外,与正常组相比,葡聚糖硫酸钠诱导的UC小鼠结肠组织中OLFM4的表达明显升高,与本研究分析结果一致。因此,OLFM4的高表达可能与UC炎症反应呈正相关。水通道蛋白8(AQP8)存在于胰腺和结肠中,在肠道吸收水分中起重要作用,其可能参与细胞内渗透调节和黏膜液通量的过程[22]。相关研究表明,液体通量可能在黏膜防御中起重要作用[23-24]。据报道,荆芥、防风可明显改善UC模型大鼠的症状和组织病理学,加快肠黏膜愈合,其机制可能与上调结肠黏膜AQP4和AQP8表达水平有关[25]。细胞壁生物合成43C末端同源物(CWH43)是一种进化保守的多位内核膜蛋白,CWH43缺失可降低小鼠大脑中L1细胞黏附分子(L1CAM)蛋白的表达[26-27]。结肠活检的免疫组织化学显示,相较于正常结肠组织,L1CAM在慢性炎症性肠病患者组织的肠上皮细胞中高表达[28]。因此,CWH43可能通过调节L1CAM的表达来参与UC的病理过程。
GO和KEGG通路富集分析结果表明,DEGs大多富集于与免疫应答相关的生物学过程及通路,包括IL-17信号通路、TNF信号通路、类风湿关节炎、趋化因子信号通路、体液免疫反应、中性粒细胞趋化和迁移等,以上表明免疫因子在UC病理生理过程中起着至关重要的作用。也有相关研究[29-32]表明UC中失调的基因主要集中在免疫过程,而且粒细胞浸润和IL-17信号传导可导致结肠组织损伤和炎症。对于UC等炎症性疾病,趋化因子可募集白细胞进入肠黏膜,引发各种炎症效应,包括白细胞活化、颗粒外渗、产生金属蛋白酶降解基质等[33]。目前已有研究通过实验动物模型和临床病例证实趋化因子与结肠炎的机制有关,表明趋化因子在UC病因中可能发挥着至关重要的作用[34]。GSEA富集分析结果表明,来自UC样本表达矩阵的差异基因主要活跃富集在体液免疫、细胞对干扰素-γ的反应、补体与凝血级联系统、细胞因子-细胞因子受体互作以及系统性红斑狼疮等免疫相关信号,进一步肯定了免疫应答在UC发病机制中的相关性及重要性。
通过CIBERSORT算法分析发现,健康对照者和UC患者中的浸润差异显著,记忆B细胞、CD4+记忆静息T细胞、M2巨噬细胞和静息树突状细胞等多种免疫细胞亚型与UC的生物学过程密切相关。据以往研究[35-36]报道,上述免疫细胞大多在UC中处于异常状态。活化的T细胞可以分化成调节性和效应性T细胞,导致炎症性肠病[37-38]。此外,滤泡辅助性T细胞和滤泡调节性T细胞的失衡也与UC相关[39]。CD4+T细胞和NKT细胞能够增加Th2相关细胞因子和Th17相关促炎细胞因子的分泌,促进肠黏膜炎症[40-41]。通过机器学习算法筛选出来的4个核心基因表达量均与肥大细胞显著相关,已有研究证实肥大细胞和嗜酸性粒细胞在功能上参与UC的过程,UC患者在缓解期出现的直肠高敏感性及肠易激综合征样症状与肥大细胞的活性相关[42-43]。另有实验结果提示,肥大细胞膜稳定剂色甘酸钠灌胃可减轻小鼠UC炎症反应,间接表明肥大细胞参与了UC的发病[44]。近年对UC免疫因素的研究主要集中在T细胞、自身抗体、下游损伤免疫因子、纤维化和固有免疫系统、过氧化物酶体增殖体激活受体和其他细胞因子[45]。本研究结果与现有文献结论一致,同时还注意到肥大细胞在UC免疫微環境中的作用和机制,其与LOC389023、OLFM4、AQP8和CWH43四个潜在诊断免疫相关基因的关联和调控可能是UC发病的重要环节,可作为后续研究的关注点和切入点,以期为疾病的发生发展提供理论依据,开发更为有效的临床治疗手段。
根据病因、病机及临床表现,中医将UC归类于“久痢”“休息痢”“肠澼”“大瘕泄”等范畴[46]。本研究通过在HERB数据库对UC核心基因进行检索,找到其对应的靶向中药,并查阅《中华本草》和《中药大辞典》对中药的性味归经进行归纳总结,整理得到淡豆豉、牡荆子、骨节草、酒、苦豆子、鹿茸和紫河车7味靶向中药,上述药物大多药性偏温,药味偏苦,归经入肺。药理研究表明,淡豆豉对人体肠杆菌、肠球菌、双歧杆菌、乳杆菌、产气荚膜梭菌和脆弱拟杆菌6种人体肠道常驻菌具有不同程度的调节作用[47]。而肠道菌群紊乱在UC的病理上起重要作用,中药与肠道菌群的相互作用是UC治疗的关键环节[48]。已有研究证实牡荆子脂质能扩张小鼠气道平滑肌,延长由Ach和组胺介导的豚鼠喘息潜伏期[49]。凌纬纬[50]发现牡荆粗提物对枯草杆菌、大肠埃希菌、四联球菌、荧光假单胞菌都有一定的抑制作用。骨节草,又名节节草,实验证明其总生物碱对大肠杆菌、藤黄微球菌、奇异变形杆菌、枯草杆菌、黑曲霉菌、产气杆菌6个菌种均具有较好的抑菌效果[51]。由此推断,淡豆豉、牡荆子和骨节草3味中药可能通过调节肠道菌群在UC病理过程中发挥疗效。繁体字“醫”由3部分组成:“医”意为外部受到创伤,“殳”指针灸推拿等治疗手段,“酉”则意为酒。即在受伤后通过按摩、针刺等治疗,再配合酒的饮用,最后达到治疗效果,如此一来方可称之为“醫”[52]。可见古人早已意识到酒的医用价值。《本草纲目》有云:“唯米酒入药用”。米酒,今称黄酒,现代药理研究表明其有降血压、抗氧化、增强机体免疫力等功效[53]。苦豆子化学成分以生物碱类为主,实验研究结果表明其具有抗病毒、抗炎及免疫调节作用,而且是以免疫抑制为主的中草药[54]。鹿茸具有较好的抗炎及增强免疫作用,其成分鹿茸多肽能调节免疫细胞相关因子,抑制多种慢性炎症的发生[55]。紫河车为健康产妇娩出的胎盘,现代医学研究认为胎盘含蛋白质、糖、钙、维生素、免疫因子等成分,能增强机体抵抗力,同时胎盘γ-球蛋白含有干扰素,可用于预防和控制病毒感染[56]。因此,酒、苦豆子、鹿茸和紫河车4味中药对UC的药理作用或主要体现在抗炎及调节免疫。上述7味中药大多性温味苦,归肺经。刘晓燕等[57]通过探讨四气五味与脏腑补泻的关系,总结出“苦温泻寒湿”及“苦温泻肺燥”等治法规律。此外,本研究DO富集分析结果表明,DEGs主要富集在肺和肠道疾病,结合靶向中药的主要性味归经,皆与“肺与大肠相表里”理论不谋而合。早在《黄帝内经》中就已提出“肺与大肠相表里”的思想。随着系统生物学的兴起,多组学方法的应用,学者们将微生物研究和免疫研究等结合在一起,提出了“肠-肺轴”的概念,将“肺与大肠相表里”的机制研究过渡到新阶段[58-59]。罗瑞娟等[60]通过“肺-肠轴”概念阐述了肺-肠联系,诠释了“肺与大肠相表里”理论的科学性,同时发现中医药能够从调节肺肠菌群、影响炎症通路、调节免疫等多方面发挥对UC的治疗作用。
综上所述,LOC389023、OLFM4、AQP8和CWH43可能作为UC的诊断生物标志物,然而这些生物标志物能否区分不同的内表型尚未清楚。因此,未来有必要进一步研究这些基因对不同内表型的区分效能。此外,淡豆豉、牡荆子、骨节草、酒、苦豆子、鹿茸和紫河车7味中药可能通过调节肺肠菌群、影响炎症通路、调节免疫等方面干预UC的病理进程,这也为其临床治疗用药提供了参考和方向。
参考文献:
[1]HUANG J K, ZHANG J Q, MA J X, et al. Inhibiting ferroptosis: A novel approach for ulcerative colitis therapeutics[J]. Oxidative Medicine and Cellular Longevity, 2022, 2022: 9678625. DOI: 10.1155/2022/9678625.
[2]TALLEY N J, ABREU M T, ACHKAR J P, et al. An evidence-based systematic review on medical therapies for inflammatory bowel disease[J]. The American Journal of Gastroenterology, 2011, 106(S1): S2-S25. DOI: 10.1038/ajg.2011.58.
[3]KOCH A K, SCHLS M, LANGHORST J, et al. Perceived stress mediates the effect of yoga on quality of life and disease activity in ulcerative colitis.Secondary analysis of a randomized controlled trial[J]. Journal of Psychosomatic Research, 2020, 130: 109917. DOI: 10.1016/j.jpsychores.2019.109917.
[4]HARBORD M, ELIAKIM R, BETTENWORTH D, et al. ThirdEuropean evidence-based consensus on diagnosis and management of ulcerative colitis. part 2: Current management[J]. Journal of Crohn′s and Colitis, 2017, 11(7): 769-784. DOI: 10.1093/ecco-jcc/jjx009.
[5]劉琼, 成哲, 陈广. 溃疡性结肠炎中医治疗进展[J]. 中国中医基础医学杂志, 2021, 27(7): 1191-1194.
[6]ZENG H W, LIU X Q, ZHANG Y S. Identification of potential biomarkers and immune infiltration characteristics in idiopathic pulmonary arterial hypertension using bioinformatics analysis[J]. Frontiers in Cardiovascular Medicine, 2021, 8: 624714. DOI: 10.3389/fcvm.2021.624714.
[7]ZHAO E F, XIE H, ZHANG Y S. Predicting diagnostic gene biomarkers associated with immune infiltration in patients with acute myocardial infarction[J]. Frontiers in Cardiovascular Medicine, 2020, 7: 586871. DOI: 10.3389/fcvm.2020.586871.
[8]KEIRM E, FUH F, ICHIKAWA R, et al. Regulation and role of αe integrin and gut homing integrins in migration and retention of intestinal lymphocytes during inflammatory bowel disease[J]. Journal of Immunology, 2021, 207(9): 2245-2254. DOI:10.4049/jimmunol.2100220.
[9]PAVLIDIS P, TSAKMAKI A, PANTAZI E, et al. Interleukin-22 regulates neutrophil recruitment in ulcerative colitis and is associated with resistance toustekinumab therapy[J]. Nature Communications, 2022, 13(1): 1-17. DOI: 10.1038/s41467-022-33331-8.
[10]LI K, STRAUSS R, OUAHED J, et al. Molecular comparison of adult and pediatric ulcerative colitis indicates broad similarity of molecular pathways in disease tissue[J]. Journal of Pediatric Gastroenterology and Nutrition, 2018, 67(1): 45-52. DOI: 10.1097/MPG.0000000000001898.
[11]FANG SS, DONG L, LIU L, et al. HERB: A high-throughput experiment-and reference-guided database of traditional Chinese medicine[J]. Nucleic Acids Research, 2021, 49(D1): D1197-D1206. DOI: 10.1093/nar/gkaa1063.
[12]国家中医药管理局《中华本草》编委会. 中华本草第九卷[M]. 上海: 上海科学技术出版社, 1999.
[13]趙国平,戴慎,陈仁寿. 中药大辞典[M]. 上海: 上海科学技术出版社, 2009.
[14]SHULHA H P, CRISCI J L, RESHETOV D, et al. Human-specific histone methylation signatures at transcription start sites in prefrontal neurons[J].PLoS Biology, 2012, 10(11): e1001427. DOI: 10.1371/journal.pbio.1001427.
[15]ALLEN M, HEINZMANN A, NOGUCHI E, et al. Positional cloning of a novel gene influencing asthma from Chromosome 2q14[J]. Nature Genetics, 2003, 35(3): 258-263. DOI: 10.1038/ng1256.
[16]ZHANG Y M, POOBALASINGAM T, YATES L L, et al. Manipulation of dipeptidylpeptidase 10 in mouse and human in vivo and in vitro models indicates a protective role in asthma[J]. Disease Models & Mechanisms, 2018, 11(1): dmm031369. DOI: 10.1242/dmm.031369.
[17]KOSINSKI C, LI V S W, CHAN A S Y, et al. Gene expression patterns of human colon tops and basal crypts and BMP antagonists as intestinal stem cell niche factors[J]. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(39): 15418-15423. DOI: 10.1073/pnas.0707210104.
[18]van der FLIER L G, HAEGEBARTH A, STANGE D E, et al. OLFM4 is a robust marker for stem cells in human intestine and marks a subset of colorectal cancer cells[J]. Gastroenterology, 2009, 137(1): 15-17. DOI: 10.1053/j.gastro.2009.05.035.
[19]NEYAZI M, BHARADWAJ SS, BULLERS S, et al. Over expression of cancer-associated stem cell gene OLFM4 in the colonic epithelium of patients with primary sclerosing cholangitis[J]. Inflammatory Bowel Diseases, 2021, 27(8): 1316-1327. DOI: 10.1093/ibd/izab025.
[20]FANG H Q, PENGAL R A, CAO X H, et al. Lipopolysaccharide-induced macrophage inflammatory response is regulated by SHIP[J]. Journal of Immunology, 2004, 173(1): 360-366. DOI: 10.4049/jimmunol.173.1.360.
[21]HE T Z, WANG K, ZHAO P, et al. Integrative computational approach identifies immune-relevant biomarkers in ulcerative colitis[J]. FEBS Open Bio, 2022, 12(2): 500-515. DOI: 10.1002/2211-5463.13357.
[22]CALAMITA G, MAZZONE A, BIZZOCA A, et al. Expression and immunolocalization of the aquaporin-8 water channel in rat gastrointestinal tract[J]. European Journal of Cell Biology, 2001, 80(11): 711-719. DOI: 10.1078/0171-9335-00210.
[23]ASFAHA S, MACNAUGHTON W K, APPLEYARD C B, et al. Persistent epithelialdysfunction and bacterial translocation after resolution of intestinal inflammation[J]. American Journal of Physiology Gastrointestinal and Liver Physiology, 2001, 281(3): G635-G644. DOI: 10.1152/ajpgi.2001.281.3.G635.
[24]MORRIS G P, FALLONE C A, PRINGLE G C, et al. Gastriccytoprotection is secondary to increased mucosal fluid secretion: a study of six cytoprotective agents in the rat[J]. Journal of Clinical Gastroenterology, 1998, 27(S1): S53-S63. DOI: 10.1097/00004836-199800001-00010.
[25]屈映,張书信,傅丽元,等. 荆芥、防风对溃疡性结肠炎大鼠结肠黏膜AQP4和AQP8表达的影响[J].中国摘要杂志, 2020, 45(15): 3719-3725. DOI:10.19540/j.cnki.cjcmm.20200220.401.
[26]LEIPUS A, OLSSON I, BERREZ J M, et al. Cwh43 is an evolutionary conserved polytopic inner nuclear membraneprotein[EB/OL].[2023-01-13]. http://urn.kb.se/resolve?urn=urn%3Anbn%3Ase%3Asu%3Adiva-24987.
[27]YANG D J, YANG H W, LUISELLI G, et al. Increased plasmin-mediated proteolysis ofL1CAM in a mouse model of idiopathic normal pressure hydrocephalus[J]. Proceedings of the National Academy of Sciences of the United States of America, 2021, 118(33): e2010528118. DOI: 10.1073/pnas.2010528118.
[28]SCHFER H, STRUCK B, FELDMANN E M, et al. TGF-β1-dependent L1CAM expression has an essential role in macrophage-induced apoptosis resistance and cell migration of human intestinal epithelial cells[J]. Oncogene, 2013, 32(2): 180-189. DOI: 10.1038/onc.2012.44.
[29]TANAKA K. Expression ofToll-like receptors in the intestinal mucosa of patients with inflammatory bowel disease[J]. Expert Review of Gastroenterology & Hepatology, 2008, 2(2): 193-196. DOI: 10.1586/17474124.2.2.193.
[30]DIECKGRAEFE B K, STENSON W F, KORZENIK J R, et al. Analysis of mucosal gene expression in inflammatory bowel disease by parallel oligonucleotide arrays[J]. Physiological Genomics, 2000, 4(1): 1-11. DOI: 10.1152/physiolgenomics.2000.4.1.1.
[31]DENT G, LOWETH S C, HASAN A M, et al. Synergic production of neutrophil chemotactic activity by colonic epithelial cells and eosinophils[J]. Immunobiology, 2014, 219(10): 793-797. DOI: 10.1016/j.imbio.2014.06.008.
[32]NANKI K, FUJII M, SHIMOKAWA M, et al. Somatic inflammatory gene mutations in human ulcerative colitis epithelium[J]. Nature, 2020, 577(7789): 254-259. DOI: 10.1038/s41586-019-1844-5.
[33]PAPADAKIS K A. Chemokines in inflammatory bowel disease[J]. Current Allergy and Asthma Reports, 2004, 4(1): 83-89. DOI: 10.1007/s11882-004-0048-7.
[34]SINGH U P, SINGH N P, MURPHY E A, et al. Chemokine and cytokine levels in inflammatory bowel disease patients[J]. Cytokine, 2016, 77: 44-49. DOI: 10.1016/j.cyto.2015.10.008.
[35]LUO Y X, LIU S Y, LI H B, et al. Masscytometry and single-cell transcriptome analyses reveal the immune cell characteristics of ulcerative colitis[J]. Frontiers in Molecular Biosciences, 2022, 9: 859645. DOI: 10.3389/fmolb.2022.859645.
[36]MITSIALIS V, WALL S, LIU P, et al. Single-cell analyses of colon and blood reveal distinct immune cell signatures of ulcerative colitis andcrohn′s disease[J]. Gastroenterology, 2020, 159(2): 591-608.e10. DOI: 10.1053/j.gastro.2020.04.074.
[37]KMIEC' Z, CYMAN M, S'LEBIODA T J. Cells of the innate and adaptive immunity and their interactions in inflammatory bowel disease[J]. Advances in Medical Sciences, 2017, 62(1): 1-16. DOI: 10.1016/j.advms.2016.09.001.
[38]SANCHEZ-MUNOZ F, DOMINGUEZ-LOPEZ A, YAMAMOTO-FURUSHO J-K. Role of cytokines in inflammatory bowel disease[J]. World Journal of Gastroenterology, 2008, 14(27): 4280-4288. DOI:10.3748/wjg.14.4280.
[39]LONG Y, XIA C S, XU L J, et al. The imbalance of circulating follicular helperT cells and follicular regulatory T cells is associated with disease activity in patients with ulcerative colitis[J]. Frontiers in Immunology, 2020, 11: 104. DOI: 10.3389/fimmu.2020.00104.
[40]BAUMGART D C, SANDBORN W J. Crohn′s disease[J]. Lancet, 2012, 380(9853): 1590-1605. DOI: 10.1016/S0140-6736(12)60026-9.
[41]LATELLA G, PAPI C. Crucial steps in the natural history of inflammatory bowel disease[J]. World Journal of Gastroenterology, 2012, 18(29): 3790-3799. DOI: 10.3748/wjg.v18.i29.3790.
[42]STASIKOWSKA-KANICKA O, DANILEWICZ M, GOWACKA A, et al. Mast cells and eosinophils are involved in activation of ulcerative colitis[J]. Advances in Medical Sciences, 2012, 57(2): 230-236. DOI: 10.2478/v10039-012-0029-3.
[43]van HOBOKEN E A, THIJSSEN A Y, VERHAAREN R, et al. Symptoms in patients with ulcerative colitis in remission are associated with visceral hypersensitivity and mast cell activity[J]. Scandinavian Journal of Gastroenterology, 2011, 46(7/8): 981-987. DOI: 10.3109/00365521.2011.579156.
[44]戈伊芹, 黃雨霁, 李玮泽, 等. 色甘酸钠灌胃对葡聚糖硫酸钠诱导的BALB/c小鼠溃疡性结肠炎模型的影响[J]. 上海交通大学学报(医学版), 2022, 42(10):1375-1382. DOI: 10.3969/j.issn.1674-8115.2022.10.002.
[45]宋亚芳, 裴丽霞, 赵婷婷. 溃疡性结肠炎免疫因素发病机制的研究进展[J]. 医学研究生学报, 2019, 32(4):432-436. DOI: 10.16571/j.cnki.1008-8199.2019.04.019.
[46]张晓明, 柳越冬, 都静, 等. 中医学理论指导下的溃疡性结肠炎病因病机研究进展[EB/OL]. [2023-01-20].https://kns.cnki.net/kcms/detail//21.1546.r.20230131.1106.001.html.
[47]陈丽艳, 官雪莲, 张蕾, 等. 淡豆豉对人体肠道六种常住菌的调节作用[J]. 中国微生态学杂志, 2017, 29(10): 1122-1126. DOI: 10.13381/j.cnki.cjm.201710002.
[48]王潇璐, 姚海强, 万瑾毅. 中药-肠道菌群互作效应在溃疡性结肠炎治疗中的作用[J]. 世界中医药, 2023, 18(1): 132-136.
[49]刘懋生, 刘昌林, 顾刚妹, 等. 牡荆子脂质对实验动物气道平滑肌的影响[J]. 中国药理学通报, 1993(4): 307-310.
[50]凌玮玮. 牡荆化学成分及其抑菌活性研究[D]. 合肥: 安徽农业大学,2011.
[51]陈莉华, 张俊生, 张丽, 等. 湘西节节草总生物碱的提取及抑菌性研究[J]. 湖南农业科学, 2011(9):101-104. DOI: 10.3969/j.issn.1006-060X.2011.09.031.
[52](汉)许慎撰.说文解字注[M]. (清)段玉裁,注. 上海: 上海古籍出版社, 1981.
[53]刘月, 祁国栋, 张炳文. 黄酒功能成分的研究进展[J]. 中国酿造, 2015, 34(11)27-30. DOI: 10.11882/j.issn.0254-5071.2015.11.007.
[54]郝伟亮, 孟根达来, 解红霞. 苦豆子的化学成分及药理作用研究进展[J]. 中国药房, 2016, 27(13): 1848-1850.
[55]胡艳红, 颜鑫, 雷燕, 等. 鹿茸的化学成分、药理作用与临床应用研究进展[J]. 辽宁中医药大学学报, 2021, 23(9): 47-52. DOI:10.13194/j.issn.1673-842x.2021.09.010.
[56]郭广英, 刘家安. 紫河车功效及药理作用探析[J]. 中国民间疗法, 2014, 22(11): 77-78.
[57]刘晓燕, 崔亚东, 田合禄. 中医四气五味理论与脏腑补泻关系的探讨[J]. 世界中医药, 2021, 16(1): 121-124. DOI: 10.3969/j.issn.1673-7202.2021.01.018.
[58]莫芳芳, 马师雷, 李鸿涛, 等. 基于中医古籍研究的“肺与大肠相表里”理论源流及其内涵探讨[J]. 环球中医药, 2015, 8(2): 165-168. DOI: 10.3969/j.issn.1674-1749.2015.02.010.
[59]王宪正, 赵霞, 狄留庆, 等. “肺与大肠相表里”的研究進展[J]. 世界科学技术(中医药现代化), 2020, 22(3): 850-855.
[60]罗瑞娟, 柳越冬, 潘海鸥, 等. 基于“肺与大肠相表里”理论的溃疡性结肠炎中医药治疗研究进展[J]. 中华中医药学刊, 2022, 40(5): 58-61. DOI:10.13193/j.issn.1673-7717.2022.05.015.

