基于斑马鱼模型研究木蝴蝶苷A的抗阿尔茨海默病活性和作用机制
时瑞碟 高鑫 王宝堃 高代丽 靳梦 张秀军

摘要:基于六水合氯化鋁诱导的斑马鱼阿尔茨海默病模型,探究木蝴蝶苷A的抗阿尔茨海默病活性及作用机制。将受精后3 d的野生型AB品系斑马鱼随机分为阴性对照组,80 μmol/L六水合氯化铝模型对照组,80 μmol/L六水合氯化铝与6 μmol/L多奈哌齐阳性对照组,80 μmol/L六水合氯化铝与不同浓度(5、10、20 μmol/L)木蝴蝶苷A受试物组。斑马鱼受精后6 d,利用明暗交替行为学实验观察不同处理组斑马鱼行为差异并分析其变化;通过硫黄素S染色测定各组斑马鱼头部Aβ斑块沉积数;采用酶活测定试剂盒检测各组斑马鱼乙酰胆碱酯酶活性;以实时荧光定量PCR检测自噬相关基因(beclin1、ulk1b、ulk2和atg7)的表达变化;借助分子对接技术验证木蝴蝶苷A与自噬相关蛋白(beclin1、ulk1b、ulk2和atg7)结合的可靠性。结果表明,木蝴蝶苷A缓解了六水合氯化铝造成的斑马鱼运动障碍,降低了Aβ斑块沉积数和乙酰胆碱酯酶活性水平,使自噬相关基因的异常表达趋于正常。该研究初步揭示了木蝴蝶苷A能够缓解六水合氯化铝诱导的斑马鱼运动障碍,其机制可能与激活细胞自噬有关,这为木蝴蝶苷A的临床应用及其治疗阿尔茨海默病的相关研究提供了理论依据。
关键词:阿尔茨海默病;六水合氯化铝;自噬;斑马鱼;木蝴蝶苷A
中图分类号:R965 文献标志码:A 文章编号:1002-4026(2023)06-0028-10
Anti-Alzheimer′s disease activity of oroxin A and its
mechanism of action based on zebrafish model
SHI Ruidie1,2, GAO Xin2, WANG Baokun2, GAO Daili2, JIN Meng2*, ZHANG Xiujun1*
(1. College of Psychology and Mental Health, North China University of Science and Technology, Tangshan 063200, China;
2. Key Laboratory of Drug Screening Technology of Shandong Academy of Sciences, Biology Institute,
Qilu University of Technology (Shandong Academy of Sciences), Jinan 250103, China)
Abstract∶To investigate the ameliorative effects of oroxin A on Alzheimer′s disease (AD) and the underlying mechanism of action, a zebrafish AD model induced by aluminum chloride hexahydrate (AlCl3) was used. Wild-type zebrafish AB larvae at 3 dpf(days post fertilization) were divided into different groups, including negative control group, AlCl3 (80 μmol/L) model control group, AlCl3 (80 μmol/L) combined with donepezil (6 μmol/L) positive control group, and AlCl3 (80 μmol/L) combined with different concentrations (5, 10, and 20 μmol/L) of oroxin A test group. At 6 dpf, zebrafish behavior was monitored and analyzed using zebrafish light-dark locomotion test. Aβ deposition in zebrafish heads was assayed by thioflavin S staining. Acetylcholine assay kit tested acetylcholinesterase (AchE) activity. In addition, the expression of autophagy-related genes(beclin1、ulk1b、ulk2 and atg7) was tested by real-time quantitative polymerase chain reaction. Molecular docking was performed to validate the interaction between oroxin A and autophagy-related protein(beclin1、ulk1b、ulk2 and atg7). The results indicated that oroxin A significantly relieved the dyskinesia and inhibited Aβ deposition and AchE activity of zebrafish induced by AlCl3. The expression of autophagy-related genes tended to be normal after oroxin A treatment. This study preliminarily revealed that oroxin A alleviated AlCl3-induced AD symptoms in zebrafish, where the underlying mechanism of action is possibly associated with activated autophagy, providing a theoretical basis for the clinical application of oroxin A and its related research in treating AD.
Key words∶Alzheimer′s disease; aluminum chloride hexahydrate; autophagy; zebrafish; oroxin A
阿尔茨海默病(Alzheimer′s disease,AD)是一种常见的神经退行性疾病,主要病理特征是细胞外β-淀粉样蛋白(amyloid β-protein,Aβ)斑块的沉积和细胞内神经原纤维缠结的形成[1]。AD的发病机制复杂多样,目前广为认可的发病机制假说包括淀粉样蛋白级联假说、tau蛋白异常磷酸化假说、胆碱能假说等[2]。目前针对AD的治疗,主要是胆碱酯酶抑制剂(多奈哌齐、加兰他敏和卡巴拉汀)和N-甲基-D-天冬氨酸受体拮抗剂(美金刚)[2]。这些药物虽然能在一定程度上改善AD患者的行为和认知障碍,但并不能治愈或者预防该疾病。
自噬是细胞自我降解的过程,在去除错误折叠或聚集的蛋白质、清除受损细胞器等方面起着重要作用[3]。研究表明自噬的增强能够降低人神经元细胞中tau蛋白的过度磷酸化,缓解AD小鼠模型的记忆障碍[4]。杜仲雄花通过调节自噬基因异常表达来改善AD样症状[5]。自噬与AD病理之间存在复杂的联系,这表明自噬相关蛋白(beclin1、ulk2、ulk1b和atg7)可能是AD治疗的重要靶点。
中药木蝴蝶来源于紫葳科植物木蝴蝶的干燥成熟种子,具有清肺利咽、疏肝和胃等作用[6]。木蝴蝶苷A是木蝴蝶提取而得到的一种黄酮类物质。研究表明,木蝴蝶苷A具有抗氧化、抗炎、抗病毒、抗癌等特性,但目前还缺乏关于木蝴蝶苷A对神经系统疾病作用的研究[7-8]。斑马鱼是人类疾病和药物开发的理想模型系统,常用于研究AD、帕金森病、精神分裂症等神经退行性疾病。六水合氯化铝诱导的斑马鱼AD模型,是一种比较成熟的能够反映AD主要特征性病理变化的体内动物模型[9]。
本研究中,我們使用六水合氯化铝诱导的斑马鱼AD模型,通过观察并记录斑马鱼的行为表现,检测乙酰胆碱酯酶(acetylcholinesterase,AchE)的活性和Aβ斑块沉积以及测定自噬相关基因的表达变化,从而分析木蝴蝶苷A对六水合氯化铝诱导的斑马鱼AD症状是否具有缓解作用,并对其机制进行探究。
1 仪器与材料
1.1 实验仪器
Z-A-S5斑马鱼养殖系统(上海海圣公司);ZebraLab 3.3 Zebrabox 斑马鱼行为分析仪(法国Viewpoint 公司);HPG-280BX光照培养箱(东联电子技术开发有限公司);13720实时荧光定量 PCR 仪器(瑞士Roche 诊断产品有限公司);C1000 Touch梯度 PCR 仪(美国Bio-Rad公司);FV1200激光扫描共聚焦显微镜(日本Olympus 公司);NanoDrop One超微量分光光度计(上海基因生物技术国际贸易有限公司 );Spectra MR全波长酶标仪(美国Dynex 公司)。
1.2 实验材料
木蝴蝶苷A(批号DM0028,纯度≥96%,成都乐美天医药科技有限公司);六水合氯化铝(批号A112511,纯度99.99%,上海阿拉丁生化科技股份有限公司);盐酸多奈哌齐(批号D129948,纯度≥98%,上海阿拉丁生化科技股份有限公司); RNA 快速提取试剂盒(批号312423AX,北京艾德莱生物科技有限公司);逆转录试剂盒(批号E047-01B,苏州近岸蛋白质科技股份有限公司);BCA蛋白浓度测定试剂盒(批号052319190910, 上海碧云天生物技术有限公司);实时荧光定量PCR试剂盒(批号E096-01B,苏州近岸蛋白质科技股份有限公司);硫磺素S(批号MKCH4108,美国Sigma公司);AchE活性检测试剂盒(批号20200829,南京建成生物工程研究所);N-苯基硫脲(批号P7629,美国Sigma公司);0.3% Triton X-100(批号3466850,上海生工生物工程有限公司);柠檬酸钠抗原修复液(1×)(批号20190322,北京索莱宝科技有限公司);4%多聚甲醛(批号71041800,北京兰杰柯科技有限公司)。
1.3 斑马鱼品系
野生型AB品系斑马鱼由山东省科学院生物研究所提供。将成年斑马鱼饲养在恒温 28 ℃的养殖系统中,每天同一时间段给与14 h/10 h的光照循环,定点喂食两次丰年虾。将成年斑马鱼按照2:2的雌雄比例于前一天分别放置于鱼缸中,用挡板将雌雄鱼分开,并于第二天早上8:30抽取挡板,大概2 h后,将鱼缸中的鱼卵转移到玻璃缸中,并加入5 g/L的亚甲基蓝,之后放置在恒温28 ℃的光照培养箱中培养。
2 方法
2.1 实验分组及处理
将受精后3 d的斑马鱼随机转移到6孔细胞培养板中,之后将斑马鱼随机分为6个组:阴性对照组,六水合氯化铝(80 μmol/L)模型对照组,六水合氯化铝和不同浓度 (5、10和20 μmol/L) 木蝴蝶苷A受试物共处理组,六水合氯化铝和多奈哌齐(6 μmol/L)阳性对照组。每天给药一次,之后放置在光照培养箱中培养。在斑马鱼受精后6 d进行明暗交替行为学观察,AchE活性检测,斑马鱼头部Aβ斑块数检测和实时荧光定量 PCR分析自噬相关基因的表达。
2.2 明暗交替行为学观察
将受精后6 d的斑马鱼(n=32)分别吸入到48孔板中,每孔加入1 mL的养鱼水。将斑马鱼置于行为学观测箱中在100%光照环境中适应10 min,之后进行60 min包括3组明暗交替循环(10 min黑暗,10 min光照)的行为学测试。实验结束后利用Zebrabox 斑马鱼行为分析仪对斑马鱼的游动轨迹、游动速度和游动距离进行分析。
2.3 AchE活性检测
将药物处理结束的受精后6 d的斑马鱼(n=100)收集在1.5 mL的离心管中,每管加入200 μL的生理盐水,之后用破碎机进行破碎匀浆。以11 000 r/min的转速在4 ℃离心10 min后取上清液,之后按照BCA蛋白浓度测定试剂盒说明书进行操作,用全波长酶标仪测定562 nm处的光密度值(optical density,OD)并计算样品的蛋白浓度。之后根据AchE活性检测试剂盒的说明书,稍作修改后进行实验。具体操作为分别吸取双蒸水、底物缓冲液和显色应用液各5、50、50 μL配置空白管所需溶液;分别吸取标准液、底物缓冲液和显色应用液各5、50、50 μL配置标准管所需溶液;分别吸取各组斑马鱼样品蛋白上清液、底物缓冲液和显色应用液各5、50、50 μL配置不同处理组的测定溶液。之后将各组配置好的溶液振荡混匀后加入到96孔板中,每个处理组5次重复。在37 ℃恒温培养箱中孵育20 min后,每孔加入10 μL的透明剂和3 μL的抑制剂。在室温下放置15 min后,使用酶标仪在412 nm波长和0.5 cm光径处测定OD值,之后根据各样品组的OD值和浓度,计算得出各处理组的AchE活力。
2.4 斑马鱼头部Aβ斑块数检测
将受精后的斑马鱼卵收到养鱼缸之后,加入1 mg/mL的N-苯基硫脲以抑制黑色素的形成。每天同一时间换一次液,其他药物处理方法同2.1节所述。将4%多聚甲醛处理后的受精后6 d的斑马鱼放入4 ℃冰箱中过夜。第二天使用磷酸缓冲盐缓冲液(phosphate buffered saline,PBS)将斑马鱼清洗3次,每次10 min。将清洗完的斑马鱼使用1%的琼脂凝胶固定后,进行酒精梯度脱水,二甲苯透明,石蜡浸润。之后将处理完的蜡块,以7 μm间距进行横切切片。脱蜡之后在室温下用PBS洗涤切片5 min,重复3次。吸干水分,用免疫组化笔将载玻片上的组织框起来。然后按照3 μL:1 mL比例配制0.3 %TritonX-100和柠檬酸钠抗原修复液(1×),混匀后加到框起来的组织上,在4 ℃冰箱孵育20 min后,用PBS清洗2次,每次5 min。用滤纸将载玻片上的PBS完全吸干后,在免疫组化笔圈住的部分加入0.3%硫黄素S,并放入4 ℃冰箱避光过夜。第二天用PBS在避光环境下洗涤切片10 min,重复3次,之后用激光扫描共聚焦显微镜观察斑马鱼头部Aβ斑块沉积状况并进行拍照。使用Image-Pro Plus 5.1分析图像,并计数斑马鱼头部Aβ斑块沉积数。
2.5 实时荧光定量 PCR分析自噬相关基因的表达
将药物处理结束的受精后6 d的斑马鱼(n=30)收集在1.5 mL的离心管中,每管加入500 μL的裂解液,之后用破碎机进行破碎匀浆。按照RNA快速提取试剂盒的说明书进行RNA提取后,利用超微量分光光度计检测不同组别斑马鱼的RNA浓度。之后立即使用C1000 Touch梯度PCR仪将RNA进行逆转录,将逆转录得到的cDNA进行稀释,之后根据实时荧光定量PCR试剂盒说明书,加入相应的引物。用实时荧光定量PCR仪对基因进行扩增,扩增结束后,用Cq值计算各组样品基因的差异表达,选用rpl13a为内参,目的基因与内参基因的Cq差值用ΔCq表示,ΔΔCq值为各样品的ΔCq值与Ctl组ΔCq值平均数的差值,mRNA的相对表达量根据2-ΔΔCq相对定量法计算,每组设置3个重复组。引物序列见表1。
2.6 分子对接的准备过程
木蝴蝶苷A的3D结构从PubChem(https://pubchem.ncbi.nlm.nih.gov/)数据库中下载,自噬相关蛋白(beclin1、ulk1b、ulk2和atg7)的3D结构从Protein Data Bank(https: //www.rcsb.org/)数据库下载。使用薛定谔分子对接软件对自噬相關蛋白进行加氢、去水等处理,之后将自噬相关蛋白和木蝴蝶苷A进行对接,以对接分数作为分子对接的结果,最后借助Pymol进行可视化分析。
2.7 统计分析
使用Graph Pad Prism 7.0通过单向方差分析和双向方差分析进行统计分析,结果用x±s表示,P<0.05表示差异有统计学意义。
3 结果
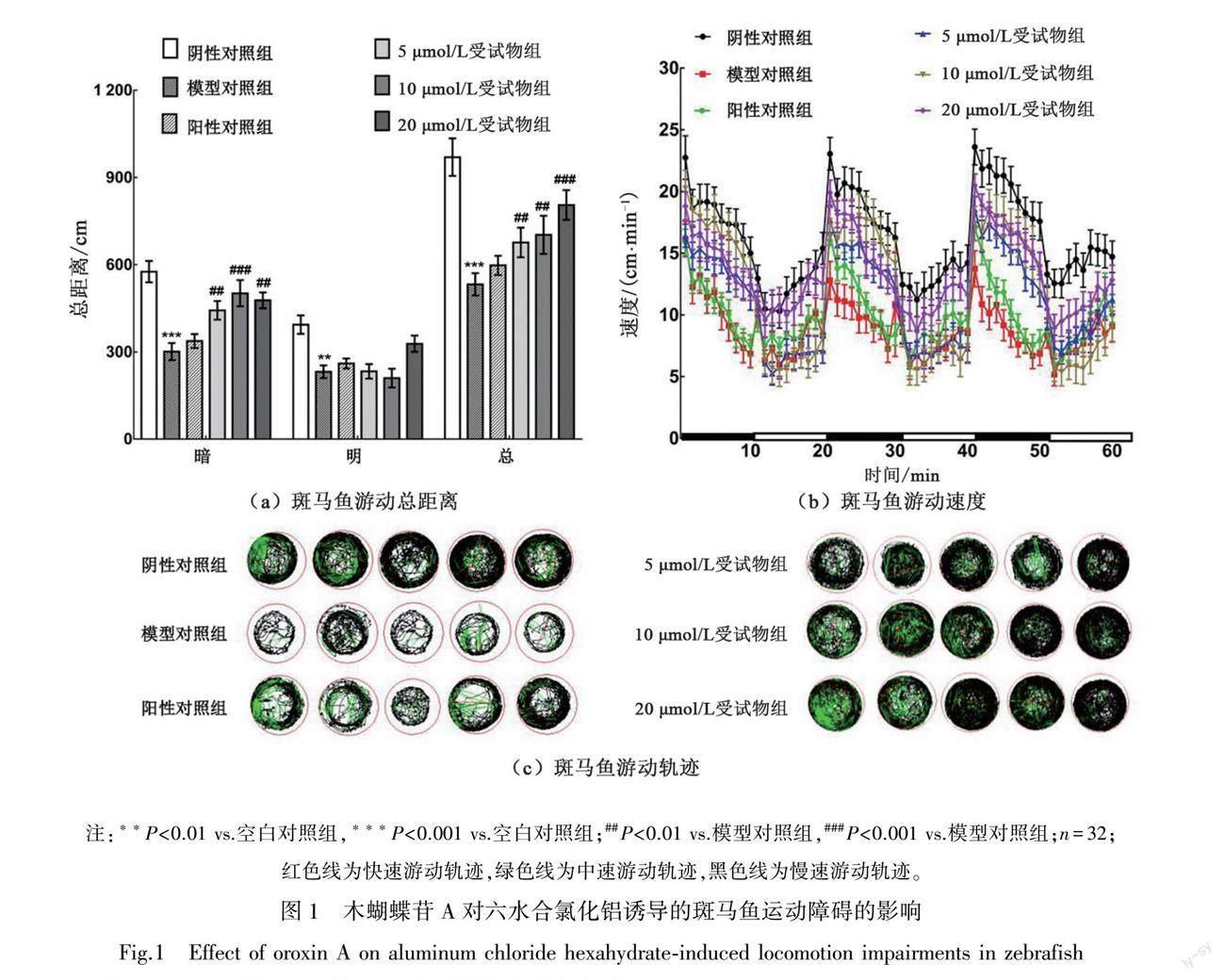
3.1 木蝴蝶苷A具有缓解六水合氯化铝诱导的斑马鱼运动障碍作用
如图1(a)和1(b)所示,与空白对照组的斑马鱼相比,六水合氯化铝模型对照组中斑马鱼的游动总距离明显变短(P<0.001),游动速度减缓。与六水合氯化铝模型对照组相比,不同浓度的木蝴蝶苷A受试物(5、10、20 μmol/L)与六水合氯化铝共同处理时,斑马鱼的游动总距离(P=0.009,P=0.002,P<0.001)和速度均显著增加。与六水合氯化铝模型对照组相比,六水合氯化铝和多奈哌齐阳性对照组的速度和总距离有所增加,其结果(P=0.23)不具有统计学意义。如图1(a)所示,在黑暗环境下,不同药物处理组斑马鱼的游动距离变化与总游动距离变化具有一致性。以上结果表明,木蝴蝶苷A对六水合氯化铝诱导的斑马鱼运动障碍具有一定的缓解作用。
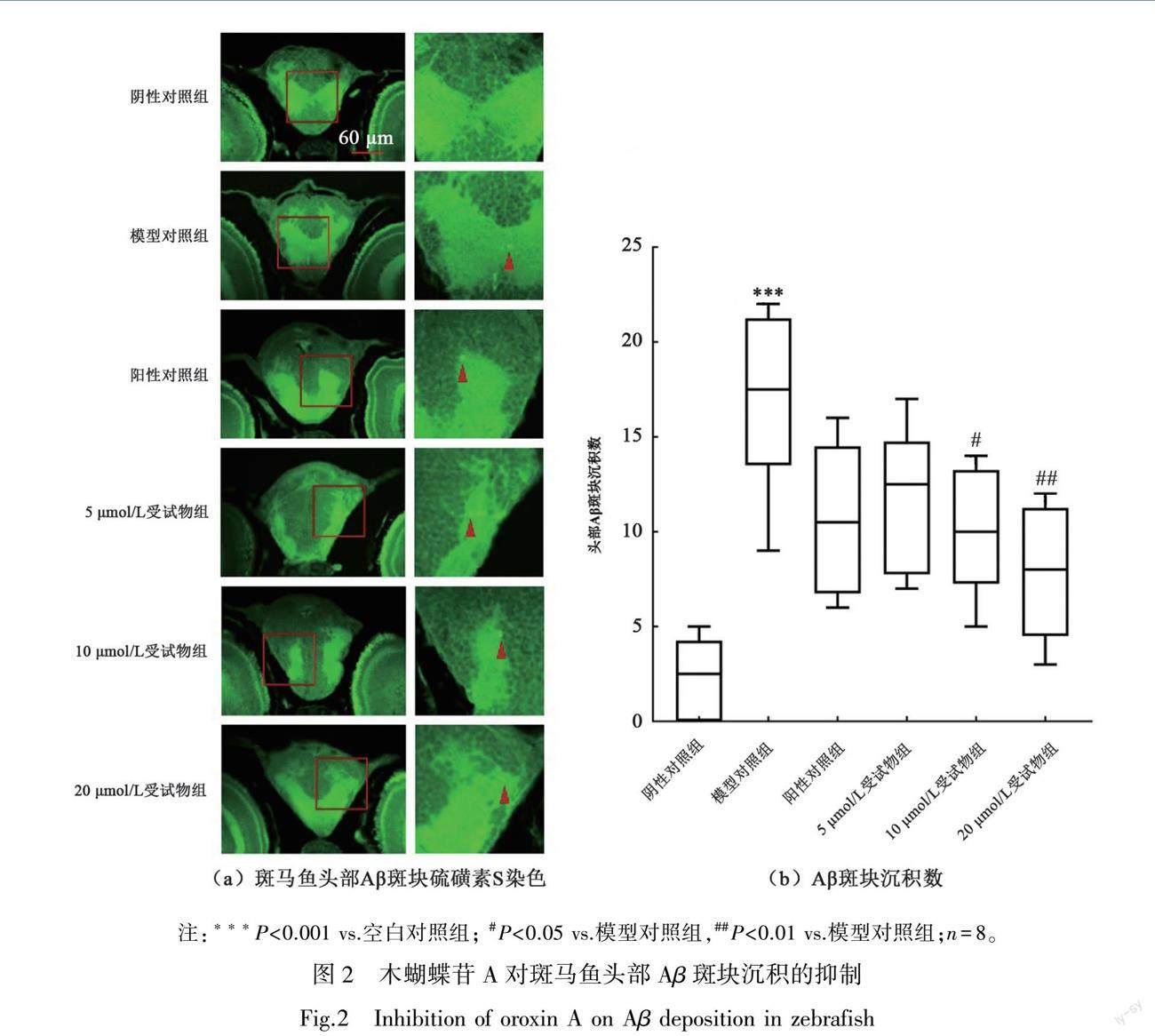
3.2 木蝴蝶苷A对斑马鱼头部Aβ斑块沉积的抑制作用
如图2(a)和2(b)所示,与空白对照组相比,六水合氯化铝模型对照组的斑马鱼大脑中Aβ斑块的数明显增多(P<0.001)。与六水合氯化铝模型对照组相比,六水合氯化铝和多奈哌齐阳性对照组中Aβ斑块沉积数减少(P=0.06),六水合氯化铝和木蝴蝶苷A受试物组的Aβ斑块沉积数显著降低(P=0.03,P=0.002)。
3.3 木蝴蝶苷A对AchE活性的抑制作用
抑制AchE活性,可以提高脑中的乙酰胆碱水平,从而改善AD患者的学习记忆障碍[10]。在本实验中,研究探讨了木蝴蝶苷A对六水合氯化铝处理的斑马鱼AchE活性的影响。如图3所示,与空白对照组相比,六水合氯化铝模型对照组斑马鱼的AchE活性显著增加(P<0.001)。与六水合氯化铝模型对照组相比,六水合氯化铝和多奈哌齐阳性对照组中斑马鱼的AchE活性显著降低(P=0.008),在六水合氯化铝和木蝴蝶苷A受试物组中斑马鱼的AchE活性也显著降低(P<0.001),且剂量与效应呈正相关。
3.4 木蝴蝶苷A对自噬相关基因表达的影响
如图4所示,与空白对照组相比,六水合氯化铝模型对照组中beclin1、ulk1b、ulk2、和atg7的表达明显下调(P=0.02,P<0.001,P<0.001,P<0.001)。如图4(a)所示,与六水合氯化铝模型对照组相比,六水合氯化铝与5、20 μmol/L木蝴蝶苷A受试物组beclin1表达明显上调(P=0.001,P<0.001);如图4(b)所示,六水合氯化铝与不同浓度木蝴蝶苷A(5、10、20 μmol/L)受试物组中ulk1b的表达明显上调(P<0.001,P<0.001,P<0.001);如图4(c)所示,六水合氯化铝与5、20 μmol/L木蝴蝶苷A受试物组ulk2表达明显上调(P<0.001,P<0.001);如图4(d)所示,六水合氯化铝与不同浓度木蝴蝶苷A(5、10、20 μmol/L)受试物atg7的表达也明显上调(P=0.01,P<0.001,P<0.001)。
3.5 分子对接结果
通过2.6方法对木蝴蝶苷A与自噬相关蛋白(beclin1、ulk1b、ulk2和atg7) 进行分子对接,得出图5,即belclin1(PDB ID:4ZW1)与木蝴蝶苷A的对接、ulk1b(PDB ID:6YID)与木蝴蝶苷A的对接、ulk2(PDB ID:6QAT)与木蝴蝶苷A的对接、atg7(PDB ID:4PH4)与木蝴蝶苷A的对接。木蝴蝶苷A与belclin1、ulk1b、ulk2和atg7的对接分数分别为-6.707、-7.708、-7.888、-7.249,这说明木蝴蝶苷A对自噬相关蛋白发挥调控作用。
4 讨论与结论
AD是一种进行性神经退行性疾病,可导致神经元丧失、脑萎缩和死亡。研究表明,木蝴蝶能够改善AD小鼠的学习记忆能力,但具体哪些化学成分起作用还未见报道,所以我们利用六水合氯化铝诱导的斑马鱼AD模型去探讨木蝴蝶苷A的抗AD活性。正常斑马鱼在面对突然的刺激时,会表现出快速的保护反应。研究表明斑马鱼幼鱼在受精后4 d后暴露于明暗交替的刺激时,在光亮中运动活动会突然增加[11]。斑马鱼明暗交替行为学测试常被用来识别测定药物的神经保护活性,通过评估斑马鱼的游动轨迹、游动距离和速度,可以了解其神经行为效应[10]。在本研究中,明暗交替行为学测试表明,与空白对照组相比六水合氯化铝模型组的斑马鱼游动速度减慢,游动距离变短,表明斑马鱼的认知能力受损,反应迟缓,不能对外界刺激做出及时的反应。而经过木蝴蝶苷A的处理,这种表现有所改变,这提示木蝴蝶苷A对六水合氯化铝诱导的斑马鱼运动障碍具有缓解作用。AD的特征在于海马和新皮层中AchE活性升高,使AD患者脑内乙酰胆碱水平降低,影响神经信号的传递,从而损伤学习记忆能力[12]。抑制AchE活性,可以提高脑中的乙酰胆碱水平,改善AD患者的学习记忆障碍[13]。有研究表明暴露于六水合氯化铝的斑马鱼在50~250 μmol/L的浓度范围内显示出AchE活性增加,运动活性缺乏[14]。我们的研究结果表明,六水合氯化铝和木蝴蝶苷A受试物组的斑马鱼AchE的活性水平降低,这说明木蝴蝶苷A能够抑制AchE活性,减少乙酰胆碱的水解。Aβ的细胞毒性已在众多体内和体外研究中得到证实,脑实质中Aβ斑块的沉积在AD发病机制中起着核心作用[15]。Aβ沉积会引发一系列相关反应,导致tau蛋白的错误折叠和组装,进而将病变扩散到整个神经回路和皮层,最终损害神经系统,导致认知能力下降[16]。我们的研究表明,木蝴蝶苷A明显降低了AD模型中斑马鱼头部的Aβ斑块计数。以上表明木蝴蝶苷A能够缓解六水合氯化铝诱导的AD样症状。为了进一步探究木蝴蝶苷A是如何发挥抗AD活性的,我们进行了机制探究。
自噬在Aβ的生成和代謝中起重要作用,与AD发病进展密切相关[17]。beclin1是酵母自噬蛋白atg6和apg6的同系物,被认为是自噬体形成的标记蛋白。研究表明抑制beclin1的表达会增加AD中Aβ的聚集,从而加速神经病变[18]。还有研究表明AD患者神经元beclin1表达明显下降[19]。在本研究中,六水合氯化铝模型组,beclin1的基因表达量明显下调,六水合氯化铝和木蝴蝶苷A受试物组beclin1的表达量上调,说明木蝴蝶苷A能够促进Aβ在细胞内部降解。ulk1b具有丝氨酸/苏氨酸激酶活性,ulk2和ulk1b在自噬的起始阶段发挥着重要的调控作用[20]。六水合氯化铝模型组ulk2和ulk1b的表达明显下调,而六水合氯化铝和木蝴蝶苷A受试物组ulk2和ulk1b的表达明显上调,说明木蝴蝶苷A能够激活自噬的表达。atg7是与自噬相关的细胞降解和再循环的必需蛋白质,主要参与自噬小体的形成,是调节自噬偶联系统的关键基因[21]。研究发现AD小鼠模型大脑皮层和海马体中atg7蛋白水平降低[22]。六水合氯化铝模型组,atg7的表达明显降低,抑制了自噬的过程,而六水合氯化铝和木蝴蝶苷A受试物组atg7的表达明显上调,说明atg7激活了自噬,可能促进自噬性溶酶体的形成,恢复细胞内稳态。基于分子对接初步模拟木蝴蝶苷A与自噬相关蛋白(beclin1、ulk1b、ulk2和atg7)之间的分子作用机制,对接分数的大小直接反应预测结果的可靠性,对接分数越小表示结合活性越高。其对接分数均为负数,表明木蝴蝶苷A与自噬相关蛋白(beclin1、ulk1b、ulk2和atg7)具有良好的结合能力。这进一步验证了木蝴蝶苷A能对自噬相关蛋白发挥调控作用,但后续仍需进一步的生物实验验证。
本研究通过对六水合氯化铝诱导的斑马鱼行为的观察、AchE活性的检测以及Aβ斑块的沉积情况,预测了木蝴蝶苷A对AD的潜在治疗作用。实时荧光定量PCR以及分子对接的结果提示木蝴蝶苷A可能通过激活自噬, 从而发挥抗AD活性。本研究为治疗AD药物研发拓展了新思路,但还需要采取哺乳动物实验及临床试验等方法做进一步的验证。
参考文献:
[1]TATULIAN S A. Challenges and hopes for Alzheimer′s disease[J]. Drug Discovery Today, 2022, 27(4): 1027-1043. DOI: 10.1016/j.drudis.2022.01.016.
[2]TAM K, JU Y J. Pathological mechanisms and therapeutic strategies for Alzheimer′s disease[J]. Neural Regeneration Research, 2022, 17(3): 543. DOI: 10.4103/1673-5374.320970.
[3]SRIRAM N, SAH M K. Regulatory insights into progression of cancer and Alzheimer′s disorder from autophagy perspective[J]. Molecular Biology Reports, 2021, 48(12): 8227-8232. DOI: 10.1007/s11033-021-06838-4.
[4]FANG E F, HOU Y J, PALIKARAS K, et al. Mitophagy inhibits amyloid-β and tau pathology and reverses cognitive deficits in models of Alzheimer′s disease[J]. Nature Neuroscience, 2019, 22(3): 401-412. DOI: 10.1038/s41593-018-0332-9.
[5]SUN C, ZHANG SS, BA S K, et al. Eucommia ulmoides olive male flower extracts Ameliorate alzheimer′s disease-like pathology in zebrafish via regulating autophagy, acetylcholinesterase, and the dopamine transporter[J]. Frontiers in Molecular Neuroscience, 2022, 15: 901953. DOI: 10.3389/fnmol.2022.901953.
[6]國家药典委员会.中华人民共和国药典2020年版二部 [M]. 北京: 中国医药科技出版社, 2020.
[7]CHENG X D, HUANG T T, WANG C H, et al.Natural compound library screening identifies oroxin A for the treatment of myocardial ischemia/reperfusion injury[J]. Frontiers in Pharmacology, 2022, 13: 894899. DOI: 10.3389/fphar.2022.894899.
[8]鲁冰冰. 木蝴蝶苷A对食管鳞癌增殖的抑制作用及其机制的研究[D]. 郑州: 郑州大学, 2020.
[9]任擎宇, 靳梦, 商学良, 等. 基于网络药理学和斑马鱼模型的金盏菊缓解阿尔茨海默病症状及作用机制[J]. 中国药理学通报, 2022, 38(3): 429-436. DOI: 10.12360/CPB202108075.
[10]BASNET R M, ZIZIOLI D, TAWEEDET S, et al. Zebrafish larvae as a behavioral model in neuropharmacology[J]. Biomedicines, 2019, 7(1): 23. DOI: 10.3390/biomedicines7010023.
[11]SHENOY A, BANERJEE M, UPADHYA A, et al. The brilliance of the zebrafish model: perception on behavior and alzheimer′s disease[J]. Frontiers in Behavioral Neuroscience, 2022, 16: 861155. DOI: 10.3389/fnbeh.2022.861155.
[12]PATIL D N, PATIL S A, SISTLA S, et al. Comparative biophysical characterization: A screening tool for acetylcholinesterase inhibitors[J].PLoS One, 2019, 14(5): e0215291. DOI: 10.1371/journal.pone.0215291.
[13]SAXENA M, DUBEY R. Target enzyme in Alzheimer′s disease: acetylcholinesterase inhibitors[J]. Current Topics in Medicinal Chemistry, 2019, 19(4): 264-275. DOI: 10.2174/1568026619666190128125912.
[14]SENGER M R, SEIBT K J, GHISLENI G C, et al. Aluminum exposure alters behavioral parameters and increases acetylcholinesterase activity in zebrafish (Danio rerio) brain[J]. Cell Biology and Toxicology, 2011, 27(3): 199-205. DOI: 10.1007/s10565-011-9181-y.
[15]WALSH D M, SELKOE D J. Amyloid β-protein and beyond: the path forward in Alzheimer′s disease[J]. Current Opinion in Neurobiology, 2020, 61: 116-124. DOI: 10.1016/j.conb.2020.02.003.
[16]BUSCHE M A, WEGMANN S, DUJARDIN S, et al. Tau impairs neural circuits, dominating amyloid-β effects, in Alzheimer models in vivo[J]. Nature Neuroscience, 2019, 22(1): 57-64. DOI: 10.1038/s41593-018-0289-8.
[17]DENG Z Q, DONG Y, ZHOU X T, et al. Pharmacological modulation of autophagy for Alzheimer′s disease therapy: Opportunities and obstacles[J]. Acta Pharmaceutica Sinica B, 2022, 12(4): 1688-1706. DOI: 10.1016/j.apsb.2021.12.009.
[18]PICKFORD F, MASLIAH E, BRITSCHGI M, et al. The autophagy-related protein beclin1 shows reduced expression in early Alzheimer disease and regulates amyloid beta accumulation in mice[J]. The Journal of Clinical Investigation, 2008, 118(6): 2190-2199. DOI: 10.1172/JCI33585.
[19]JAEGER P A, PICKFORD F, SUN C H, et al. Regulation of amyloid precursor protein processing by the beclin1 complex[J]. PLoS One, 2010, 5(6): e11102. DOI: 10.1371/journal.pone.0011102.
[20]MCALPINE F, WILLIAMSON L E, TOOZE S A, et al. Regulation of nutrient-sensitive autophagy by uncoordinated 51-like kinases 1 and 2[J]. Autophagy, 2013, 9(3): 361-373. DOI: 10.4161/auto.23066.
[21]任李梅, 楊松, 卢姝言, 等. 人参总皂苷在巨噬细胞RAW264.7中降低脂多糖诱导的炎症和氧化应激[J]. 中国医院药学杂志, 2022, 42(9): 896-901. DOI: 10.13286/j.1001-5213.2022.09.04.
[22]CARVALHO C, SANTOS M S, OLIVEIRA C R, et al.Alzheimer′s disease and type 2 diabetes-related alterations in brain mitochondria, autophagy and synaptic markers[J]. Biochimica et Biophysica Acta (BBA)-Molecular Basis of Disease, 2015, 1852(8): 1665-1675. DOI: 10.1016/j.bbadis.2015.05.001.

