基质细胞评分的胃癌临床意义及胃复春胶囊干预机制
陈春 祁大庆 潘靖文

摘要:采用生物信息學方法分析基质细胞与胃癌的临床特征关联,预测胃复春胶囊的干预机制。从TCGA数据库下载胃癌活检数据,基于ESTIMATE计算基质细胞评分(stromal score,STRS)并以中位数为分组依据,分析STRS与患者临床信息关联并筛选DEGs(differentially expressed genes)作为潜在干预靶点。基于胃复春胶囊入血成分预测药物靶点,DEGs与药物靶点取交集并通过PPI网络及MCODE筛选核心子网络及基因,分析生存预后及不同分期表达。构建药味-入血成分-靶点网络筛选核心成分并进行ADMET预测及分子对接验证。交集靶点进行GO(gene ontology)、KEGG(Kyoto encyclopedia of genes and genomes)富集。结果表明:STRS与生存时间显著相关且随Stage及T分期显著升高,分析得DEGs 1 975个;胃复春胶囊入血成分75个,对应靶点663个,交集靶点107个;核心子网络4个,其中VCAM1、SERPINE1、TLR4、FGF1为核心靶点,SERPINE1、PDGFRB表达与生存时间相关极显著(P<0.01),VCAM1、NOX4、PDGFRB、ITGAL等在不同Stage分期表达差异极显著(P<0.01);异金雀花素B、香茶菜素O、蓝萼甲素等为核心成分,ADMET特性及核心靶点蛋白结合活性良好;GO富集于钙离子浓度调节、钙离子稳态等条目,KEGG富集于钙信号通路、神经活性配体-受体相互作用等通路。基质细胞与生存时间、分期密切相关,胃复春胶囊可能通过调控基质细胞发挥抑制肿瘤生长、转移及延缓耐药性等作用。
关键词:基质细胞评分;胃癌;临床特征;胃复春胶囊;网络药理学
中图分类号:R285 文献标志码:A 文章编号:1002-4026(2023)06-0038-10
Clinical significance of stromal cell score in gastric cancer
and intervention with Weifuchun capsules
CHEN Chun1, QI Daqing2, PAN Jingwen1*
(1. Department of Pharmacy, The Eighth People′s Hospital of Qingdao, Qingdao 266000, China;
2. Hangzhou Huqingyutang Pharmaceutical Co., Ltd., Hangzhou 311100, China)
Abstract∶Bioinformatics methods were used to analyse the association between stromal cells and clinical characteristics of gastric cancer, and to predict the intervention mechanism of Weifuchun capsule. Gastric cancer biopsy data were downloaded from TCGA database, the stromal score (STRS) was calculated based on ESTIMATE, and the median was used as the basis for grouping, and the association between STRS and patients′ clinical information was analysed, and the DEGs were screened as the potential intervention targets. Based on the blood components of Weifuchun capsule, we predicted the drug targets, intersected DEGs with drug targets, and screened the core sub-networks and genes through PPI network and MCODE, and analysed the expression of differentially expressed genes in terms of survival prognosis and different stages of the disease. The drug-taste-intake component-target network was constructed to screen the core components, and ADMET prediction and molecular docking validation were performed. The intersecting targets were enriched by GO and KEGG. The results showed that STRS was significantly correlated with survival time and increased significantly with Stage and T stage, and 1 975 DEGs were analysed; 75 components of Weifuchun capsule into the blood, corresponding to 663 targets, and 107 intersecting targets; and 4 core sub-networks, of which VCAM1, SERPINE1, TLR4, FGF1 were the core target, and SERPINE1, PDGFRB expression correlated with survival time was highly significant (P<0.01), and the differences in the expression of VCAM1, NOX4, PDGFRB, ITGAL, etc. in different Stage phases were highly significant (P<0.01); isocryptoxanthin B, geranylgeranyl O, and bluocalyx methylin were the core components, with good ADMET properties and core target protein binding activity. GO was enriched in calcium ion concentration regulation, calcium ion homeostasis and other entries. KEGG is enriched in calcium signalling pathway, neuroactive ligand-receptor interaction and other pathways. Stromal cells are closely related to survival time and stage, and Weifuchun capsule may inhibit tumour growth, metastasis and delay drug resistance by regulating stromal cells.
Key words∶stromal cell score; gastric cancer; clinical features; Weifuchun capsules; network pharmacology
胃癌为国内第二大好发癌症及致死性癌症[1],是全球癌症致死的主因之一。早期症状不明显、保守手术切除后易复发等原因导致胃癌5年生存率较低,因此寻找预测、诊断、治疗胃癌的标志物,干预靶点及抑制恶化的药物有重要意义。胃恶性实体瘤组织由肿瘤细胞、正常上皮细胞、基质细胞、免疫细胞等细胞以及细胞因子和胞外基质蛋白共同组成,浸润性基质细胞和免疫细胞作为肿瘤组织中正常细胞的主要部分,在干扰肿瘤信号方面有重要作用。研究显示基质细胞与肿瘤生长抑制剂逃避、维持增殖信号、细胞死亡耐受、细胞能量代谢重编程、血管生成启动、免疫监管逃避、侵袭和转移等特征相关[2]。 ESTIMATE(estimation of stromal and immune cells in malignant tumor tissues using expression data)[3]利用癌症样本转录谱的独特性质来推断肿瘤细胞的内容以及不同的浸润正常细胞。通过单样本基因集富集分析(ssGSEA),计算基质和免疫评分来预测基质细胞和免疫细胞的水平,推断肿瘤组织中的肿瘤纯度,分析与肿瘤组织中基质和免疫细胞浸润相关的特异性基因特征。研究显示,基质细胞与患者生存恶化和治疗耐药性相关,并通过激活基质重塑、代谢效应和可溶性分泌因子促进肿瘤侵袭[4]。肿瘤相关成纤维细胞(cancer-associated fibroblasts,CAFs)占基质细胞50%以上,通过分泌各种细胞因子来调节肿瘤生长和炎症反应,促进肿瘤生长。因此,在未分化胃癌活检中通常表现出过度纤维化和大量CAFs浸润[5]。基质细胞作为构成肿瘤微环境的重要成分[6],探究其相关特征基因并寻找干预方法对肿瘤微环境调节具有现实意义。
天然药物具有多成分、多靶点的作用特点,在肿瘤微环境的调节方面有巨大潜力。胃复春胶囊主要成分包括红参细粉及香茶菜、枳壳提取物等,具有健脾益气、活血解毒的功效,临床上用于胃癌前期病变及胃癌术后的辅助治疗[7]。胃复春胶囊疗效确切,但对其作用机制及其对应物质基础的研究尚不多见。目前基于肿瘤基质细胞组成探究复方作用机制的研究鲜有报道,因此,本文采用生物信息学技术探究肿瘤基质细胞与胃癌临床特征的关联及胃复春胶囊的干预作用机制。
1 材料与方法
1.1 数据库及分析软件
TCGA数据库(https://portal.gdc.cancer.gov/)、中药系统药理学数据库与分析平台(traditional Chinese medicine systems pharmacology database and analysis platform,TCMSP)(http://tcmspw.com/tcmsp.php);SwissTargetPrediction(http://www.swisstargetprediction.ch/);STRING数据库(https://string-db.org)、R 3.6.3、ClusterProfiler 3.14.3、ggplot 2.3.3.0、DOSE 3.12.0、Enrichplot 1.6.1、Cytoscape 3.7.2、Discovery studio 2019等。
1.2 表达及临床数据下载及分析
从TCGA数据库中下载胃癌RNA FPKM(fragments per kilobase per million)表达数据及患者的临床信息。数据包含407例胃癌活检数据,其中32例患者样本包含正常胃组织和癌组织,剔除正常组织剩余343例样本备用。采用ESTIMATE计算基质细胞得分并以中位数为标准将患者分为高基质细胞组和低基质细胞组。分析基质细胞得分与生存时间、年龄、Stage分期、T(原发性肿瘤)、N(区域淋巴结转移)、M(远处转移)关系。2组数据采用wilcox.test函数进行秩和检验,分组大于2组的数据则采用kruskal.test函数进行检验。采用Limma包对高、低基质细胞组进行差异表达分析,并以Log FC值>1、FDR值<0.05(FC为fold change,FDR为false discovery rate)为标准筛选差异表达基因(differentially expressed genes, DEGs)作为潜在干预靶点。
1.3 胃复春胶囊入血成分及靶点信息
检索文献整理得胃复春胶囊入血成分,于TCMSP、SwissTargetPrediction检索及预测靶点,基于UniProt数据库(https://www.uniprot.org/)标准化靶点名称,得到胃复春胶囊作用靶点。
1.4 蛋白质-蛋白质相互作用及拓扑网络分析
将药物作用靶点与潜在干预靶点交集得干预靶点,导入STRING数据库,设置物种为“Homo sapiens”进行检索,设定置信度为“high confidence >0.7”,删除游离节点,得蛋白質-蛋白质相互作用(protein-protein interaction,PPI)网络,保存为TSV格式文件并导入Cytoscape 3.7.2绘图,并采用MCODE(molecular complex detection)插件分析核心子网络(degree cutoff=2,node cutoff =0.2,kcore=2,max.depth=100),分析子网络基因生存预后及不同Stage中表达。构建药材-入血成分-靶点关联网络图,根据节点获得每个靶点与其他靶点互相作用,以degree中位数为标准筛选核心入血成分并分析ADMET(药物的吸收、分布、代谢、排泄、毒性)特性。
1.5 生物富集分析
将筛选的潜在作用靶点采用ClusterProfiler包进行基因本体(gene ontology,GO)、京都基因与基因组百科全书(Kyoto encyclopedia of gene and genomics,KEGG)富集分析,采用enrichplot、ggplot2包对富集结果进行可视化,从细胞组分、分子功能、生物过程、通路分析胃复春胶囊干预胃癌基质细胞的作用机制。
1.6 分子对接验证
从PDB(https://www.rcsb.org/)数据库下载关键靶点蛋白及晶体构象,通过前处理与核心化合物进行分子对接验证。受体前处理为去原配体、去除溶剂、补充氨基酸残基等。配体前处理为加氢及合适的电荷等。选择晶体结构中配体所在的位置作为结合位点(无原配体的晶体则采用预测位点),选择距离该位点一定半径内的球集为活性结合位点。采用LibDockScore评价小分子化合物与蛋白靶点的结合活力。
2 结果
2.1 TCGA数据分析
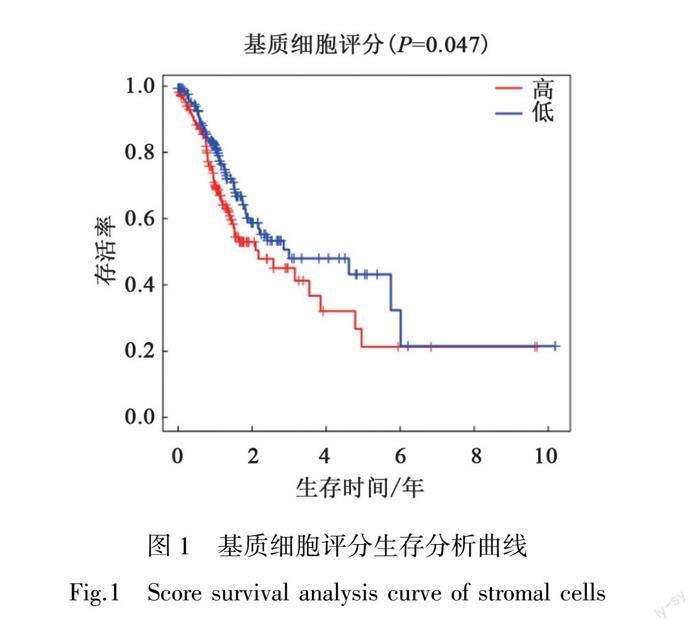
利用ESTIMATE算法评分,以中位数(n=132.699 3)将其分为低、高基质细胞组,关联临床数据分析结果如图1、OSID科学数据与内容附图1 所示。图1显示基质细胞评分与胃癌患者生存时间显著相关,表明基质细胞为潜在的有效干预机制。不同性别,年龄,N、M分期与基质细胞评分无显著差异。不同Stage分期及T分期基质细胞评分存在显著差异(P=7.80×10-4,P=8.44×10-7),基质细胞评分在Stage Ⅰ到Ⅱ阶段及T Ⅰ到Ⅱ阶段中迅速增加,在后续阶段中增长不明显(OSID科学数据与内容附图2),表明早期干预肿瘤微环境中的基质细胞增长有一定价值。采用Limma包进行差异分析得1 975个 DEGs作为潜在干预靶点,热图及火山图详见OSID科学数据与内容附图3(a)~3(b)所示。
2.2 常用复方入血成分
胃复春胶囊临床上用于胃癌前病变及胃癌辅助治疗,疗效确切。基于已公开文献整理得胃复春胶囊入血成分75个[8],其中香茶菜入血成分38个,分析结构以二萜类化合物为主,其次为归属于红参及枳壳的黄酮和皂苷,基于TCMSP、SwissTargetPrediction数据库检索、去重、标准化得胃复春胶囊入血成分作用靶点663个。主要入血成分见表1,全表见OSID科学数据与内容附表1。
2.3 PPI网络构建及核心靶点预测
将药物作用靶点与潜在干预靶点取交集,得到107个潜在药物作用靶点(OSID科学数据与内容附图4)导入STRING数据库中分析,共获得107个节点,141条边,平均节点度为 2.64,PPI富集P<1×10-16,结果导出至Cytoscape中可视化,并采用MCODE插件分析核心子网络及靶点,结果见OSID科学数据与内容附图5。分析得核心子网络4个,其中血管细胞黏附因子1(VCAM1)、人纤溶酶原激活物抑制剂1(SERPINE1)、toll样受体4(TLR4),成纤维生长因子(FGF1)为核心子网络的seed靶點,18个靶点为聚集靶点,分别对这18个靶点进行生存分析及不同阶段的表达量分析,结果见OSID科学数据与内容附图6~7。SERPINE1、PDGFRB表达与患者生存时间相关极显著(P<0.01),TGFB1、FGF1、MPO表达与胃癌患者生存时间显著相关(P<0.05),VCAM1、NOX4、PDGFRB、ITGAL、TGFB1、ITGA4、CCR5在Stage分期差异表达极显著(P<0.01),CCR2、PDGFRA、ITGB2、MMP2、SELL差异表达显著(P<0.05)。
2.4 核心入血成分分析
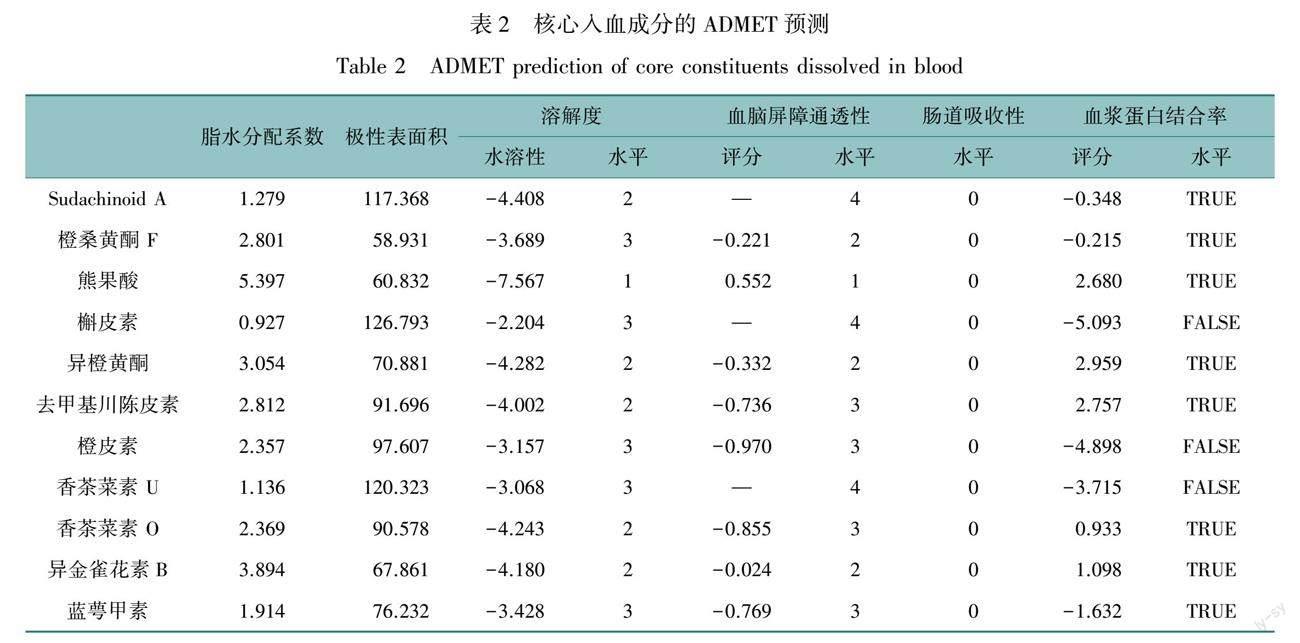
采用Cytoscape 3.7.2软件构建药材-入血成分-靶点调控网络(OSID科学数据与内容附图8),节点为靶点或化合物,连线表示成分与靶点之间互作关系。由附图8可知胃复春胶囊通过多成分、多靶点干预胃肿瘤基质细胞组成。异金雀花素B、香茶菜素O、香茶菜素U、蓝萼甲素、橙桑黄酮F、去甲基川陈皮素、熊果酸、橙皮素、Sudachinoid A、异橙黄酮、槲皮素等为潜在核心入血成分(degree值大于4倍中位数),ADMET预测分析结果如表2所示,核心成分水溶性均介于良好和低,表现出良好的肠道吸收性以及良好的血浆蛋白结合率。
2.5 生物功能注释分析
采用“ClusterProfiler”软件包对交集靶点进行生物功能注释。分别选取GO富集结果BP/CC/MF前10 GO term绘图(OSID科学数据与内容附图9(a)),交集靶点富集于胞浆钙离子浓度调节、钙离子稳态、细胞钙离子稳态、胞浆钙离子浓度的正调控、细胞二价阳离子稳态、磷脂酶活性的调节等生物过程,以及质膜膜筏、神经元细胞体、膜小凹、轴突末梢等细胞组成以及前列腺素受体活性、G蛋白偶联肽受体活性、肽受体活性、类二十烷酸受体活性、跨膜受体蛋白激酶活性、跨膜受体蛋白酪氨酸激酶活性、细胞因子结合等分子功能。
KEGG前20富集结果绘图(OSID科学数据与内容附图9(b)),交集靶点通过作用于钙信号通路、神经活性配体-受体相互作用、糖尿病并发症中的AGE-RAGE信号通路、磷脂酰肌醇3-激酶/蛋白激酶B信号通路、人类表皮生长因子受体酪氨酸激酶抑制剂耐药、Ras信号通路、Rap1信号通路、磷脂酶 D 信号通路等通路发挥平滑肌收缩调节、晚期糖基化终末产物代谢调节、炎症信号传导调节、细胞存活生长、免疫细胞转移和聚集、机体低氧浓度或缺氧应答等作用。
2.6 分子对接验证
将潜在核心入血起效成分作为分子对接配体,将子网络核心靶点蛋白作为分子对接受体,采用Libdock对其进行分子对接,对接得分值如表3所示,图2为各核心靶点与入血成分对接结果2D呈现(Libdock Score>70为对接活性良好)。
3 讨论与结论
肿瘤细胞行为受肿瘤微环境中基质细胞相互作用影响[9],肿瘤基质中CAF、MSCs等细胞分泌HGF、FGF、ISF-1、IGF-2等因子可促进血管的形成及肿瘤细胞的浸润;周围基质细胞分泌TGF-β诱导内皮细胞向瘤性间质细胞转化从而利于肿瘤细胞浸润;基质细胞可调节组织间隙液压影响药物跨越毛细管以及能直接降低肿瘤细胞对化学药物、酪氨酸激酶抑制剂的敏感性,从而降低了药物疗效。基质细胞随着癌症周期进展含量显著升高,尤以Ⅰ/Ⅱ期变化明显,生存分析显示基质细胞含量低组患者生存时间显著延长,表明基质细胞增长可加快胃癌进展,缩短患者生存时间,因而早期针对基质细胞进行干预有重大意义。此外,低、高基质细胞含量组存在大量基因表达显著失调,而化疗药物由于成分单一、对应靶点少难以覆盖,故中药复方的多成分、多靶点干预策略合理。
潜在药物作用靶点的PPI网络分析得到以VCAM1、SERPINE1、TLR4、FGF1为核心的4个子网络,核心靶点及子网络靶点表达与患者生存时间显著相关。VCAM1为免疫球蛋白超家族成员之一,广泛存在于活化内皮细胞、平缓肌细胞、骨髓基质细胞、巨噬细胞、树突状细胞集成纤维细胞等表面,入血成分干预其表达进而调节炎症反应、细胞和组织的分化及肿瘤的扩散、转移等生物过程[10]。SERPINE1为丝氨酸蛋白酶抑制剂(SERPIN)家族的重要成员,是尿激酶和组织蛋白酶原激活剂(uPA和tPA)的主要抑制剂,在细胞外基质重塑中起关键作用,研究显示其可促进血管生成、抗凋亡、诱导肿瘤血管化、激活炎症反应等,与肿瘤进展及转移紧密相关[11-12]。TLR4为toll样受体家族重要成员,通过识别病原相关分子模式而激活相应的信号传导通路,进一步促进NF-κB的激活,TLR4在多种恶性肿瘤组织中呈高表达状态,可促进恶性肿瘤的增殖、抑制肿瘤细胞凋亡及诱导免疫逃逸等[13]。FGF1为成纤维细胞生长因子家族的成员,通过与种内皮细胞表面受体相互作用促进血管生成,而且能够促进多种类型细胞的有丝分裂增殖,促进血管生成以及肿瘤细胞的增殖、侵袭和迁移等,研究显示多种恶性癌症中FGF1均存在异常高表达[14-15]。结合生存时间及不同分期表达量统计分析,核心靶点及其子网络靶点表达与临床预后密切相关,可能为胃复春胶囊发挥调节基质细胞、抑制癌症进展的作用靶点。
胃癌在中医学并无具体对应名称,根据患者症状可将其归入“积聚”“胃脘痛”“噎膈”等范畴[16],医家以为“正气亏损、邪毒侵袭”与之相关,属于本虚标实之证,基本病机是正虚、血瘀、痰阻、癌毒蕴结于胃,导致胃失和降,病因为情志因素、饮食因素、湿热虫毒感染等[17-18]。胃复春胶囊方中红参可补元气、益气摄血、复脉固脱,香茶菜可清热利湿、活血散淤、解毒消肿,枳壳可健脾开胃、理气宽中、行滞消胀,共奏健脾益气、活血解毒之功,减轻幽门螺杆菌及致癌物质对胃黏膜的损害,抑制癌细胞增生,促进癌细胞凋亡等[19-20]。
药味-靶点-入血成分网络分析得异金雀花素、香茶菜素O、香茶菜素U、蓝萼甲素、橙桑黄酮F、去甲基川陈皮素等为核心起效物质。归属于香茶菜中的活性成分如异金雀花素、香茶菜素O、香茶菜素U、蓝萼甲素等有抗菌消炎、促进组织修复、抑制血小板聚集、血管内皮细胞保护作用,能够减轻微血管内皮功能障碍及损伤,促进受损的胃组织黏膜修复与再生,抑制肿瘤细胞增生及转移等[21-22]。归属于枳壳、红参的成分如橙皮素、Sudachinoid A、异橙黄酮、去甲基川陈皮素等可促进胃肠道运动、抑制胃癌细胞增殖,具有抗炎、抑菌等作用[23-24]。采用药代动力学特性分析显示核心入血成分生物藥剂学效应良好,分子对接显示核心入血成分与核心靶点蛋白结合活性良好,筛选所得入血成分可能为发挥基质细胞调节的物质基础来源。
KEGG通路分析显示潜在药物作用靶点与多条通路相关。钙离子信号是细胞迁移和侵袭的重要调节因子,与幽门螺杆菌诱导的胃癌细胞迁移和侵袭有关,作用于该通路可抑制幽门螺杆菌通过Wnt/β-catenin/TRPC6/Ca2+信号通路诱导的胃癌细胞迁移和侵袭[25-26]。神经活性配体-受体相互作用是质膜上所有与细胞内外信号通路相关的受体和配体的集合,作用于该通路可调节多种神经递质及其受体结合[27]。晚期糖基化终产物 (AGEs) 是由蛋白质、脂质和核酸的非酶糖基化和氧化产生,AGE/RAGE信号传导引发涉及还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶、蛋白激酶 C 和丝裂原活化蛋白激酶的多个细胞内信号通路的激活,进而导致核转录因子-κB活化[28]。研究显示RAGE可促进幽门螺杆菌对细胞的黏附性,同时幽门螺杆菌可促进胃癌细胞RAGE的表达,两者通过协同增加炎性反应因子的释放促进胃癌进展[29]。PI3K-AKT信号通路的激活与肿瘤的发生发展密切相关[30-31],可促进肿瘤细胞的生长、增殖和转移,抑制凋亡,促血管生成及诱导化疗和放疗抗性[32]。活性物质通过调节PI3K和AKT磷酸化水平影响肿瘤细胞的增殖、凋亡甚至化疗和放疗抗性,从而在胃癌的辅助性治疗中发挥作用。EGFR与肿瘤细胞的增殖、迁移和侵袭密切相关,其过表达或组成性激活在肿瘤细胞常见,与配体EGF结合后活化受体的酪氨酸激酶,再将活化后的信号向下游传递诱导激活下游的VEGF高表达,并与其主要配体VEGFR2结合,促进肿瘤组织的血管生成[33-34],活性物质靶向肿瘤细胞、微环境细胞,从而调节微环境的平衡作用,可抑制肿瘤生长[35]。MAPK信号通路从细胞周期、分化、凋亡、自噬、侵袭转移及耐药等多维度调控肿瘤的发生和发展,活性物质可通过激活MAPK通路,诱导细胞凋亡,发挥其抗肿瘤药理作用[36-37]。磷脂酶D具有促进癌细胞的存活增殖及细胞迁移、侵袭的作用,活性物质通过作用磷脂酶D下调Wnt信号通路的活性抑制癌细胞增殖和转移,抑制β-catenin蛋白入核进转录而抑制Wnt信号通路靶基因的表达,抑制癌细胞增殖和转移过程[38]。生长因子如EGF、PDGF、FGF等激活受体酪氨酸激酶后,可活化由原癌基因FaS编码的Ras蛋白,催化其底物蛋白的酪氨酸磷酸化反应,引发蛋白磷酸化的级联反应,调节一系列与细胞生长、分化、凋亡有关的重要功能[39]。Rapl是Ras癌基因家族成员之一,调节细胞黏附和肿瘤发生[40],活性物质作用于Ras、Rap1信号通路可直接或间接调节细胞分化、增殖和凋亡过程。胃癌患者约35%~60%伴随不同程度的幽门螺杆菌感染[41-42],不同类别白细胞如中性粒细胞、嗜酸性粒细胞、巨噬细胞、单核细胞、肥大细胞等可在感染部位激活和募集,分泌炎症因子、趋化因子、生长因子等,如IL-6、TNF、PDGF、EGF、FGF、VEGFA等,组成炎症-肿瘤微环境,并刺激肿瘤细胞生长,血管和淋巴管生成以及肿瘤的浸润转移[43-44]。活性物质通过作用于白细胞跨内皮迁移、中性粒细胞胞外陷阱形成、TRP通道的炎症介质调节、趋化因子等通路干预慢性炎症过程,辅助抗癌治疗,抑制癌症复发。
綜上所述,本研究通过生物信息学分析基质细胞含量与胃癌临床特征关联,发现基质细胞为潜在的胃癌干预策略,并阐述了胃复春胶囊干预基质细胞的潜在物质基础、作用靶点及信号通路。由于本研究未能进一步进行体外、体内实验验证,后续将进一步完善,为胃癌干预策略及胃复春作用机制及物质基础研究提供参考依据。
参考文献:
[1]JOSHI S S, BADGWELL B D. Current treatment and recent progress in gastric cancer[J]. CA: a Cancer Journal for Clinicians, 2021, 71(3): 264-279. DOI: 10.3322/caac.21657.
[2]黄超. 肺癌肿瘤微环境的系统解析及靶向中药发现[D]. 杨凌: 西北农林科技大学, 2021.
[3]YOSHIHARA K, SHAHMORADGOLI M, MARTNEZ E, et al. Inferring tumour purity and stromal and immune cell admixture from expression data[J]. Nature Communications, 2013, 4: 2612. DOI: 10.1038/ncomms3612.
[4]KANG B X, CAMPS J, FAN B, et al. Parallel single-cell and bulk transcriptome analyses reveal key features of the gastric tumor microenvironment[J]. Genome Biology, 2022, 23(1): 265. DOI: 10.1186/s13059-022-02828-2.
[5]OYA Y, HAYAKAWA Y, KOIKE K. Tumor microenvironment in gastric cancers[J]. Cancer Science, 2020, 111(8): 2696-2707. DOI: 10.1111/cas.14521.
[6]BUSSARD K M, MUTKUS L, STUMPF K, et al. Tumor-associated stromal cells as key contributors to the tumor microenvironment[J]. Breast Cancer Research: BCR, 2016, 18(1): 84. DOI: 10.1186/s13058-016-0740-2.
[7]王锦云, 赵树珍. 人参香茶片治疗胃癌术后101例的近期疗效观察[J]. 中医杂志, 1983, 24(7): 27-29. DOI: 10.13288/j.11-2166/r.1983.07.015.
[8]WANG H J, WU R M, XIE D, et al. A combined phytochemistry and network pharmacology approach to reveal the effective substances and mechanisms of Wei-fu-Chun Tablet in the treatment of precancerous lesions of gastric cancer[J]. Frontiers in Pharmacology, 2020, 11: 558471. DOI: 10.3389/fphar.2020.558471.
[9]de VISSER K E, JOYCE J A. The evolving tumor microenvironment: from cancer initiation to metastatic outgrowth[J]. Cancer Cell, 2023, 41(3): 374-403. DOI: 10.1016/j.ccell.2023.02.016.
[10]LU X, MU E, WEI Y, et al. VCAM-1 promotes osteolytic expansion of indolent bone micrometastasis of breast cancer by engaging α4β1-positive osteoclast progenitors[J]. Cancer Cell, 2011, 20(6): 701-714. DOI: 10.1016/j.ccr.2011.11.002.
[11]DUFFY M J, MCGOWAN P M, HARBECK N, et al. uPA and PAI-1 as biomarkers in breast cancer: Validated for clinical use in level-of-evidence-1 studies[J]. Breast Cancer Research, 2014, 16(4): 1-10. DOI: 10.1186/s13058-014-0428-4.
[12]KILLEEN S, HENNESSEY A, EL HASSAN Y, et al. The urokinase plasminogen activator system in cancer: a putative therapeutic target?[J]. Drug News & Perspectives, 2008, 21(2): 107. DOI: 10.1358/dnp.2008.21.2.1188197.
[13]RAN S. The role of TLR4 in chemotherapy-driven metastasis[J]. Cancer Research, 2015, 75(12): 2405-2410. DOI: 10.1158/0008-5472.CAN-14-3525.
[14]BILLOTTET C, TUEFFERD M, GENTIEN D, et al. Modulation of several waves of gene expression during FGF-1 induced epithelial-mesenchymal transition of carcinoma cells[J]. Journal of Cellular Biochemistry, 2008, 104(3): 826-839. DOI: 10.1002/jcb.21667
[15]李浩. FGF1异常表达促进结直肠癌细胞增殖和迁移的机制研究[D]. 苏州: 苏州大学, 2021.
[16]梁云麒, 沈克平, 胡兵. 中医胃癌病机与治法研究[J]. 中华中医药学刊, 2014, 32(3): 513-515. DOI: 10.13193/j.issn.1673-7717.2014.03.021.
[17]戈淑超, 王高玉, 刘红宁, 等. 中医药治疗胃癌的研究概况[J]. 江西中医药, 2018, 49(9): 72-75.
[18]马善美, 陈雅文. 中医药治疗胃癌的研究进展[J]. 中国民间疗法, 2022, 30(3): 114-117. DOI: 10.19621/j.cnki.11-3555/r.2022.0340.
[19]陈曦, 赵亚红, 张也青, 等. 胃复春的临床应用和现代研究进展[J]. 江西中医药, 2016, 47(9): 77-80.
[20]祁大慶, 陈琳慧, 潘海春, 等. 胃复春胶囊通过NF-κB信号通路诱导胃癌细胞凋亡并抑制胃癌细胞转移作用[J]. 现代药物与临床, 2022, 37(6): 1175-1181. DOI: 10.7501/j.issn.1674-5515.2022.06.002.
[21]宿玉, 崔佳, 施务务, 等. 中药香茶菜研究进展[J]. 亚太传统医药, 2011, 7(6): 155-158.
[22]费洪荣, 王凤泽, 赵雪梅, 等. 唇形科香茶菜属植物中主要二萜类成分的抗肿瘤活性研究进展[J]. 中国药房, 2010, 21(7): 661-663.
[23]WANG Y, CHEN Y Y, ZHANG H, et al. Polymethoxyflavones from citrus inhibited gastric cancer cell proliferation through inducing apoptosis by upregulating RARβ, both in vitro and in vivo[J]. Food and Chemical Toxicology, 2020, 146: 111811. DOI: 10.1016/j.fct.2020.111811.
[24]王慧, 钟国跃, 张寿文, 等. 枳壳化学成分、药理作用的研究进展及其质量标志物的预测分析[J]. 中华中医药学刊, 2022, 40(9): 184-192. DOI: 10.13193/j.issn.1673-7717.2022.09.041.
[25]樊伟旭, 詹志来, 侯芳洁, 等. 红参的化学成分及药理作用研究进展[J]. 天然产物研究与开发, 2021, 33(1): 137-149. DOI: 10.16333/j.1001-6880.2021.1.017.
[26]SONG Y, LIU G, LIU S A, et al. Helicobacter pylori upregulates TRPC6 via Wnt/β-catenin signaling to promote gastric cancer migration and invasion[J]. OncoTargets and Therapy, 2019, 12: 5269-5279. DOI: 10.2147/ott.s201025.
[27]PREVARSKAYA N, SKRYMA R, SHUBA Y. Calcium in tumour metastasis: new roles for known actors[J]. Nature Reviews Cancer, 2011, 11(8): 609-618. DOI: 10.1038/nrc3105.
[28]LAUSS M, KRIEGNER A, VIERLINGER K, et al. Characterization of the drugged human genome[J]. Pharmacogenomics, 2007, 8(8): 1063-1073. DOI: 10.2217/14622416.8.8.1063.
[29]SHEN C Y, LU C H, WU C H, et al. The development of Maillard reaction, and advanced glycation end product (AGE)-receptor for AGE (RAGE) signaling inhibitors as novel therapeutic strategies for patients with AGE-related diseases[J]. Molecules, 2020, 25(23): 5591. DOI: 10.3390/molecules25235591.
[30]许新才, 曹博威, 张银华, 等. 幽门螺杆菌及RAGE表达对胃癌协同作用的机制探讨[J]. 中华胃肠外科杂志, 2017, 20(9): 1072-1074. DOI: 10.3760/cma.j.issn.1671-0274.2017.09.024.
[31]WANG L Q, WONG K Y, ROSN A, et al. Epigenetic silencing of tumor suppressor miR-3151 contributes to Chinese chronic lymphocytic leukemia by constitutive activation of MADD/ERK and PIK3R2/AKT signaling pathways[J]. Oncotarget, 2015, 6(42): 44422-44436. DOI: 10.18632/oncotarget.6251.
[32]HONG S, KIM S, KIM H Y, et al. Targeting the PI3K signaling pathway in KRAS mutant colon cancer[J]. Cancer Medicine, 2016, 5(2): 248-255. DOI: 10.1002/cam4.591.
[33]ANG K L, SHI D L, KEONG W W, et al. Upregulated Akt signaling adjacent to gastric cancers: implications for screening and chemoprevention[J]. Cancer Letters, 2005, 225(1): 53-59. DOI: 10.1016/j.canlet.2004.11.021.
[34]SIGISMUND S, AVANZATO D, LANZETTI L. Emerging functions of theEGFRin cancer[J]. Molecular Oncology, 2018, 12(1): 3-20. DOI: 10.1002/1878-0261.12155.
[35]刁藝, 田新华, 黄延林, 等. 靶向表皮生长因子受体和血管内皮生长因子受体-2治疗多形性胶质母细胞瘤[J]. 中华实验外科杂志, 2010, 27(3): 358-360. DOI: 10.3760/cma.j.issn.1001-9030.2010.03.032.
[36]CORSO S, PIETRANTONIO F, APICELLA M, et al. Optimized EGFR blockade strategies in EGFR addicted gastroesophageal adenocarcinomas [J]. Clinical Cancer Research, 2021, 27(11): 3126-3140. DOI:10.1158/1078-0432.CCR-20-0121.
[37]张晗, 苏韫, 龚红霞, 等. 归芪白术方联合奥沙利铂对胃癌荷瘤小鼠EGFR, VEGFR2表达和血管生成的影响[J]. 中国实验方剂学杂志, 2022, 28(7): 57-63. DOI: 10.13422/j.cnki.syfjx.20220521.
[38]SUN Y, LIU W Z, LIU T, et al. Signaling pathway of MAPK/ERK in cell proliferation, differentiation, migration, senescence and apoptosis[J]. Journal of Receptors and Signal Transduction, 2015, 35(6): 600-604. DOI: 10.3109/10799893.2015.1030412.
[39]李紫瑞, 邢莹, 胡玥, 等. 基于网络药理学的川楝素调控MAPK通路诱导人胃癌MKN-28细胞凋亡[J]. 中医药信息, 2021, 38(11): 6-14. DOI: 10.19656/j.cnki.1002-2406.20211102.
[40]高雅. 磷脂酶D通过Wnt信号通路促进人结肠癌细胞增殖和侵袭[D]. 厦门: 厦门大学, 2014.
[41]ZENONOS K, KYPRIANOU K. RAS signaling pathways, mutations and their role in colorectal cancer[J]. World Journal of Gastrointestinal Oncology, 2013, 5(5): 97-101. DOI: 10.4251/wjgo.v5.i5.97.
[42]ZHANG Y L, ZHANG Y L, WANG R C, et al. Roles of Rap1 signaling in tumor cell migration and invasion[J]. Cancer Biology & Medicine, 2017, 14(1): 90-99. DOI: 10.20892/j.issn.2095-3941.2016.0086.
[43]SANTOS M L C, de BRITO B B, da SILVA F A F, et al. Helicobacter pylori infection: beyond gastric manifestations[J]. World Journal of Gastroenterology, 2020, 26(28): 4076-4093. DOI: 10.3748/wjg.v26.i28.4076.
[44]KUMAR S, METZ D C, ELLENBERG S, et al. Risk factors and incidence of gastric cancer after detection of Helicobacter pylori infection: A large cohort study[J]. Gastroenterology, 2020, 158(3): 527-536.e7. DOI: 10.1053/j.gastro.2019.10.019.

