基于网络药理学和分子对接技术探究地胆草治疗溃疡性结肠炎的作用机制
慕娜娜 廖彬彬 李镇 李吉品 李伊花 王莹 陈旭冰
摘要: 基于網络药理学和分子对接技术,研究地胆草治疗溃疡性结肠炎(ulcerative colitis,UC)的分子机制。根据文献调研确定地胆草的化学成分,利用SwissADME数据库筛选活性成分、SwissTargetPrediction数据库预测其作用靶点。通过GeneCards、Disgenet、PharmGKB和TTD数据库获取UC的相关靶点,并进行拓扑分析,采用Metascape数据库对候选靶点进行GO (gene ontology)功能和KEGG(Kyoto encyclopedia of genes and genomes )生物通路富集分析,最后结合RCSB PDB数据库及Chemdraw、PyMoL、AutoDock 4.2.6对核心成分和关键靶点进行分子对接验证并进行可视化分析。从地胆草中筛选出34个调控UC的潜在靶点,对关键靶点作GO功能和KEGG通路富集分析,显示地胆草可能通过对系统过程的调节、外部刺激反应的负面调节、凋亡信号通路的调节以及机械刺激的反应等生物学过程调节MAPK3、PIK3CA、STAT3和JAK2等关键靶点的表达,从而参与调控癌症信号通路、PI3K-Akt信号通路、NF-κB信号通路、幽门螺旋杆菌感染的上皮细胞信号传导和钙信号传导通路等多个KEGG信号通路,从而达到治疗UC的目的。分子对接结果显示,各活性成分与关键靶点的亲和力较好。研究认为地胆草治疗UC的作用机制可能与抑制 MAPK3、PIK3CA、STAT3 等靶点的表达,缓解结肠组织炎症反应有关。
关键词:地胆草;溃疡性结肠炎;网络药理学;分子对接
中图分类号:P41 文献标志码:A 文章编号:1002-4026(2023)06-0048-08
Investigating the mechanism of action of Elephantopus scaber L.
in the treatment of ulcerative colitis based on network
pharmacology and molecular docking
MU Nana,LIAO Binbin,LI Zhen,LI Jipin,LI Yihua,WANG Ying,CHEN Xubing*
(College of Pharmacy, Dali University, Dali 671000, China)
Abstract∶Investigating the molecular mechanism of Elephantopus scaber L. in the treatment of ulcerative colitis (UC) based on network pharmacology and molecular docking techniques. The chemical composition of Elephantopus scaber L. was determined based on literature research, the active ingredients were screened using the SwissADME database, and the targets were predicted by SwissTargetPrediction database. The GeneCards, Disgenet, PharmGKB, and TTD databases were used to obtain the relevant targets for UC, and the topological analysis was performed. The Metascape database was used to perform Gene Ontology (GO) function and Kyoto Encyclopedia of Genes and Genomes (KEGG) was used for biological pathway enrichment analysis on the candidate targets. In addition, the RCSB PDB database and Chemdraw, PyMoL, AutoDock 4.2.6 was used for molecular docking validation and visualization of core components and key targets. 34 potential targets were screened out, and GO function and KEGG pathway enrichment analysis were performed on the key targets. The results showed that Elephantopus scaber L. can regulate systemic processes, negatively regulate the response to external stimuli, and regulate apoptosis signaling pathways. MAPK3, PIK3CA, STAT3, and JAK2 are regulated by biological processes such as responses to mechanical stimuli. Therefore it participates in the regulation of various KEGG signaling pathways, such as cancer signaling pathway, PI3K-Akt signaling pathway, NF-κB signaling pathway, Helicobacter pylori infection epithelial cell signaling pathway, calcium signaling pathway, etc. to treat UC.The molecular docking results showed that each active ingredient had good affinity to the key targets. The mechanism of Elephantopus scaber L. in treating UC may be related to inhibiting the expression of MAPK3, PIK3CA, STAT3 and other targets, and relieving the inflammatory reaction of colon tissue.
Key words∶ Elephantopus scaber L.; ulcerative colitis; network pharmacology; molecular docking
溃疡性结肠炎(ulcerative colitis,UC)是一种慢性肠道炎症性疾病,以反复发作的腹泻、黏液脓血便、里急后重、腹痛为主要症状,其病程长、易反复、预后差,甚至有癌变风险[1],可发生在任何年龄段,多见于20~40岁[2]。作为消化科的疑难病,我国近年来UC的发病率持续增长,复合增长率达9.4%,且中重度患者占比高达83.61%,形势严峻[3]。目前临床多采用肾上腺皮质激素、氨基水杨酸类、生物制剂、免疫抑制剂等药物治疗UC[4],但都存在用药周期长、不良反应严重,且停藥后易复发的局限性[5-6]。UC在严重影响患者生活质量的同时,高昂的治疗费用也给患者造成了沉重的经济负担。在欧洲,与UC相关的年度直接和间接治疗费用估值高达12.5亿~291亿欧元,在美国则高达8.1亿~149亿美元[7]。因此,UC药物的研发已成为研究者亟待解决的问题。传统民族药在治疗慢性病方面有着重要作用,故本文选择民族药地胆草,探究其对UC的作用机制。
彝族药地胆草(Elephantopus scaber L.)是菊科地胆草属多年生直立草本植物,俗称苦鸡姆,别名地胆头、草鞋底、铁灯盏、地苦胆等,生长于我国西南及华南地区的开旷山坡、山谷林缘、具有一定植被覆盖度的潮润地[8]。曾被1977版《中国药典》收录[9],现收录于2010版《广东省中药材标准》第二册[10]。地胆草全草入药,性寒,味苦辛,在民间应用广泛。据《中国民族药志》记载,少数民族如苗族、傣族、瑶族、布依族、黎族、壮族、侗族等根据经验方,用于牙痛、痢疾等病症的治疗。《中国植物志》中记载,地胆草主治感冒、菌痢、胃肠炎、肾炎水肿、疖肿等症[11]。但是目前关于地胆草在药理活性方面的研究局限于粗提物或体外实验,其作用机制尚不明确,故本文基于网络药理学的方法探讨地胆草对UC的药理作用,以期为后续的研究提供参考。
1 材料和方法
1.1 地胆草的潜在作用靶点筛选
基于知网 (https://www.cnki.net/), Pubmed (https://pubmed.ncbi.nlm.nih.gov/), 百度学术(https://xueshu.baidu.com),Science Direct (https://www.sciencedirect.com)等查阅相关文献得知,目前已经从地胆草中分离得到64种化合物[12]。从化源网 (https://www.chemsrc.com)数据库中获得各个成分的CAS号,在PubChem (https://pubchem.ncbi.nlm.nih.gov/)数据库中查找地胆草的Canonical Smiles号,将其导入SwissADME数据库(http://www.swissadme.ch)(搜不到CAS号的成分,可直接利用其画图功能在线画图),筛选有效成分,确认为有效成分之后再利用成分靶点数据库SwissTargetPrediction (http://www.swisstargetprediction.ch/)获得地胆草的潜在作用靶点。
1.2 UC的相关靶点预测
在GeneCards (https://www.genecards.org/)数据库中输入“Ulcerative Colitis”,求得基因得分中位数,取中位数之前的基因。在Disgenet (http://www.disgenet.org), PharmGKB (https://www.pharmgkb.org/)和TTD ( http://db.idrblab.net/ttd/)中输入“Ulcerative Colitis”获取基因,合并4个数据库的靶点信息并去除重复值。
1.3 地胆草和UC交集靶点获取
利用微生信 (https://www.bioinformatics.com.cn)对获得的药物靶点和疾病靶点取交集,即为地胆草治疗UC的潜在靶点。
1.4 疾病与药物的差异基因分析
将交集靶点导入STRING数据库中,限定物种为 Homo sapiens,构建蛋白质-蛋白质相互作用(protein-protein interaction, PPI)网络,将结果保存为tsv文件。导入Cytoscape 3.7.2软件,筛选该网络的核心节点。
1.5 基因本体和京都基因与基因组百科全书通路富集分析
将交集靶点导入Metascape数据库中,限定物种为Homo sapiens ,并按照P值大小进行排序。将选取的结果用微生信在线工具进行基因本体(gene ontology ,GO)、京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes, KEGG)通路富集分析结果的可视化。
1.6 分子对接
将PPI网络图中的核心基因和KEGG富集分析得到的前3条通路中的基因取交集,筛选出11个基因,选用度值较大的10个成分进行分子对接分析。在PDB (https://www.rcsb.org/)、PubChem (https://pubchem.ncbi.nlm.nih.gov/)数据库获取活性成分和核心靶点的2D结构和晶体结构,利用Chem3D软件将其格式转化为3D结构,并进行结构优化,PyMol软件对蛋白质结构进行处理,最后使用AutoDock 4.2.6进行分子对接,计算结合能。
2 结果
2.1 地胆草有效成分及靶点的筛选
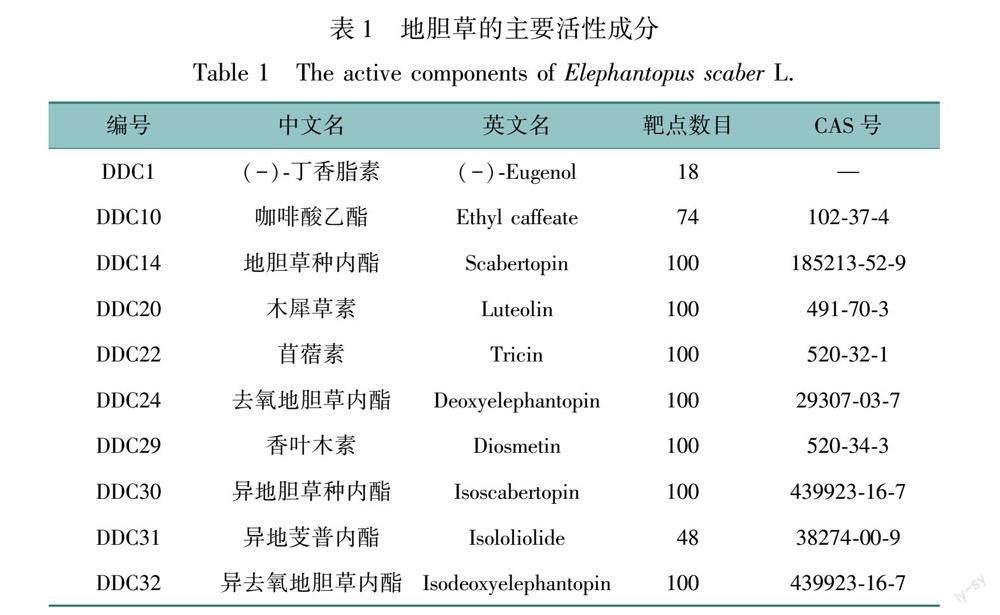
通过SwissTargetPrediction数据库,结合药代动力学筛选到34个有效成分,1 804个靶点,去除重复值之后得到555个靶点,部分活性成分信息见表1,全表见OSID科学数据与内容附表1。
2.2 UC潜在靶点的筛选
在GeneCards、DisGenet、PharmGKB和TTD数据库分别以 “Ulcerative Colitis”为关键词,搜索与UC相关的靶点,去重后共得到1 837个疾病靶点。
2.3 核心靶点的获取
将获得的药物靶点与疾病靶点上传至微生信在线绘制网站,共获得200个潜在靶点,韦恩图见OSID科学数据与内容附图1。
2.4 药物-成分-靶点网络图的构建
利用Cytoscape 3.7.2构建地胆草药物-成分-靶点的网络图,见OSID科学数据与内容附图2,中央红色节点代表药材地胆草,下方绿色菱形节点为地胆草的活性成分,外周蓝色三角形节点为药物-疾病交集靶点,节点的大小与其所连接的靶点数目成正比,连线表示药物與靶点之间的相互作用关系。筛选出排名靠前的活性成分依次是香叶木素、木犀草素、苜蓿素、(Z)-8,11,12-三羟基-9-十八碳烯酸、大黄素甲醚、3-甲氧基-4-羟基-桂皮醛、异地胆草种内酯、去氧地胆草内酯、阿魏酸和异去氧地胆草内酯以及地胆草种内酯。排名前10位的靶点蛋白分别是CA2、ESR2、MMP1、PTGS2、MMP9、MMP2、ALOX5、TERT、EGFR、ESR1等,说明其在疾病治疗过程中可能发挥重要作用。
2.5 疾病与药物的差异基因分析
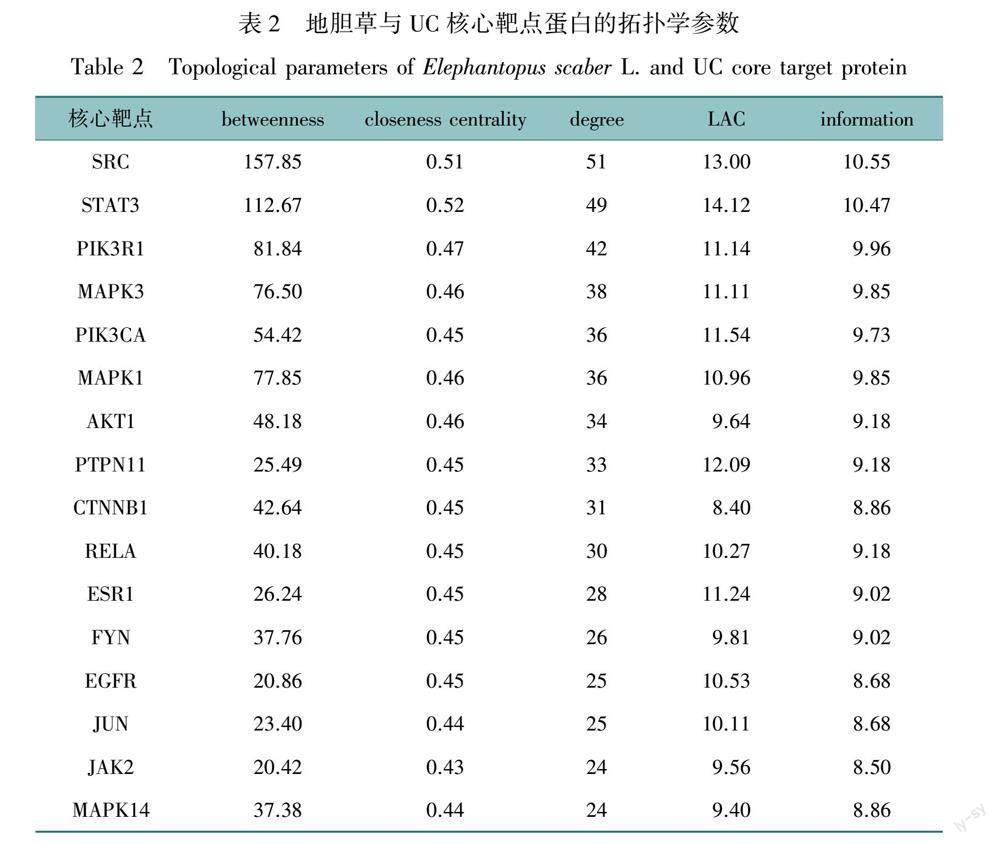
将200个潜在靶点导入STRING数据库,隐藏无相互作用的节点,构建网络图,保存初始的tsv文件,将其导入Cytoscape 3.7.2中进一步优化,计算该网络中degree的中位数为6,先根据degree的二倍中位数筛选一次得到43个核心靶点,再利用Cyto NCA插件分析。计算其degree、betweenness、closeness centrality、information、LAC的中位数作为筛选条件,即 degree>19、betweenness >13.71、closeness centrality >0.42、information >7.87 、LAC>8.4,最终筛选出16个网络核心节点,并进行可视化处理。得到的网络图中的面积越大、颜色越接近绿色,代表degree越高,而degree越高,说明该靶点与其他靶点的相关性越明显,见OSID科学数据与内容附图3。最终筛选的靶点拓扑学参数见表2,推测其可能是地胆草治疗UC的关键靶点。
2.6 GO和KEGG的富集分析
将Metascape数据库中的富集结果用微生信平台进行可视化处理,以P值为筛选条件分别选取生物过程(biological process,BP)、细胞组分(cell component,CC)、分子功能(molecular function,MF)前5个条目,选取KEGG分析中前20条通路进行可视化分析,结果见OSID科学数据与内容附图4、图5。可见交集靶点主要参与对系统过程的调节、对外部刺激反应的负面调节、对凋亡信号通路的调节以及对机械刺激的反应等多个GO生物学过程;并参与调控癌症信号通路、脂质和动脉硬化通路、PI3K-Akt信号通路、NF-κB信号通路、p53信号通路、幽门螺旋杆菌感染的上皮细胞信号传导和钙信号传导通路等多个KEGG信号通路。由富集分析可知,地胆草对 UC 的治疗作用涉及生物过程、分子功能和细胞组分以及通路过程,可能是一个多成分、多靶点、多通路的一个复杂生化过程。
2.7 分子对接
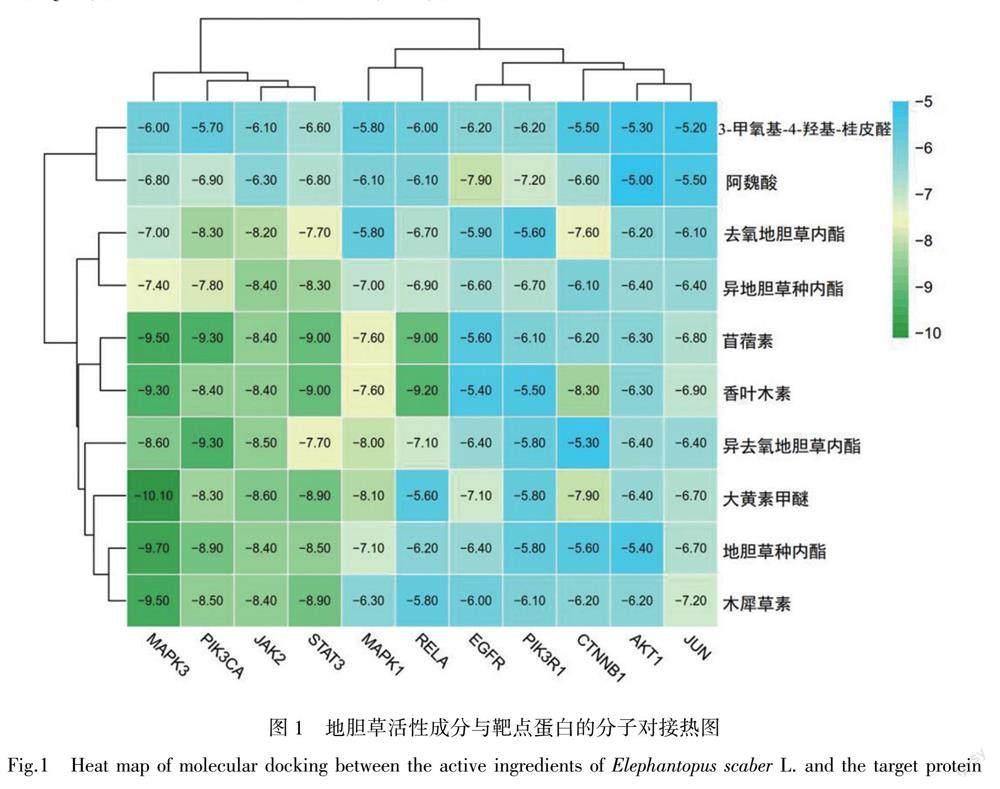
根据蛋白核心网络和通路富集筛选出的核心靶点,与度值排名靠前的化合物作分子对接,选取的化合物即香叶木素、木犀草素、苜蓿素、大黄素甲醚、3-甲氧基-4-羟基-桂皮醛、异地胆草种内酯、去氧地胆草内酯、阿魏酸和异去氧地胆草内酯以及地胆草种内酯,靶点蛋白分别为JUN(PDBID:6OSN)、MAPK1(PDBID:4ZZN)、AKT1(PDBID:1UNQ)、PIK3R1(PDBID:5GJI)、CTNNB1(PDBID:5IVN)、RELA(PDBID:2CE2)、STAT3(PDBID:6DLG)、EGFR(PDBID:6ICG)、PIK3CA(PDBID:6I1S)和JAK2(PDBID:5WA5)以及MAPK3(PDBID:4QTB)。对接的结果用热图表示(图1)。
热图中,绿色越深,其结合能越小,表明其结合情况较好,图中的数据显示,各成分与蛋白之间的结合能均小于-20.92 kJ/mol,证明了筛选的活性成分与靶点蛋白之间结合较好。其中MAPK3、PIK3CA、STAT3和JAK2蛋白与各成分结合较佳,尤其MAPK3与大黄素甲醚、地胆草种内酯、木犀草素、苜蓿素的结合能小于-39.748 kJ/mol,因此,推测所选取的化合物为地胆草治疗UC的主要活性成分。最后,选取对接结合能量最低的构象用于分析对接结合模型,见图2,其中蓝色表示受体,彩色表示小分子配体,黄色虚线表示形成的氢键,紫色表示氨基酸残基。
3 讨论与结论
UC发病机制复杂,目前尚无明确定论,可能与遗传、免疫、感染及精神等多因素交互作用有关,其中炎症因子平衡起重要作用,如炎性细胞的浸润和炎症介质的异常表达,抗炎因子与促炎因子调控失衡,以及其平衡失调引起免疫反应,均可导致结肠免疫功能失衡及紊乱,损伤结肠黏膜从而导致 UC 的发生发展,最终导致慢性炎症[13]。
地胆草的民间药用历史悠久,在中国南方多用作食材,被广泛用作煲汤原料,其临床疗效也颇为显著[14]。民间有用于治疗痢疾的经验,也广泛用于咽炎、扁桃体炎等多种感染性疾病的治疗[15],且目前已有研究证明其在炎症和抗氧化方面具有良好的活性[16-17]。何昌国等[18]研究表明,地胆草全草提取物具有明显的体外抗菌作用,能显著抑制实验小鼠和大鼠的各期炎症反应,抗炎强度优于阿斯匹林组(P<0.05)。陈昌刚[19]从地胆草中提取的咖啡酸乙酯抑制T细胞免疫反应 ,推测下调 Th1细胞因子可能是其免疫抑制效应的机制之一, 咖啡酸乙酯对胶原诱导性小鼠关节炎具有抑制作用,下调高致病性Th17表达,调控Th17细胞/Treg 平衡,可能是其治疗类风湿关节炎的机制之一。本研究通过数据分析预测地胆草可能通过调节MAPK3、PIK3CA、STAT3和JAK2等靶点,从而进一步调控癌症信号通路、PI3K-Akt信号通路、NF-κB信号通路、p53信号通路、幽门螺旋杆菌感染的上皮细胞信号传导和钙信号传导通路,以达到治疗UC的作用,进一步说明了其对UC患者的作用是多靶点、多通路的特点。
根據PPI网络和分子对接分析,筛选出的4种潜在靶点可参与或控制多条信号通路和生物学途径,以此来调节机体的免疫状态,及时对药物和炎症分子刺激做出应答反应。杨丽萍[20]发现MAPK和STAT3共同调节引起TNF-α启动子活性的增加,从而影响炎症反应。有研究表明ERK-MAPK通路的过度表达和激活在结肠癌的进展中起着重要作用[21]。 PIK3CA与细胞增殖、黏附、分化和迁移等过程有密切联系[22] ,PIK3CA基因突变,会引起PI3K酶处于持续激活状态导致信号通路的紊乱。根据 PIK3CA基因在结直肠癌中高频突变, 并激活 PI3K/AKT信号传导通路,说明阻断该信号通路激活对 AKT的磷酸化可能成为治疗结直肠癌的一条有效途径[23] 。因此,抑制PIK3CA基因的突变是非常有必要的。STAT3为细胞因子和受体相互作用的载体,调节细胞生长、生化、炎症和免疫反应[24]。目前公认 STAT3 参与活化 IL-10 受体,进而调控其表达和分泌。IL-10 可减弱 T 淋巴细胞活性,同时还可以抑制被激活的过度免疫功能,通过抑制炎性因子的合成和释放,强烈抑制促炎因子转录水平,从而起到抗炎的作用,尤其在肠道黏膜免疫中起到了重要作用[25]。JAK2 能识别细胞外信号,发生磷酸化,激活后能够使下游 STAT3 发生磷酸化;而 p-STAT3 具有转录激活活性,可以调节下游多种基因表达,从而参与凋亡和炎症的调控[26]。JAK2、STAT3 蛋白的磷酸化水平降低,导致进入细胞核内调控下游基因转录的 p-STAT3 减少,随之引起细胞中促凋亡蛋白 Bax水平升高、抗凋亡蛋白Bcl-2水平下降[27]。因此推测地胆草可通过上述靶点,干预UC 炎症、抗氧化及促凋亡的发生发展,达到治疗目的。
通过KEGG富集分析,预测得到几条重要信号通路。其中涉及到癌症信号通路,很多癌症细胞都是由炎症的正常细胞发展生成的[28], Dvorak[29]报道,癌症和炎症具有类似的信号通路,如细胞增殖、存活、迁移和血管生成改变,这些信号通路受生长因子、促炎细胞因子和促血管生成因子的调节。PI3K/AKT通路的异常激活在UC的发病机制中起到了重要作用。蒋寅[30]研究表明,黄芩苷能减轻大鼠溃疡性结肠炎的炎症反应,抑制PI3K磷酸化,下调Akt的活化,从而抑制 TNF-α、 IL-6等炎症因子的分泌,进而发挥其抗炎效应。Li 等[31]报道,LRH黄酮类化合物通过减轻肠道炎症和氧化应激,恢复上皮细胞屏障功能,并通过调节PI3K/AKT途径改善肠道微环境,对DSS引起的小鼠UC表现出多方面的保护作用。Chen等[32]研究表明,氧化苦参碱可以通过PI3K/AKT途径抗炎、促凋亡、下调Th1和Th17细胞的分化来显著改善UC症状,这一结果表明,参与UC发病机制的PI3K/AKT信号通路可能是一个有吸引力的治疗靶点。Rahmani等 [33]发现,在结肠炎小鼠模型中,RGS能显著减轻结肠炎的症状,其保护作用是由PI3K/AKT和NF-kB信号通路的失活所介导的。
综上所述,本研究采用网络药理学与分子对接方法,分析了地胆草多成分、多靶点、多通路治疗UC的复杂机制过程。结果表明,地胆草活性成分可能通过调控癌症通路、PI3K/AKT信号通路和NF-κB信号通路等,发挥抗炎、抗氧化和抑制免疫反应的作用,从而缓解UC的临床症状,为地胆草治疗UC的深入研究提供了参考依据。
参考文献:
[1]葛均波, 徐永健, 王辰. 内科学[M]. 9版. 北京: 人民卫生出版社, 2018.
[2]王婧夷. 基于数据挖掘方法研究周正华治疗溃疡性结肠炎用药规律及其分子机制初探[D]. 天津: 天津中医药大学, 2020.
[3]NG S C, SHI H Y, HAMIDI N, et al. Worldwideincidence, and prevalence of inflammatory bowel disease in the 21st century: a systematic review of population-based studies[J]. The Lancet, 2017, 390(10114): 2769-2778. DOI: 10.1016/S0140-6736(17)32448-0.
[4]晁江峰. 芍药汤加减联合美沙拉嗪对溃疡性结肠炎患者炎性因子水平的影响[J]. 光明中医, 2018, 33(2): 254-256. DOI: 10.3969/j.issn.1003-8914.2018.02.046
[5]HARVEY K A, XU Z D, PAVLINA T M, et al. Modulation of endothelial cell integrity and inflammatory activation by commercial lipid emulsions[J]. Lipids in Health and Disease, 2015, 14: 9. DOI: 10.1186/s12944-015-0005-6.
[6]BINIENDA A, FICHNA J, S ALAGA M. Recent advances in inflammatory bowel disease therapy[J]. European Journal of Pharmaceutical Sciences, 2020, 155: 105550. DOI: 10.1016/j.ejps.2020.105550.
[7]COHEN R D, YU A P, WU E Q, et al. Systematic review: the costs of ulcerative colitis in western countries[J]. Alimentary Pharmacology & Therapeutics, 2010, 31(7): 693-707. DOI: 10.1111/j.1365-2036.2010.04234.x
[8]郑世炎, 胡伟平, 杜一新. 地胆草人工栽培技术[J]. 上海农业科技, 2016(5): 80-81.
[9]中华人民共和国卫生部药典委员会. 中华人民共和国药典1977年版一部[M]. 北京: 人民卫生出版社, 1977.
[10]广东省食品药品监督管理局. 广东省中药材标准(第二册)[M]. 广州: 广东科技出版社, 2011.
[11]中国科学院中国植物志编辑委员会. 中国植物志第七十四卷[M]. 北京:科学出版社, 1985.
[12]王炜辰, 江川, 张增弟, 等. 地胆草的现代药学研究进展[J]. 海峡药学, 2020, 32(2): 46-49. DOI: 10.3969/j.issn.1006-3765.2020.02.015.
[13]顾思臻, 薛艳, 高阳, 等. 青黛对溃疡性结肠炎肠上皮细胞炎症模型的抗炎机制研究[J]. 中药药理与临床, 2021, 37(6): 67-71. DOI: 10.13412/j.cnki.zyyl.2021.06.011.
[14]谢学方, 张永发, 丰明, 等. 林下间作地胆草不同施肥效应对比研究[J]. 福建农业学报, 2017, 32(11): 1185-1188. DOI: 10.19303/j.issn.1008-0384.2017.011.003.
[15]江苏新医学院. 中药大辞典(缩印本)(上册)[M]. 上海: 上海科学技术出版社, 2005.
[16]付露, 沙合尼西·赛力克江, 洪吟秋, 等. 地胆草抗氧化活性成分分离鉴定[J]. 中国实验方剂学杂志, 2019, 25(2): 156-162. DOI: 10.13422/j.cnki.syfjx.20190109.
[17]温先敏, 杨缅南, 胡田魁. 地胆草水提物抗炎镇痛作用的动物实验研究[J]. 云南中医中药杂志, 2015, 36(12): 71-72. DOI: 10.16254/j.cnki.53-1120/r.2015.12.034.
[18]何昌国, 董玲婉, 阮肖平, 等. 地胆草全草提取物抗菌抗炎作用的实验研究[J]. 中国中医药科技, 2008, 15(3): 191-192. DOI: 10.3969/j.issn.1005-7072.2008.03.015.
[19]陈昌刚. 地胆草有效成分免疫抑制效应及作用机制研究[D]. 昆明: 云南中医学院, 2015.
[20]杨丽萍. JAK/STAT3通路与MAPK通路协同调节早期炎症介质TNF-α转录活性[D]. 北京: 中国人民解放军军医进修学院, 2008.
[21]FUMERY M, SINGH S, DULAI P S, et al. Natural history of adult ulcerative colitis in population-based cohorts: a systematic review[J]. Clinical Gastroenterology and Hepatology:The Official Clinical Practice Journal of the American Gastroenterological Association, 2018, 16(3): 343-356. DOI: 10.1016/j.cgh.2017.06.016.
[22]林志坚, 徐韫健, 温广明. KRAS、NRAS、BRAF及PIK3CA基因突变与结直肠癌患者临床病理特征的关系[J]. 中华临床实验室管理电子杂志, 2021, 9(4): 217-221. DOI: 10.3877/cma.j.issn.2095-5820.2021.04.005.
[23]蒋健坤, 莫维光. 结直肠癌组织中PIK3CA基因突变与AKT1/2蛋白的表达及其意义[J]. 广西医学, 2010, 32(1): 24-27. DOI: 10.3969/j.issn.0253-4304.2010.01.008.
[24]张雯婷, 顾林, 柯希权, 等. 溃疡性结肠炎患者中TLR9和STAT3的表达及其与IL-10的相关性研究[J]. 中华全科医学, 2021, 19(6): 921-924. DOI: 10.16766/j.cnki.issn.1674-4152.001950.
[25]JOFRA T, GALVANI G, COSORICH I, et al. Experimental colitis in IL-10-deficient mice ameliorates in the absence of PTPN22[J]. Clinical and Experimental Immunology, 2019, 197(3): 263-275.
[26]石歡, 曾有桂, 牛一桐, 等. 穿心莲内酯调控JAK2/STAT3信号通路对佐剂诱导的小鼠脚掌炎性肿胀的抗炎作用[J]. 广西医科大学学报, 2020, 37(2): 172-176. DOI: 10.16190/j.cnki.45-1211/r.2020.02.003.
[27]阿丽亚·依拉木, 阿布都艾则孜·艾尔肯, 闫波, 等. 没食子乙醇提取物对结肠癌细胞JAK2/STAT3信号通路的调控作用研究[J]. 中国药房, 2022, 33(3): 326-331. DOI: 10.6039/j.issn.1001-0408.2022.03.12.
[28]贺湘. 糖皮质激素治疗重度溃疡性结肠炎的临床效果及相关因素分析[J]. 中国医药, 2017, 12(4): 554-557. DOI: 10.3760/cma.j.issn.1673-4777.2017.04.018.
[29]DVORAK H F. Tumors: Wounds that do not heal. Similarities between tumor stroma generation and wound healing[J]. The New England Journal of Medicine, 1986, 315(26): 1650-1659. DOI: 10.1056/NEJM198612253152606.
[30]蔣寅. 黄芩苷对溃疡性结肠炎PI3K/Akt/NF-κB信号通路的影响及其机制研究[D]. 南京: 南京中医药大学, 2016.
[31]LI C C, WANG L, ZHAO J B, et al. Lonicera rupicola Hook.f.et Thoms flavonoids ameliorated dysregulated inflammatory responses, intestinal barrier, and gut microbiome in ulcerative colitis via PI3K/AKT pathway[J]. Phytomedicine, 2022, 104: 154284. DOI: 10.1016/j.phymed.2022.154284.
[32]CHEN Q Y, DUAN X Y, FAN H, et al. Oxymatrine protects against DSS-induced colitis via inhibiting the PI3K/AKT signaling pathway[J]. International Immunopharmacology, 2017, 53: 149-157. DOI: 10.1016/j.intimp.2017.10.025.
[33]RAHMANI F, ASGHARZADEH F, AVAN A, et al. Rigosertib potently protects against colitis-associated intestinal fibrosis and inflammation by regulating PI3K/AKT and NF-κB signaling pathways[J]. Life Sciences, 2020, 249: 117470. DOI: 10.1016/j.lfs.2020.117470.

