鼠李糖乳杆菌Probio-M9 连续传代过程中的遗传稳定性
黄 天,刘凯龙,刘晓晔,姚国强,孙天松
(内蒙古农业大学 乳品生物技术与工程教育部重点实验室 农业农村部奶制品加工重点实验室 呼和浩特 010018)
益生菌是指摄入足够量后,对人体健康产生益处的一类活的微生物的总称[1]。乳杆菌属、双歧杆菌属,以及乳球菌、嗜热链球菌和酵母菌等作为目前益生菌产业中主要应用的微生物[2],其的安全性与稳定性问题不容忽视。
益生菌株的筛选标准极严格,大多数菌株通常来自于无致病菌历史、健康人群的胃肠道。菌株需具备在胃肠道中定植的能力,同时兼具较高的耐酸和耐胆盐能力[3]。在此基础上,通过对菌株全基因组测序结果进行深度分析,并结合微生物学检测和毒理学评价等,对其所携带的耐药基因、致病性基因和环境抗性基因进行系统阐述[4]。以人群试验和临床试验结果为重要评判指标,最终确定菌株是否具有安全性[5]。然而,随着菌株的流通和广泛使用,菌株往往会出现衰退现象,具体表现为,原有形态变得不典型,发酵周期变长,发酵特性变差,抗不良环境减弱等生物学特性。因此,深入研究与评估益生菌的遗传稳定性具有重要意义[6]。
鼠李糖乳杆菌Probio-M9 是由内蒙古农业大学团队于2017 年从健康妇女母乳样中分离得到的1 株具有潜在益生特性的益生乳酸菌[7],其在胃肠液中具有较强的存活率,同时鼠李糖乳杆菌Probio-M9 还可通过肠道-脑轴途径改善应激后成人的心理和生理生活质量以及通过调节肠道环境和改善炎症来抑制大肠肿瘤的形成等[8-10]。本研究以鼠李糖乳杆菌Probio-M9 为研究对象,从菌株形态变化、碳水化合物利用能力以及菌株代谢特性等多方面对其在连续传代培养(100 代)过程中的稳定性进行系统评价,同时结合比较基因组学深入分析其遗传稳定性,找寻其进化的基本规律,确保其具备优良的遗传稳定性,为鼠李糖乳杆菌Probio-M9 后续更深层次的研究提供理论基础。
1 材料与方法
1.1 试验材料
1.1.1 菌株来源 鼠李糖乳杆菌Probio-M9 菌株由内蒙古农业大学“乳品生物技术与工程”教育部重点实验室乳酸菌菌种资源库(LABCC)提供。
1.1.2 设备与仪器 HWS28 型电热恒温水浴锅,天津知署科技有限公司;立式低速离心机,德国Eppendorf 公司;恒温培养箱,上海恒科技仪器有限公司;DG250 厌氧工作站,英国DWS 公司;EF20 pH 计,瑞士梅特勒-托利多公司;UV-1100微量紫外分光光度计,NanoDrop 公司;BX50 光学显微镜,日本OLYMPUS 公司;Applied biosystems PCR 仪,伯乐公司;电泳仪,北京六一生物科技有限公司。
1.2 试验方法
1.2.1 鼠李糖乳杆菌Probio-M9 连续传代培养方法
1.2.1.1 绘制生长曲线 将鼠李糖乳杆菌Probio-M9 原始菌种从-80 ℃保藏环境中取出,活化后接种到液体MRS 培养基中(设置3 组平行),接种量为1%。在37 ℃恒温条件下、厌氧培养24 h,每隔2 h 取样,测定其在波长600 nm 处的吸光值,确定菌株到达稳定期时间。
1.2.1.2 菌株连续传代培养 将鼠李糖乳杆菌Probio-M9 原始菌种从-80 ℃保藏环境中取出,活化2 代后,在固体MRS 培养基上进行划线操作,并将划线后平板于37 ℃恒温条件下培养72 h 后,随机挑取3 个单菌落,每个单菌落分别接种于液体MRS 培养基中,37 ℃恒温条件下厌氧培养24 h,再接种到相应液体培养基中进行传代,接种量为1%,将第0,25,50,75,100 代分别标记为A0、A25、A50、A75 和A100。
1.2.1.3 菌株培养代数计算 以1.2.1.1 节确定的稳定期时间作为传代培养时间,将菌株以1%接种量接入新鲜液体培养基时的初始活菌数记为N0,稳定期时的活菌数记为Nf,通过公式log2100(Nf/N0)计算一个生长周期内的生长代数(也即细菌进行分裂的次数)[11]。
1.2.1.4 菌株连续传代培养过程细胞、菌落形态观察 鼠李糖乳杆菌Probio-M9 连续培养100 代过程中,对不同代时菌株进行革兰氏染色、镜检,观察细胞、菌落形态,初步检验菌株纯度,并保留A0、A25、A50、A75 和A100 代革兰氏染色镜检图片。
1.2.1.5 菌株连续传代培养过程碳水化合物代谢能力检测 鼠李糖乳杆菌Probio-M9 在连续培养100 代过程中,采用梅里埃碳水化合物鉴定(API 50CH)试剂盒分析其利用49 种碳水化物化合物(表1)的代谢能力,将A0、A25、A50、A75 和A100代菌悬液吸取至BioMerieux API 50CHL 碳水化合物鉴定试剂条中,并用无菌石蜡封口,37 ℃培养48 h 后进行结果判定。培养液中所含溴甲粉紫指示剂变为黄色(25 号管变为黑色)为阳性反应,表明该菌株可代谢对应的碳水化合物;不变色为阴性反应,表明该菌不可代谢对应碳水化合物。

表1 API 50CHL 乳杆菌鉴定系统各种碳水化合物一览表Table 1 API 50CHL Lactobacillus identification system list of various carbohydrates
1.2.1.6 菌株连续传代培养过程代谢产物检测保留鼠李糖乳杆菌Probio-M9 A0、A25、A50、A75及A100 代菌液的上清液,以苯乳酸(Phenyllactic acid)、柠檬酸(Citric acid)、酒石酸(Tartaric acid)、苹果酸(Malic acid)、琥珀酸(Succinic acid)、4-羟基苯乳酸(4-Hydroxyphenyllactic acid)、苯甲酸(Benzoic acid)、草酸(Oxalate)、水杨酸(Salicylic acid)、苯丙酸(Propionic acid)、乳酸(Lactic acid)、丙酸(Propionic acid)、丁酸(Butyrate)、己酸(Hexanoic acid)、乙酸(Acetic acid)物质为标品,进行靶向代谢物测定。
1.2.2 鼠李糖乳杆菌Probio-M9 连续传代过程比较基因组学研究
1.2.2.1 基因组DNA 提取及纯度检测 对鼠李糖乳杆菌Probio-M9 第0,25,50,75,100 代 的DNA 进行提取,提取到的DNA 通过Nanodrop 超微量分光光度计平台进行纯度测定,使用1.0%琼脂糖凝胶电泳对DNA 完整度及纯度进行检测。使用经典STE 法对菌株的全基因组进行提取,纯度检测同上,使用Qubit 荧光定量仪进行浓度检测,满足要求后通过Nanopore 三代测序平台进行全基因组的测序。
1.2.2.2 组装及环化 通过NextDenovo 软件完成3 代数据的组装[12],进一步使用circlator 软件将三代数据进行环化[13],采取CGview 在线软件对环化结果可视化。通过pilon 软件使用二代数据对三代数据进行polish[14]。参照Perl 脚本统计15 株不同代时菌株基因组信息。
1.2.2.3 平均核苷酸一致性(ANI)计算 15 株不同代时菌株基因组与鼠李糖乳杆菌Probio-M9 原始基因组进行ANI 计算,借鉴Goris 等[15]报道的方法,用自制Perl 脚本比较菌株之间的ANI 值。TBtools 软件进行ANI 聚类热图绘制[16]。
1.2.2.4 单核苷酸多态性(Single Nucleotide Polymorphism,SNP)位点分析 DNA 传代过程中,SNP 位点常作为分子突变标记之一[17],单个碱基的插入或缺失导致的单个核苷酸发生突变从而导致DNA 序列的改变。利用Soapsnp 软件对三代序列进行SNP 位点检测[18]。Samtools 软件对二代数据进行突变碱基识别[19]。
1.2.2.5 系统发育树构建 将1.2.2.4 节中识别到的SNP 位点整理成序列,在软件iTol(http://https://itol.embl.de/)内将基于邻接法(Neighbor-Joining,NJ)构建的系统发育树进行可视化。
1.2.2.6 共线性分析 本研究中将鼠李糖乳杆菌Probio-M9 与5 个不同代时的15 株全基因组序列在Mauve(v2.3.1)软件内进行共线性分析[20]。
1.3 数据处理
2 结果与分析
2.1 鼠李糖乳杆菌Probio-M9 连续培养100 代过程中表型研究
2.1.1 绘制生长曲线 不同的生长周期,菌种的生理状态有所差异,因此,菌种的传代通常选择对数生长期末期或者稳定期初期为宜,以1%的接种量,将原始菌株接种于液体MRS 培养基中,37 ℃恒温培养24 h 过程中OD600nm值变化情况如图1所示。

图1 鼠李糖乳杆菌Probio-M9 原始菌株生长曲线Fig.1 Growth curve of original strain of L.rhamnosus Probio-M9
由图1 可知鼠李糖乳杆菌 Probio-M9 在37℃恒温培养24 h 过程中OD600nm值的变化趋势,0~2 h 鼠李糖乳杆菌Probio-M9 处于延滞期,2~20 h处于对数生长期,20 h 后进入稳定期,这与Liu等[7]对鼠李糖乳杆菌Probio-M9 生长特性研究结果基本一致。活菌数变化趋势与OD600nm值总体相似,初始接入活菌数为(1.37±1.40)×106CFU/mL,对数生长期(2~20 h)活菌数增加至(1.64±0.71)×108CFU/mL,且此后随着时间推移活菌数不再增加。如图1 所示,20~24 h 时虽OD600nm值略有增加,但活菌数基本维持不变,表明在20~24 h 期间鼠李糖乳杆菌Probio-M9 生长已处于稳定期。参照1.2.1.3 节菌株生长代时计算方法,到达稳定期鼠李糖乳杆菌Probio-M9 的生长代数约为6.90代,且一直培养到24 h 仍处于稳定期,同时考虑到便于连续传代操作,故选择每个培养周期为(24±0.50)h 作为传代周期。
2.1.2 菌株连续传代过程中的菌体形态观察 对鼠李糖乳杆菌Probio-M9 A0、A25、A50、A75 和A100 菌悬液进行革兰氏染色并在显微镜下观察菌体形态,发现鼠李糖乳杆菌Probio-M9 连续传100 代菌体形态均属于鼠李糖乳酪杆菌典型形态,且在连续传代过程中,各代时的菌体形态无明显差异。
2.1.3 菌株连续传代过程中碳水化合物利用能力
本试验对连续传代培养的鼠李糖乳杆菌Probio-M9 的碳水化合物代谢能力进行了分析。原始菌株及连续培养传代过程中(0,25,50,75,100代)的菌株对49 种不同碳水化合物的代谢能力进行检测,结果见表2。

表2 不同代时鼠李糖乳杆菌Probio-M9 碳水化合物(API 50CH)利用情况Table 2 Utilization of carbohydrates(API 50CH)of L.rhamnosus Probio-M9 in different generations
由表2 可知,鼠李糖乳杆菌Probio-M9 可利用28 种碳水化合物:丙三醇、D-核糖、D-半乳糖、D-葡萄糖、D-果糖、D-甘露糖、L-山梨糖、L-鼠李糖、肌醇、甘露醇、山梨醇、甲基-α-D-吡喃葡萄糖苷、N-乙酰葡萄糖胺、苦杏仁苷、熊果苷、七叶灵-柠檬酸铁、水杨苷、D-纤维二糖、D-麦芽糖、D-乳糖、D-蔗糖、D-海藻糖、D-松三糖、D-龙胆二糖、D-土伦糖、D-来苏糖、D-塔格糖和葡萄糖酸钾。鼠李糖乳杆菌Probio-M9 在连续培养100 代过程中,5 个不同代时(A0/A25/A50/A75/A100 代)的碳水化合物利用能力无变化,说明鼠李糖乳杆菌Probio-M9 连续培养100 代对其碳水化合物的代谢能力没有影响,菌株在此连续培养传代过程中稳定。
2.1.4 菌株传代过程靶向代谢物分析 本研究对鼠李糖乳杆菌Probio-M9 在连续传代过程中,各代时(0/25/50/75/100 代)菌株有机酸及短链脂肪酸代谢物进行分析,结果表明如图3 所示,各代时(0/25/50/75/100 代)在苯乳酸(Phenyllactic acid)、柠檬酸(Citric acid)、酒石酸(Tartaric acid)苹果酸(malic Acid)、琥珀酸(Succinic acid)、4-羟基苯乳酸(4-Hydroxyphenyllactic acid)、苯甲酸(Benzoic acid)、草酸(Oxalate)、水杨酸(Salicylic acid)、苯丙酸(Propionic acid)、乳酸(Lactic acid)、丙酸(Propionic acid)、丁酸(Butyrate)、己酸(Hexanoic acid)、乙酸(Acetic acid)等代谢物质之间无明显差异。

图3 不同代时鼠李糖乳杆菌Probio-M9 靶向代谢特征比较Fig.3 Comparison of targeted metabolic characteristics of L.rhamnosus Probio-M9 in different generations
2.2 鼠李糖乳杆菌Probio-M9 连续传代过程中比较基因组学分析
2.2.1 基因组信息 本研究中不同代时菌株组装的基因组信息如表3 所示,鼠李糖乳杆菌Probio-M9 原始菌株基因组大小3.00 Mb,GC 含量46.76%。传代过程中菌株的平均基因组大小为(3.00±0.002)Mb,GC 含量(46.76±0.007)%。
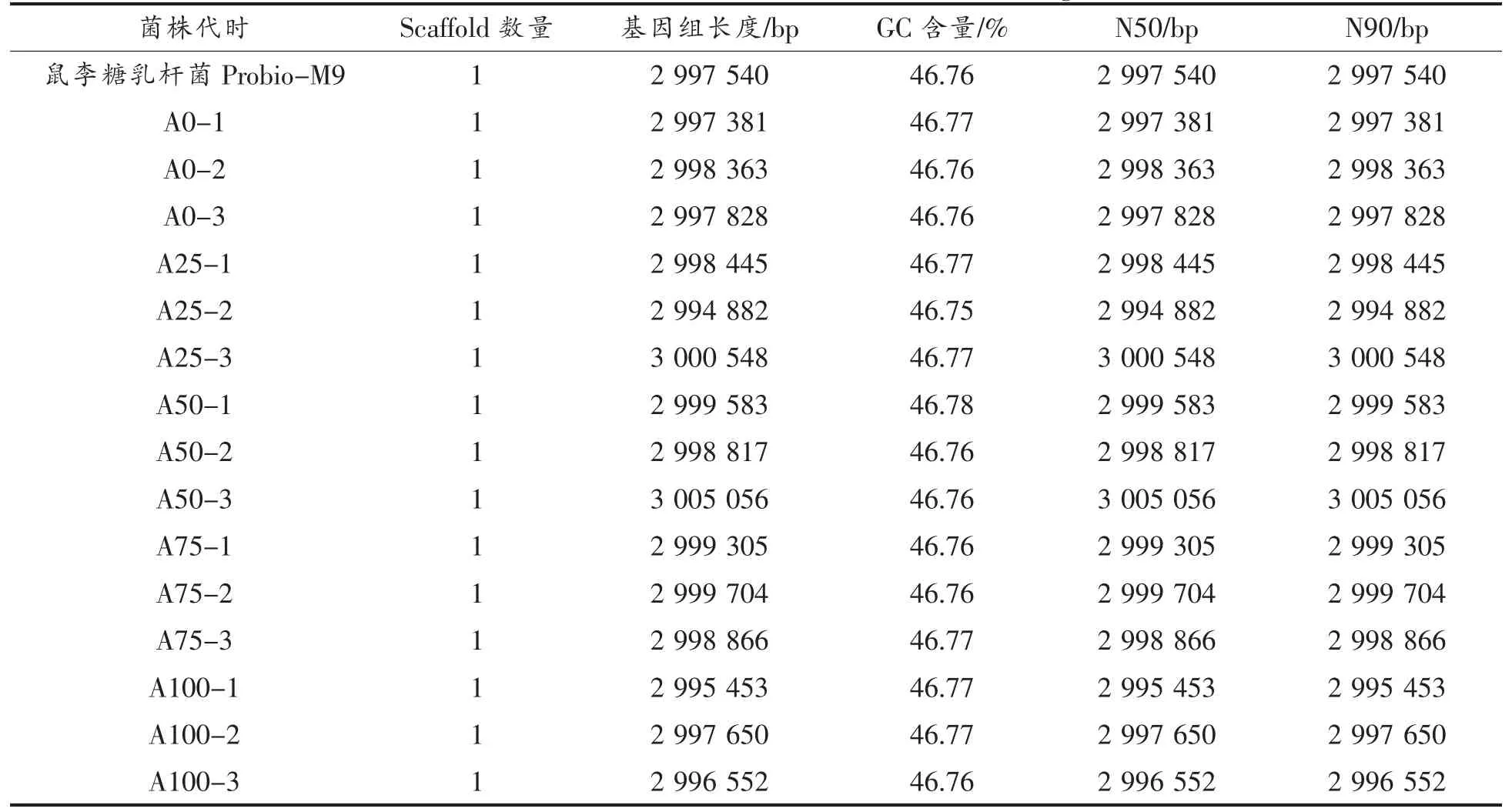
表3 5 个不同代时15 株菌基因组信息Table 3 Genomic information of 15 strains from 5 different generations
2.2.2 系统发育分析 本研究中利用系统发育树来描述传代过程中菌株的进化关系,进而判断菌株在连续培养过程中的稳定性[21]。以鼠李糖乳杆菌CNCM-I-3698 作为外群,使无根树转为有根树,鼠李糖乳杆菌Probio-M9 原始基因组为参考基因组,使用Soapsnp 方法得到的15 个菌株的SNP 位点连成序列,通过邻接法(NJ 法)构建系统发育树。
如图4 所示,系统发育树共分为两个分支,5个代时的15 株菌聚在同一系统发育分支,亲缘关系极近,且明显与外群基因组处于不同分支。

图4 基于SNP 位点构建系统发育树Fig.4 Phylogenetic tree constructed based on SNP locus
2.2.3 平均核苷酸一致性分析 平均核苷酸一致性(ANI)是在核苷酸的水平上,用以比较两个基因组之间亲缘关系的常用指标,其特点是对于近缘种群的区分度更高[22]。在比较基因组学分析中,常用ANI 评估基因组间的多态性和相似性,当ANI大于95%时,即表示为同一个种[23]。通过计算鼠李糖乳杆菌Probio-M9 原始基因组和15 株不同代时菌株基因组间的ANI 值,并绘制成热图。
由图5 可知,鼠李糖乳杆菌Probio-M9 原始基因组和15 株不同代时菌株基因组,两两菌株间的ANI 值均在99.00%,菌株之间表现出极高的相似性,且高于种间鉴定标准,可准确鉴定为同一亚种,表明连续培养100 代过程中菌株均属同一亚种即鼠李糖乳杆菌Probio-M9。

图5 基于5 个不同代时基因组序列绘制ANI 热图Fig.5 Heatmap of ANI based on genome sequences of five different generations strains
2.2.4 共线性分析 共线性可用来描述同一染色体上基因的位置关系,对不同的基因组间通过基因排列顺序对其共同祖先进行探索[24],基因组相关性越高则其中同源序列一致性越高。本研究选取鼠李糖乳杆菌Probio-M9 原始基因组序列作为参考,利用Mauve 软件对15 株不同代时基因组进行共线性分析。
结果如图6 所示,15 株不同代时培养的菌株与鼠李糖乳杆菌Probio-M9 原始基因组的共线性较好,具有极高的相似性,每个基因组中均未检测到基因片段的倒位。与鼠李糖乳杆菌Probio-M9比较,A50-3 和A75-2 有大片段缺失,约为15 kb,主要包含整合酶家族蛋白、组氨酸激酶、核糖核酸酶、假设蛋白、tuf、cobB_1 和ATP 结合酶蛋白等基因。其余菌株均有小片段缺失,且基因缺失位置随机。

图6 基于15 株不同代时序列组装结果与鼠李糖乳杆菌Probio-M9 原始基因组的共线性分析Fig.6 Collinearity analysis based on the sequence assembly results of 15 strains at different generations and the original genome of L.rhamnosus Probio-M9
2017 年,Zhang 等[25]发现一种由asp23 基因编码的碱性休克蛋白参与了干酪乳杆菌Zhang 对庆大霉素的适应性,从蛋白质组学对其适应性机制进行探究,通过比较含有庆大霉素的培养基中生长的asp23 基因缺失突变体及其亲本菌株的蛋白质组,发现与asp23 突变株相比,一些膜相关蛋白在亲本菌株中显著上调,表明asp23 编码的碱性休克蛋白能够通过调节细胞膜蛋白来适应庆大霉素的环境胁迫。本研究中15 株不同代时培养的菌株均有一定的基因片段缺失现象发生,因此对于本研究中缺失片段所表达的基因功能还有待进一步研究。
2.2.5 SNP 突变位点 以鼠李糖乳杆菌Probio-M9 为参考菌株,利用Soapsnp 软件对15 株不同代时鼠李糖乳杆菌Probio-M9 菌株进行SNP 位点识别,同时使用Samtools 软件对测序数据检测到的突变位点进行过滤,剔除假阳性结果,结果见表4。

表4 15 株不同代时菌株提取的SNP 突变位点及注释信息Table 4 SNP mutation sites and annotation information extracted from 15 strains of different generation
以鼠李糖乳杆菌Probio-M9 原始菌株基因组为参照,鼠李糖乳杆菌Probio-M9 在连续培养100代时的不同代时菌株中共发现16 个SNP 位点,SNP 位点分布及功能如表4 所示,包括6 个同义突变和4 个非同义突变,6 个位于非编码区。非同义突变主要位于编码酪氨酸受体激酶YwqD(Tyrosine-protein kinase)和假设蛋白(Hypothetical protein)的基因上。根据突变位点对其稳定性进行分析发现,连续培养100 代过程中高频突变数量较少,检测到2 个SNP,且首次发生在第0 代基因组与参考基因组之间,一旦建立将稳定遗传。菌株低频突变检测到的个数均小于21。研究表明,SNP个数小于21 时,可将其鉴定为同一物种[26]。不同代时15 株菌所识别到的SNP 位点均小于21 个,表明15 株不同代时菌株可鉴定为同一物种。
5 个代时菌株SNP 位点随机产生,从0 代到25 代、25 代到50 代、50 代 到75 代、75 代 到100代的菌株中,均未发现稳定存在的突变位点。表明鼠李糖乳杆菌Probio-M9 在连续传代100 代时过程中,遗传稳定性良好。
2.2.6 碳水化合物活性酶注释 碳水化合物活性酶数据库(CAZy)是物质对碳水化合物及其衍生物的合成及分解的酶类数据资源库[24]。本研究通过该数据库对鼠李糖乳杆菌Probio-M9 碳水化合物活性酶功能基因进行分析,在基因组水平观察鼠李糖乳杆菌Probio-M9 菌株在连续培养100 代时对碳水化合物利用能力的稳定程度。
如图7 所示,从15 株不同代时基因组中共注释到6 大类碳水化合物活性酶的68 个小类基因家族,主要以GHs(糖苷水解酶)和GTs(糖苷转移酶)酶类的含量最为丰富。大部分基因家族在不同代时无显著差异,虽然极个别菌株注释到的酶类存在不一致情况,但不会稳定遗传,且总体碳水化合物利用情况相同,遗传稳定性较好,与表型中不同代时碳水化合物利用能力相同的结果相吻合。

图7 不同代时菌株碳水化合物活性酶注释Fig.7 Results of active enzyme annotation of carbohydrate in different generations
3 结论
遗传稳定性即子代产生的性状与亲本拥有相同的基因型[27]。在生物进化过程中,遗传变异会经常出现,如不严格进行人工选择,就会导致菌种的衰退,从而导致菌种在生产应用过程中出现低产、不稳定现象[28]。研究表明,菌株在培养及使用过程中,因保藏方法不同、培养基选择、传代代次和人工操作等原因会导致菌种出现衰退现象[29]。早在1983 年,Clements 等[30]发现不同批次用相同方法制备的乳杆菌在治疗腹泻的效果上存在显著的差异。引发了人们对于遗传稳定性的关注。
近年来,益生菌愈加的受大众欢迎,而在选择益生菌时,不应该仅仅考虑菌株的功能,更要参考菌株的遗传稳定性和生存能力等,这些性能关系到益生菌在肠道中的生存和定殖以及在生产应用中其益生特性的发挥[31]。鼠李糖乳杆菌Probio-M9是2017 年从中国多地的健康母乳中分离出的一株益生菌[7],多项研究证实,鼠李糖乳杆菌Probio-M9 具有耐酸、耐胆盐特性,其显著的益生特性体现在能够活着进入人体肠道,对肠道菌群起到调节作用并增强机体免疫力[8-10],其在食品工业中广泛应用,而目前所做研究更多的停留在生理生化水平,对菌株的遗传稳定性研究少之又少。
本研究中,对鼠李糖乳杆菌Probio-M9 在MRS 培养基(液体培养基)中连续培养5 个代时(0,25,50,75,100 代)过程中的表型特征及基因组稳定性进行分析。采用全基因组及重测序方法对不同代时15 株菌进行测序,基因组大小、GC 含量表明15 株连续培养的菌株与鼠李糖乳杆菌Probio-M9 原始菌株基因组均无明显差异,系统发育关系表明15 株菌与原始基因组具有较近的亲缘性。在识别到的SNP 位点来看,每两个传代代时间均未发现稳定遗传的突变位点,且菌株共线性良好。同时,从基因组水平编码基因的突变水平证实了鼠李糖乳杆菌Probio-M9 在连续培养100代过程中具有稳定表型特征及代谢特性。
综上所述,本试验结果表明鼠李糖乳杆菌Probio-M9 在连续传代过程中具有良好的遗传稳定性,可为其后期开发应用提供理论参考。

