体外模拟消化过程中余甘子果实及醇提物的活性成分和抗氧化能力的变化
吴 娜,朱孛琛,章 旭,董方钰,刘 姣,陈 芳,邓泽元,潘 瑶,*
(1.南昌大学公共卫生学院,江西南昌 330000;2.南昌大学食品科学与资源挖掘全国重点实验室,江西南昌 330000)
余甘子(Phyllanthus emblicaLinn),也称滇橄榄、庵摩勒(古代名)或印度醋栗等[1-2],在我国南部地区分布广泛[3],其根、叶、果实均可入药,是世界多个国家及民族传统药学体系中的重要药物[4]。在我国,《本草纲目》称其“久服轻身,延年益寿”,现已被载入《中国药典》[5]。我国《“十四五”国民健康规划》提出“食药同源”等健康产业进入快速发展期,相关健康产业将成为中国经济发展的新引擎和新动力。然而,作为一种“食药同源”的作物,少有研究将余甘子作为日常膳食中的水果来源,从食品角度探究其健康效应及其影响因素,也少有研究探索其经消化道消化后,其健康效应的差异。现代研究表明,余甘子富含多酚、黄酮类、氨基酸、维生素[6]等成分,具有抗氧化[7]、抗衰老[8]、抗炎[9]、抗肿瘤[10]等多种健康效应。国内外大量研究证实,余甘子所富含的多酚和黄酮类植物化学物具备较强的抗氧化能力,这是其表现健康效应的关键因素[11-12]。
多酚和黄酮类物质是植物次生代谢产物的主要成分,也是膳食抗氧化剂重要成分[13]。水果、蔬菜中的植物化学物具有安全、无毒、高效、易得等特点,可以清除体内过多的自由基,使之保持在正常的生理范围内[14]。膳食多酚类化合物容易与其他组分(如蛋白质、糖类等)结合形成衍生物,可以按其结合程度[15]将膳食多酚分为游离型多酚和结合型多酚。研究认为,容易被溶剂(如水、甲醇、乙醇等)提取出来的多酚为游离型多酚,而溶剂提取之后的残渣中存在的主要是结合型多酚。结合型多酚容易与细胞壁中的脂蛋白以及纤维素等紧密结合,很难被提取出来。研究发现富含食物基质的植物化学物相较于提取物对细胞及动物体内抗氧化指标表现出显著差异[16]。此外,研究表明,多酚类物质在被吸收前,会在胃肠道发生结构的改变或降解[17],且其抗氧化能力在消化前后也有显著差异[18]。目前关于余甘子多酚、黄酮抗氧化能力的研究,多停留在其果汁或提取物的游离型多酚的体外抗氧化能力上,如杨冰鑫等[19]利用乙醇对余甘子多酚进行提取,并通过体外实验证实提取物具有很强的抗氧化能力;赵谋明等[20]和李张伟等[21]也得出了相似的结论。然而,我国现有研究一方面未系统地分析鉴定余甘子中的多酚和黄酮类物质,不能为阐述余甘子健康效益提供理论基础;另一方面国内外的研究缺乏考虑消化过程对余甘子多酚和黄酮类物质的影响,不具有膳食指导价值;此外,尚未有基于“全食品”概念[22],全面研究比较全食物基质为代表的余甘子果实冻干粉和以提取物为代表的余甘子醇提物在消化过程中的差异。因此,未能进一步挖掘余甘子作为“食药同源”果实的经济价值和社会效益,将很大程度上制约余甘子营养价值提升与功能食品的研发。
通过人体实验或动物实验来探究余甘子中多酚类物质在人体消化过程中的含量变化存在诸多困难,而体外模拟消化具有操作简单、易行、实验条件易于控制、实验周期较短的优点,成为研究食物在人体胃肠道消化中变化的重要途径[23]。因此,本文以余甘子冻干粉和醇提物作为研究对象,利用高效液相色谱串联四极杆飞行时间质谱(High Performance Liquid Chromatography Quadrupole Time of Flight Mass Spectrometry,HPLC-QTOF-MS/MS)对余甘子醇提物和冻干粉主要进行分析鉴定,通过体外模拟消化模型探讨在各阶段(口腔、胃、小肠和大肠)的消化液中多酚与黄酮含量以及抗氧化活性的变化情况,比较余甘子醇提物和冻干粉在上述阶段多酚与黄酮含量和抗氧化活性的差异。该研究有望为余甘子的加工利用、营养价值提升和相关功能食品的研发提供理论依据。
1 材料与方法
1.1 材料与仪器
余甘子果实 产自江西赣州,为新鲜无损果实;α-淀粉酶(酶活力≥1500 U/mL)、胃蛋白酶(酶活力≥25000 U/mL)、胰蛋白酶(酶活力≥800 U/mL)、纤维素酶(酶活力≥1000 U/mL)、1,1-二苯基-2-三硝基苯肼(DPPH)、水溶性维生素E ( Trolox)、氯化钾、磷酸二氢钾、氯化钠、碳酸氢钠、氯化镁、碳酸铵、氢氧化钠 均为分析纯,上海Aladdin 公司;2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2’-azinobis-(3-ethylbenzothiazoline-6-sulphonate,ABTS)试剂盒 碧云天生物技术研究所;无水乙醇、盐酸均为分析纯,中国上海Apel 公司。
JY-86-2-50 型-80 ℃冰箱 青岛海尔电冰柜有限公司;FA1604 电子分析天平 美国奥豪斯贸易公司;EXL800 全波段酶标仪 美国伯腾仪器有限公司;KL-UP-III-10 超纯水制备机 台湾艾柯(成都)实验专业纯水设备厂;RE-3000A 旋转蒸发仪 上海越众仪器有限公公司;LGJ-12A 真空冷冻干燥机 北京四环仪器有限公司;Agilent6540 超高解析度四级杆-飞行时间质谱仪(Q-TOF) 安捷伦科技(中国)有限公司;TDL-5-A 离心机 上海安亭科技仪器。
1.2 实验方法
1.2.1 样品制备
1.2.1.1 余甘子冻干粉的制备 挑选新鲜无损余干果,用超纯水洗净,去核,切成1 cm×1 cm×1 cm 的方块;置于真空冷冻干燥机中进行冷冻干燥。冻干后的样品经粉碎后过80 目筛3 次,得到余甘子果实冻干粉,冻干粉于-80 ℃冰箱储存备用。
1.2.1.2 余甘子醇提物的制备 参照本团队前期方法[24]优化改良,按照料液比1:30(mg/mL)向上述得到的余甘子冻干粉中加入70%的乙醇,再使用超声细胞破碎仪对其进行超声提取,其中超声功率(200 W),超声温度(60 ℃),超声时间(30 min)。超声后离心(8000 r/min,10 min),弃残渣取上清液,使用旋转蒸发仪除去乙醇并浓缩,浓缩后的样品置于真空冷冻干燥机中进行冷冻干燥,得到余甘子醇提物,醇提物于-80 ℃冰箱储存备用。
1.2.2 余甘子果实成分分析鉴定 参照Yang 等[25]的方法,稍作修改,使用HPLC-QTOF-MS/MS 对余甘子果实的基本成分进行分析鉴定。修改的实验条件如下:
液相色谱条件:采用C18色谱柱(1.8 μm,3 mm×100 mm)。流动相由纯乙腈A,含0.1%甲酸的水溶液B 组成。冻干粉的洗脱梯度为:0~1 min,2% A;1~8 min,2%~4% A;8~15 min,4%~5% A;15~23 min,5%~15% A;23~28 min,15%~30% A;28~32 min,30%~35%A;32~37 min,35%~50% A;37~38 min,50%~2% A;38~39 min,2% A。醇提物的洗脱梯度为0~8 min,5% A;8~16 min,5%~15% A;16~18 min,15%~35% A;18~28 min,50%~100% A;28~35 min,100% A; 35~45 min, 100%~0% A; 45~54 min,0% A。后运行1 min 以重新平衡色谱柱。进样量2 μL,流速为0.3 mL/min,柱温30 ℃。
质谱条件:电喷雾离子源(ESI),负离子模式。数据获取和分析软件为Qualitative Analysis 10.0。
1.2.3 体外模拟消化液的制备 参考胡琪睿[26]的方法进行体外消化,首先按表1 配制各阶段工作液。模拟体外消化工作液均用蒸馏水定容至500 mL。配制1 mol/L 的氢氧化钠溶液或6 mol/L 盐酸溶液,将pH 分别调节至3 和7,于4 ℃冰箱保存备用。
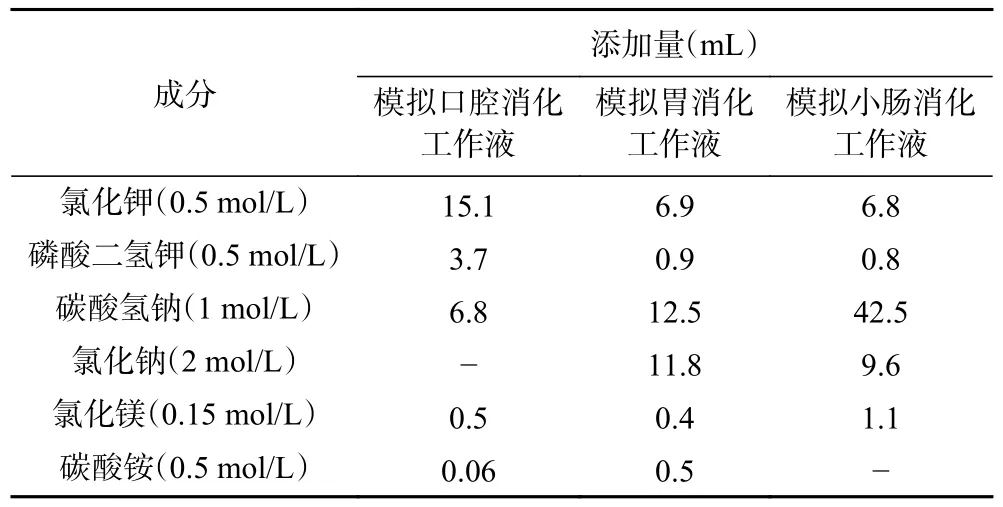
表1 模拟工作液的配制Table 1 Configuration of simulated working fluid
模拟口腔消化:1 g 余甘子原料冻干粉和等余甘子量(本实验的提取率为50%,即1 g 冻干粉可以提取出0.5 g 提取物,则称0.5 g 提取物为等余甘子量)的提取物于10 mL 的离心管中,分别加入4 mL 80%乙醇复溶,摇匀,使其充分混合,得到余甘子冻干粉及醇提物溶液。随后,向离心管中依次加入3.5 mL 的口腔模拟工作液、0.5 mL 的α-淀粉酶(1500 U/mL)和25 μL 氯化钙溶液(0.3 mol/L),蒸馏水定容至10 mL,混匀后置于恒温水浴摇床中,在31 ℃避光振荡5 min;结束后取上清液S1 置于4 ℃冰箱储存,进行相关测定,保留残渣进行下一步。
模拟胃消化:上一消化阶段结束后,向其消化残渣中加入1.6 mL 胃蛋白酶(25000 U/mL)、7.5 mL的胃模拟工作液以及5 μL 氯化钙溶液(0.3 mol/L)。调节pH 至3 后,蒸馏水定容至20 mL。混匀后置于恒温水浴摇床内,37 ℃避光振荡2 h,取上清液S2进行相关测定,置于4 ℃冰箱储存,保留残渣进行下一步。
模拟小肠消化:上一消化阶段结束后,向胃消化残渣中加入5 mL 胰蛋白酶(800 U/mL)、11 mL 小肠消化工作液、40 μL 氯化钙溶液(0.3 mol/L)和2.5 mL 猪胆盐溶液(160 mmol/L),调整pH 至7.0后,蒸馏水定容至40 mL。混匀后,置于恒温水浴摇床,37 ℃避光振荡2 h,取上清液S3 进行相关测定,置于4 ℃冰箱储存,保留残渣进行下一步。
模拟大肠消化:上一消化阶段结束后,向其消化残渣中继续加入20 mL 蒸馏水,用HCl(6 mol/ L)调节pH 至4.0 后,加入80 μL 纤维素酶,置于恒温水浴摇床,37 ℃避光振荡 16 h(过夜)后,使用离心机离心(8000 r/min,10 min),取上清液S 进行相关测定,置于4 ℃冰箱储存。
1.2.4 总酚含量的测定 总酚标准曲线绘制:参考王若兰等[27]的实验方法,使用福林酚法对样品中的总酚含量进行测定。通过测定不同浓度梯度下没食子酸标准品(0.001、0.003、0.0075、0.0125、0.0175 和0.02 mg/mL)的吸光度,绘制标准曲线。得到的标准曲线方程为y=15.49x+0.0565,R2=0.9987。
提取液中总酚含量的测定:按照上述总酚的检测方法,检测待测样品中的总酚含量,根据标准曲线计算样品中总多酚的没食子酸当量,总酚含量用mg GAE(没食子酸当量)/g 表示,计算公式如下:
式中:A 为没食子酸浓度(mg/mL);V 为测定后体积(mL);m 为样品质量(g)。
1.2.5 总黄酮含量的测定 总黄酮标准曲线的绘制:采用氯化铝-亚硝酸钠比色法测定。向300 μL 不同浓度梯度的芦丁标准溶液(0.005、0.01、0.02、0.04和0.06 mg/mL)中加入40 μL 的 25% NaNO2,反应6 min 后加入40 μL 10%的AlCl3·6H2O,反应6 min后加入500 μL(1 mol/L) NaOH 和1.12 mL 的80%乙醇,于波长510 nm 处测定吸光值。根据不同浓度梯度的芦丁标准溶液对应的吸光度绘制标准曲线,得到的标准曲线方程为y=1.1265x+0.0555,R2=0.9958。
提取液中总黄酮含量的测定:按上述总黄酮的检测方法,测定待测样品中总黄酮的含量。总黄酮量以芦丁当量计算,单位为mg RT/g。
1.2.6 DPPH 自由基清除能力测定 参考李文婷等[28]的实验方法,稍作修改。配制不同浓度的Trolox 标准溶液(10、50、100、200、300、400 和500 μmol /L),向96 孔板中加入100 μL 的DPPH 乙醇溶液(0.065 mmol/L)与20 μL 的Trolox 标准溶液,充分混匀,室温避光反应30 min 后,使用全波段酶标仪于517 nm测定其吸光度。以Trolox 标准溶液的浓度及对应的DPPH 自由基清除率绘制标准曲线。得到的标准曲线方程为y=213.8x-0.1029,R2=0.9932。
按照上述方法检测待测样品的DPPH 自由基清除率,以Trolox 为参考标准,结果表示为μmol 维生素E 当量(TE)/g。清除DPPH 自由基能力用以下公式计算:
式中:Ai为样品溶液加DPPH 试剂混合液的吸光度,Aj为样品溶液加乙醇的光度,A0为DPPH 溶液加样品溶剂的吸光度。
1.2.7 ABTS+自由基清除能力测定 参考李文婷等[28]的实验方法。以不同浓度Trolox 溶液(25、50、100、200、300、400 和500 μmol /L)及其相应的清除率绘制标准曲线,得到的标准曲线为y=144.89x+0.0207,R2=0.9993。样品溶液的ABTS+自由基清除能力以维生素E 为参考标准,结果表示为μmol TE/g。ABTS+自由基清除率计算用以下公式计算:
式中:An为样品溶液加ABTS 溶液的吸光度;Am为样品溶液加80%乙醇的吸光度;Al为ABTS溶液加样品溶剂的吸光度。
1.2.8 铁离子还原能力测定 参考李文婷等[28]的实验方法,稍作修改。向1.6 mL 冰乙酸中加入0.31 g醋酸钠,加入少量超纯水定容至100 mL,配制成试剂A;向0.0312 g 的TPTZ 中加入400 mmol/L 的盐酸定容至10 mL,配制成试剂B;向0.0541 g 六水合氯化铁中加入超纯水定容至10 mL,得到试剂C;按照A:B:C=10:1:1 的比例配制工作液。取1.8 mL上述工作液置于2 mL 的EP 管中,加入不同体积的样品(见表2)使工作液变色,再加入少量超纯水定容至2 mL,暗反应30 min 于波长593 nm 测定吸光度。根据不同浓度的Trolox 标准溶液对应的吸光度绘制标准曲线,得到的标准曲线方程为y=85.547x+0.2094,R2=0.9921。样品溶液的铁离子还原能力以维生素E 为参考标准,结果表示为μmol TE/g。
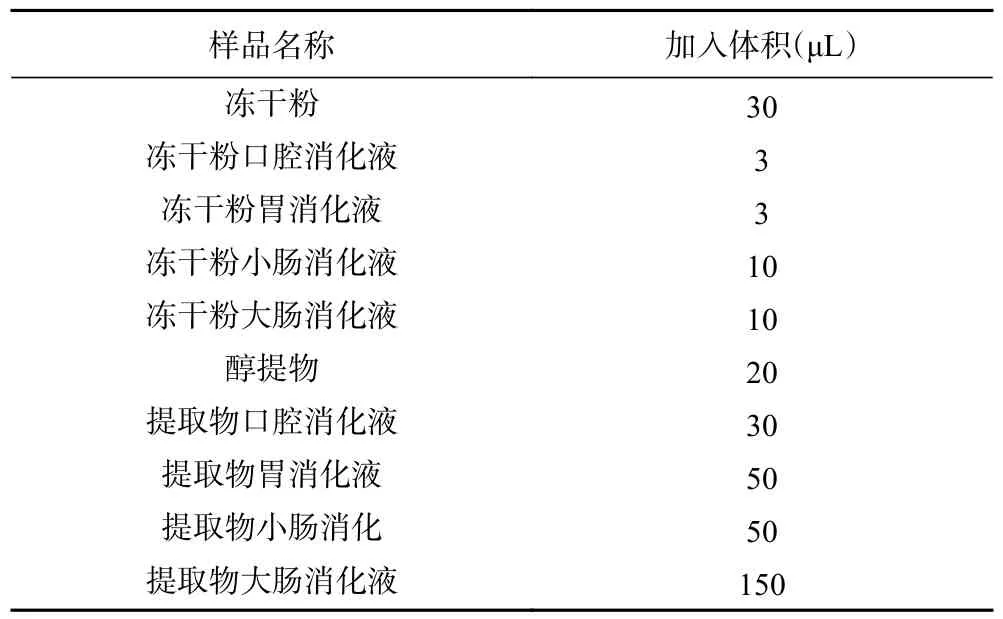
表2 FRAP 模型中加入样品的体积Table 2 Sample volume added on the FRAP model
1.3 数据处理
所有实验采用6 组平行,所得数据以平均值±标准差表示,用SPSS 17.0 软件进行统计分析,结果以±s 表示。通过单因素方差分析(ANOVA)进行显著性分析,P<0.05 为差异显著,并使用Pearson 法对多酚和黄酮含量与抗氧化能力进行相关性分析。使用GraphPad Prism 8 进行绘图。
2 结果与分析
2.1 余甘子果实成分分析
使用HPLC-QTOF-MS/MS 对余甘子冻干粉和醇提物样品的成分进行分析鉴定。得到的负离子模式下的一级总离子流图谱分别为图1 和图2。通过将母离子质荷比和特征碎片的离子信息与文献进行比对,结果见表3 和表4。余甘子冻干粉共鉴定出40 种成分,醇提物共鉴定出29 种成分,由鉴定出的结果可知,余甘子富含鞣质、酚酸类、黄酮类及黄烷醇类等多酚和黄酮类物质。

图1 负离子模式下余甘子冻干粉样品的总离子流图Fig.1 Primary total ion current spectrum of PE lyophilized powder sample in negative ion mode
图2 负离子模式下余甘子醇提物样品的总离子流图Fig.2 Primary total ion current spectrum of PE ethanol extracts sample in negative ion mode
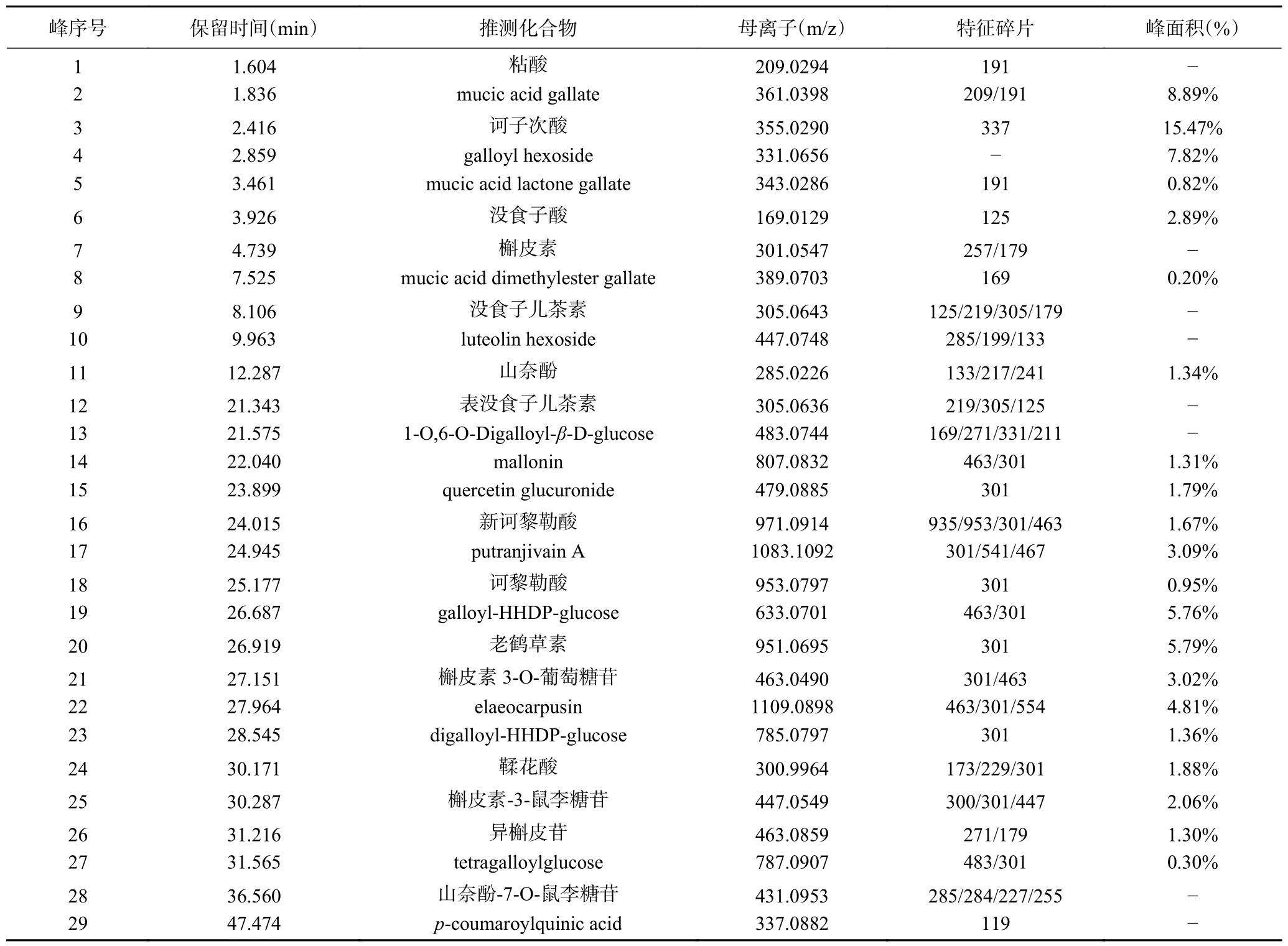
表4 HPLC-QTOF-MS/MS 鉴定出的余甘子醇提物样品中的化学成分Table 4 Compounds determined by HPLC-QTOF-MS/MS of PE ethanol extracts sample.
由图1 和表3 可知,余甘子冻干粉中既包括游离态的多酚,如没食子酸(峰10)、山奈酚(峰18)、鞣花酸(峰31)等;也包括结合态多酚,如粘酸衍生物(峰3、5、8)、槲皮素衍生物(峰37)等。根据相应的峰面积可知,冻干粉中的结合型酚酸的含量略高于游离型。由图2 和表4 可以看出,余甘子醇提物中的多酚主要为游离态多酚(峰3、6、22、26),结合型多酚较少,可能是由于结合型多酚很难被溶剂提取出来。总之,余甘子冻干粉中的结合型多酚要高于醇提物。
研究表明,结合态多酚可以被体内的消化酶和肠道微生物进一步分解利用,将其释放出来,从而提高健康效益[29],但是目前关于余甘子多酚的研究多停留在提取物的游离多酚的相关研究上,余甘子全水果的多酚含量和抗氧化能力或许被低估。因此,对比余甘子冻干粉和醇提物及两者消化前后的总酚总黄酮含量及其抗氧化能力的变化对更充分地利用余甘子的健康效益具有重要意义。
2.2 总酚和总黄酮含量
余甘子冻干粉和醇提物在体外模拟胃肠消化过程中的多酚和黄酮含量变化如表5 所示。由表5 中可知,消化前样品中的多酚含量最高,且冻干粉显著高于醇提物(P<0.05),这可能是由于醇提物仅提取出了游离型多酚,在提取过程中损失了结合型多酚。体外模拟消化过程中,两者的总酚含量均在口腔最高,大肠最低,这和王贵一等[30]的研究结论是一致的。口腔消化后,多酚含量显著降低,可能是因为酚类化合物直接和α-淀粉酶结合产生大分子聚合物,从而降低酚类化合物的含量[31]。但是在胃和小肠中,冻干粉胃的多酚含量要高于小肠,这可能是因为溶于溶剂的多酚多为游离酚,胃消化液的强酸环境和胃蛋白酶的存在可使残渣中的部分结合酚释放,但是肠液的碱性环境可能导致胃部释放的结合酚向其他物质转变,从而使小肠消化后的总酚含量低于胃消化液中的含量[17]。而醇提物小肠的多酚含量高于胃,这可能是由于和冻干粉醇溶液相比,醇提物的残渣在提取过程中被舍弃,缺少结合酚的释放,而小肠内的胆汁和胰酶可以增加多酚的释放[32],故胃消化液中的总酚含量低于小肠消化液中的含量。虽然在体外模拟消化过程中,余甘子冻干粉和醇提物多酚含量的变化趋势不一致,但在同一消化阶段,两者之间多酚的含量并无显著性差异。

表5 余甘子各样品中总酚和总黄酮含量Table 5 Total phenols and total flavonoids in each sample of PE.
对于消化前的样品来说,冻干粉中的黄酮含量要显著低于醇提物的含量(P<0.05),可能是醇提物采用的是超声辅助提取,提取时间较长,温度较高[33],且黄酮多为非极性类物质,经过超声空化效应可以促进总黄酮类物质的释放[34]。在整个体外模拟消化过程中,冻干粉的黄酮含量变化趋势为口腔>小肠>胃>大肠,醇提物的黄酮含量变化趋势为口腔>胃>小肠>大肠,这和两个样品消化过程中多酚含量的变化趋势不一致。胃消化液中,冻干粉中的黄酮含量要高于醇提物中的含量,可能是由于冻干粉的残渣中的结合型黄酮在胃酸和胃蛋白酶的作用下被分解释放[35]。而小肠中的胆汁和胰酶进一步促进结合型黄酮的释放,因此,冻干粉小肠中的黄酮含量要高于胃中的含量[36]。但是对于醇提物而言,其结合型黄酮较少,而黄酮类物质在弱碱性环境下不稳定,容易被降解,故其在小肠消化液中的黄酮含量要低于胃,这和Chen 等[37]的研究结果是一致的。
总之,由于余甘子冻干粉和醇提物中结合型、游离型多酚和黄酮含量的差异,以及体外模拟消化环境中的pH 和酶的种类的不同,导致两者在消化各阶段酚类物质的结合、释放、降解也有所不同,即两者在消化各阶段的总酚含量和总黄酮含量存在差异。因此,研究继续探索余甘子冻干粉和醇提物在消化前后抗氧化能力的变化是有必要的。
2.3 模拟体外消化过程中抗氧化能力分析
2.3.1 DPPH 自由基清除能力 根据标准曲线计算得出的不同样品的DPPH 自由基清除率如图3 所示。由图3 可以看出,消化前,余甘子冻干粉的DPPH自由基清除能力显著高于醇提物(P<0.05),可能是由于冻干粉的多酚含量更高。但体外模拟消化后,余甘子醇提物的DPPH 自由基清除能力更强,可能是由于在酚酸类物质中,含有三个邻位酚羟基的化合物DPPH 自由基清除能力明显强于其他化合物[38],本实验中醇提物的成分主要为游离型多酚如没食子酸(3,4,5-三羟基苯甲酸),其抗氧化能力远强于结合酚。在整个体外消化过程中,两者的DPPH 自由基清除能力的变化趋势是一致的,均为消化前>小肠>胃>口腔>大肠。但是两者的DPPH 自由基清除能力与总酚含量的变化趋势存在差异,尤其是在口腔和胃。胃的总酚含量高,但DPPH 自由基清除能力不一定强,这可能是因为强酸对该分析体系影响较大,可降低多酚对DPPH 自由基的清除能力[39]。
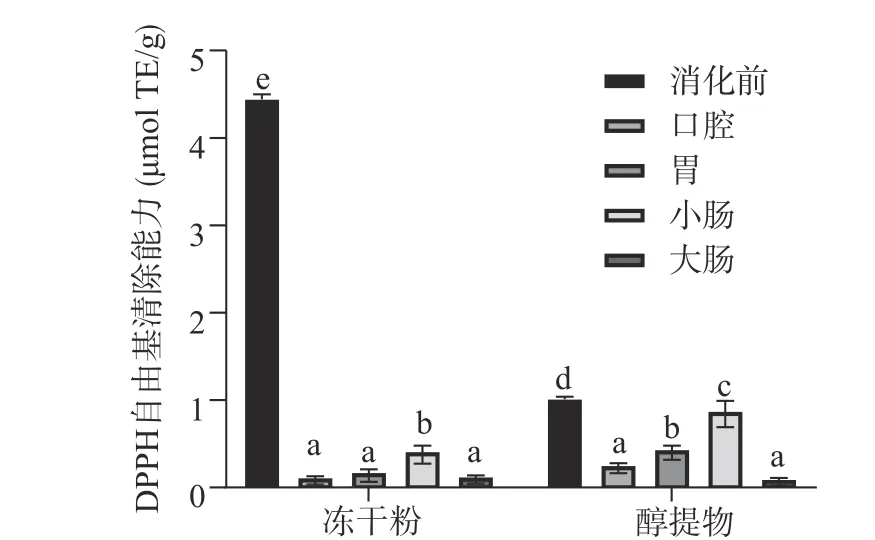
图3 DPPH 法测定体外消化过程中余甘子的抗氧化能力Fig.3 Antioxidant activity determined by DPPH assays of PE in vitro digestion
2.3.2 ABTS+自由基清除能力 根据标准曲线计算得出的不同样品的ABTS+自由基清除率如图4 所示。从图4 可以看出,消化前,余甘子冻干粉的ABTS+自由基清除能力显著高于醇提物(P<0.05)。消化后,两者的ABTS+自由基清除能力均显著降低(P<0.05),但其变化趋势存在差异,除了口腔,其余消化阶段的ABTS+自由基清除能力和总酚含量的变化趋势基本一致。其中,冻干粉在胃和小肠的ABTS+自由基清除能力较高,可能由于酸解和碱解均可显著提高结合酚的ABTS+自由基清除能力,且碱解(小肠)>酸解(胃)[28]。醇提物的ABTS+自由基清除能力在不同消化阶段没有显著性差异,但其变化趋势和总酚含量基本一致。消化后,冻干粉各阶段的ABTS+自由基清除能力均低于醇提物,可能是由于冻干粉各阶段的总酚含量均低于醇提物。
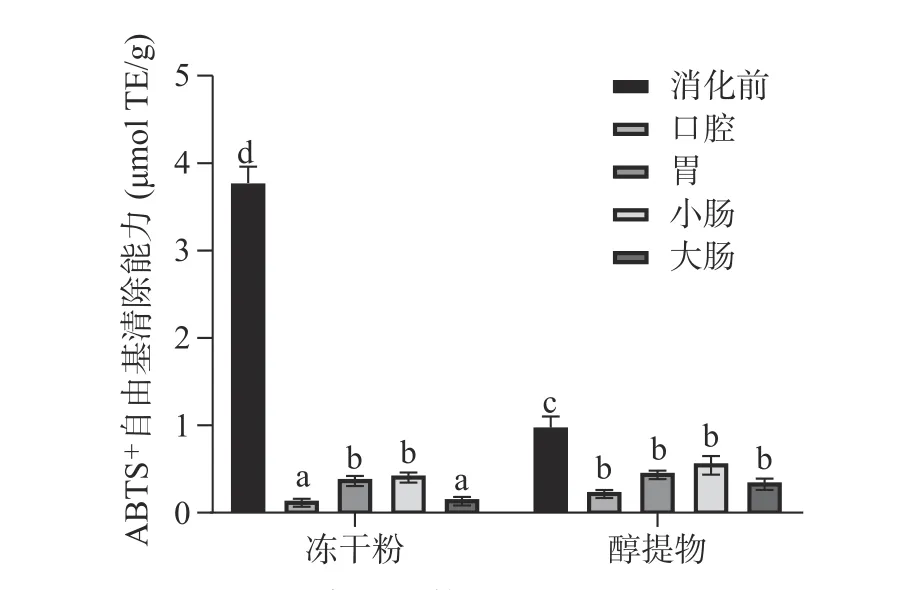
图4 ABTS 法测定余甘子体外消化过程中的抗氧化能力Fig.4 Antioxidant activity determined by ABTS assays of PE in vitro digestion
2.3.3 Fe3+还原能力 根据标准曲线计算得出的不同样品的Fe3+还原能力如图5 所示。从图5 中可以看出,不管是消化前还是消化后,冻干粉的Fe3+的还原能力基本显著高于醇提物(P<0.05)。和消化前相比,经体外消化后,两者的Fe3+的还原能力均显著降低(P<0.05),且除了冻干粉的口腔消化液,其余的Fe3+的还原能力均与总酚含量的变化趋势基本一致。即总酚含量越高,Fe3+的还原能力越强。
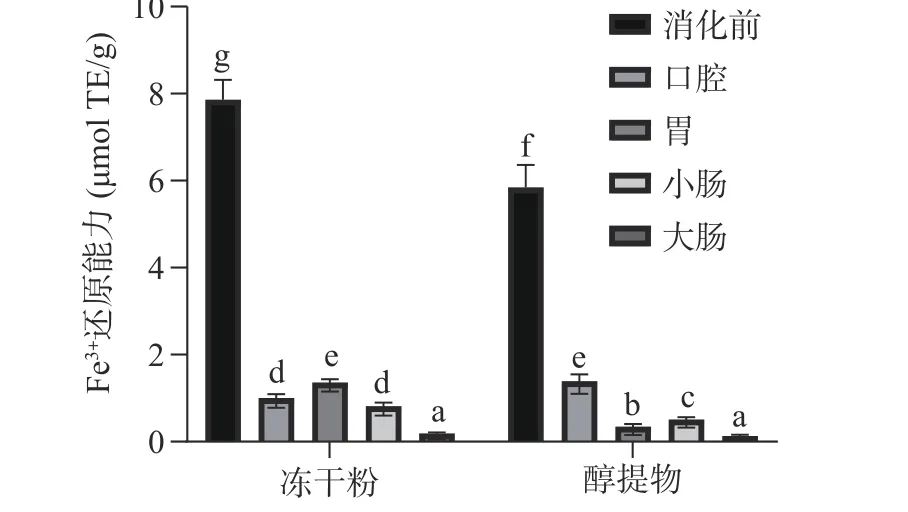
图5 FRAP 法测定体外消化过程中余甘子的抗氧化能力Fig.5 Antioxidant activity determined by FRAP assays of PE in vitro digestion
在以上三个抗氧化体系中,和消化前相比,消化后的抗氧化能力均显著降低。但消化后,在DPPH和ABTS 体系中,余甘子醇提物的抗氧化能力要高于冻干粉,但在FRAP 体系中,冻干粉的抗氧化能力较高,这可能是不同的抗氧化体系的原理不同导致的[31]。总体上,抗氧化能力和总酚含量的变化趋势基本一致,但在冻干粉的口腔消化液中,虽有较高的多酚含量,其在三个体系的抗氧化能力均较低,这和李滨旭[40]的研究结果相似,可能是因为冻干粉的结合型多酚未经提取,口腔消化后,细胞壁尚未被破坏,导致多酚和黄酮难以被释放出来,因此,抗氧化能力较弱。
2.4 总酚总黄酮含量与抗氧化能力之间的相关性
相关性分析是指对两个或多个具备相关性的变量元素进行分析,从而衡量两个变量因素的相关密切程度,相关系数的绝对值越大,表明因子之间的相关性越大。图6 为余甘子冻干粉和醇提物样品总酚总黄酮的含量与抗氧化能力之间的关系,颜色越深,表明相关系数越大。从图6 中可以看出,总酚含量和DPPH 自由基清除能力、ABTS+自由基清除能力以及Fe3+还原能力之间均呈现正相关,且相关性极显著(P<0.01),这和张灿等[41]的研究结果是一致的。总黄酮含量与抗氧化能力之间为负相关,但在α=0.05水平上相关性不显著。可能是因为黄酮类化合物是多酚的一种,消化过程中,黄酮含量在某些消化阶段增加,但相应阶段的多酚含量减少,抗氧化能力变弱,因此呈现出黄酮含量与抗氧化能力之间的负相关。
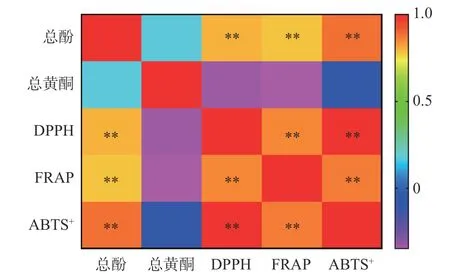
图6 总酚和总黄酮的含量与抗氧化能力的相关性分析Fig.6 Correlation analysis of the content of total phenols and total flavonoids with antioxidant capacity
总之,经过相关性分析可知,余甘子果实的抗氧化能力与其多酚类物质的含量呈现出显著的正相关。结合上述体外消化模型,模拟余甘子功能性成分和抗氧化能力在消化过程中的变化过程,可发现,通过适当的提取加工能够提高余甘子产品中游离型多酚的含量,有助于提升其抗氧化健康效益,从而为余甘子产品的开发提供理论基础,更好地发挥余甘子相关产品的健康价值。
3 结论
本研究通过体外模拟消化法对余甘子冻干粉和醇提物的活性成分及抗氧化能力进行了探究。结果发现,余甘子果实富含多酚和黄酮类物质,其中,冻干粉不仅富含游离型多酚,还富含结合型多酚,而醇提物的成分主要为游离型多酚。体外模拟消化前,冻干粉和醇提物的总酚含量分别为5.40±0.07 mg GAE/mL和3.65±0.05 mg GAE/mL。总黄酮含量分别为1.48±0.15 mg RT/mL 和14.80±0.74 mg RT/mL。和消化前相比,在消化过程中,两者的总酚含量均显著降低(P<0.05),但两者总黄酮的含量在口腔消化液中最高。消化酶和pH 可能是消化过程中影响总酚总黄酮含量的主要因素,强酸和消化酶可以促进结合型多酚的分解释放,而碱性环境又会导致结合酚向其他物质转变。结果还发现,消化前,余甘子醇提物对ABTS+、DPPH 自由基的清除能力和Fe3+还原能力都显著低于冻干粉(P<0.05),但消化后余甘子醇提物的抗氧化能力强于冻干粉。可能是由于醇提物中游离型多酚的抗氧化能力更强。最后,研究对总酚总黄酮含量与抗氧化能力的相关性分析表明,总酚含量与抗氧化能力之间存在显著的正相关性。综上,消化后,和余甘子冻干粉相比,醇提物的抗氧化能力更强。作为“食药同源”的食品的开发应用,经过适当的提取加工可使得余甘子产品可能会有更高的健康效益。
本研究基于体外消化模型,创新性地比较余甘子冻干粉与提物经体外口腔-胃肠道消化后的差异,旨在探究余甘子在此过程中活性成分和抗氧化能力的变化规律。本项目可将研究成果更好地应用于功能性食品开发;满足健康产业发展需求,为余甘子食品产品的设计提供新思路和新方法,为切实推动我国食品营养健康发展、落实《“健康中国2030”规划纲要》、促进国民营养健康需求提供科学依据。

