猪肉中2-(三氟甲基)吩噻嗪的Ic-ELISA检测
刘广兴,韩晓利,李昳晴,王庭欣
(河北大学 质量技术监督学院,计量仪器与系统国家地方联合工程研究中心,河北省能源计量与安全检测技术重点实验室(筹),河北 保定 071002)
2-(三氟甲基)吩噻嗪(2- (trifluoromethyl) phenothiazine,TFPTZ),又名三氟拉嗪主环,是一种人工合成的吩噻嗪类镇静剂,在常温下为淡黄色粉末,分子式为C13H8F3NS,相对分子质量为267.27,TFPTZ通常用于治疗精神疾病,也可作为三氟拉嗪、氟奋乃静的中间体.对动物具有镇静催眠、消除狂躁不安的作用.在饲料或饮用水中违法添加TFPTZ可以使禽畜快速增重、缩短出栏时间[1].在动物运输过程中使用TFPTZ还可以减少体重下降和防止肉品质降低,但残留在动物源食品中的TFPTZ及其代谢产物会对人的神经系统造成不良影响,严重危害消费者的身体健康.根据文献[2]要求,氯丙嗪、地西泮等仅允许治疗使用,动物源食品中不得检出.国际食品法典委员会、欧盟、澳大利亚等国家和组织均对镇静剂的最高限量值作出了规定.目前禽畜养殖行业中仍有一些不法分子使用TFPTZ获取利益,为确保动物源食品安全,亟需开发一种快速定量分析动物源食品中TFPTZ残留量的检测方法.
目前镇静剂类药物残留的检测通常采用色谱分析方法,如朱砾等[3]建立了反相高效液相色谱法测定血液中氯丙嗪的浓度,cerkvenik-flajs[4]建立了猪肾脏组织中哌氟苯丁酮残留的液相色谱检测方法,冯静等[5]建立了牛肉中16种镇静剂类药物残留检测的超高效液相色谱-串联质谱分析方法,谭贵良等[6]采用气相色谱-质谱法同时测定腊肠中7种镇静剂类药物残留.上述仪器检测方法虽然准确度较高,但对实验条件要求苛刻,样品处理也比较烦琐,不适合大量样本的快速筛查.基于抗原-抗体特异性反应的酶联免疫分析方法效率高、特异性好、成本低,已经被广泛应用于食品药品的快速检测[7].本研究设计合成了TFPTZ完全抗原,通过免疫新西兰大耳白兔获得了多克隆抗体,建立了快速检测猪肉中TFPTZ的间接竞争酶联免疫方法(Ic-ELISA),该方法操作简单、特异性好、灵敏度高,满足现行的镇静剂残留分析要求,为动物源性食品中的TFPTZ残留检测提供了一种新方法.
1 材料与方法
1.1 材料
新西兰大耳白兔(保定全友养兔厂);生鲜猪肉(保定惠友超市);2-(三氟甲基)吩噻嗪、氯丙嗪、美喹他嗪、奋乃静、甲硫达嗪、三氟拉嗪(分析纯,上海源叶生物科技有限公司);卵清蛋白(OVA)、牛血清白蛋白(BSA)(Sigma-Aldrich);酶标二抗(CW0103S)(康为世纪生物科技有限公司);对氨基苯甲酸、1,4-二氧六环、N,N-二甲基甲酰胺(分析纯,上海阿拉丁生化科技有限公司);亚硝酸钠、氯化钠、磷酸二氢钾、磷酸氢二钠、三乙胺、氯甲酸异丁酯(分析纯,天津汇杭化工科技有限公司);乙腈、甲醇(色谱纯,天津科密欧化学试剂有限公司).
1.2 仪器
Model 680酶标仪(Bio-Rad公司,美国);1260 Infinity Ⅱ高效液相色谱仪(安捷伦科技有限公司,美国);T6新世纪紫外可见分光光度计(北京普析通用仪器有限公司);FC5718R冷冻离心机(Chaus公司,德国);Molatom 18100纯水机(上海摩勒科学仪器).
1.3 方法
1.3.1 半抗原的合成
称取对氨基苯甲酸13.7 mg于10 mL离心管内,加1 mL超纯水,用1.2 mol/L的盐酸调节pH至2.0,冰浴10 min,振荡3 min使其溶解,缓慢滴加1 mol/L的亚硝酸钠溶液100 μL,溶液颜色由无色变为淡黄色,4 ℃静止30 min.加入26.73 mg TFPTZ,溶液由淡黄色变为深红色,25 ℃ 1 800 r/min振荡12 h,得到红褐色液体为半抗原(TFPTZ)[8],合成过程见图1.
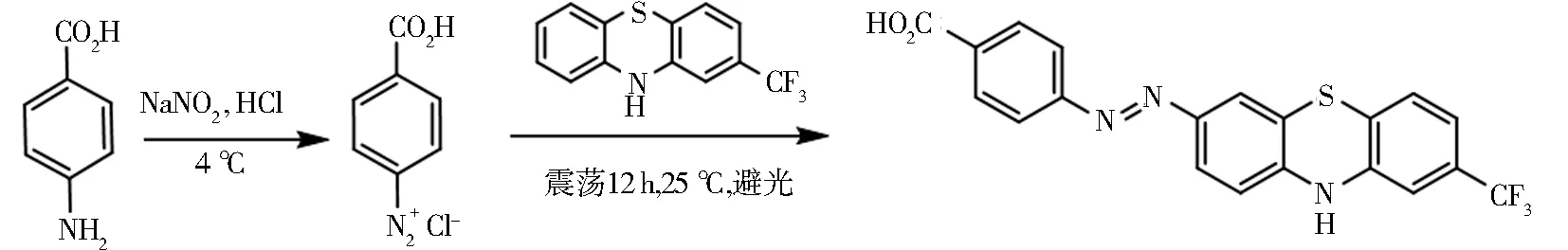
图1 半抗原合成路线Fig.1 Hapten synthesis route
1.3.2 完全抗原的合成与鉴定
溶液A:半抗原中加入1 mL 1,4-二氧六环和1 mLN,N-二甲基甲酰胺,振荡2 min,加入26.5 μL三乙胺,冰浴10 min,加入16 μL氯甲酸异丁酯,25 ℃振荡30 min.溶液B:量取2 mL 0.01 mol/L的硼酸盐溶液,加入12 mg OVA或BSA.将溶液A、B混合,4 ℃振荡12 h.将产物在0.01 mol/L的磷酸缓冲盐溶液(PBS)中透析72 h,每12 h更换1次PBS,透析完成后得到偶联产物[9](完全抗原),合成路线见图2.将偶联原料与偶联产物进行紫外吸收光谱扫描鉴定和聚丙烯酰胺凝胶电泳鉴定,-20 ℃下分装保存.
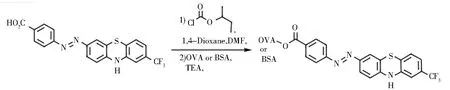
图2 完全抗原合成路线Fig.2 Complete antigen synthesis route
1.3.3 Ic-ELISA方法的建立
抗原包被:用包被液(0.01 mol/L碳酸盐缓冲溶液)将完全抗原稀释后包被到酶标板上,每孔150 μL,37 ℃ 孵育1 h,包被液倾出,每孔加入200 μL PBST洗液,静止1 min,倾去洗液,拍干,重复洗板3次.封闭:每孔加入150 μL封闭液,37 ℃ 孵育1 h,洗板3次.竞争反应:每孔加入75 μL用PBS稀释16 000倍的多克隆抗体和75 μL稀释后的TFPTZ标准品,37 ℃竞争反应1 h,倾去酶标板中的液体,洗板3次.每孔加入150 μL稀释2 000倍的酶标二抗,37 ℃ 孵育1 h,洗板3次[10].显色:每孔加入150 μL TMB单组分显色剂,37 ℃ 反应20 min.加入终止液(体积分数10% 硫酸)50 μL,上机测定OD450[11].
1.3.4 Ic-ELISA工作条件的优化
采用方阵法确定最佳的包被抗原质量浓度和多克隆抗体稀释倍数,再根据阴性孔OD450、半抑制浓度(IC50)和OD450/IC50分别对包被条件、封闭液、标准品稀释液和竞争反应时间进行优化[12],参照表1采取单一变量原则,按照1.3.3方法进行.

表1 优化项目及设定值
1.3.5 Ic-ELISA标准曲线的建立
按1.3.3优化条件,将TFPTZ标准品梯度稀释(10.00,5.00,2.50,1.00,0.50,0.25,0.10 μg/L),每个质量浓度重复3次.以OD450为纵坐标,以TFPTZ质量浓度的对数为横坐标绘制标准曲线,用Origin软件进行线性拟合,计算TFPTZ的IC50、线性范围(IC20~IC80)和最低检测限(IC10)[13].
1.3.6 方法特异性和稳定性评价
选择5种吩噻嗪类镇静剂进行交叉反应实验,分别绘制每种药品的标准曲线,得到5种药品的IC50并计算出与TFPTZ的交叉反应率[14]:
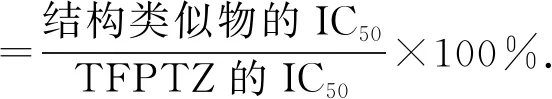
设置6个TFPTZ标准品质量浓度(1.0,2.5,5.0,10.0,20.0,40.0 μg/L),在不同的时间里进行6次完全相同的重复测定,计算变异系数,评价方法的稳定性.
1.3.7 实际样品检测及高效液相色谱(HPLC)验证
鲜猪肉去脂肪后做成肉糜,分别取20 g,加入4 mL不同质量浓度(5.0,12.5,25.0,50.0 ng/mL)的TFPTZ标准品,加入20 mL乙腈和0.5 mL质量分数40% 氢氧化钠溶液,振荡2 min,超声10 min,4 000 r/min离心5 min,吸取2 mL上清液,氮气吹干,用PBS稀释至1 mL,按步骤1.3.3将样品的检出值乘以稀释倍数,即为Ic-ELISA方法测得的猪肉样品中TFPTZ含量.HPLC验证在安捷伦1260系统上进行,选用安捷伦ZORBAX SB-C18分析色谱柱,流动相A为乙腈,流动相B为体积分数0.2%的甲酸水溶液,洗脱液体积比为9∶1,25 ℃下流速为0.2 mL/min,进样量为20 μL,检测器为二极管阵列检测器[15].
2 结果与分析
2.1 完全抗原的鉴定
TFPTZ、OVA和偶联产物(OVA-TFPTZ)的紫外吸收光谱如图3所示.由图3可知,OVA和TFPTZ的最大吸收峰分别在280 nm和322 nm,OVA-TFPTZ的最大吸收峰则出现在286 nm,而且在330 nm也存在吸收峰,其光谱曲线明显区别于TFPTZ和OVA.在聚丙烯酰胺凝胶电泳鉴定实验中,蛋白质的迁移速率取决于相对分子质量.如图4所示:偶联产物(BSA-TFPTZ)的移动距离小于BSA,且有明显的拖尾现象,推断BSA-TFPTZ分子质量比BSA大.由以上两点可以判定药物小分子与载体蛋白偶联成功.
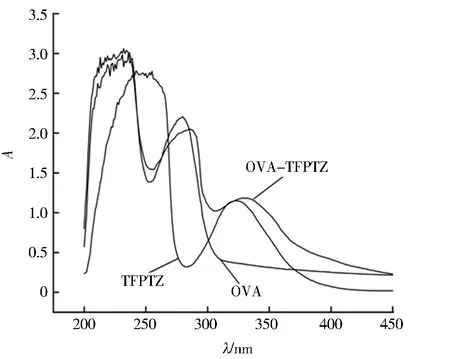
图3 OVA、TFPTZ、OVA-TFPTZ的紫外光谱Fig.3 UV spectrum of OVA、TFPTZ and OVA-TFPTZ
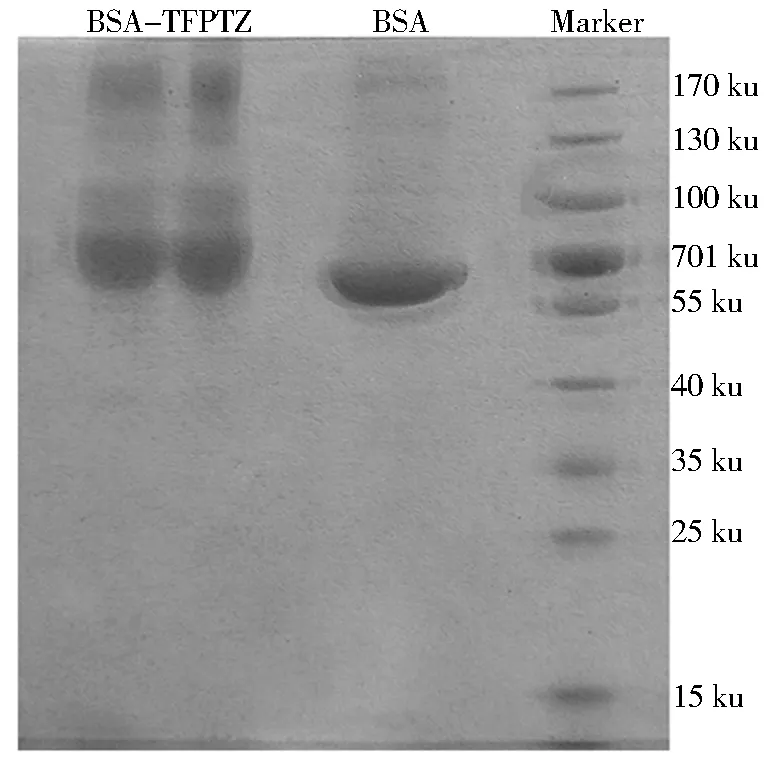
图4 BSA、BSA-TFPTZ的电泳图谱Fig.4 Electrophoretic map of BSA、BSA-TFPTZ
2.2 Ic-ELISA工作条件的优化
方阵法测定OD450结果见表2,由表2可知:当包被抗原质量浓度较低时,多克隆抗体稀释倍数变化对OD450影响不大,此时灵敏度不高.在保证实验性能和节约药品的原则下应选择OD450为0.994时所对应的包被抗原质量浓度和多克隆抗体稀释倍数,故最佳的包被抗原质量浓度为1.250 μg/mL,多克隆抗体稀释16 000倍.
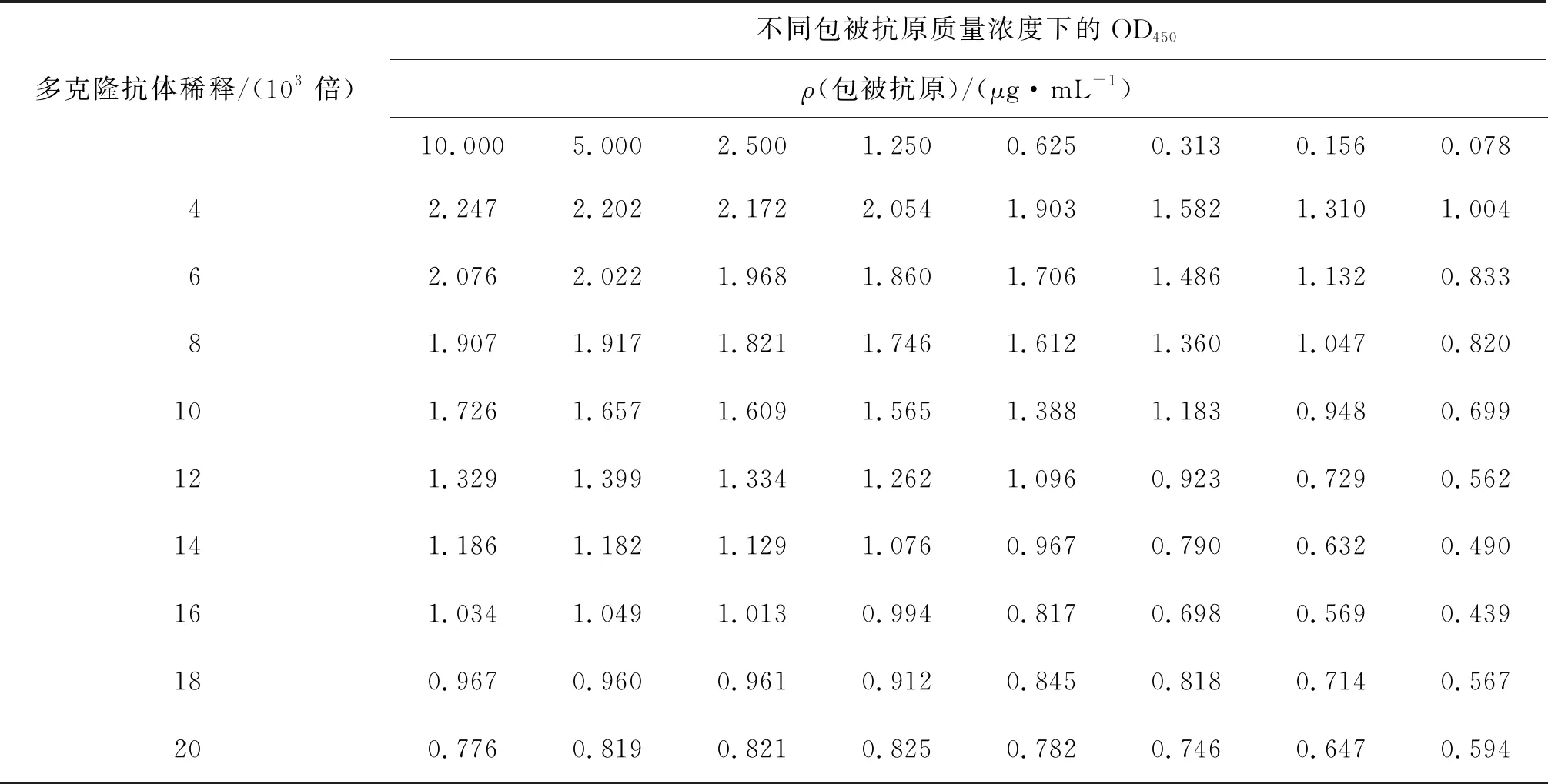
表2 方阵法测定结果
包被条件、封闭液(质量分数1%)、标准品稀释液和竞争时间的优化结果如图5~8所示,当IC50越小、OD450/IC50越大时灵敏度越高,方法的性能越好.故包被条件为37 ℃、3 h,封闭液为质量分数1%的BSA,标准品稀释液为含体积分数10% DMSO的PBS,竞争反应时间为60 min.
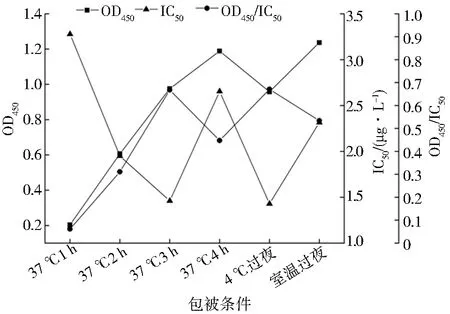
图5 不同包被条件的OD450、IC50和OD450/IC50Fig.5 OD450、IC50 and OD450/IC50 for different coating conditions
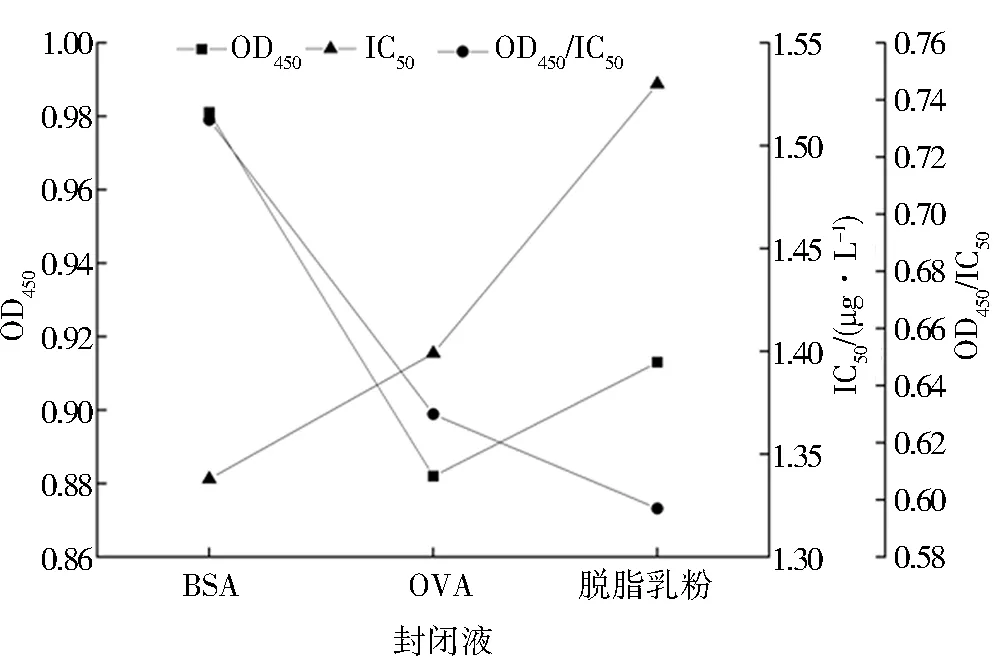
图6 不同封闭液的OD450、IC50和OD450/IC50Fig.6 OD450、IC50 and OD450/IC50 of different sealing fluids
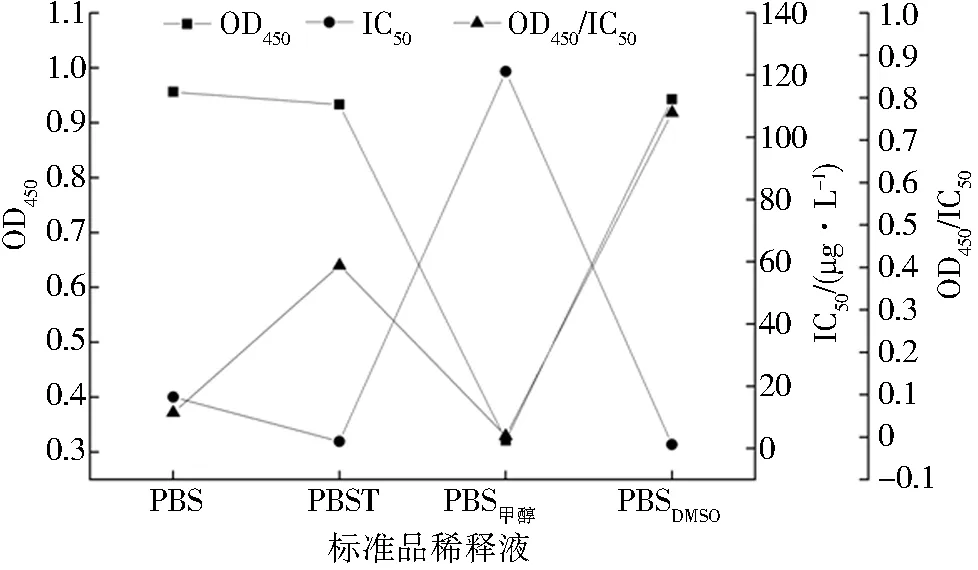
PBS甲醇和PBSDMSO分别表示含体积分数10%甲醇和体积分数10%DMSO的PBS图7 不同标准品稀释液的OD450、IC50和OD450/IC50Fig.7 OD450、IC50 and OD450/IC50 of different standard diluents
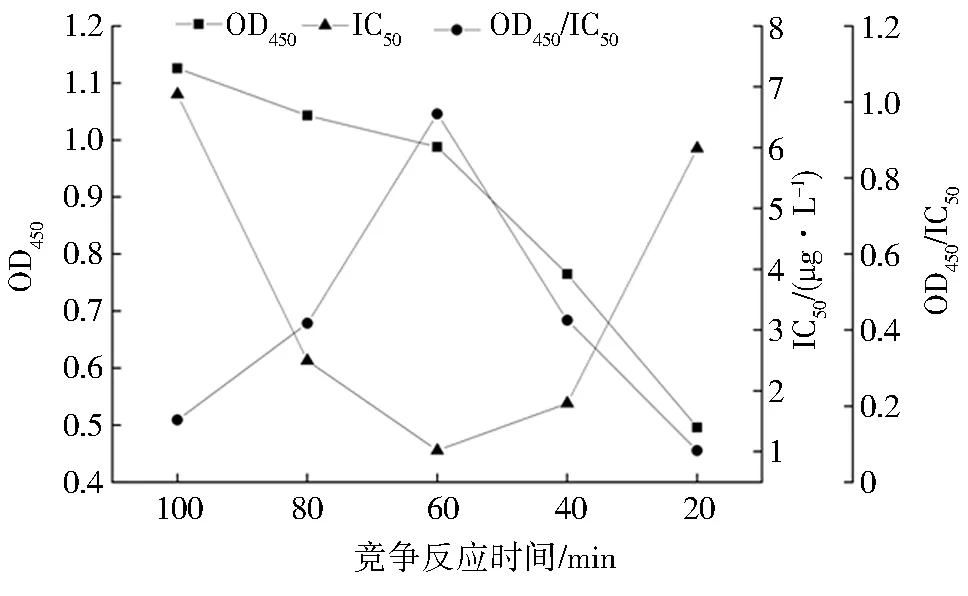
图8 不同竞争反应时间下的OD450、IC50和OD450/IC50Fig.8 OD450、IC50 and OD450/IC50 under different competitive response times
2.3 Ic-ELISA方法的建立
2.3.1 建立Ic-ELISA标准曲线
间接竞争ELISA标准曲线如图9,以lg[ρ(TFPTZ)/(μg·mL-1)]为自变量X,以OD450为因变量Y建立标准曲线的拟合方程Y=0.594 83-0.496 49X,相关系数R2为0.999 1,IC50为1.500 2 μg/L,IC10为0.284 1 μg/L,IC20~IC80为0.430 7~5.225 2 μg/L.
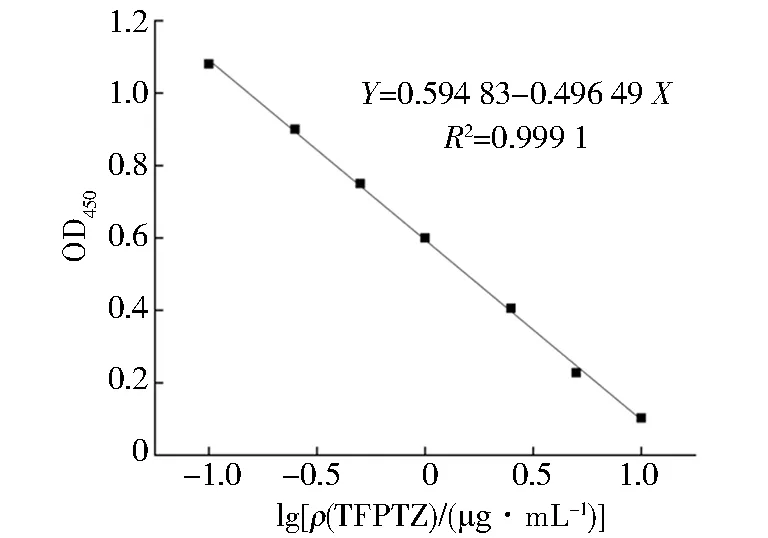
图9 间接竞争ELISA标准曲线Fig.9 Indirect competition ELISA standard curve
2.3.2 特异性和稳定性评价
多克隆抗体对5种吩噻嗪类镇静剂的交叉反应率如表3,与氯丙嗪的交叉反应率为1.20%,奋乃静为0.61%,其余3种药物的交叉反应率均小于0.1%,说明制备的多克隆抗体特异性强.稳定性测试结果如表4,批内变异系数为1.477%~5.679%,批间变异系数为2.573%~12.476%,显示本方法精密度良好.

表3 特异性评价
2.3.3 样品添加回收实验及HPLC验证
HPLC标准曲线如图10,以峰面积为纵坐标Y,以TFPTZ质量浓度为横坐标X,拟合方程为Y=79.722X-192.842,R2为0.994 7,可用于验证Ic-ELISA方法的准确性.Ic-ELISA法和HPLC法对猪肉中添加TFPTZ的回收率结果如表5, 2种方法检测结果的Pearson相关性分析为0.995 9,说明Ic-ELISA法与HPLC法的检测结果高度一致,建立的快速检测猪肉中TFPTZ的Ic-ELISA方法结果准确可靠.
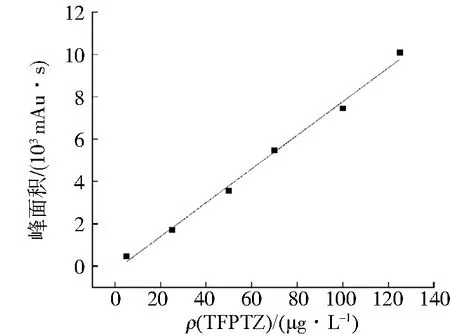
图10 HPLC标准曲线Fig.10 HPLC standard curve
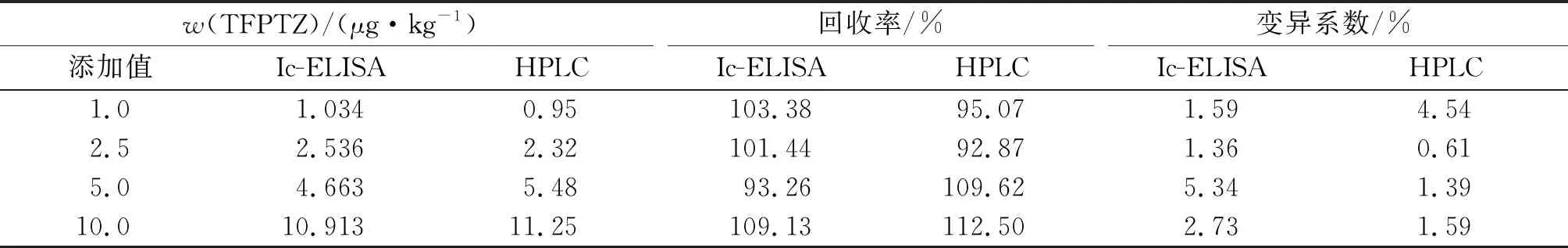
表5 猪肉中TFPTZ添加回收率
3 讨论
目前Ic-ELISA方法已成为兽药残留最理想的检测技术之一,而建立高灵敏Ic-ELISA方法的关键在于制备出效价高、特异性强的抗体.半抗原和完全抗原的设计及合成是关键的开端,影响小分子和载体蛋白偶联的因素有很多:小分子的结构、中间反应、活性基团的引入位置、连接臂的长度、载体的选择、连接的位置等[16].TFPTZ的分子质量小于10 ku,不具备免疫原性,也没有可以直接与载体蛋白连接的活性基团,因此TFPTZ修饰后才可以与载体蛋白偶联形成完全抗原,刺激动物产生免疫应答反应.遵循不产生新的抗原决定簇、性质稳定、能刺激机体产生足够抗体、简单易行的原则,TFPTZ的特征基团应尽可能地暴露在人工抗原的表面,免疫系统一般对远离载体端的结构识别能力较强[17].本研究采用偶氮苯甲酸法通过引入羧基作为连接臂的结合位点合成了免疫原和包被原,通过Ic-ELISA法测定多克隆抗体的效价达到了1∶16 000.
Ic-ELISA方法的性能受包被抗原质量浓度、多抗稀释倍数、标准品稀释液、竞争时间等多种因素的影响,优化反应条件是建立高灵敏度Ic-ELISA检测方法的重要一步.廖文彬[18]报道包被抗原质量浓度过高时会出现检测限变高的问题,包被抗原质量浓度过低时又会出现灵敏度下降的弊端,这与本研究方阵法的实验结果一致,在确保检测限和灵敏度都较好的情况下确定了包被抗原质量浓度为1.250 μg/mL,多克隆抗体稀释16 000倍.包被条件优化中发现37 ℃包被3 h与4 ℃包被过夜的效果几乎相同,但37 ℃包被3 h所需时间更少,适当提高温度可以加快抗原抗体的结合速率.标准品大多为有机化合物,标准品稀释液中通常会加入部分有机溶剂以增加其溶解度,这就导致标准品稀释液会直接影响标准品的溶解度、抗体活性以及实际样品的提取效率等,为了减少标准品稀释液的非特异性干扰,需要对标准品稀释液中的有机溶剂进行优化.目前常用的有机溶剂有甲醇、乙腈和乙酸乙酯等[19-20],本实验中甲醇的效果较差,有报道称甲醇会使抗体失活[21],导致竞争反应无法进行,DMSO的效果较好,推测是由于DMSO良好的助溶性和低毒性使得竞争反应达到最优.
本研究通过优化Ic-ELISA工作条件进而建立了定量分析猪肉中TFPTZ的Ic-ELISA方法.该方法的IC50为1.500 2 μg/L,线性范围为0.430 7~5.225 2 μg/L,最低检测限为0.284 1 μg/L.特异性测试中与其他结构类似物均无明显交叉反应,说明本方法发生假阳性,错检的概率较低.稳定性测试中批内变异系数小于6%,批间变异系数小于13%,由于样本差异、前处理方法、操作习惯等都会影响Ic-ELISA方法的稳定性[22],多数国家标准或行业标准中变异系数要求在15%以内即可满足实际检测要求.猪肉中添加TFPTZ标准品的回收率为93.26%~109.13%,变异系数小于6%,本方法与HPLC方法的检测结果高度一致.综上结果说明,本研究建立的Ic-ELSA方法准确度高,特异性好,检测限低,线性范围宽,适用于猪肉中TFPTZ残留的快速定量检测,同时也为开发其他药物残留检测方法提供了新的技术思路.

