T-2毒素降解菌株的筛选、鉴定与降解机制分析
马 妍,孙长坡,王 峻,杜 稳,刘虎军,周文化,赵一凡,*
(1.中南林业科技大学食品科学与工程学院,湖南 长沙 410004;2.国家粮食和物资储备局科学研究院,北京 100037)
T-2毒素是由拟枝孢镰刀菌、枝孢镰刀菌、三线镰刀菌等真菌产生的有毒次生代谢物[1],属于毒性最强的A类单端孢霉烯族毒素,主要污染燕麦、小麦、大麦、玉米等谷物和动物饲料[2],随之进入食物链对人畜的健康造成巨大危害。T-2毒素具有肝脏、消化、神经、免疫和生殖毒性,可引起动物和人体肝细胞水肿、胃肠道溃疡、脑膜出血、淋巴细胞坏死、妊娠率降低等症状[3-5]。由于T-2毒素的高毒性和污染广泛性,如何控制与消除T-2毒素的危害受到学者们越来越多的关注。
目前,T-2毒素的脱毒方法主要有物理、化学和生物法,前两者均能有效去除毒素,但存在损害营养物质,引入新杂质带来二次污染的局限性[6-7];生物法包括利用微生物产酶(或代谢物)降解毒素和吸附毒素两种方式,具有绿色、安全、专一、高效等优点,是近年来真菌毒素脱毒研究的热点。微生物吸附具有可逆性会导致毒素分子重新释放,限制其实际应用;微生物产生的酶可将毒素降解为其他低毒或无毒的产物,应用前景广阔,因此国内外学者对T-2毒素降解微生物展开了广泛研究。向雨珂[8]从土壤中利用96 孔板高通量筛选出6 株T-2毒素脱毒菌株,通过质谱对其中1 株氧化微杆菌(Microbacterium oxydans)的代谢产物进行了分析与推导;吴娱[9]以苯基环氧乙烷为底物筛选到1 株黑曲霉(Aspergillus niger),通过小鼠实验证明了该菌株分泌的胞外酶能将T-2毒素降解为毒性较低的物质;Fuchs[10]和Gao Xiaojuan[11]等从瘤胃液中分离的真杆菌(Eubacteriumsp.)BBSH797使T-2毒素部分降解为HT-2,并且能将T-2毒素的代谢产物(HT-2、T-2三醇、T-2四醇等)转化为其脱环氧形式,该菌株是目前唯一一株被批量生产的脱毒菌剂。现有研究主要集中于T-2毒素降解微生物的筛选、降解效果的表征以及降解产物的推导上,对降解机制的分析还有所欠缺,且菌株降解性能不稳定、易退化等问题限制了大规模应用,生物降解T-2毒素的菌种资源仍然较为匮乏。
本研究从小麦样品中分离筛选对T-2毒素具有降解性能的微生物,并进行菌种鉴定与降解特性研究,利用超高效液相色谱-四极杆飞行时间质谱(ultra-high performance liquid chromatography-quadrupole time-offlight mass spectrometry,UPLC-Q-TOF-MS)仪分析2 株菌单独和共同降解T-2毒素产生的代谢产物,从而分析其降解机制,以期降低谷物中T-2毒素的含量,为保障粮油食品和饲料质量安全奠定基础。
1 材料与方法
1.1 材料与试剂
小麦样品来源于安徽淮北、安庆等地区(2020年)。
甲醇、乙腈(均为色谱级)美国Thermo Fisher公司;T-2毒素、HT-2毒素、T-2三醇、新茄镰孢菌醇(neosolaniol,NEO)标准品 北京Pribolab科技有限公司。
LB肉汤培养基:胰蛋白胨10 g/L,酵母提取物5 g/L,氯化钠10 g/L,固体培养基加20 g/L琼脂;基础盐培养基(minimal salt medium,MSM):硫酸铵0.5 g/L,七水硫酸镁0.2 g/L,磷酸氢二钠2.44 g/L,磷酸二氢钾1.52 g/L,最后加氯化钙0.05 g/L,pH 6.8;磷酸盐缓冲液(phosphate buffer saline,PBS):氯化钠8 g/L,氯化钾0.2 g/L,十二水磷酸二氢钠3.63 g/L,磷酸二氢钾0.24 g/L,pH 7.4。
1.2 仪器与设备
Evolution 300紫外-可见分光光度计 美国Thermo Fisher公司;e2695型高效液相色谱(high performance liquid chromatography,HPLC)仪、2475型荧光检测器、XBridge C18色谱柱(250 mm×4.6 mm,5 μm)美国Waters公司;UPLC-Q-TOF-MS仪 美国Agilent公司;VCX-130超声波破碎仪 美国Sonics公司;真空离心浓缩仪 美国Labconco公司;C1000 Touch聚合酶链式反应(polymerase chain reaction,PCR)仪 美国Bio-Rad公司。
1.3 方法
1.3.1 T-2毒素脱毒菌株筛选
初筛:取10 g小麦样品与20 mL生理盐水混匀,静置后取上清液50 μL与MSM(含3 μg/mL T-2毒素)于37 ℃、200 r/min条件下培养7 d,HPLC检测T-2毒素残留量;具有降解效果的样品梯度稀释后涂布到LB固体培养基上,连续划线纯化至长出单菌落;挑取单菌落接种于MSM(含3 μg/mL T-2毒素),37 ℃、200 r/min条件下培养 5~7 d,HPLC检测T-2毒素残留量,脱除率大于90%的样品进行复筛。
复筛:将初筛菌株单菌落接种于LB液体培养基,于37 ℃、200 r/min条件下培养12~24 h,收集菌液于5 000 r/min离心5 min,菌体用MSM培养基洗涤2 次后重悬,菌悬液接种于MSM中(含3 μg/mL T-2毒素),37 ℃、200 r/min振荡培养5~7 d,HPLC检测T-2毒素残留量。重复进行多次复筛,以验证菌株对T-2毒素脱除效果的稳定性。
1.3.2 T-2毒素脱毒菌株鉴定
形态鉴定:将获得的菌株划线于LB固体平板上,37 ℃恒温培养12~48 h,观察菌落形态;挑取单菌落接种于LB液体培养基中,37 ℃、200 r/min培养24 h,取适量菌液用草酸铵结晶紫溶液染色,在光学显微镜下观察菌体特征。
分子鉴定:挑取少量单菌落作为16 SrDNA扩增的PCR 模板。引物采用细菌通用引物:27 F(5’-AGAGTTTGATCTGGCTCAG-3’)、1492R(5’-GGTTACCTTGTTACGACTT-3’)。PCR扩增体系(25 μL):上下游引物各0.5 μL,TaqDNA聚合酶12.5 μL,无菌水11 μL。PCR扩增程序:94 ℃预变性10 min;95 ℃变性60 s,55 ℃退火30 s,72 ℃延伸90 s,30 个循环;72 ℃延伸10 min。PCR产物送至生工生物工程(上海)股份有限公司测序,16S rDNA基因序列通过BLAST程序与GenBank中核酸数据比对进行同源性分析,采用MEGA7.0软件中的Neighbor-joining法构建系统发育树。
1.3.3 脱毒曲线测定
参考Zhai Yaoyao等[12]的方法并适当修改。挑取单菌落接种于LB液体培养基进行发酵培养,收集发酵菌液于5 000 r/min离心5 min,菌体用PBS洗涤2 次后重悬,以初始OD600nm值0.1接种于LB液体培养基中(一组含5 μg/mL T-2毒素,一组无T-2毒素),于37 ℃、200 r/min条件下振荡培养。每间隔2 h取样,测定其OD600nm值并用HPLC检测T-2毒素残留量。
1.3.4 吸附作用分析与降解活性物质定位
参考Chen Yong等[13]的方法。收集两份发酵菌液,一份直接于5 000 r/min离心5 min,另一份121 ℃高压灭活20 min后再离心,两组菌体均用新的LB液体培养基重悬,菌悬液分别与5 μg/mL T-2毒素于37 ℃、200 r/min条件下共培养,含T-2毒素的LB液体培养基作为空白对照,HPLC检测T-2毒素残留量。
上述活细胞组将T-2毒素完全消除的时间点,收集剩余反应体系于5 000 r/min离心5 min,上清液过0.22 μm无菌滤膜即为胞外上清液;菌体用等体积PBS洗涤2 次后重悬,菌悬液通过超声破碎仪进行细胞破碎,4 ℃、12 000 r/min离心10 min,上清液过0.22 μm无菌滤膜为细胞内容物;将它们分别与5 μg/mL T-2毒素于37 ℃、200 r/min条件下培养2 h,含T-2毒素的PBS作为空白对照,HPLC检测T-2毒素残留量。
1.3.5 灭活与抑制剂对细胞内容物降解T-2毒素的影响
参考Zhang Jing等[14]的方法。将上述获得的细胞内容物作如下处理:1)与1 mg/mL蛋白酶K、1%十二烷基硫酸钠(sodium dodecyl sulfate,SDS)于55 ℃金属浴中反应1 h;2)与1 mmol/L乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、1 mmol/L苯甲基磺酰氟(phenyl methane sulfonyl fluoride,PMSF)于37 ℃金属浴中反应1 h;3)121 ℃高压灭活30 min。取上述反应液分别与5 μg/mL T-2毒素于37 ℃、200 r/min条件下培养2 h,含T-2毒素的PBS作为空白对照,HPLC检测T-2毒素残留量。
1.3.6 菌株AFJ-2和AFJ-3降解T-2毒素产物分析
粗酶液制备:收集发酵菌液于5 000 r/min离心5 min,菌体用PBS洗涤2 次后重悬,超声波破碎仪对菌悬液进行破碎,12 000 r/min、4 ℃离心10 min,上清液过0.22 μm无菌滤膜得到胞内粗酶液。
酶反应:1)AFJ-2和AFJ-3粗酶液分别与T-2毒素共培养;2)AFJ-2和AFJ-3粗酶液1∶1混匀后再与T-2毒素共培养;3)AFJ-2(AFJ-3)粗酶液先与T-2毒素共培养,在T-2毒素完全降解的时间点加入AFJ-3(AFJ-2)粗酶液,同时以加入等体积PBS作为对照。上述反应均以不加酶液含T-2毒素的PBS作为空白对照,T-2毒素终质量浓度为10 μg/mL,37 ℃、200 r/min条件下振荡培养,不同时间取样,质谱检测T-2毒素含量与产物生成。
1.3.7 T-2毒素检测
1.3.7.1 HPLC
参照GB 5009.118—2016《食品中T-2毒素的测定》。样品前处理:待测样品于12 000 r/min离心10 min,取100 μL上清液,当培养基为MSM或PBS时,加入等体积甲醇混匀,取出100 μL于真空离心浓缩仪中蒸干,衍生,HPLC检测;当培养基为LB时,加入等体积乙酸乙酯混匀,7 000 r/min离心5 min收集上清液,重复萃取3 次,合并上清液,于真空离心浓缩仪中蒸干,衍生,HPLC检测。
T-2毒素标准曲线:以T-2毒素质量浓度(1~5 μg/mL)为横坐标,相对应的峰面积为纵坐标,绘制标准曲线,得到一元回归线性方程y=5×106x-120 373,R2=0.999 2,T-2毒素质量浓度与峰面积的线性关系良好。T-2毒素降解率计算公式如下:
1.3.7.2 UPLC-Q-TOF-MS
色谱条件:色谱柱为Agilent Poreshell 120 EC-C18柱(2.1 mm×100 mm,2.7 μm);流动相A为0.1%甲酸-5 mmol/L甲酸铵,流动相B为甲醇-0.1%甲酸;流动相梯度洗脱程序:0~1 min,0%~90% A、100%~10% B;1~1.5 min,90%~55% A、10%~45% B;1.5~8.5 min,55%~0% A、45%~100% B;8.5~9.5 min,维持0% A、100% B;9.5~10 min,0%~90% A、100%~10% B。流速0.3 mL/min;柱温30 ℃;上样量3 μL;Post Run 2 min。
质谱条件:电喷雾离子源;正离子扫描;雾化气压力40 psi;干燥气流速5 L/min;干燥气温度300 ℃;锥孔电压65 V;碎裂电压175 V;帽电压4 000 V;质量扫描范围m/z100~1 200(MS)、30~1 000(MS/MS);采集速率2 spectra/s(MS)、3 spectra/s(MS/MS);碰撞能量范围10~40 eV。
样品前处理:取待测样品(12 000 r/min离心10 min上清液)100 μL加等体积甲醇混匀,质谱检测。
1.4 数据处理
2 结果与分析
2.1 T-2毒素脱毒菌株筛选
从50 份小麦样品中筛选出30 份对T-2毒素具有脱毒效果的样品,分离纯化得到48 种单菌落,其中10 株菌对T-2毒素的脱除率大于90%,对其进行多轮复筛后,获得2 株脱毒效率高且稳定的菌株AFJ-2和AFJ-3,复筛结果如表1所示。
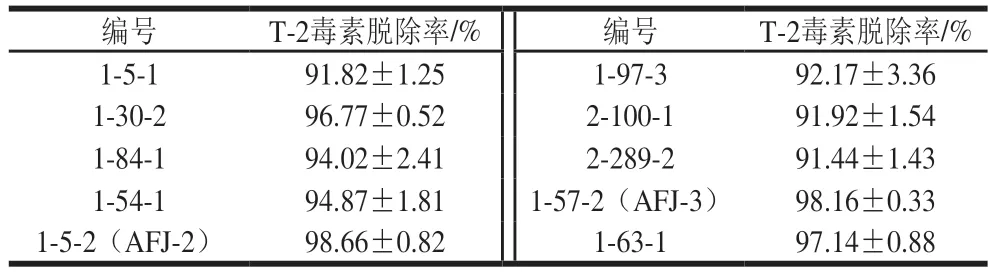
表1 T-2毒素脱毒菌株复筛结果Table 1 Secondary screening results of T-2 toxin-degrading strains
2.2 T-2毒素脱毒菌株鉴定
菌株AFJ-2和AFJ-3经16S rDNA初步鉴为短小杆菌属(Curtobacteriumsp.)和芽孢杆菌属(Bacillussp.)菌株。菌株AFJ-2在LB上呈较小的黄色圆形,菌落不透明,边缘不整齐,显微镜下呈现短杆状,单个或成对排列;菌株AFJ-3在LB上呈光滑的乳白色圆形,形状较大,菌落不透明,边缘光滑,显微镜下呈现粗大杆状,单个或短链排列。AFJ-2和AFJ-3的形态学和系统发育特征如图1所示。
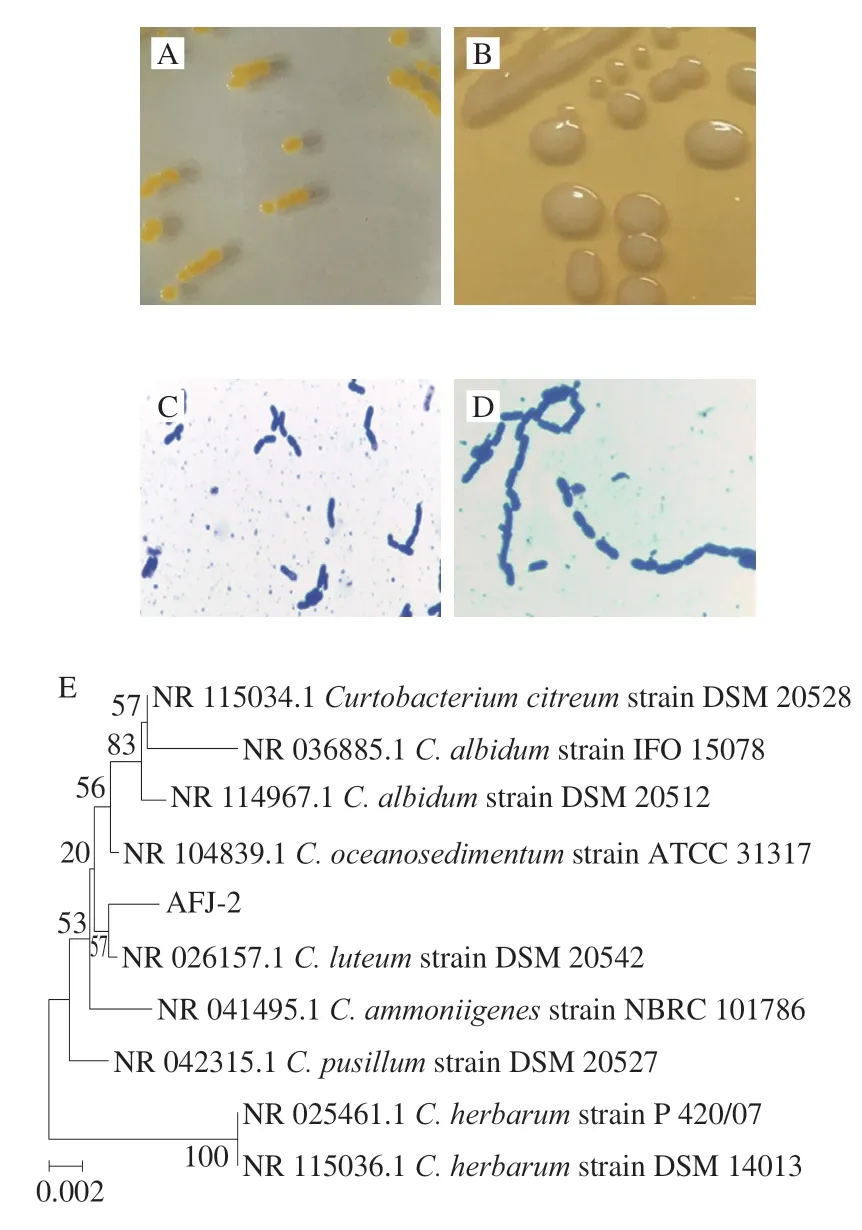
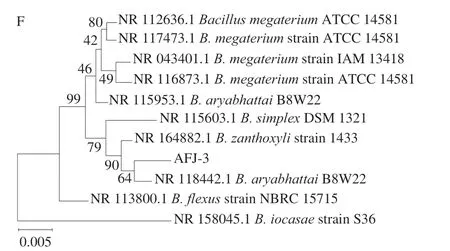
图1 菌株AFJ-2和AFJ-3的形态学和系统发育特征Fig.1 Morphological and phylogenetic characteristics of strains AFJ-2 and AFJ-3
2.3 菌株AFJ-2和AFJ-3对T-2毒素的降解特性
2.3.1 脱毒曲线
以初始OD600nm=0.1将菌株AFJ-2和AFJ-3接种至含(无)T-2毒素的LB培养基中,观察2 株菌的生长状况、T-2毒素的脱毒过程以及T-2毒素对菌株生长的抑制效果。如图2所示,菌株AFJ-2和AFJ-3分别在2~12 h和6~14 h内呈对数生长,T-2毒素质量浓度随着菌体密度快速增加而迅速减少,分别在7 h和12 h将5 μg/mL T-2毒素完全消耗,因此2 株菌对T-2毒素的脱除效率较高,而在12 h和14 h菌株生长才进入稳定期,说明菌株优先利用T-2毒素作为碳源以供生长需要。AFJ-2的生长未受T-2毒素毒性作用的影响,但AFJ-3的生长受到明显抑制,故其脱毒效率低于AFJ-2。T-2毒素可通过抑制微生物细胞蛋白质、RNA和DNA的合成,从而影响菌体生长繁殖[15]。
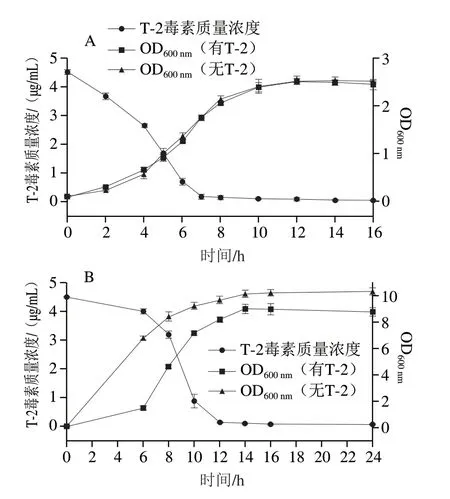
图2 菌株AFJ-2(A)和AFJ-3(B)脱毒曲线Fig.2 Time courses of T-2 toxin degradation by strains AFJ-2 (A) and AFJ-3 (B)
2.3.2 菌株AFJ-2和AFJ-3对T-2毒素的吸附作用
将2 株菌菌体的活细胞与灭活细胞与T-2毒素共培养,观察其对T-2毒素的降解与吸附能力。由图3可知,当菌株AFJ-2和AFJ-3的活细胞与T-2毒素反应时,T-2毒素质量浓度随着培养时间延长逐渐降低,分别在2 h和12 h内将T-2毒素从5 μg/mL降至0.16 μg/mL和0.11 μg/mL,而灭活细胞对T-2毒素不产生任何作用。因此2 株菌对T-2毒素的脱除均属于生物降解,且不存在吸附作用。

图3 菌株AFJ-2(A)和AFJ-3(B)对T-2毒素的吸附Fig.3 Adsorption efficiency of T-2 toxin by strains AFJ-2 (A) and AFJ-3 (B)
2.3.3 T-2毒素降解活性物质定位
为了进一步确定2 株菌降解T-2毒素的活性物质位于胞内或胞外,将胞外上清液和细胞内容物与T-2毒素反应2 h后检测T-2毒素含量,结果如图4所示,菌株AFJ-2和AFJ-3的胞外上清液对T-2毒素几乎不降解,而细胞内容物在2 h内分别使T-2毒素质量浓度从5 μg/mL减少至0.24 μg/mL和1.16 μg/mL,反应效率极高。因此,2 株菌降解T-2毒素的活性物质均位于胞内,并且很可能是一种或多种酶。
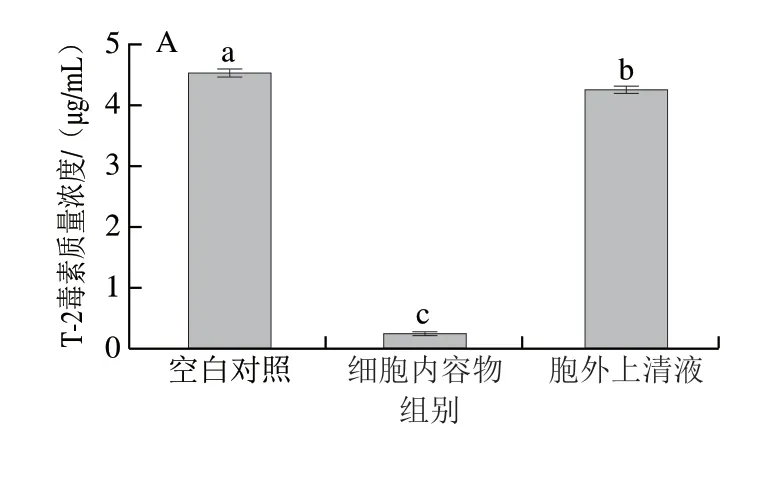
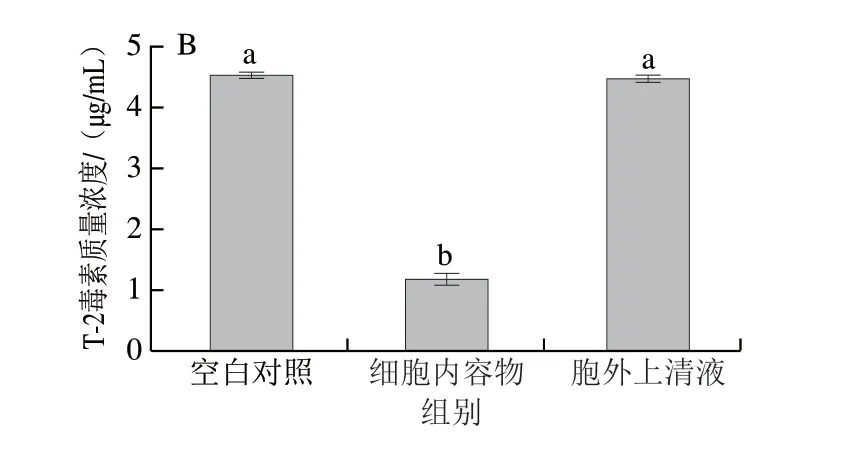
图4 菌株AFJ-2(A)和AFJ-3(B)降解活性物质定位Fig.4 Localization of T-2 toxin-degrading substance in strains AFJ-2 (A) and AFJ-3 (B)
2.3.4 灭活与抑制剂对细胞内容物降解T-2毒素的影响
灭活、蛋白酶K、SDS和PMSF均能破坏蛋白质的结构使酶变性失活,通过上述处理后的细胞内容物与T-2毒素反应2 h后,测定其含量并计算降解率,结果如图5所示,2 株菌的细胞内容物对T-2毒素的降解均受到显著抑制(P<0.05),由此证明的确是酶发挥了作用,且PMSF的显著抑制效果说明T-2毒素降解酶系统中含有丝氨酸基团[16]。而EDTA仅表现出轻微抑制效果,可能是浓度偏低或反应时间较短的原因,已有研究[17-19]使用的EDTA浓度均超过10 mmol/L,向雨珂等[20]使用1 mmol/L EDTA处理胞外上清液,需反应24 h才观察到上清液对T-2毒素降解的抑制作用。

图5 灭活与抑制剂对AFJ-2(A)和AFJ-3(B)细胞内容物降解T-2毒素的影响Fig.5 Effect of inactivators and inhibitors on the degradation of T-2 toxin by cellular contents of AFJ-2 (A) and AFJ-3 (B)
2.4 T-2毒素降解产物分析
2.4.1 菌株AFJ-2降解T-2毒素产物分析
采用UPLC-Q-TOF-MS分析菌株AFJ-2降解T-2毒素的产物,总离子流图如图6A~D所示,T-2毒素(保留时间(retention time,tr)=7.1 min)随时间递增而减少,4 h即被完全降解,未知峰a(tr=6.5 min)先大量增加后略微减少,未知峰b(tr=5.8 min)在反应后期缓慢增加,因此二者均为T-2毒素转化的产物。
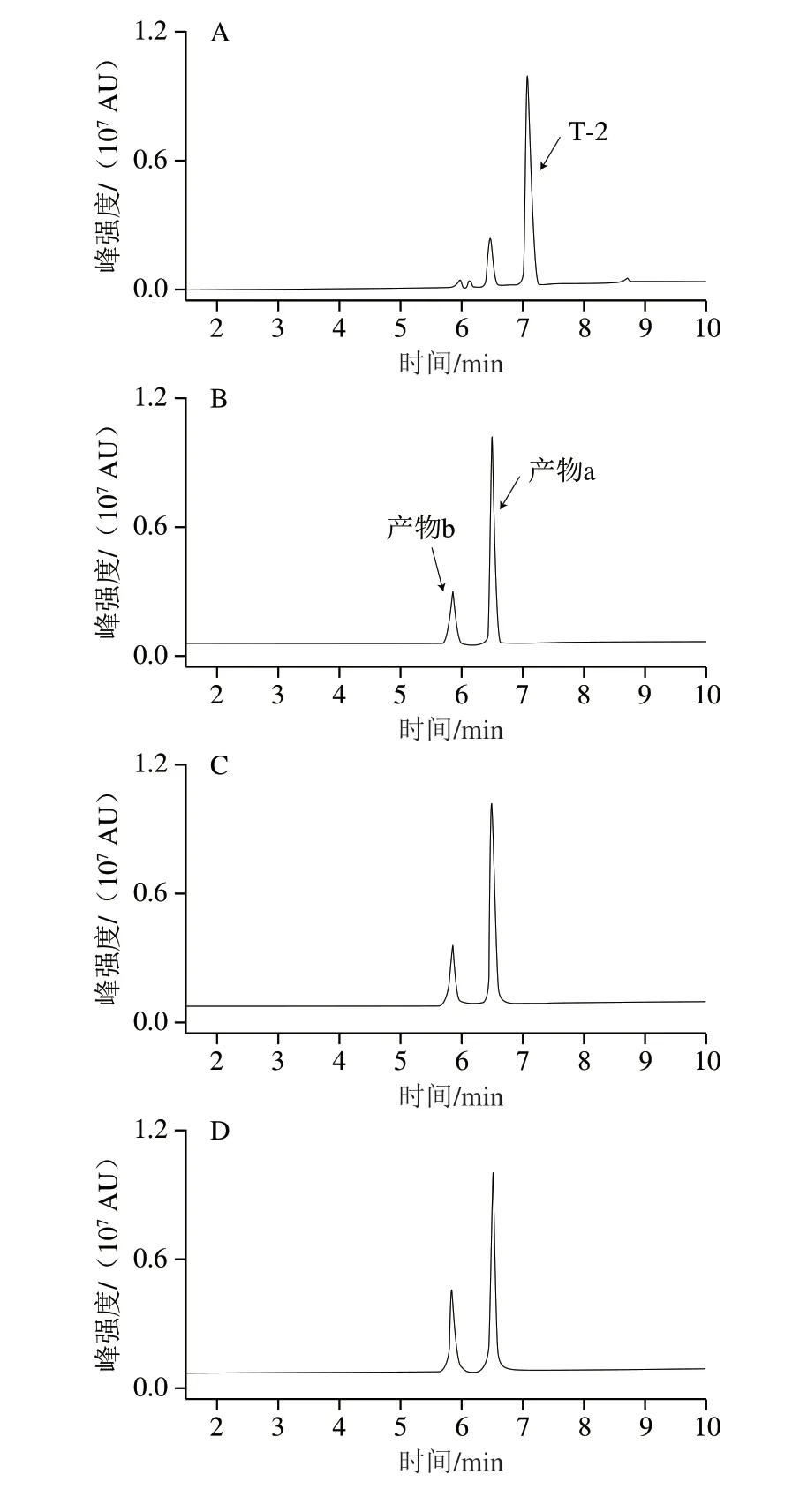
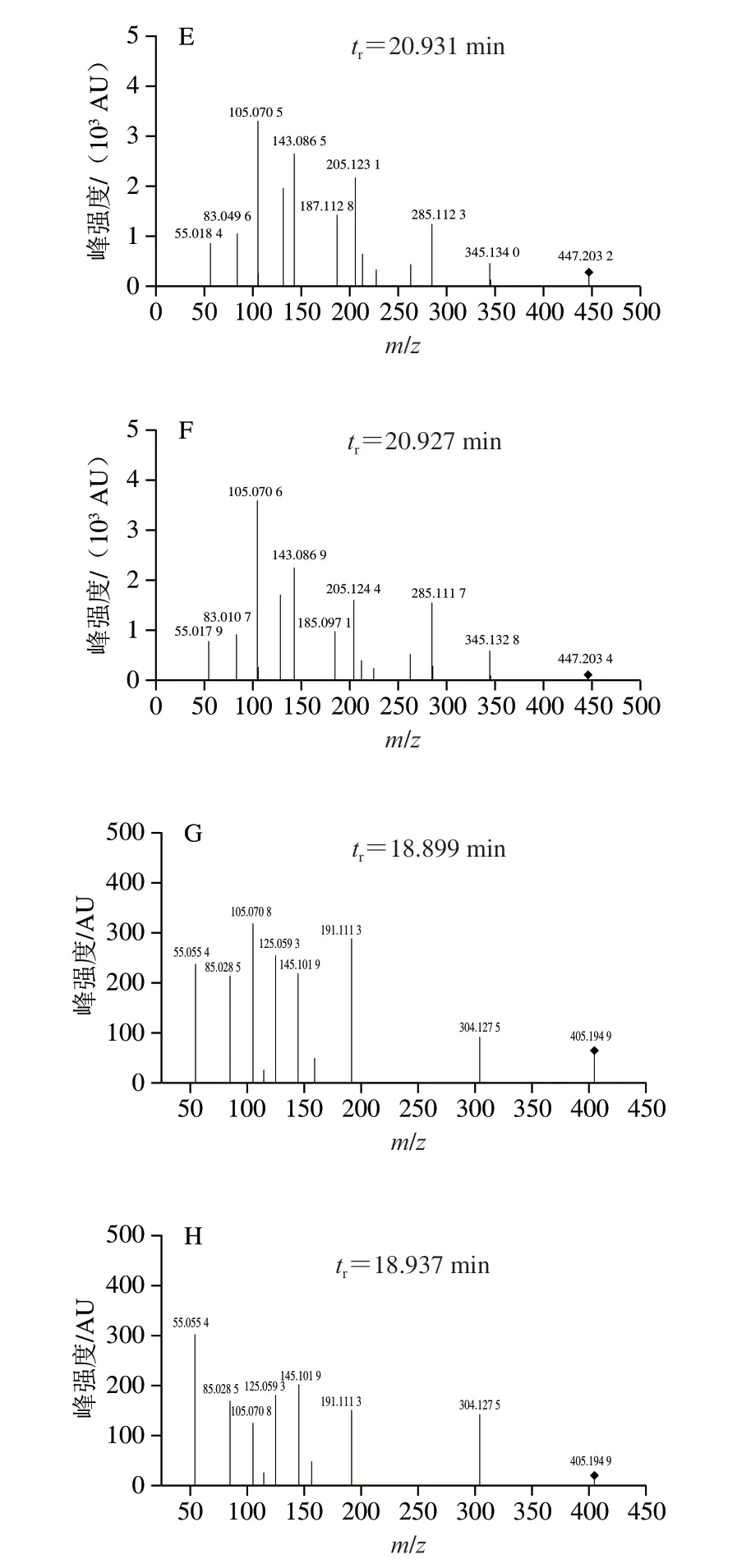
图6 菌株AFJ-2降解T-2毒素产物分析Fig.6 Analysis of degradation products of T-2 toxin by strain AFJ-2
利用软件Mass Hunter搜索所有可能化合物,与软件PCDL中T-2毒素常见代谢产物数据库进行比对。产物a、b的匹配结果为HT-2(C22H32O8)、T-2三醇(C20H30O7),m/z分别为447.204 4[+Na]、405.189 0[+Na],与T-2毒素(489.215 1[+Na])依次相差42,等于一个乙酰基[—COCH3]的相对分子质量,且化学结构与T-2毒素依次在C-4和C-15位相差一个乙酰基团。
采用40 eV的碰撞能量,对产物a、b与HT-2、T-2三醇标准品溶液进行二级质谱分析,结果如图6E~H所示,二级质谱图中tr、碎片离子的分布和相对丰度三者基本吻合,可以确定产物a、b分别是HT-2、T-2三醇。
2.4.2 菌株AFJ-3降解T-2毒素产物分析
采用UPLC-Q-TOF-MS分析菌株AFJ-3降解T-2毒素的产物,如图7A~D所示,T-2毒素(tr=7.0 min)在12 h被完全降解,而此时观察到未知峰c(tr=4.0 min)大量增加。通过软件Mass Hunter和PCDL分析,产物c的匹配结果为NEO(C19H26O8),m/z为405.152 8[+Na],与T-2毒素相差84,等于一个异戊酰基[—CH3CCH3CH2CO]的相对分子质量,化学结构与T-2毒素在C-8位相差一个异戊酰基。通过对产物c和NEO标准品溶液的二级质谱图分析,可以确定产物c是NEO,结果见图7E、F。
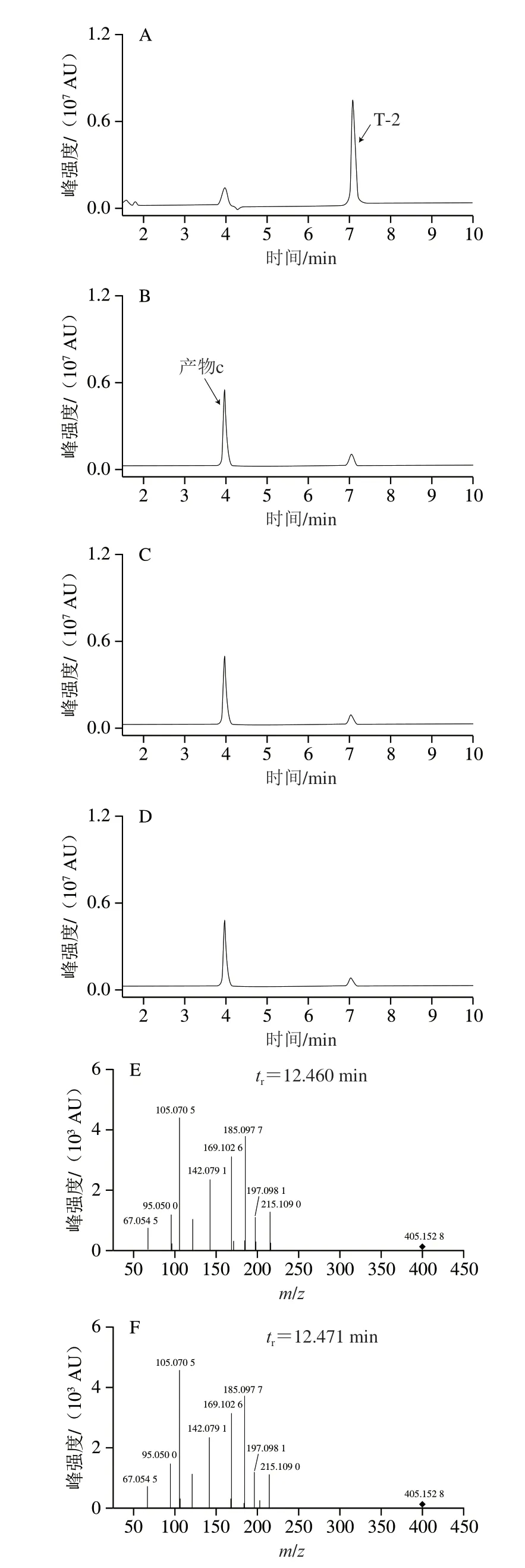
图7 菌株AFJ-3降解T-2毒素产物分析Fig.7 Analysis of degradation products of T-2 toxin by strain AFJ-2
2.4.3 菌株AFJ-2和AFJ-3共同降解T-2毒素产物分析
菌株AFJ-2和AFJ-3粗酶液混合后与T-2毒素反应,利用Mass Hunter分析产物变化规律,通过m/z提取总离子流图中各产物峰并积分可获得其峰面积,用来代表降解产物的相对含量,结果如图8A所示。2 株菌单独作用的产物HT-2、T-2三醇和NEO都存在,单独作用下HT-2和NEO大量生成后维持不变(数据未显示),而共同作用时它们大量生成后均存在下降趋势。同时,发现新的产物X随时间延长大量增加,因此产物X可能是HT-2和NEO继续发生转化生成的产物。通过软件分析产物X匹配结果为4-脱乙酰-NEO或8-乙酰-T-2四醇或15-脱乙酰-NEO,3 种物质为同分异构体,仅侧链烷基的位置不同。
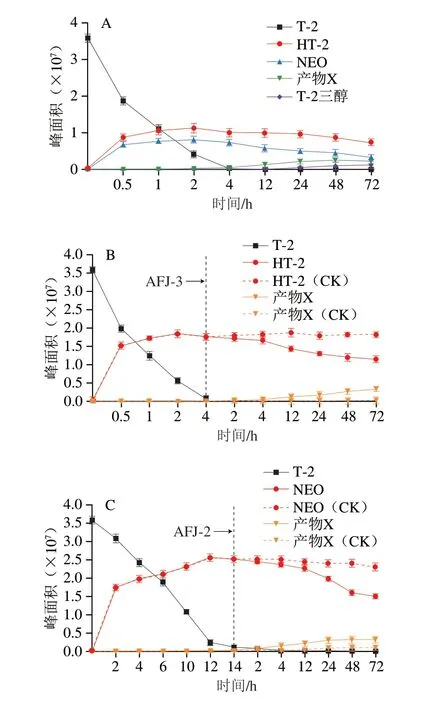
图8 菌株AFJ-2和AFJ-3共同降解T-2毒素产物分析Fig.8 Analysis of co-degradation products of T-2 toxin by strains AJ-2 and AFJ-3
通过不同时间先后加入AFJ-2和AFJ-3粗酶液分析产物X。如图8B所示,在AFJ-2将T-2毒素完全降解的时间点(图中虚线处)加入AFJ-3的粗酶液,HT-2开始呈现下降趋势,也出现了产物X随时间缓慢大量增加,因此认为产物X是HT-2减少转化的产物。同理可得,如图8C所示,AFJ-3将T-2毒素完全降解时加入AFJ-2粗酶液,NEO开始减少,产物X缓慢大量增加,因此产物X也是NEO减少转化的产物。
根据上述实验结果推断,如图9所示,AFJ-2能够以AFJ-3降解T-2毒素产生的NEO为底物,使其脱去C-4乙酰基变成产物X;AFJ-3能够以AFJ-2降解T-2毒素产生的HT-2为底物,使其脱去C-8异戊酰基变成产物X;结合降解位点和化学结构推测产物X为4-脱乙酰-NEO。据文献报道,HT-2、T-2三醇和NEO的毒性均低于T-2毒素,毒性大小依次为T-2>HT-2>T-2三醇>NEO[21-23]。至今未有4-脱乙酰-NEO毒性作用的详细报道,根据其烷基侧链仅剩一个乙酰基团推测,4-脱乙酰-NEO的毒性低于上述3 种产物。
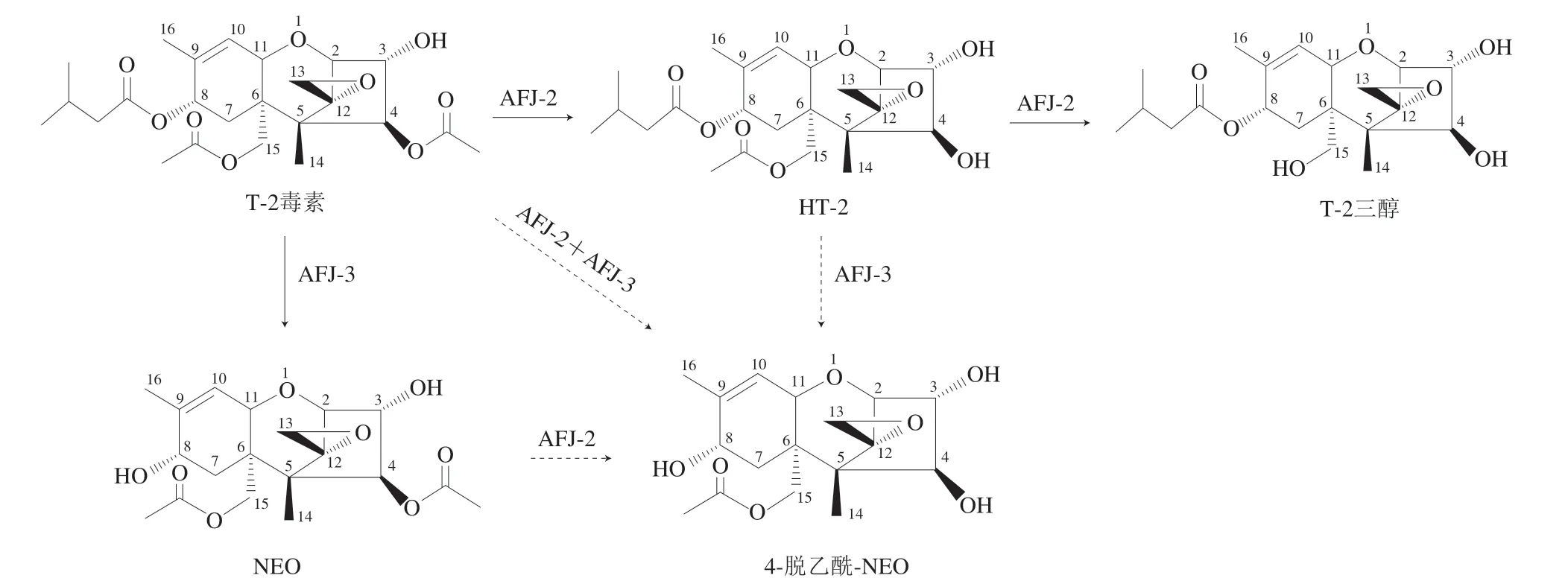
图9 菌株AFJ-2和AFJ-3对T-2毒素的降解机制Fig.9 Degradation mechanism of T-2 toxin by strains AFJ-2 and AFJ-3
3 讨论与结论
作为毒性最强的单端孢霉烯族毒素、T-2毒素可导致亚致死性或致死性中毒,严重威胁人类和动物的生命健康。相较于传统的物理、化学脱毒法,生物法具有高效、专一、安全的特点,筛选降解微生物是控制T-2毒素污染的一项有效措施。早在20世纪80年代,Ueno等[24]从土壤中发现了短小杆菌114-2能将T-2毒素转化为HT-2和T-2三醇;本研究中菌株AFJ-2的降解途径与Uneo的研究结果一致,并进一步结合芽孢杆菌AFJ-3共同降解T-2毒素,获得了新的产物4-脱乙酰NEO,同时这也是首次明确芽孢杆菌属菌株降解T-2毒素的代谢产物。迄今为止,国内外报道了多种微生物能够降解T-2毒素,而AFJ-2和AFJ-3在降解性能方面表现出一定的优势:Hassan等[25]在草莓酱中发现巨大芽孢杆菌344-1在44 h内仅去除78%的T-2毒素(0.6 μg/mL);施琦[26]从自然环境中筛选的弯曲假单胞菌和尼泊尔葡萄球菌,72 h对5 ng/mL T-2毒素的降解率分别为90.9%和85.5%;黑曲霉7 d内对5 μg/mL T-2毒素的降解率仅为69.8%[9]。本研究中AFJ-2和AFJ-3分别在7 h和12 h内能够去除99.9%的T-2毒素(5 μg/mL),降解效率均高于上述菌株,具有很大的应用潜力。
降解产物的安全性是决定降解菌株实际应用价值的重要指标之一。本研究中降解产物HT-2、T-2三醇、NEO和4-脱乙酰NEO均由T-2毒素水解侧链烷基酯键产生,而侧链烷基的数量与位置与T-2毒素的毒性息息相关[27-29]。C-4位取代基可抑制多肽链的延伸和终止[30],研究表明,T-2毒素会优先脱去C-4乙酰基产生HT-2,但HT-2与T-2毒素毒性相差不大[31-32];当C-15和C-4位均存在较大基团时,会抑制蛋白质合成的起始阶段,且C-4至C-15之间的大环(烃链)本身也具有毒性作用[27,30],因此T-2毒素转化为T-2三醇后毒性降低99.64%[33];C-8位异戊酰基的亲脂性使T-2毒素更易渗透到生物体,当C-8异戊酰基被取代生成NEO时,对小鼠淋巴瘤细胞的毒性显著降低了91%[27,30]。由上述研究可知,本研究中代谢产物的毒性均低于T-2毒素。通过降解位点推测出共代谢产物4-脱乙酰-NEO,由于目前市场上无标准品出售,未能通过二级质谱分析对它进行鉴定,根据侧链基团缺失的数量与位置推测其毒性低于另外3 种产物,但它的毒性机制尚不清晰。
多项研究表明,T-2毒素的水解过程主要由羧酸酯酶参与。大鼠肝微粒体中T-2毒素被代谢为HT-2,由特定酶抑制剂鉴定出是丝氨酸羧基酯酶的作用[34],这与本研究中利用抑制剂PMSF得出T-2毒素降解酶中含有丝氨酸基团的结论一致;Johnsen[35]和Lin Nini[36]等同样采用酶抑制剂的方法,证明了人类血细胞和肝微粒体中的羧酸酯酶对T-2毒素具有水解作用;Lattanzio等[37-38]从玉米中纯化出具有酯酶活性的蛋白部分,该蛋白提取物能在90 min内将5 μg T-2毒素完全转化为HT-2。酶法降解真菌毒素具有显著的优势,但T-2毒素降解酶的鉴定至今未取得突破。根据本研究中的产物类型可知,菌株AFJ-2和AFJ-3产生的T-2毒素降解酶属于羧酸酯酶类,后续可借助分子生物学、蛋白质组学等手段,对该降解酶进行分离纯化。
本研究从小麦样品中分离获得2 株T-2毒素高效降解菌株AFJ-2和AFJ-3,由16S rDNA初步鉴定为短小杆菌属和芽孢杆菌属菌株。AFJ-2和AFJ-3分别能在7 h和12 h内将5 μg/mL T-2毒素完全降解;明确了2 株菌对T-2毒素的降解来源于细胞内产生的酶,不存在吸附作用;灭活与抑制剂(蛋白酶K、SDS和PMSF)处理会显著抑制胞内酶对T-2毒素的降解效果。菌株AFJ-2和AFJ-3分别将T-2毒素降解为低毒产物HT-2、T-2三醇和NEO,推测它们共同降解T-2毒素能产生新的产物4-脱乙酰-NEO,且AFJ-3能以HT-2为底物(AFJ-2能以NEO为底物)生成4-脱乙酰-NEO。本研究获得的微生物资源对T-2毒素的污染防控与酶制剂的开发应用具有重要意义。

