微创肺叶切除术和肺段切除术对非小细胞肺癌治疗效果、免疫功能及预后的影响
宋伟 王恩华
肺癌是临床上呼吸系统中较为多见的一种恶性肿瘤, 临床主要有咳嗽、肺部反复感染、胸痛等症状, 该疾病的发病率极高, 且患者预后也相对较差。肺癌的主要类型为非小细胞肺癌, 占80%~85%, 且患病率在不断增加, 严重影响患者的日常生活及生命安全[1]。不同分期非小细胞肺癌的治疗方法不同, 对于晚期的非小细胞肺癌患者而言, 其预后通常较差, 临床主要给予免疫化疗、分子靶向治疗等治疗手段, 手术效果也比较差。且非小细胞肺癌的病机较为复杂, 当前主要认为其与环境污染、遗传、长期大量吸烟等因素有关, 临床常用肺段切除术及肺叶切除术进行治疗, 两者均属于胸腔镜下的微创手术, 主要以切除患者病变部位实现临床治疗目的, 因治疗方式不同, 患者的疗效及其预后等也不一样[2]。临床应用肺叶切除术的时间相对较长, 但该治疗的方式会将患者健康的肺组织大量切除, 肺段切除手术则能够对该缺点进行弥补, 减少给患者带来的损伤[3]。本研究对2020 年5 月~2022 年5 月本院收治的80 例非小细胞肺癌患者采取不同治疗方法的效果给予分析, 报告如下。
1 资料与方法
1.1 一般资料 选择2020 年5 月~2022 年5 月到本院进行治疗的80 例非小细胞肺癌患者进行研究, 按随机数字表分为对照组和研究组, 每组40 例。对照组男20 例, 女20 例;年龄44~75 岁, 平均年龄(59.47±5.61)岁;患病时间4~11 个月, 平均患病时间(7.47±1.53)个月;体质量52~75 kg, 平均体质量(63.49±5.11)kg。研究组男21 例, 女19 例;年龄44~76 岁, 平均年龄(59.96±5.63)岁;患病时间4~12 个月, 平均患病时间(7.99±1.45)个月;体质量52~76 kg, 平均体质量(64.00±5.15)kg。两组一般资料比较差异无统计学意义(P>0.05), 具有可比性。
1.2 纳入及排除标准 纳入标准:①特征、表现符合《实用中西医结合肿瘤内科学》[4]中的相关诊断标准;②经胸部CT 检查显示为肺磨玻璃样小结节, 结节直径<2 cm;③病理组织活检后确诊为非小细胞肺癌;④手术治疗前无放疗、化疗等治疗史;⑤本研究患者、家属均清楚研究目的且愿意参与。排除标准:①病情复发或既往接受化疗者;②对本研究中使用的药物过敏者;③妊娠期女性;④继发性的肺癌者;⑤并有肝肾功能异常、贫血且不能进行化疗者。本研究获医院医学伦理委员会同意。
1.3 方法 术前对所有患者开展常规检查, 有效排除相关手术禁忌证, 并开展心电图及胸片等相关检查, 有效评估手术治疗耐受程度, 通过相关影像学检查患者的肿瘤部位情况, 对其病情进行了解。对照组采用微创肺叶切除术:在开展具体手术前, 给予患者双腔气管插管和单肺通气麻醉。麻醉成功后, 调整患者体位,以健侧卧位为主, 上举患者术侧上肢且将其固定在头架位置, 适当垫高患者腋下位置, 常规消毒手术位置,在患者腋中线的7~8 肋之间将胸腔镜置入其观察孔内, 在腋前线的3~4 肋之间切一个3 cm 大小的切口为手术的主操作孔, 副操作孔位置在患者肩胛的下角线8~9 肋之间, 其切口大小为2 cm, 与显像系统相互连接,并根据顺序对肿瘤的大小、位置、四周侵犯情况进行查探, 再按照肺叶进行解剖, 根据患者颈动脉、气管对其肺叶进行水平分离后切除, 清扫肺门、支气管四周淋巴结且进行病检, 重点做好止血工作, 保证手术过程中视野清晰, 防止损伤;术后需仔细冲洗碎块, 对出血点必须彻底电凝, 放置好引流管后关闭伤口。研究组给予微创肺段切除术:指导患者选择侧卧的姿势且术侧朝上, 全身麻醉后进行双腔插管, 实施常规的消毒、铺单, 在患者腋中线的7~8 肋之间将胸腔镜置入其观察孔内, 在腋前线的3~4 肋之间切一个3 cm 大小的切口为手术的主操作孔, 副操作孔位置在患者肩胛的下角线8~9 肋之间, 其切口大小为2 cm, 利用CT 进行三维重建, 确定患者结节的具体位置, 有效离断其肺段的动、静脉, 需保留肺段之间的静脉, 有效分离靶段支气管, 再做好相应的夹闭及通气等工作, 确保不会对患者其他的肺段造成影响, 将靶段的支气管也随之离断, 再通过电凝钩做好相应的标记, 沿着界限切断患者的肺组织。缝合肺组织、肺裂平面, 清扫患者淋巴结系, 给予适量的无菌注射用水, 检查肺部的残端及其支气管有无漏气。
1.4 观察指标及判定标准
1.4.1 比较两组手术指标 包括手术用时、术中出血量、胸腔引流量及住院时间。
1.4.2 比较两组手术前后免疫功能 通过流式细胞仪对患者手术前后的免疫功能进行检测, 包括T 淋巴细胞CD4+/CD8+、CD4+、CD3+。
1.4.3 比较两组手术前后肺功能 利用肺功能检查仪检测患者手术前后的肺功能情况, 包括FEV1 占预计值百分比、FEV1/FVC、MVV。
1.4.4 比较两组并发症发生情况 包括肺漏气、肺不张、肺部感染[5]。
1.5 统计学方法 采用SPSS20.0 统计学软件对研究数据进行统计分析。计量资料以均数±标准差( x-±s)表示, 采用t 检验;计数资料以率(%)表示, 采用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组手术指标比较 研究组手术用时、住院时间均短于对照组, 术中出血量、胸腔引流量均少于对照组,差异有统计学意义(P<0.05)。见表1。
表1 两组手术指标比较( ±s)

表1 两组手术指标比较( ±s)
注:与对照组比较, aP<0.05
组别例数手术用时(min)术中出血量(ml)胸腔引流量(ml)住院时间(d)研究组40 150.46±13.41a 102.53±10.36a 263.75±23.59a 5.75±1.13a对照组40160.52±14.65152.24±16.73316.82±27.547.63±1.17 t 3.20415.9779.2567.310 P 0.0020.0000.0000.000
2.2 两组手术前后免疫功能指标比较 治疗前, 两组CD4+/CD8+、CD4+、CD3+比较, 差异无统计学意义(P>0.05);治疗后, 研究组CD3+、CD4+、CD4+/CD8+均高于对照组, 差异有统计学意义(P<0.05)。见表2。
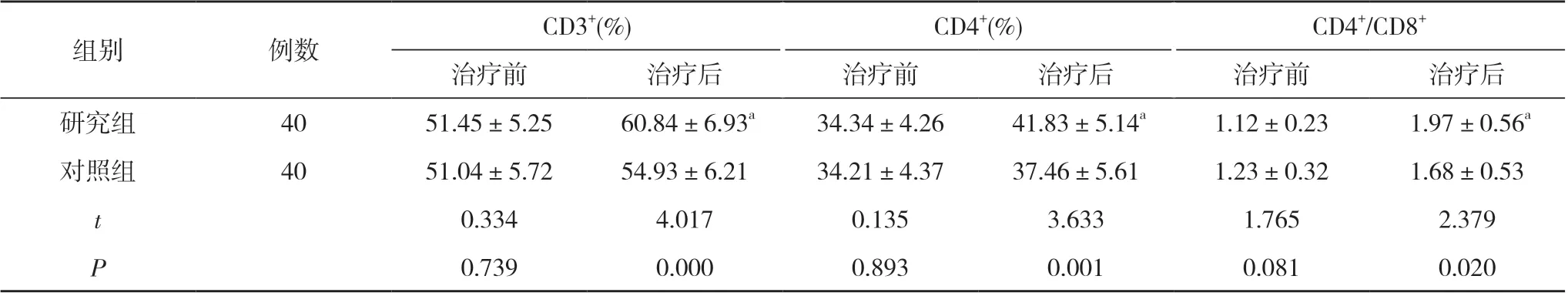
表2 两组手术前后免疫功能指标比较( x-±s)
2.3 两组手术前后肺功能指标比较 治疗前, 两组FEV1 占预计值百分比、FEV1/FVC、MVV 比较, 差异无统计学意义(P>0.05);治疗后, 研究组FEV1 占预计值百分比、FEV1/FVC、MVV 均高于对照组, 差异有统计学意义(P<0.05)。见表3。
表3 两组手术前后肺功能指标比较( ±s)
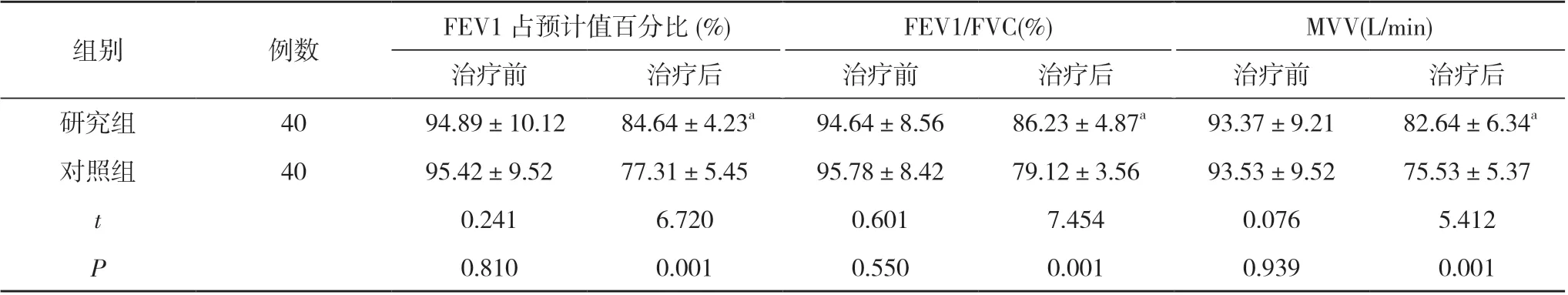
表3 两组手术前后肺功能指标比较( ±s)
注:与对照组治疗后比较, aP<0.05
组别例数FEV1 占预计值百分比(%)FEV1/FVC(%)MVV(L/min)治疗前治疗后治疗前治疗后治疗前治疗后研究组40 94.89±10.12 84.64±4.23a94.64±8.56 86.23±4.87a93.37±9.21 82.64±6.34a对照组4095.42±9.5277.31±5.4595.78±8.4279.12±3.5693.53±9.5275.53±5.37 t 0.2416.7200.6017.4540.0765.412 P 0.8100.0010.5500.0010.9390.001
2.4 两组并发症发生情况比较 研究组并发症发生率5.00%低于对照组的20.00%, 差异有统计学意义(P<0.05)。见表4。

表4 两组并发症发生情况比较[n(%), %]
3 讨论
非小细胞肺癌是临床较为常见的一种恶性肿瘤,该病的播散性及转移性较强, 随着病情逐渐发展, 其病变也会出现转移, 威胁患者的生命健康[6]。临床对该病通常采取手术治疗, 主要目的是切除病变组织, 帮助患者延长生存周期, 传统开胸手术需要时间较长, 造成的创伤较大, 术后患者易产生各种并发症, 而胸腔镜手术不会给患者造成较大创伤, 且术后患者可快速恢复[7,8]。基于此, 本文对本院收治的80 例非小细胞肺癌患者临床资料予以分析。
本研究结果显示, 研究组手术用时、住院时间均短于对照组, 术中出血量、胸腔引流量均少于对照组,差异有统计学意义(P<0.05)。说明给予非小细胞肺癌患者微创肺叶切除术与肺段切除术治疗, 后者效果更佳。究其原因, 可能是非小细胞肺癌患者中约有30%患者发现时是疾病早期, 伴随疾病进展, 其肿瘤会对四周血管、淋巴结造成侵害而向远处不断转移, 而此时若单纯给予患者传统开胸手术会给患者造成较大的创伤, 术后还会致使患者产生严重并发症, 治疗效果并不理想, 需采取其他更为有效的方法治疗[9]。微创技术在胸腔镜下能够清晰看到病灶的形状、位置, 且不需要撑开器对肋骨进行牵开, 可促使患者临床疗效得到保证, 并降低对患者胸壁的肌肉损伤, 有利于患者康复。微创肺叶切除术通过切除病变组织达到临床治疗目的, 在临床中应用较为广泛[10]。由于医学技术的快速发展, 胸外科手术强调需帮助患者尽可能保存正常肺组织, 而微创肺段切除术则具有该优势, 其病灶切除更加精准, 可保证临床疗效的同时降低对患者的损伤[11]。微创肺段切除术可降低患者术中出血量, 有效缩短手术用时, 帮助患者快速康复。本次研究结果显示, 治疗后, 研究组CD3+、CD4+、CD4+/CD8+均高于对照组, 差异有统计学意义(P<0.05)。说明给予非小细胞肺癌患者微创肺叶切除术与肺段切除术治疗, 后者能更好地提升患者免疫功能。对非小细胞肺癌患者而言, 患者免疫力低会致使癌细胞免疫逃逸, 导致发生恶性肿瘤。目前对患者免疫功能进行评估的指标主要是T 淋巴亚群, 患者因受肿瘤负荷的影响, 其免疫力逐渐降低, 表现出CD3+、CD4+指标减弱[12,13]。肺叶切除术的操作比较简单, 能对患者肺组织的切除范围进行保证, 肺段切除胸腔残腔相对较小, 出现感染的风险较低, 给予患者微创肺段切除术治疗可更好地提升患者免疫功能[14]。本研究结果显示, 治疗后, 研究组FEV1 占预计值百分比、FEV1/FVC、MVV 均高于对照组, 差异有统计学意义(P<0.05)。说明给予非小细胞肺癌患者微创肺叶切除术与肺段切除术治疗, 后者能更好地提升患者肺功能。通过微创肺叶切除术有效切除病变部位后, 同侧剩下的肺叶则会出现代偿性扩张情况, 易导致肺叶支气管变形, 提升气道的阻力, 严重影响肺通气功能。微创肺段切除术治疗则不会产生该情况, 从而帮助患者增强肺功能指标[15]。本研究结果显示, 治疗后, 研究组并发症发生率5.00%低于对照组的20.00%, 差异有统计学意义(P<0.05)。与微创肺叶切除术相比, 微创肺段切除术不仅可以对患者支气管进行保留, 使患者的肺功能得到相应保护, 微创肺段切除术后患者肺组织的代偿更少, 还能有效减少术后患者出现肺不张、肺漏气、肺部感染的几率, 促使患者快速恢复健康, 增强预后[16-20]。
总之, 非小细胞肺癌患者采取微创肺叶切除术、微创肺段切除术均有一定的治疗效果, 但后者可有效提升患者的免疫功能和肺功能, 具有较高的安全性, 值得推广应用。

