基于IVIM 影像组学模型对前列腺癌和前列腺增生的鉴别诊断价值
苏月婷,王飞,张濬韬,田为中*
1.南京医科大学附属泰州市人民医院影像科,江苏 泰州 225300;2.泰州市姜堰中医院影像科,江苏 泰州 225300;3.通用电气医疗精准医学研究院,上海 210000;*通信作者 田为中 tz_twz@163.com
前列腺癌是男性最常见的癌症之一,并且致死率很高[1]。由于男性人口老龄化,前列腺癌发病率不断上升,预计到2030年前列腺癌将超过胃癌成为中国男性第三大常见癌症[2-3]。MRI是目前诊断前列腺癌的最佳影像学检查。近年来,体素内不相干运动(intravoxel incoherent motion,IVIM)逐渐用于诊断前列腺癌,可更准确地反映病灶的微观结构和病理特征,关于IVIM在前列腺癌的研究一直备受关注。影像组学从医学图像中提取大量定量成像特征,丰富的影像组学特征与机器学习方法相结合可以有效辅助、指导临床工作[4]。既往研究显示T2WI和扩散加权成像影像组学模型可以提高前列腺癌的诊断及风险评估,减少术前不必要活检[5-8],但IVIM影像组学模型在前列腺癌中的研究鲜有报道。本研究拟通过建立IVIM影像组学模型,对前列腺癌和前列腺增生进行鉴别诊断。
1 资料与方法
1.1 研究对象 回顾性分析2019年1月—2021年5月南京医科大学附属泰州市人民医院经病理证实为前列腺癌及前列腺增生的患者资料。纳入标准:①穿刺或术前采用同一台3.0T MRI检查,扫描序列和参数保持统一;②MRI图像上存在肉眼可观察的病灶,在MRI检查前未接受内分泌治疗、放化疗等其他治疗。所有病例按7∶3随机抽样分成训练组及验证组。共纳入206例患者,其中前列腺癌组106例,平均年龄(75.4±7.6)岁,前列腺特异性抗原1.424~1 000(53.45±15.45)ng/ml;良性前列腺增生组100例,平均年龄(68.7±5.6)岁,前列腺特异性抗原0.01~86.6(5.68±0.26)ng/ml。训练组144例,验证组62例。本研究经本院伦理委员会批准(KY2019046),受试者均签署知情同意书。
1.2 MRI检查 采用Siemens Skyra 3.0T超导全身MR扫描仪,患者取仰卧位,头先进,检查前嘱患者禁食、排出宿便并适当充盈膀胱。扫描序列包括常规T1WI、T2WI、扩散加权成像序列及IVIM序列。IVIM序列b值取0~1 000 s/mm2(0、20、40、60、80、100、200、400、600、800、1 000 s/mm2),扫描时间为6 min 19 s,TR 3 700 ms,TE 70 ms,矩阵140 mm×140 mm,信噪比1,层厚3.5 mm,层间距1 mm。
1.3 图像后处理 首先应用Firevoxel软件得到IVIM序列真性扩散系数(D)图、伪扩散系数(D*)图及灌注分数(f)图,将所得伪彩图导入ITK-SNAP软件勾画感兴趣区(ROI)(图1、2)。由2名影像科医师(A与B)手动逐层勾画前列腺病灶的边缘,勾画的范围结合T2WI序列及穿刺结果。如同一例患者存在多处病灶且Gleason评分不同时,则选取Gleason评分最高区域进行勾画,避开尿道、射精管、钙化、囊肿等区域。勾画完成后保存为三维ROI。A医师间隔1周后再次勾画,即每个病灶有3个ROI。

图1 前列腺癌MRI感兴趣区提取。A:T2WI轴位图,箭示低信号区为肿瘤病灶;B~D为分别在D、f、D*图中手动勾画ROI,红线轮廓内为勾画的癌组织范围
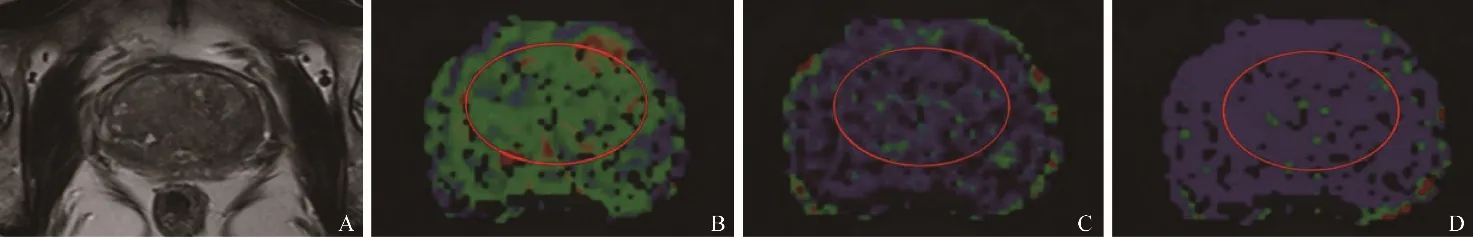
图2 前列腺增生MRI感兴趣区提取。A:前列腺增生T2WI轴位图,前列腺中央带呈高低混杂信号;B~D分别在D、f、D*图中手动勾画ROI,红线轮廓内为勾画的增生组织范围
1.4 图像特征提取及筛选 基于Python(https://www.python.org)的Pyradiomics包,将NII.格式的原始图像与ROI图像导入以提取特征,包括直方图特征、几何形态特征和纹理特征3类。
特征筛选前进行观察者内与观察者间的一致性检验。分别计算A医师勾画的2次ROI所提取的特征间,及A医师第1次勾画与B医师勾画的ROI提取的特征间的组内相关系数(ICC),保留2次ICC均>0.75的特征。选择A医师第1次勾画ROI提取的特征用于后续分析。
2种特征筛选方法:使用R 3.3.3软件(https://www.r-project.org)剔去与鉴别相关性较低的特征:应用最大相关最小冗余程序包筛选出具有高相关性和低冗余的前30个特征,此筛选的子集最具预测性。
再采用最小绝对收缩和选择算子稀疏约束法对特征进行筛选,为防止过度拟合,使用十折交叉验证,使特征更具有普适性。每个特征的计算公式、定义及相应注解见:http://pyradiomics.readthedocs.io/en/latest/features.html。最终将选定特征的回归系数加权构建Logistic回归模型,计算影像组学评分,预测前列腺病灶的良恶性及恶性病灶的高低级别。
1.5 统计学方法 采用R 3.4.0软件,计量资料以±s表示,计数资料以绝对数表示;以受试者工作特征(ROC)曲线评价预测模型的影像组学评分在训练组和测试组中鉴别前列腺良、恶性病灶的效能,获得敏感度、特异度、准确度、阴性预测值、阳性预测值及曲线下面积(AUC)。决策曲线用于评估其临床预测效能。
2 结果
2.1 影像组学特征构成 通过筛选,最终D、D*及f图分别得到8、9、8个特征,各特征类型及个数见表1,其中直方图特征均为能量相关特征,纹理特征包括灰度相关矩阵特征、灰度区域大小矩阵特征、灰度行程阵矩阵特征、灰度共生矩阵特征,几何特征包括伸长特征。每个选定特征参数的名称及权重比例见图3。
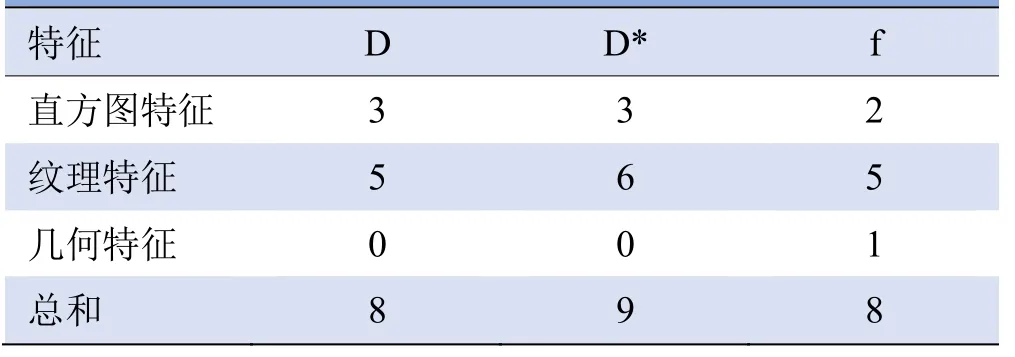
表1 D、D*、f图筛选后得到的特征类型及数量

图3 筛选得出8个与D有关(A)、9个与D*有关(B)、8个与f有关(C)的影像组学特征及权重。纵轴(Feature)代表每个相关影像组学特征名称,横轴(Coefficients)代表每个特征对应的权重系数;蓝色方形条越长,代表的权重越高
2.2 影像组学特征 基于D、D*及f图影像组学模型预测前列腺癌和前列腺增生,训练组中AUC分别为0.987、0.978、0.992,验证组中AUC分别为0.985、0.975、0.985(图4)。在训练组及验证组中,D、D*及f图影像组学模型预测前列腺癌和前列腺增生的准确度、特异度、敏感度、阳性预测值及阴性预测值见表2、3。决策曲线显示D、D*及f图影像组学模型在临床上可以获得较好的净获益,其中D图组学模型最高(图5)。

表2 训练组不同影像组学模型ROC曲线分析结果

表3 验证组不同影像组学模型ROC曲线分析结果

图4 D、D*、f图影像组学模型鉴别前列腺癌及前列腺增生的ROC曲线。A为训练组,B为验证组
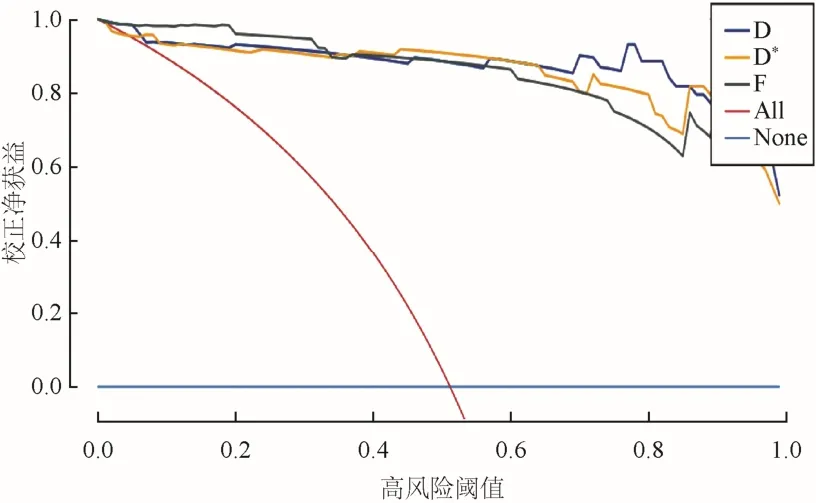
图5 D、D*、f图影像组学模型的临床决策曲线
3 讨论
3.1 IVIM影像组学在前列腺肿瘤中的研究现状 影像组学是近年新兴的影像分析技术,能够潜在预测和反映肿瘤的组织病理学、治疗反应、复发、患者生存期以及其他临床特征。IVIM影像组学模型在鼻咽肿瘤、直肠癌及胰腺肿瘤的研究中具有一定价值[9-11],但在前列腺肿瘤方面的研究较少。
IVIM序列可以同时提取组织内水分子扩散信息和液体灌注的信息,既往的参数研究[12-14]中,D值对于前列腺良、恶性病灶的鉴别具有一定价值,但是对于f值及D*值的价值尚无统一意见。但本研究中,基于D、D*及f图像组学模型对前列腺良、恶性病灶的预测均有重要意义和价值,训练组及验证组均有较高的AUC,其准确度、特异度、敏感度、阳性预测值及阴性预测值也均较高,决策曲线D图组学模型净获益最高。Qin等[9]的研究表明,IVIM组学模型在预测鼻咽癌放化疗反应中,D图模型具有较高的预测效能,与本研究结果相似,表明IVIM影像组学模型能够发掘更多的人眼识别不出的影像特征,从而提供更多有关病变的信息,在一定程度上可以改善单纯参数分析的诊断性能,有一定的临床价值。
3.2 筛选获得的特征及对前列腺良、恶性病灶的鉴别诊断价值 本研究共提取3类影像组学特征,其中纹理特征在D、D*、f图中均占有较大比例及比重,其次为直方图特征,几何特征仅在f图中提取到1个。
纹理特征能够通过分析像素或体素灰度的变化或体素灰度等级的变化定量评估瘤内异质性[15]。本研究中纹理特征在D、D*、f图中分别有5、6、5个,数量均为最多,反映了恶性肿块内组织异质程度高的特点,且在所提取的纹理特征中,灰度相关矩阵(original_gldm_DependenceNonUniformityNormalized)的权重均较高。灰度相关矩阵表示在任何选定的样本间距下,图像在每个方向(水平、垂直和两条对角线)上出现灰度差的数量[16]。杨玉玲等[17]在肺癌影像组学的研究表明,灰度相关矩阵可以较好地反映肿块内部纹理灰度的一致性,异质性越强,纹理分布更紊乱。Granata等[18]在直肠癌肝转移的影像组学研究中表明,灰度相关矩阵还与肿块生长的扩张性和浸润性有较高的相关性,肿块扩张生长、有浸润趋势,越偏向恶性。本研究与上述研究结果一致。
本研究所提取的直方图特征中,只有能量特征且比重较大。组织中血管的变化、组织的细胞变化和纤维肌层的存在及程度均会影响能量特征。Tharmalingam等[19]对小鼠开展的临床研究结论解释了这一现象,前列腺恶性区域的血管内皮生长因子的表达水平较高,前列腺组织的血管和组织细胞变化较明显,能量特征比重较多。
几何形态特征主要描述ROI的基本特征及与球度相似的特征,常见于肺结节、甲状腺结节的研究[20-22]。本研究中几何特征仅在f图中提取到1个且比重不高,可能提示肿瘤的形态特征对于良、恶性病灶的预测意义不大,也可能是因为样本量不足所致。
3.3 本研究的局限性 ①目前关于IVIM影像组学预测前列腺良、恶性病灶的研究较少,本研究缺乏结果对比,且本研究样本量有限,为单中心研究,重复性不足,未来将继续扩大样本量及中心,验证其重复性及预测效能;②由于观察者诊断水平的差异手动勾画ROI会造成一些主观误差;③病理结果大部分为超声引导下穿刺活检证实,缺乏根治性前列腺切除术标本的进一步验证。
本研究基于IVIM D、D*及f图的影像组学模型对前列腺良、恶性病灶有较高的预测效能,但其准确性、适用性有待进一步扩大样本研究及探讨。目前,影像组学正处于新兴阶段,未来大量的研究可能更好地发挥其在前列腺癌中的临床实践作用,应用前景广泛。

