胸腺肽α1联合深部热疗对晚期恶性肿瘤患者免疫功能及生存质量的影响
周 艳,钟光华,陈炳光,蔡月英,桑红琼
(佛山复星禅诚医院肿瘤血液科,广东 佛山 528000)
恶性肿瘤的发病率高且治疗难度大,严重影响患者的生命健康及生存质量。改善晚期恶性肿瘤患者的免疫功能不仅对延长其生存时间意义重大,也能预测其预后,甚至能降低并发症的发生率,减少后续住院次数及费用[1]。近年来,肿瘤的免疫治疗备受重视,已成为继手术、放疗和化疗之后的第四大肿瘤治疗方法。免疫调节剂因具有疗效确切、毒副作用小等优势而逐渐被临床医生和患者所接受,其中以胸腺肽α1应用最为广泛[2]。深部热疗是指将电容场热疗源所产生的物理能量作用于人体,使人体组织发生离子运动和偶极子的旋转运动,在振荡过程中产生热量,以达到治疗疾病目的的一种治疗手段。本研究旨在探讨胸腺肽α1 联合深部热疗对晚期恶性肿瘤患者免疫功能及生存质量的影响,以期为此类患者找到一个可以改善免疫功能和生存质量的治疗方案。
1 资料与方法
1.1 一般资料
研究对象为2022 年1 月至2023 年5 月我院收治的晚期恶性肿瘤患者59 例。纳入标准:(1)诊断为晚期恶性肿瘤;(2)年龄18 ~80 岁;(3)入院时Karnofsky 功能状态(Karnofsky Performance Status,KPS)评分≥50 分;(4)知悉研究内容及目的,同意参加,并签署知情同意书;(5)依从性好,可完成随访及问卷调查。排除标准:(1)合并原发性脑肿瘤或肿瘤发生脑转移;(2)存在严重的心肺功能不全;(3)体内有热积聚金属置入物或起搏器;(4)存在精神障碍;(5)加温部位皮肤发生感染或溃烂;(6)合并活动性结核或其他严重的感染性疾病;(7)处于妊娠期或哺乳期。随机将这些患者分为治疗组(29 例)与对照组(30 例)。两组的一般资料相比,差异无统计学意义(P>0.05)。详见表1。本研究已获得医院伦理委员会的批准(编号:IRB-ATT-002-61)。

表1 两组一般资料的对比
1.2 方法
给予治疗组胸腺肽α1 联合深部热疗。胸腺肽α1(生产厂家:成都地奥九泓制药厂;批准文号:国药准字H20020545;规格:1.6 mg)用法:皮下注射,1.6 mg/ 次,2 次/ 周,8 次/ 周期,共治疗2 个周期。深部热疗:选用体外高频热疗机HG-2000,治疗时取平卧位,将热疗探头放置在肿瘤部位的体表,治疗功率设为100 W,每次治疗45 min,每周治疗2 次,8 次/周期,共治疗2 个周期。给予对照组一般对症支持治疗(化疗),每4 周为1 个周期,共治疗2 个周期。
1.3 观察指标
(1)比较两组的细胞免疫功能指标:包括CD3+T细胞、CD4+T 细胞、CD4+T 细胞/CD8+T 细胞、自然杀伤细胞(NK 细胞)。(2)比较两组的功能状态:使用KPS 评分进行评估,分值0 ~100 分,评分越高表示患者的功能状态越好。(3)对比两组的生存质量:根据欧洲癌症研究和治疗组织(EORTC)生存质
量测定量表(EORTC QLQ-C30)中躯体、角色、认知、情绪和社会功能5 个功能领域内容进行评估,总分30 ~120 分,评分越高表示患者的生存质量越好。三项观察指标均在治疗前、治疗1 个周期后及治疗2个周期后各评估一次。
1.4 统计学方法
采用SPSS 21.0 软件对数据进行统计分析,计量资料以均数± 标准差(±s)表示,组间比较采用t检验;计数资料以百分比(%)表示,组间比较采用χ²检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 两组治疗前后细胞免疫功能指标的对比
治疗前,两组的CD3+T 细胞、CD4+T 细胞、CD4+T细胞/CD8+T 细胞、NK 细胞水平相比,差异无统计学意义(P>0.05)。治疗1 个周期及2 个周期后,两组的免疫功能细胞水平均较治疗前上升,且治疗组的上升幅度大于对照组,差异有统计学意义(P<0.05)。详见表2。
表2 两组治疗前后细胞免疫功能指标的对比(±s )
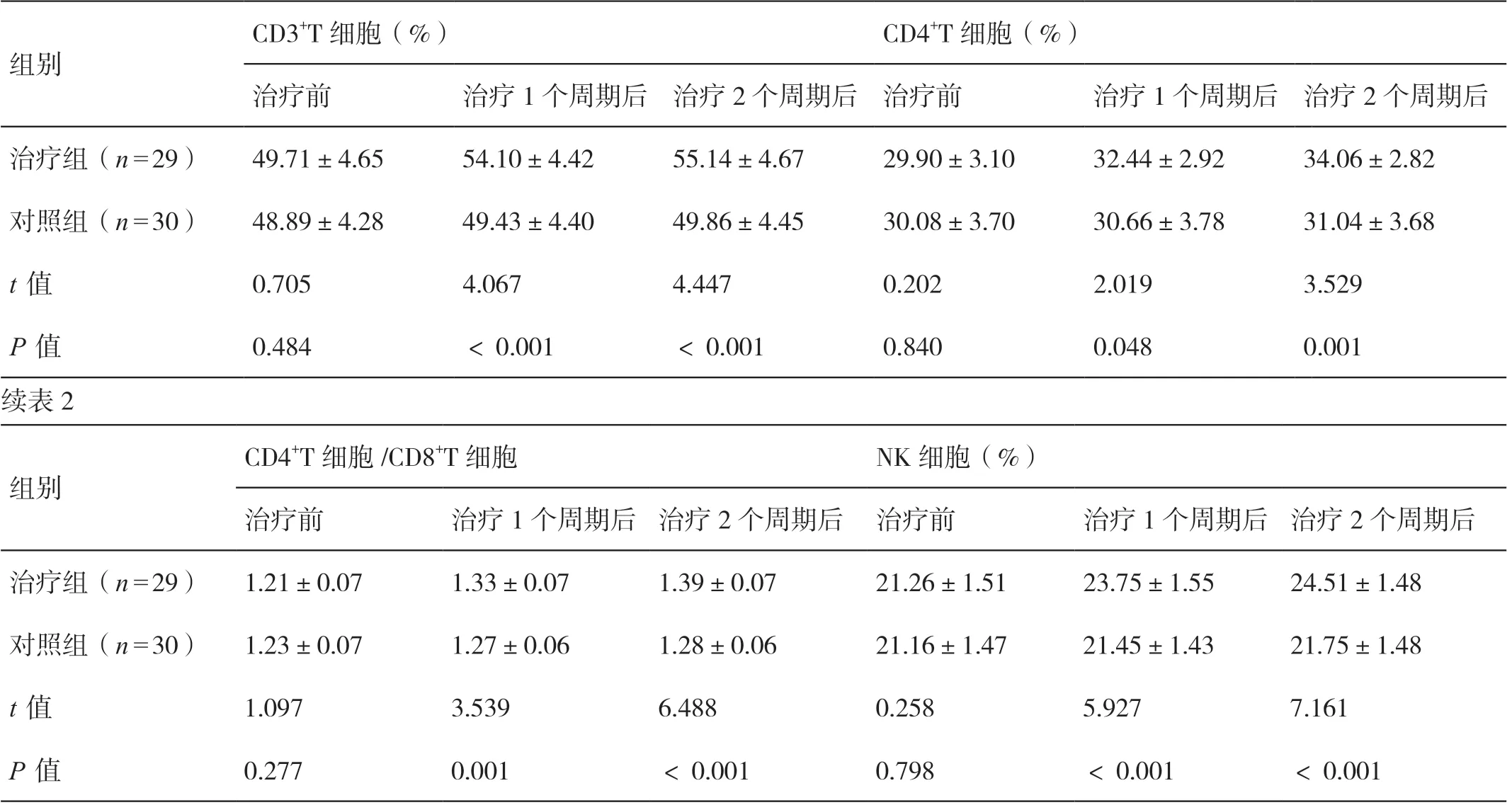
表2 两组治疗前后细胞免疫功能指标的对比(±s )
CD3+T 细胞(%)CD4+T 细胞(%)治疗前治疗1 个周期后 治疗2 个周期后 治疗前治疗1 个周期后 治疗2 个周期后治疗组(n=29)49.71±4.6554.10±4.4255.14±4.6729.90±3.1032.44±2.9234.06±2.82对照组(n=30)48.89±4.2849.43±4.4049.86±4.4530.08±3.7030.66±3.7831.04±3.68 t 值0.7054.0674.4470.2022.0193.529 P 值0.484<0.001<0.0010.8400.0480.001续表2组别CD4+T 细胞/CD8+T 细胞NK 细胞(%)治疗前治疗1 个周期后 治疗2 个周期后 治疗前治疗1 个周期后 治疗2 个周期后治疗组(n=29) 1.21±0.071.33±0.071.39±0.0721.26±1.5123.75±1.5524.51±1.48对照组(n=30) 1.23±0.071.27±0.061.28±0.0621.16±1.4721.45±1.4321.75±1.48 t 值1.0973.5396.4880.2585.9277.161 P 值0.2770.001<0.0010.798<0.001<0.001组别
2.2 两组治疗前后KPS 评分的对比
治疗前,两组的KPS 评分相比,差异无统计学意义(P>0.05)。治疗1 个周期及2 个周期后,两组的KPS 评分均较治疗前上升,且治疗组评分高于对照组,差异有统计学意义(P<0.05)。详见表3。
表3 两组治疗前后KPS 评分的对比(分,±s)

表3 两组治疗前后KPS 评分的对比(分,±s)
组别治疗前治疗1 个周期后治疗2 个周期后治疗组(n=29)63.45±8.1472.67±7.5075.17±6.34对照组(n=30)63.33±7.5868.33±6.9969.67±6.15 t 值0.0592.3003.382 P 值0.9530.0250.001
2.3 两组治疗前后EORTC QLQ-C30 评分的对比
治疗前,两组的EORTC QLQ-C30 各维度评分相比,差异无统计学意义(P>0.05)。治疗1 个周期及2 个周期后,两组的EORTC QLQ-C30 各维度评分均较治疗前上升,且治疗组评分高于对照组,差异有统计学意义(P<0.05)。详见表4。
表4 两组治疗前后EORTC QLQ-C30 评分的对比(分,±s)
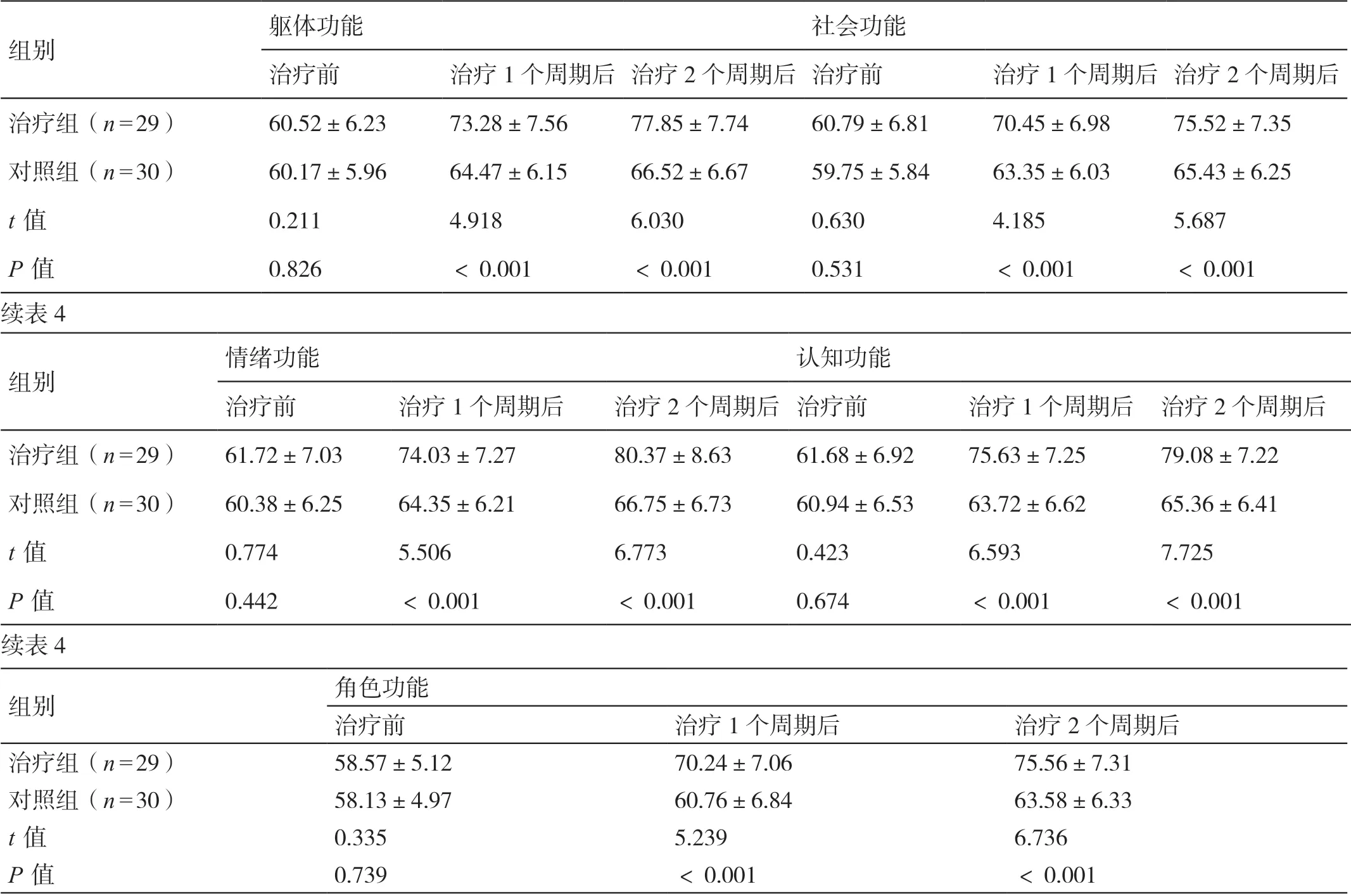
表4 两组治疗前后EORTC QLQ-C30 评分的对比(分,±s)
躯体功能社会功能治疗前治疗1 个周期后 治疗2 个周期后 治疗前治疗1 个周期后 治疗2 个周期后治疗组(n=29)60.52±6.2373.28±7.5677.85±7.7460.79±6.8170.45±6.9875.52±7.35对照组(n=30)60.17±5.9664.47±6.1566.52±6.6759.75±5.8463.35±6.0365.43±6.25 t 值0.2114.9186.0300.6304.1855.687 P 值0.826<0.001<0.0010.531<0.001<0.001续表4组别情绪功能认知功能治疗前治疗1 个周期后治疗2 个周期后 治疗前治疗1 个周期后 治疗2 个周期后治疗组(n=29)61.72±7.0374.03±7.2780.37±8.6361.68±6.9275.63±7.2579.08±7.22对照组(n=30)60.38±6.2564.35±6.2166.75±6.7360.94±6.5363.72±6.6265.36±6.41 t 值0.7745.5066.7730.4236.5937.725 P 值0.442<0.001<0.0010.674<0.001<0.001续表4组别组别角色功能治疗前治疗1 个周期后治疗2 个周期后治疗组(n=29)58.57±5.1270.24±7.0675.56±7.31对照组(n=30)58.13±4.9760.76±6.8463.58±6.33 t 值0.3355.2396.736 P 值0.739<0.001<0.001
3 讨论
恶性肿瘤是目前全球最为棘手的公共卫生问题之一,发病率和致死率居高不下,其中大部分发现时已属中晚期[3],无法治愈。近年来,随着医疗技术的进步和肿瘤分子生物学的发展,放疗、化疗、靶向治疗、免疫治疗等手段的应用使一部分晚期恶性肿瘤患者的生存期得以延长[4]。但放化疗带来的毒副反应,如胃肠道反应、肝肾毒性、骨髓抑制等使患者的身体机能受到极大的打击,即使是相对低毒的靶向治疗和免疫治疗,也会带来皮疹、腹泻、乏力、手足综合征等不良反应[5],这些都会使患者的生存质量降低,其中一些患者甚至因为无法忍受药物带来的毒副作用而被迫中止治疗。相关研究表明,恶性肿瘤患者的免疫功能较低,肿瘤的生长会导致机体免疫力不断下降,机体免疫力高的患者抗肿瘤能力更强[6];在开展常规抗肿瘤治疗(如放疗、化疗)后,机体免疫力好的患者预后一般较好。恶性肿瘤患者的免疫功能紊乱明显,主要表现为细胞免疫功能降低。因此,提高恶性肿瘤患者的免疫功能至关重要。热疗是恶性肿瘤常见的一种治疗方法,通常被视为手术、放疗、化疗和生物治疗之后的第五种选择,临床应用广泛,在不同的恶性肿瘤研究中均有报道[7-8],常联合放疗、化疗、腔内灌注治疗等,有提高疗效及改善机体免疫功能的作用。胸腺肽α1 在临床应用已久,具有调节免疫功能的作用,多用于免疫力低下的人群,如乙型病毒性肝炎、重症感染、恶性肿瘤患者等[9]。本研究采用胸腺肽α1 联合深部热疗治疗晚期恶性肿瘤患者,结果显示,治疗1 个周期及2 个周期后,治疗组的CD3+T 细胞、CD4+T 细胞、CD4+T 细胞/CD8+T 细胞、NK 细胞水平、KPS 评分和EORTC QLQ-C30 评分均显著优于对照组,差异有统计学意义(P<0.05)。提示胸腺肽α1 联合深部热疗可以提高晚期恶性肿瘤患者的免疫功能和生存质量。研究认为,胸腺肽在T 细胞分化和发育的各个阶段起着连续诱导的作用,可维持机体的免疫平衡状态,并增强T 细胞对抗原的反应能力,从而提高机体抵抗疾病的能力。热疗可增强免疫功能,可能的机制如下[10]:(1)改变肿瘤细胞免疫原性及能量代谢;(2)促使肿瘤细胞产生热休克蛋白;(3)促进细胞因子的分泌;(4)清除体内肿瘤免疫抑制因子。提示热疗和胸腺肽α1 在调节免疫功能上或许有协同作用,而免疫功能的改善可促进患者身体机能的好转,进而可促进其病情改善,提升其生存质量。
综上所述,胸腺肽α1 联合深部热疗可以有效改善晚期恶性肿瘤患者的免疫功能和生存质量。但本研究样本量较小,期待后续开展大型临床研究进一步证实该结论。

