海曲泊帕联合重组人血小板生成素治疗原发免疫性血小板减少症的临床观察
郭 星 ,赵 丹 ,左金曼 (1.蚌埠医学院第二附属医院药学部,安徽 蚌埠 00;.蚌埠市第三人民医院药学部,安徽 蚌埠 099;.蚌埠医学院第二附属医院血液内科,安徽 蚌埠 00)
原发免疫性血小板减少症(primary immune thrombocytopenia,ITP)是一种获得性自身免疫性出血性疾病,以无明确诱因的孤立性外周血血小板计数减少为主要特点[1]。其在血液科较为常见,发病率约占出血性疾病的30%[2]。对于该病的治疗,当前可选用的药物类型较少,主要有糖皮质激素、静注人免疫球蛋白(intravenous immunoglobulin,IVIg)、重组人血小板生成素(recombinant human thrombopoietin,rhTPO)和血小板生成素受体激动剂(thrombopoietin receptor agonist,TPORA)等。2018年7月,艾曲泊帕(eltrombopag)在我国被批准用于治疗ITP。作为我国首个上市的TPO-RA类药物,艾曲泊帕因其口服便利和持久的血小板应答备受瞩目。然而,国内外的一些研究发现艾曲泊帕存在一定的肝毒性[3―4]。为了克服这一问题,海曲泊帕(herombopag)作为我国自主研发的新一代TPO-RA 类药物在2021年6月应运而生。最新的研究结果表明,与艾曲泊帕相比,海曲泊帕治疗ITP不仅疗效更佳,而且不良反应发生率更低,尤其是肝毒性大幅度降低[5―7]。此外,虽然体外研究表明rhTPO 与TPO-RA 类药物存在协同增效的机制[8],但目前缺乏相关临床数据,尤其对于新一代TPO-RA类药物是否适宜与现有主要的rhTPO类药物联合应用及其药效与安全性数据仍然匮乏。鉴于此,本研究采用回顾性设计,通过观察和比较海曲泊帕联合rhTPO类药物与单独使用rhTPO类药物治疗ITP的临床疗效和安全性,以期为临床实践提供参考。
1 研究资料
1.1 病例选择
通过蚌埠医学院第二附属医院(以下简称“我院”)的医院信息管理系统(hospital information system,HIS)回顾性选取2021年1月至2022年12月出院病例中诊断为ITP 的患者。本研究经我院医学伦理委员会审查批准,批件号为BYEFY〔2023〕伦审研第6A号。
1.2 纳入与排除标准
本研究的纳入标准为:(1)符合《成人原发免疫性血小板减少症诊断与治疗中国指南(2020年版)》中关于ITP 的诊断标准[9]并在出院诊断记录中有ITP 的患者;(2)血小板计数<30×109L-1;(3)患者基本资料和治疗前后相关检查报告完整,住院期间至少每周有2次血常规检查记录;(4)年龄18~75岁。
本研究的排除标准为:(1)30 d 内接受过化疗者;(2)ITP的病程小于3个月者;(3)30 d内接受过血小板输注、IVIg输注、糖皮质激素治疗者;(4)有血栓病史者,或30 d 内接受过抗凝药物治疗者;(5)合并有其他免疫性疾病(如系统性红斑狼疮、类风湿性关节炎等)者;(6)严重心、肝、肾功能不全者;(7)有脾切除史者;(8)妊娠期或哺乳期妇女。
2 研究方法
2.1 病例分组
按照上述病例选择方法和纳入排除标准筛选后,共纳入255例患者,根据治疗方案分成2组。其中,对照组患者157例,采用重组人血小板生成素注射液(沈阳三生制药有限责任公司,国药准字S20050048,规格15 000 U/mL)按300 U/(kg·d)皮下注射,连续14 d;用药过程中待血小板计数恢复至100×109L-1以上,或血小板计数绝对值升高至50×109L-1时即停药。观察组患者98例,在对照组治疗基础上联合应用海曲泊帕乙醇胺片(江苏恒瑞医药股份有限公司,国药准字H20210021,规格2.5 mg)空腹口服,初始剂量为2.5 mg/d,口服2 h 内避免进餐;1周后根据患者的血小板计数调整剂量,个别患者最大剂量调整到7.5 mg/d。
2.2 观察指标
(1)血小板计数。记录2 组患者治疗前的血小板计数基线值。将开始治疗的时间设为第0日,观察并比较2组患者血小板计数随治疗时间的变化情况。
(2)临床疗效。①疗效主要观察终点为治疗21 d后的总有效率。疗效判定标准[10]——完全反应:治疗后血小板计数≥100×109L-1且无出血;有效:治疗后血小板计数≥50×109L-1并且比基线值增加2 倍或以上,连续维持5 d,且无出血;无效:治疗后血小板计数<50×109L-1或者血小板计数增加不到基线值的2倍或者有出血;复发:治疗后血小板计数虽达到有效水平(≥50×109L-1并且比基线值增加2倍或以上),但持续时间不足5 d或者出现出血症状。总有效率(%)=(完全反应患者例数+有效患者例数)/患者总例数×100%。②疗效次要观察终点为累积达终点率。定义终点事件为患者血小板计数≥50×109L-1。通过绘制Kaplan-Meier曲线观察并计算累积达终点率S(t),公式为:
式中,D(t)是在时间t发生终点事件的患者例数,n(t)是在时间t时的患者总例数。同时,考察2组患者的中位有效时间,即半数患者出现终点事件对应的治疗天数。
(3)出血情况。对治疗期间2 组发生出血的患者根据WHO 出血程度分级标准[11]进行评定并计算出血率。出血率(%)=发生出血的患者例数/患者总例数×100%。
(4)血小板输注率。分别计算2 组患者治疗期间的血小板输注率:血小板输注率(%)=接受血小板输注的患者例数/患者总例数×100%。
(5)不良反应(adverse drug reaction,ADR)发生情况。统计2 组患者在入组观察期间病案记录的所有ADR 并计算ADR 发生率:ADR 发生率(%)=发生不良反应的患者例数/患者总例数×100%。
2.3 统计学处理
采用R 软件进行统计分析。对重复测量的数据进行正态检验,符合正态分布的计量资料采用±s表示,组间比较采用t检验。计数资料采用例数(构成比)表示,组间比较采用χ2检验或Fisher 精确检验。采用Kaplan-Meier生存方法研究治疗时间与累积达终点率之间的关系,以log-rank 法进行组间差异性比较。检验水准α=0.05。
3 结果
3.1 2组患者基本信息与基线临床特征
2 组患者的性别、年龄、体重指数(body mass index,BMI)、病程等基本信息以及血小板计数基线值比较,差异均无统计学意义(P>0.05),具有可比性,详见表1。
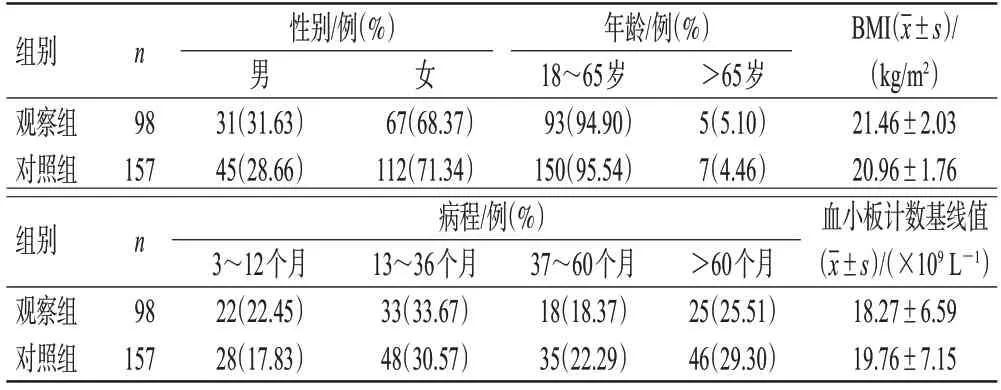
表1 2组患者的基本信息与基线临床特征
3.2 治疗过程中2组患者血小板计数的变化
2 组患者治疗前的血小板计数基线值比较,差异无统计学意义(P>0.05)。从治疗第8 天[观察组为(61.04±13.46)×109L-1,对照组为(52.11±12.06)×109L-1]开始,2 组患者的血小板计数差异有统计学意义(P<0.05)。观察组、对照组患者的血小板计数分别在第11、10 天达到峰值[观察组为(95.70±12.65)×109L-1,对照组为(66.75±9.94)×109L-1],并随后逐步回落至相对稳定值[观察组为(78.91±11.32)×109L-1,对照组为(56.88±10.48)×109L-1],且2组峰值、稳定值的差异均有统计学意义(P<0.05)。2 组患者血小板计数随治疗时间的变化趋势见图1。
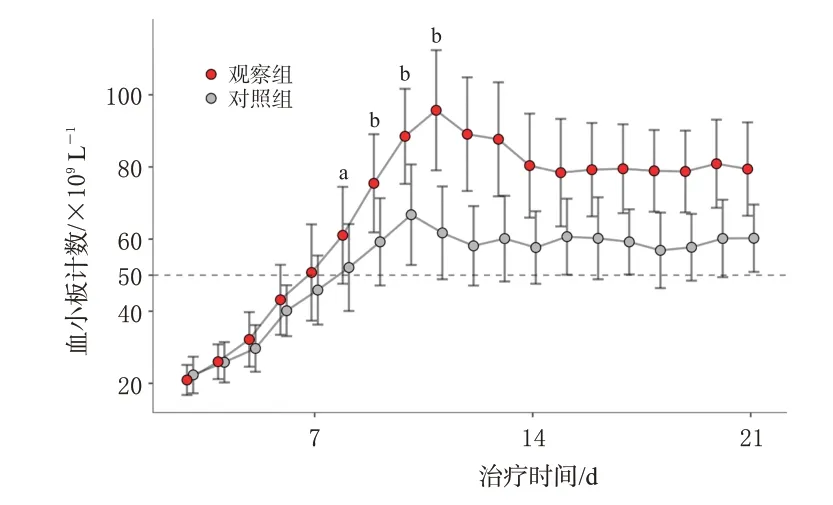
图1 2组患者血小板计数随治疗时间的变化趋势
3.3 2组患者临床疗效对比
治疗21 d 后,观察组和对照组患者的有效率分别为79.59%和66.88%,差异有统计学意义(P<0.05),详见表2。
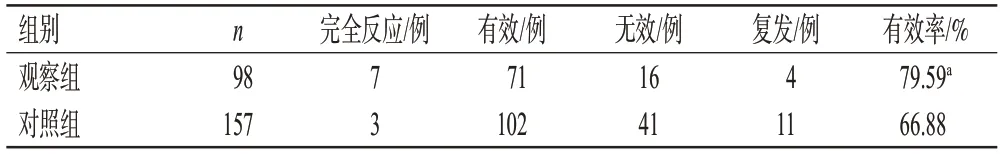
表2 两组患者有效率的比较
3.4 2组患者累积达终点率对比
观察组与对照组患者的累积达终点率分别为81.32%与68.68%,中位有效时间分别为8 d和10 d,差异均有统计学意义(累积生存曲线经log-rank 检验,P=0.000 66),详见图2。
3.5 2组患者出血情况与血小板输注率对比
治疗期间观察组和对照组患者的出血率分别为3.06%和8.28%,差异有统计学意义(P<0.05),出血等级均为1级或2级;血小板输注率分别为31.63%和40.76%,差异亦有统计学意义(P<0.05),详见表3。

表3 2两组患者出血率与血小板输注率的比较
3.6 2组患者ADR发生情况对比
观察组有11 例患者有ADR 记录,包括6 例感染、3例肝功能轻度异常、7例其他ADR(因有的患者发生了2种或以上ADR,故ADR发生例数大于11例,下同)。对照组有15 例患者有ADR 记录,包括8 例感染、9 例其他ADR,无肝功能异常记录。2 组患者发生的不良反应均为1级或2级,无中重度不良反应记录;ADR发生率分别为11.22%和9.55%,差异无统计学意义(P>0.05)。详情见表4。

表4 2组患者ADR发生情况比较
4 讨论
ITP 是一种获得性自身免疫性出血性疾病,其发病机制可能是由于免疫介导的巨核细胞损伤从而导致功能性血小板的生成减少,或功能缺陷的血小板的生成增加[12]。ITP以无明确诱因的孤立性外周血血小板数量减少为主要临床特点。据国外流行病学研究报道,ITP 的发病率大约为2/100 000~10/100 000,国内暂无准确统计数据;60 岁以上老年人是高发群体,育龄期女性的发病率略高于同年龄段男性[13―14]。
目前,用于治疗ITP的药物种类较少,主要有糖皮质激素、IVIg、rhTPO、TPO-RA 类药物(艾曲泊帕、阿伐曲泊帕、海曲泊帕)等[9]。其中,糖皮质激素和IVIg 是一线治疗药物,常用于紧急升血小板治疗,虽然这2类药物具有较好的治疗效果,但由于糖皮质激素不良反应较多、部分患者对IVIg 的治疗无应答等也导致其在使用上受到了一定的限制。对于ITP 的维持治疗,主要采用的是二线药物如rhTPO和TPO-RA类。其中rhTPO类药物虽然起效快、效果可靠,但存在与内源性血小板生成素(thrombopoietin,TPO)发生交叉反应的情况,且存在多次使用后效果下降的可能性[15]。TPO-RA类药物的发展较快,已逐步改变了ITP 的治疗前景。该类药物是一类口服、小分子、非肽类TPO-RA,可识别并结合TPO-R 跨膜结构域的小分子,激活TPO-R 依赖的STAT、PI3K 和ERK信号通路,刺激巨核细胞增殖和分化,促进血小板的生成[16―17]。TPO-RA类药物与TPO-R跨膜区的结合不同于内源性TPO与胞外区结合的作用机制,故不会与内源性TPO产生竞争,且已有研究提示二者具有协同增效的机制[8]。
艾曲泊帕是TPO-RA 类药物中首个被美国FDA 批准用于糖皮质激素、IVIg或切脾术治疗效果不佳的慢性ITP 患者的治疗药物[3]。海曲泊帕是对艾曲泊帕进行了一系列结构修饰后,由我国自主研发出的第二代TPORA类药物。已有的研究提示海曲泊帕相比于艾曲泊帕表现出更高的药物活性[8](半数效应浓度更低,2.5~5 mg 的日治疗起始剂量)和更低的不良反应发生率(肝、肾毒性大幅减少)[18]。此外,不断有一些临床试验也显示出TPO-RA 类药物对肿瘤化疗相关性血小板减少症有较好的疗效[19]。鉴于海曲泊帕有着良好的疗效及安全性,《中国临床肿瘤学会(CSCO)肿瘤治疗所致血小板减少症诊疗指南(2023)》已将其纳入肿瘤治疗所致血小板减少症的治疗和预防的推荐药物[20]。
本研究通过观察2组患者血小板计数随治疗时间的动态变化过程,可以看见血小板计数的应答开始时间约为治疗后1周,并在8~11 d左右达到峰值。2组患者血小板计数峰值与其后稳定值的差异均具有统计学意义(P<0.05)。观察组与对照组患者的总有效率分别为79.59%和66.88%,较相关报道中的数据偏高[17―18],可能是纳入的患者中持续性或难治性ITP 的病例较少所致,但这并不影响本研究2组患者的可比性。在ADR方面,整体上2 组患者均无中重度ADR 的记录;2 组均有感染的患者,但占比差异无统计学意义。值得注意的是,相比于对照组中无肝功能异常的患者,观察组中存在3例肝功能异常的患者,其中有2 例出现天冬氨酸转氨酶(aspartate aminotransferase,AST)轻度升高(约为正常参考值上限的2 倍),继续治疗未予以处理后好转;另1 例患者有肝功能不全史,出现丙氨酸转氨酶和AST的轻度升高(约为正常参考值上限的1.5 倍),并伴有血胆红素升高(总胆红素为25 μmol/L),持续7~14 d,给予保肝治疗后好转。
本研究也存在一定的局限性:(1)本研究是回顾性分析,分组虽然经过统计学检验无差异,但2组的平衡性仍会受一些混杂因素的影响,故只能做到一定程度上的基线平衡;(2)本研究只观察了治疗21 d后的临床疗效,但存在个别对治疗方案应答慢的患者,可能会导致观察组有效率偏低;(3)观察组中海曲泊帕乙醇胺片的治疗剂量范围为2.5~7.5 mg/d,然而本研究未关注各个剂量下患者的频数分布,这可能导致该结果与其他研究产生偏差;(4)2组中均发现有个别患者服用了其他辅助用升血小板的药物(病例记录中有升血小板胶囊、利可君片),虽然数量较少,但仍可能会影响统计结果。这些因素可能会给本研究结果带来一些误差。
综上所述,海曲泊帕联合rhTPO 能显著提高ITP 患者的血小板水平和有效率,降低出血率和血小板输注率,并具有良好的安全性。但该结论仍需要前瞻性、大样本的临床研究进一步验证。

