异甘草素调控肠道菌群和肠屏障功能改善小鼠非酒精性脂肪性肝病的作用机制Δ
曾海燕 ,简丽娜 ,吴辉星 ,周本杰 ,乡世健 #[1.中国科学院大学深圳医院(光明)检验科,广东 深圳518106;.广东医科大学药学院,广东 东莞 53808;3.中山大学附属第七医院药学部,广东 深圳 518107;4.深圳市中药活性物质筛选与转化重点实验室,广东 深圳 518107]
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)以过量饮酒以外的原因引起的肝脏甘油三酯(triglyceride,TG)水平升高为特征,影响着全球25%的成年人;NAFLD 具有很高的肝脏相关代谢合并症的发病率,给医疗卫生系统带来了越来越大的压力[1]。NAFLD 的治疗选择非常有限,目前首选的治疗方法仍然是运动和改善饮食,尚无批准上市的NAFLD 治疗药物,因此,开发安全低毒且药效确切的治疗药物迫在眉睫。NAFLD 发病机制复杂,可能涉及多种代谢和免疫因素,最近的研究表明,肠道菌群在NAFLD的发生发展中扮演着重要的角色[2],肠道菌群可通过影响肠道代谢产物[3]、改变肠黏膜屏障通透性、增加菌群易位等方式影响肝脏疾病进程。NAFLD的严重程度与肠道生态和共生细菌代谢功能失调有关[4],因此,肠道微生物群的调节可作为改善NAFLD的有效策略。
异甘草素是一种从中药甘草Glycyrrhiza uralensisFisch.根和根茎中分离得到的天然类黄酮,可通过调节肝细胞脂质代谢、降低炎症反应等病理情况发挥改善NAFLD的作用[5],且有效剂量下的异甘草素在体内外对正常细胞的毒性作用非常小[6],具有开发成NAFLD治疗药物的潜在价值。有研究表明,异甘草素可通过调节肠道菌群结构来降低结肠炎相关直肠癌的发病率[7],但其对NAFLD 小鼠肠道菌群的调节作用及其治疗NAFLD的关系尚未完全阐明。基于此,本研究拟以高脂饮食(high-fat diet,HFD)诱导NAFLD小鼠模型,通过探讨异甘草素对NAFLD模型小鼠肠道菌群和肠屏障功能的调控作用,阐明其改善NAFLD的作用机制。
1 材料
1.1 主要仪器
本研究所用主要仪器有ChemiDoc MP型成像系统、PowerPac Basic 型电泳系统(美国Bio-Rad 公司),EG1150H+C型组织包埋机(德国Leica公司),QuantStudioTM3 型实时荧光定量聚合酶链式反应(PCR)仪(美国Thermo Fisher Scientific 公司),QuantiFluorTM-ST 型蓝色荧光定量系统(美国Promega 公司),K5800/C/H/T 型超微量分光光度计(北京凯奥科技发展公司)等。
1.2 主要药品与试剂
异甘草素(批号I111283,纯度99%)购自上海阿拉丁生化科技有限公司;BCA 蛋白检测试剂盒(批号P0010)购自上海碧云天生物技术有限公司;增强化学发光(ECL)试剂盒、兔源闭合蛋白4(Claudin-4)单克隆抗体、兔源闭合蛋白(Occludin)单克隆抗体(批号分别为KF8001、ab210796、ab216327)均购自英国Abcam 公司;鼠源β-actin单克隆抗体(批号T0022)购自江苏亲科生物研究中心;兔源紧密连接蛋白1(ZO-1)多克隆抗体(批号21773-1-AP)购自武汉三鹰生物技术有限公司;辣根过氧化物酶标记的羊抗兔免疫球蛋白G(IgG)、辣根过氧化物酶标记的羊抗小鼠IgG(批号分别为BA1054、BA1050)均购自武汉博士德生物工程有限公司;丙氨酸转氨酶(alanine aminotransferase,ALT)试剂盒、天冬氨酸转氨酶(aspartate aminotransferase,AST)试剂盒、总胆固醇(total cholesterol,TC)测定试剂盒和TG测定试剂盒(批号分别为C009-2-1、C010-2-1、A111-1-1、A110-1-1)均购自南京建成生物工程研究所有限公司;白细胞介素6(interleukin-6,IL-6)、IL-1β、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)的酶联免疫吸附测定(ELISA)试剂盒均购自深圳欣博盛生物科技有限公司。
1.3 实验动物和饲料
本研究所用6 周龄雄性C57BL/6J 小鼠由广东省医学实验动物中心提供,体重18~20 g,动物生产许可证号为SCXK(粤)2018-0002。将小鼠饲养在SPF 实验室中,环境温度为(25±2)℃,湿度为50%~75%,在光照12 h(早上7:00 至晚上19:00)和黑暗12 h(晚上19:00至早上7:00)循环中饲养。小鼠适应性喂养2 周后,进行后续实验。本次动物实验经中国科学院大学深圳医院伦理委员会批准(批准号为LL-KT-2021062)。
高脂肪饲料(蛋白质20%、脂肪60%、碳水化合物20%)购自戴茨生物科技(无锡)有限公司。
2 方法
2.1 动物分组、造模与给药
将30只小鼠随机分为3组,每组10只:正常组(简写为“NFD 组”)饲喂普通饲料和饮用水,模型组(简写为“HFD 组”)和异甘草素组(简写为“ISL 组”)饲喂高脂饲料19 周建立NAFLD 模型。根据前期研究与本次研究目的,在造模同时,ISL 组按100 mg/kg 灌胃异甘草素[8],其余各组灌胃等量超纯水,每日1次,然后每周测定小鼠体重。在实验过程中,NFD 组和HFD 组小鼠因同笼打斗均死亡2只。在实验最后一天,收集小鼠粪便,液氮速冻,然后于-80 ℃保存备用;随后禁食18 h,摘眼球取血后颈椎脱臼处死。取小鼠白色脂肪(腹股沟脂肪和附睾脂肪)和棕色脂肪组织、肝脏和结肠组织,分别称重,计算器官指数,器官指数=器官质量/体重;组织样本液氮速冻,然后于-80 ℃保存,或以4%多聚甲醛进行固定,用于后续实验。所有动物实验操作均符合实验伦理。
2.2 小鼠肝脏组织、结肠组织的病理变化及肝脏脂质堆积情况观察
将小鼠肝脏或结肠组织置于4%多聚甲醛中固定24 h,经过脱水、石蜡包埋、组织梯度脱水等操作后,使用切片机进行切片,再进行苏木素-伊红(HE)染色,以甘油封片后在显微镜下观察并置于切片扫描仪中扫描,观察肝脏或结肠组织的病理形态,然后根据肝脏病理改变计算非酒精性脂肪性肝病活动评分(NAFLD activity score,NAS)。取冷冻的小鼠肝脏组织进行切片,待切片干燥后在10%多聚甲醛中固定15 min;以蒸馏水轻轻漂洗,在60%异丙醇溶液中浸洗5 min,然后置于油红O染色液中染色15 min;以蒸馏水漂洗染色液,再置于苏木素染色液中浸染30 s;以蒸馏水洗净染色液,经甘油封片后扫描,观察肝脏脂质积累情况(脂质被染成红色),并使用Image-Pro Plus 6.0软件计算脂质染色面积占比。
2.3 小鼠肝脏组织或血清中脂质与肝功能指标的检测
取各组小鼠部分肝脏组织进行匀浆,作为肝脏组织样品。将小鼠全血以3 000 r/min 离心,取上清液,作为血清样品。取上述两种样品,根据试剂盒说明书方法,检测肝脏组织或血清中TC、TG、ALT和AST的水平。
2.4 小鼠血清中炎症因子水平的检测
取“2.3”项下血清样品,根据试剂盒说明书方法,检测小鼠血清中IL-6、IL-1β和TNF-α的水平。
2.5 小鼠肝脏组织中炎症因子mRNA表达水平的检测
采用TRIzol 试剂从小鼠肝脏组织中分离总RNA,再将其逆转录为cDNA,以cDNA 为模板进行荧光定量PCR。采用2-ΔΔCt法,以Actb为内参,计算IL-6、IL-1β、TNF-α 的 mRNA 表达水平。引物序列及扩增产物长度见表1。

表1 引物序列及扩增产物长度
2.6 小鼠粪便的16S rRNA测序
将收集的各组小鼠粪便样本进行16S rRNA 测序。采用DNA提取试剂盒提取基因组DNA,扩增16S rRNA基因V3-V4 区,纯化扩增子,制备测序文库,进行Illumina 测序分析,原始数据经过拼接质控后生成OTUs(operational taxonomic units)聚类。将样品进行区分后基于美吉生物云平台(https://www.majorbio.com)进行OTUs 聚类分析和物种分析。根据分类信息,可以在不同的分类层次上统计分析群落结构,然后对各组OTUs聚类进行β多样性分析(主成分分析和主坐标分析)、物种组成分析(形成群落组成Bar 图)、LEfSe 多级物种差异判别分析等,同时制作属水平群落热图等。
2.7 小鼠各项指标与肠道菌群丰度的Spearman 相关性分析
将每只小鼠的各项检测参数(包括体重,肝脏质量,肝指数,血清中TNF-α、IL-1β、IL-6 水平,肝脏中TC 水平,血清中TC、ALT 水平)与候选菌属的相对丰度导入SangerBox 软件中的相关分析工具进行Spearman 相关性分析,导出相关性热图,红色代表正相关,绿色代表负相关,颜色越深代表相关性越大。
2.8 小鼠结肠组织中肠屏障功能相关蛋白表达水平的检测
称取各组小鼠(3 只)结肠组织适量进行匀浆,于4 ℃下以12 000 r/min离心15 min;取上清液,用BCA蛋白检测试剂盒测定其浓度并加热变性。取蛋白样品进行十二烷基硫酸钠-聚丙酰胺凝胶电泳,再转移到PVDF膜上,室温封闭并于特定的一抗(Claudin-4、Occludin、ZO-1的稀释度均为1∶1 000,β-actin的稀释度为1∶10 000)中孵育过夜,然后用特异性二抗进行印迹。采用化学发光检测试剂盒检测免疫反应性,以β-actin 为内参,采用Image J软件进行分析,以目的蛋白与内参的灰度值比值表示其表达水平。实验重复3次。
2.9 统计学方法
采用Graphpad Prism 8 软件进行统计学分析和图表绘制。计量资料以±s表示,多组间比较采用单因素方差分析和Tukey检验。菌群相对丰度采用Kruskal-Wallis 秩和检验和Wilcoxon 秩和检验。检验水准α=0.05。
3 结果
3.1 异甘草素对NAFLD模型小鼠肥胖症状的影响
如图1所示,随着实验的推进,HFD 组小鼠体重逐渐高于NFD组小鼠,而经异甘草素干预后小鼠体重曲线与NFD组接近。与NFD组比较,HFD组小鼠体重、肝指数、白色脂肪指数均显著升高(P<0.05),棕色脂肪指数显著降低(P<0.05);与HFD 组比较,ISL 组小鼠上述指标(白色脂肪指数除外)均显著逆转(P<0.05)。结果见表2。

图1 各组小鼠体重变化情况
表2 各组小鼠肝指数、白色脂肪指数和棕色脂肪指数的检测结果(±s)
a:与NFD组比较,P<0.05;b:与HFD组比较,P<0.05。
n 组别NFD组HFD组ISL组8 8 10体重/g 28.40±0.69 35.48±1.11a 31.00±0.41b肝指数0.039±0.001 9 0.048±0.000 6 a 0.042±0.002 9 b白色脂肪指数0.013±0.005 5 0.034±0.008 3a 0.028±0.006 7棕色脂肪指数0.003 1±0.000 53 0.001 9±0.000 37a 0.002 6±0.000 35b
3.2 异甘草素对NAFLD 小鼠肝脏组织病理变化及脂质堆积的影响
NFD 组小鼠肝脏组织细胞排列整齐;与NFD 组比较,HFD 组小鼠肝细胞肥大、空泡化、炎症细胞浸润,NAS 和脂质染色面积占比均显著增加(P<0.05);与HFD组比较,ISL组小鼠肝脏组织炎症与损伤显著改善,NAS 和脂质染色面积占比均显著减少(P<0.05)。结果见图2、表3。
表3 各组小鼠肝脏NAS 和脂质染色面积的检测结果(±s)
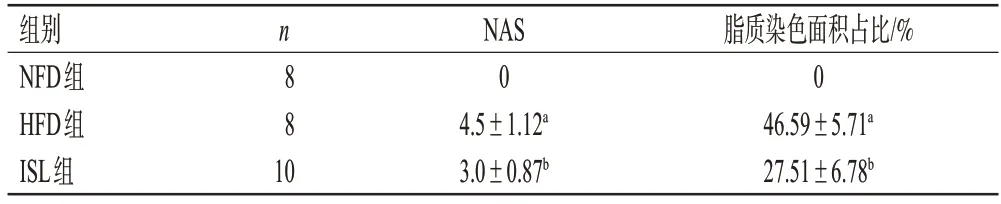
表3 各组小鼠肝脏NAS 和脂质染色面积的检测结果(±s)
a:与NFD组比较,P<0.05;b:与HFD组比较,P<0.05。
n 组别NFD组HFD组ISL组8脂质染色面积占比/%0 46.59±5.71a 27.51±6.78b 8 10 NAS 0 4.5±1.12a 3.0±0.87b
3.3 异甘草素对NAFLD 小鼠脂质含量与肝功能指标水平的影响
与NFD组比较,HFD组小鼠肝脏和血清中TC水平以及血清中AST、ALT 水平均显著升高(P<0.05);与HFD组比较,ISL组小鼠上述指标水平均显著降低(P<0.05)。结果见表4。
表4 各组小鼠肝脏和(或)血清中TC、TG、AST、ALT水平的检测结果(±s)
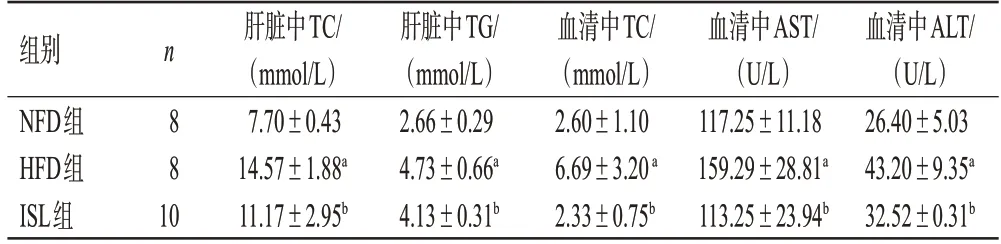
表4 各组小鼠肝脏和(或)血清中TC、TG、AST、ALT水平的检测结果(±s)
a:与NFD组比较,P<0.05;b:与HFD组比较,P<0.05。
n 组别NFD组HFD组ISL组8 8 10肝脏中TC/(mmol/L)7.70±0.43 14.57±1.88a 11.17±2.95b肝脏中TG/(mmol/L)2.66±0.29 4.73±0.66a 4.13±0.31b血清中TC/(mmol/L)2.60±1.10 6.69±3.20 a 2.33±0.75b血清中AST/(U/L)117.25±11.18 159.29±28.81a 113.25±23.94b血清中ALT/(U/L)26.40±5.03 43.20±9.35a 32.52±0.31b
3.4 异甘草素对NAFLD 小鼠血清中炎症因子水平的影响
与NFD 组比较,HFD 组小鼠血清中IL-6、IL-1β 和TNF-α水平均显著升高(P<0.05);与HFD组比较,ISL组小鼠上述指标水平均显著降低(P<0.05)。结果见表5。
表5 各组小鼠血清中炎症因子水平的检测结果(±s,pg/mL)

表5 各组小鼠血清中炎症因子水平的检测结果(±s,pg/mL)
a:与NFD组比较,P<0.05;b:与HFD组比较,P<0.05。
n 组别NFD组HFD组ISL组8 TNF-α 224.67±95.37 337.22±93.27a 208.10±37.80b 8 10 IL-6 78.70±16.11 105.28±11.75 a 60.39±17.84 b IL-1β 65.67±14.33 120.39±27.22 a 67.59±23.03 b
3.5 异甘草素对NAFLD 小鼠肝脏组织中炎症因子mRNA表达水平的影响
与NFD 组比较,HFD 组小鼠肝脏组织中TNF-α mRNA 表达水平均显著升高(P<0.05),IL-6、IL-1β mRNA 表达水平升高,但差异无统计学意义;与HFD 组比较,ISL 组小鼠TNF-α mRNA 表达水平均显著降低(P<0.05),IL-6、IL-1β mRNA 表达水平降低,但差异无统计学意义。结果见表6。
表6 各组小鼠肝脏组织中炎症因子mRNA 表达水平的检测结果(±s)

表6 各组小鼠肝脏组织中炎症因子mRNA 表达水平的检测结果(±s)
a:与NFD组比较,P<0.05;b:与HFD组比较,P<0.05。
n 组别NFD组HFD组ISL组8 TNF-α mRNA 1.00±0.48 5.35±0.56a 3.92±0.38b 8 10 IL-6 mRNA 1.00±0.55 1.30±0.60 0.90±0.10 IL-1β mRNA 1.00±0.14 1.16±0.30 0.69±0.10
3.6 异甘草素对NAFLD小鼠肠道菌群结构的影响
16S rRNA 基因测序从26 个样本中产生了890 154个序列,根据97%的相似性将序列分为984 个OTUs。采用主成分分析和主坐标分析对各样本进行差异分析,如图3所示,各组样本聚集度均较好,但HFD 组与NFD组差异较大,HFD 组和ISL 组之间也有明显距离,说明各组样本间差异明显。在3组小鼠肠道中,Firmicutes门和Bacteroidetes门占主导地位。与NFD组比较,HFD组小鼠的Firmicutes/Bacteroidetes 值显著升高;与HFD 组比较,ISL 组小鼠的Firmicutes/Bacteroidetes 值显著降低(P<0.05),结果见图4。图5 展示了小鼠肠道菌群种属中总丰度排名前50的菌属,其中异甘草素可部分逆转因NAFLD改变的属水平肠道菌群丰度。
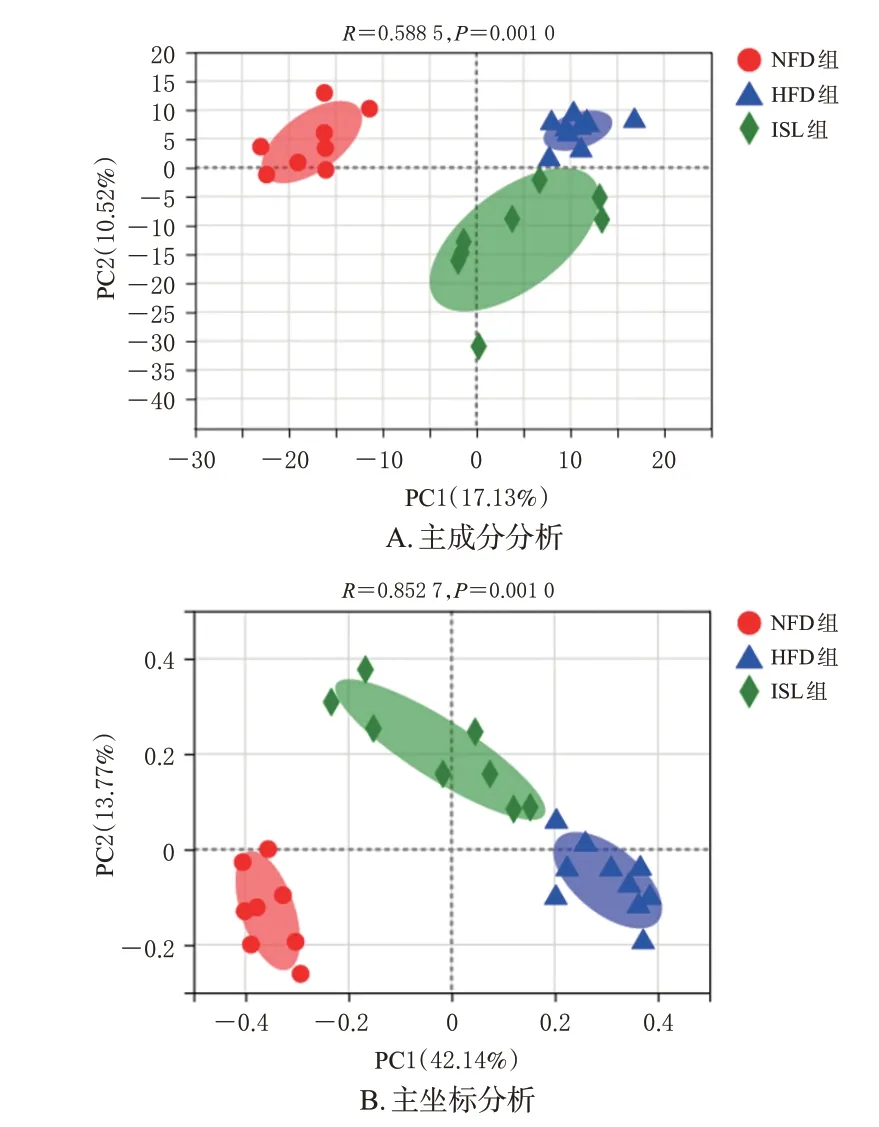
图3 小鼠肠道菌群的β多样性分析

图4 各组小鼠肠道菌群门水平群落组成
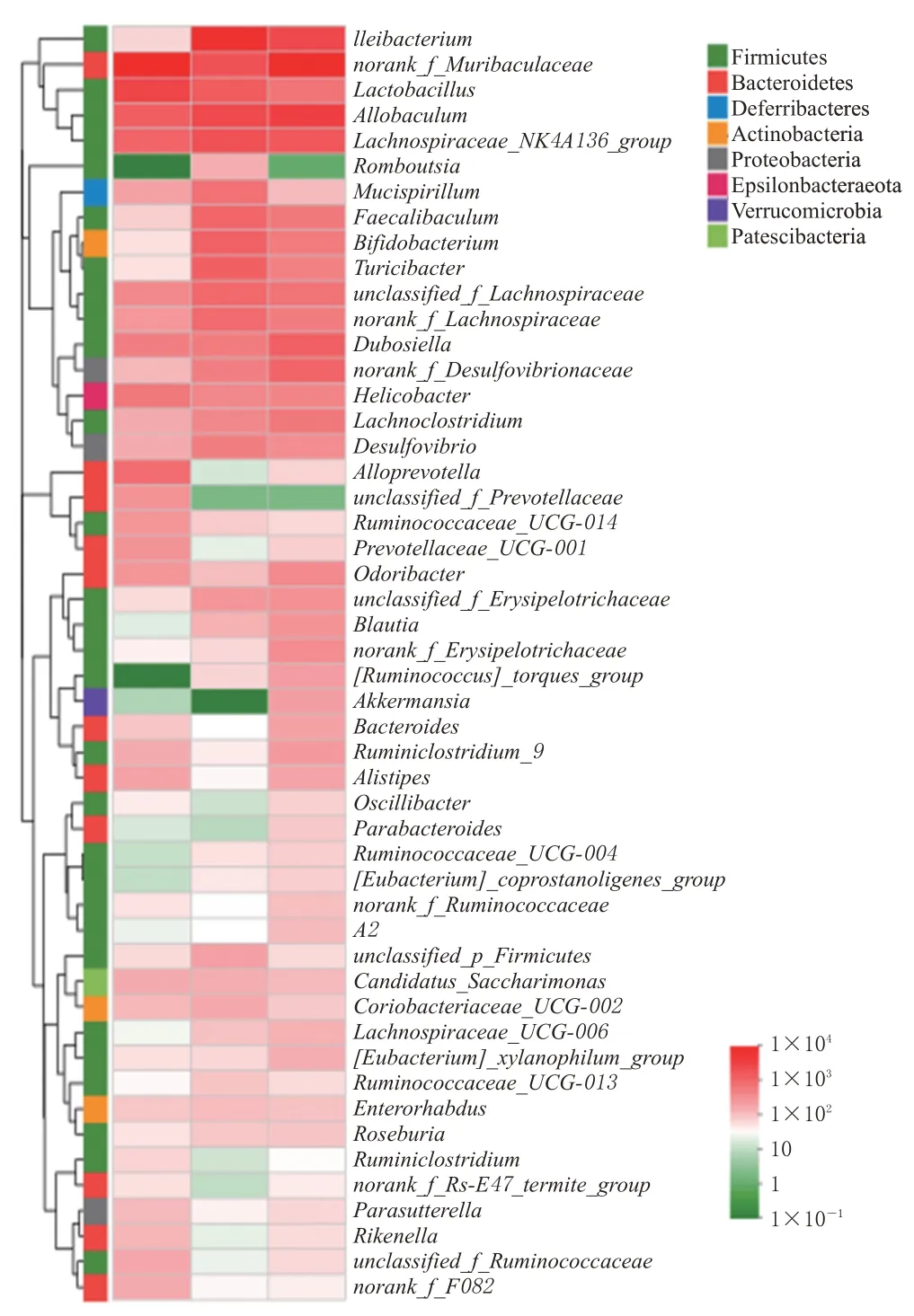
图5 各组小鼠肠道菌群属水平群落的热图
采用LEfSe 分析检测丰度差异显著的特征,寻找显著差异的种属,结合小鼠肠道菌群种属总丰度排名前50的菌属结果,筛选出异甘草素可显著影响的10个代表性菌属,其中可显著上调NAFLD小鼠肠道中益生菌norank_f_Muribaculaceae、Odoribacter、Ruminiclostridium、Akkermansia的相对丰度,显著下调有害菌Desulfovibrio、norank_f_Lachnospiraceae、unclassified_p_Firmicutes、Ileibacterium、unclassified_f_Lachnospiraceae、Turicibacter的相对丰度(P<0.05)。结果见图6。

图6 10个代表性菌属相对丰度的组间比较
3.7 小鼠各项指标与肠道菌群丰度的相关性分析结果
基于上述10个代表性菌属发现,有4个菌属与小鼠NAFLD 指标呈负相关,6 个菌属呈正相关,其中相关性较大的菌属包括norank_f_Muribaculaceae,Odoribacter,Akkermansia,Ileibacterium,unclassified_p_Firmicutes等,结果见图7。
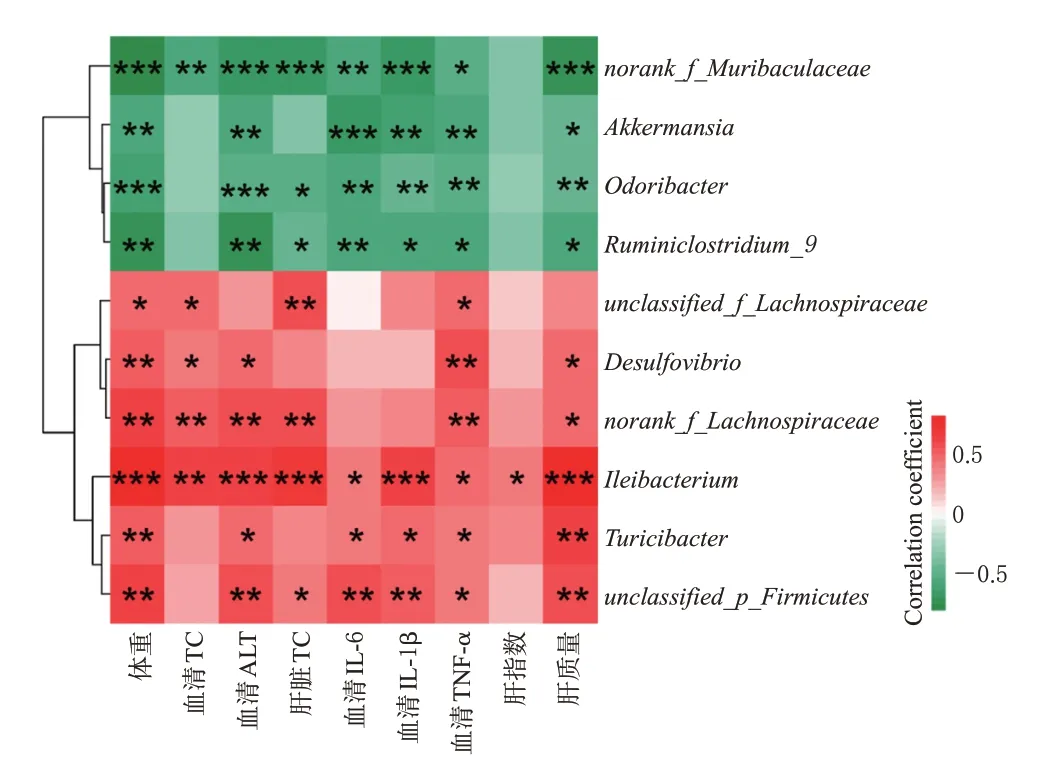
图7 肠道菌属与小鼠代谢参数的相关性分析
3.8 异甘草素对NAFLD小鼠肠黏膜屏障功能的影响
结肠组织病理染色结果显示,NFD组小鼠肠道绒毛较为完整,未出现病理改变;与NFD 组比较,HFD 组小鼠肠道绒毛完整性受损,出现少量炎症细胞浸润,Claudin-4、Occludin、ZO-1 蛋白表达水平均显著降低(P<0.05);与HFD组比较,ISL组小鼠肠道有明显改善,上述指标水平均显著升高(P<0.05)。结果见图8、图9、表7。
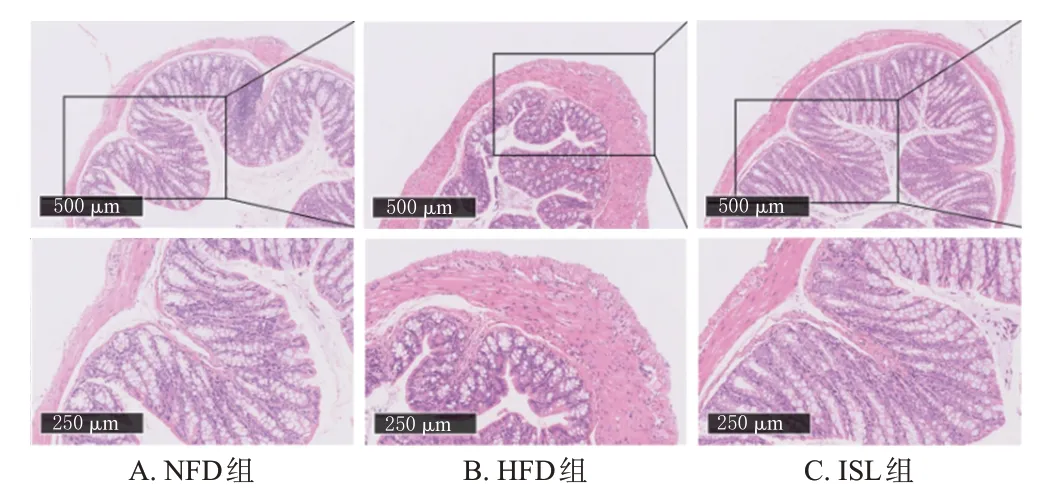
图8 各组小鼠结肠组织病理形态观察结果

图9 各组小鼠肠屏障功能相关蛋白表达的电泳图
表7 各组小鼠肠黏膜屏障功能相关蛋白表达水平的检测结果(±s,n=3)

表7 各组小鼠肠黏膜屏障功能相关蛋白表达水平的检测结果(±s,n=3)
a:与NFD组比较,P<0.05;b:与HFD组比较;P<0.05。
组别NFD组HFD组ISL组Claudin-4/β-actin 1.00±0.26 0.42±0.05a 1.22±0.13b Occludin/β-actin 1.00±0.05 0.66±0.03a 0.90±0.15b ZO-1/β-actin 1.00±0.17 0.38±0.06a 0.76±0.10b
4 讨论
NAFLD的发病机制目前并未完全阐明,脂质代谢、炎症和纤维化是研究治疗NAFLD药物时重点关注的方向[9]。异甘草素抗炎作用明确,本研究表明其可以显著减缓NAFLD小鼠体重的增加速度,改善肝脏脂质积累、炎症和损伤,具有良好的护肝抗炎作用,可有效缓解NAFLD 症状。棕色脂肪组织是一种独特的产热组织,在新陈代谢和能量消耗中起重要作用,最近已成为对抗肥胖、糖尿病和NAFLD 等代谢性疾病的靶标[10]。本研究发现,异甘草素可显著升高NAFLD 小鼠棕色脂肪指数,从而增加小鼠机体能量消耗效率。
肠道菌群失调在NAFLD发展中起关键作用。肠道和肝脏之间的相互作用,称为“肠-肝轴”。肠道菌群产生的代谢产物通过门静脉随血流进入肝脏,包括酚类、乙醛、氨以及其他促炎成分,如肽聚糖和脂多糖等,这些代谢产物可启动先天性免疫系统,从而导致肝脏炎症的发生[11]。本研究通过16S rRNA 菌群测序发现,异甘草素可改善NAFLD 模型小鼠的肠道菌群紊乱情况,结合LEfSe 分析结果,筛选出10 个异甘草素显著调控的菌属;结合Spearman 相关分析发现,异甘草素可显著上调益生菌norank_f_Muribaculaceae和Akkermansia(这两种菌与NAFLD 相关指标呈负相关),可显著下调有害菌Ileibacterium、Turicibacter(这两种菌与NAFLD 相关指标呈正相关)。相关研究发现,Akkermansia可代谢产生丙酸盐,从而激活G蛋白偶联受体43,缓解NAFLD造成的脂肪积累,降低胰岛素抵抗;且Akkermansia表面的配体可结合肠道黏膜表面的Toll 样受体2,从而改善肠道炎症和肠黏膜屏障损伤[12]。Ileibacterium被报道其丰度与结肠炎和动脉粥样硬化呈正相关[13―14]。肠黏膜屏障对于吸收人体必需营养物质以及防止肠道有害微生物入侵至关重要,其功能改变可导致肠道黏膜通透性增加。Claudin-4、Occludin、ZO-1 等肠道屏障功能相关蛋白的表达下降,可增加细菌产生的病原体相关分子模式从肠道中经肝门静脉进入肝脏的可能性,进而引起肝脏炎症,促进NAFLD的进程[15]。本研究结果显示,异甘草素可显著升高肠道屏障功能相关蛋白的表达水平。这提示,异甘草素可通过调节肠道菌群,改善肠黏膜屏障,进而缓解NAFLD。
综上所述,异甘草素可显著延缓NAFLD的进展,其作用机制可能与调节肠道菌群、改善肠屏障功能有关。

