三色散凝胶贴膏原料药提取工艺的优化Δ
冯明庆 ,杨 楠 ,方 媛 ,廖太阳 ,王培民 ,刘子修 #(1.南京中医药大学附属医院骨伤科,南京210029;2.江苏省中医院骨伤科,南京 210029)
膝骨关节炎(knee osteoarthritis,KOA)是涉及到软骨、软骨下骨、韧带、关节囊、滑膜以及周边肌肉等结构改变的一种退行性疾病[1]。近年来由于人们生活习惯的改变,KOA已成为一种常见的疾病,对患者个人和卫生保健系统都造成很大的影响[2]。目前,针对KOA的主要治疗手段有口服非甾体抗炎药、对乙酰氨基酚[3],关节腔内注射皮质类固醇、玻璃酸钠等[4]。然而非甾体抗炎药虽然具有一定疗效,但易引起心血管疾病,对乙酰氨基酚则会引起过敏及胃肠道不良反应;关节腔内注射则易引起感染,且可能对软骨造成不良影响[5]。
江苏省中医院自主研发改进的“三色散”方可有效改善膝关节肿胀、疼痛,以及膝关节功能障碍等临床症状[6],对软组织急慢性损伤及足跟疼痛也有显著治疗效果[7]。本课题组在前期研究中使用三色散药材粉碎后的药粉颗粒制备凝胶贴膏,以综合感官、初黏力、持黏力、剥离强度为评价指标筛选基质处方,得到传统工艺凝胶贴膏的最佳配比[8],然而也发现药粉颗粒作为原料药制备所得的凝胶贴膏内含杂质较多,手感较为粗糙;但若只进行粉碎过筛,所得产物中含有大量不含药理活性的成分,在目前固定投药量的制备方法下有效成分的含量低于溶剂提取方法,且存在不便于贮存及较难制定质量评价标准的缺点。故本研究通过比较三色散凝胶贴膏原料药在不同提取方式下制备所得的凝胶贴膏的抗炎镇痛药效与方中主要成分的含量,来优化其提取方式。
1 材料
1.1 主要仪器
Alliance 2695e 型高效液相色谱仪购自沃特世科技(上海)有限公司;7500型实时定量PCR仪购自美国Applied Biosystems 公司;35150 型冷热板购自意大利Ugo Basile 公司;Enspire 型酶标仪购自珀金埃尔默企业管理(上海)有限公司;BioPhotometer型核酸蛋白测试仪购自德国Eppendorf公司;Mini-protein Tetra型电泳及转膜仪购自美国Bio-Rad 公司;LAS4000 型超灵敏化学发光成像系统购自美国GE公司;MS105DU型电子天平购自梅特勒托利多科技(中国)有限公司。
1.2 主要药品与试剂
三色散(由蔓荆子、紫荆皮、当归、木瓜、丹参、赤芍、白芷、片姜黄、独活、羌活、天花粉、川牛膝、威灵仙、防己、防风、马钱子、秦艽、连翘、川芎、甘草按16∶16∶4∶4∶4∶4∶4∶4∶4∶4∶4∶4∶4∶4∶4∶4∶2∶2∶2∶1 的质量比混合而成,批号Z04000566)购自江苏省中医院中药房;蔓荆子黄素对照品(批号111554-201705,纯度98.30%)购自中国食品药品检定研究院;马钱子碱、士的宁对照品(批号分别为RP200721、RP190320,纯度分别为99.58%、98.84%)均购自成都麦德生科技有限公司;RNA extraction kit(批号RN001)购自上海奕杉生物科技有限公司;BCA 蛋白检测试剂盒、RIPA强裂解液、5×蛋白上样缓冲液(批号分别为P0012、P0013B、P0015)均购自上海碧云天生物技术有限公司;小鼠肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素6(interleukin-6,IL-6)、IL-1β 单克隆抗体(批号分别为sc-52746、sc-57315、sc-12742)均购自美国Santa Cruz 公司;小鼠β-actin 单克隆抗体(批号66009-1-Ig)购自武汉三鹰生物科技有限公司;辣根过氧化物酶标记的山羊抗小鼠IgG(H+L)多克隆二抗(批号bs-0296G-HRP)购自北京博奥森生物技术有限公司;胰酶(批号BL512A)购自南京顺捷生物科技有限公司;降钙素基因相关肽(calcitonin gene-related peptide,CGRP)、前列腺素E2(prostaglandin E2,PGE2)、P 物质(substance P,SP)及环氧合酶2(cyclooxygenase-2,COX-2)酶联免疫吸附测定(ELISA)试剂盒(批号分别为ml003082、ml00303、ml003119、ml058808)均购自上海酶联生物科技有限公司。其余试剂均为分析纯。
1.3 动物
SPF级雄性SD大鼠25只,3月龄,体重250~280 g,购自北京维通利华实验动物技术有限公司,生产许可证号为SCXK(京)2021-0011。大鼠饲养于南京中医药大学实验动物中心。实验经过南京中医药大学实验动物伦理委员会审批(伦理批号A211207)。
2 方法与结果
2.1 筛选三色散凝胶贴膏原料药的提取方式
2.1.1 药物分组及制备
(1)传统工艺组:按相关专利[9]所述方法制备凝胶贴膏。将乙二胺四乙酸、甘羟铝、聚丙烯酸钠加入甘油中,在反应釜内搅拌7 min,作为A 相;将聚丙烯酸酯、聚丙烯酸水溶液、薄荷脑、樟脑、防腐剂和150 g 三色散粉(过800 目筛)加入纯水中,搅拌10 min,作为B 相;将酒石酸加入纯水中,超声使其充分溶解,作为C相;将共计1 000 g 的A、B、C 按约12∶23∶5 比例相混合,真空搅拌15 min,涂布在背衬层,盖上防黏膜,即得15%载药量的凝胶贴膏。
(2)水提组:将过800 目筛的三色散粉加水浸泡0.5 h后加入10倍纯水加热回流提取1 h,过滤后取滤渣按相同条件重复提取1次,过滤后合并2次滤液,减压浓缩后按传统工艺组方法制备15%载药量的水提物凝胶贴膏。
(3)醇提组:将过800 目筛的三色散粉加水浸泡0.5 h 后加入10 倍75%乙醇加热回流提取1 h,过滤后取滤渣按相同条件重复提取1次,过滤后合并2次滤液,减压浓缩后按传统工艺组方法制备15%载药量的醇提物凝胶贴膏。
2.1.2 动物KOA模型的建立、分组及给药
取20 只大鼠,采用前交叉韧带横断术建立KOA 模型[10],使用3%戊巴比妥钠溶液按2 mL/kg剂量将大鼠麻醉,脱毛备皮并消毒。切开关节囊,打开关节腔后将髌骨内外侧脱位,屈曲膝关节显露前交叉韧带,直视下用手术刀切断,并行抽屉实验确定前交叉韧带是否断裂。止血、髌骨复位并缝合,连续3 d 肌注青霉素钠以防感染。
造模成功后,将大鼠分为模型组、醇提组、传统工艺组、水提组,每组5 只。另取5 只大鼠,不做任何处理作为空白组。除了空白组与模型组外,醇提组、传统工艺组与水提组于大鼠造模成功后14 d,参照临床组方按0.08 g/cm2剂量分别给药[11],每日1次,连续给药28 d。
2.1.3 冷热板致痛实验
给药28 d 后,将5 组大鼠分别放于(55±0.5)℃与(0±3)℃冷热板仪上,以舔后足作为痛反应指标,记录其疼痛阈值。采用SPSS 26.0 软件对数据进行统计分析,使用Graphpad Prism v8.0.2.263软件绘图。实验数据以±s表示,多组间比较采用单向或双向方差分析,组间比较采用Tukey检验。检验水准α=0.05。
热板法和冷板法的大鼠疼痛阈值变化见图1。与空白组比较,模型组大鼠的冷痛阈值与热痛阈值均显著下降(P<0.05);与模型组比较,各给药组大鼠的冷痛阈值和热痛阈值(除传统工艺组外)均显著升高(P<0.05),表明三色散凝胶贴膏提取工艺改进后对KOA 大鼠冷、热痛具有良好的缓解作用,可提高疼痛耐受能力;与传统工艺组比较,醇提组与水提组的大鼠热痛阈值均显著升高(P<0.05),表明醇提组与水提组提取物制备的凝胶贴膏对KOA大鼠热痛的缓解作用较传统工艺组凝胶贴膏有改善,而冷痛阈值无显著差异。

图1 各组大鼠冷、热痛阈值的测定结果(n=5)
2.1.4 大鼠取材
在冷热板致痛实验结束后,使用3%戊巴比妥钠溶液按2 mL/kg 剂量麻醉大鼠并进行腹主动脉取血,于4 ℃下按3 000 r/min 离心15 min 后,取上层血清,于-80 ℃冻存备用。消毒大鼠膝关节后两侧横向下刀,打开关节腔,取滑膜组织于冻存管,置于液氮中,于-80 ℃冻存备用。
2.1.5 大鼠血清中疼痛介质CGRP、COX-2、SP、PGE2含量的检测
取“2.1.4”项下血清样品,严格按照ELISA试剂盒说明书进行操作检测CGRP、COX-2、SP、PGE2 的含量,于450 nm波长处检测OD值。统计学方法同“2.1.3”项下。
结果(图2)显示,与空白组比较,模型组大鼠血清中CGRP、COX-2、SP、PGE2含量均显著升高(P<0.05);与模型组比较,各给药组大鼠血清中CGRP、COX-2、SP、PGE2 含量均显著下降(P<0.05);与传统工艺组比较,醇提组大鼠血清中PGE2、COX-2 含量均显著下降(P<0.05)。

图2 各组大鼠血清中疼痛介质CGRP、COX-2、SP、PGE2含量的检测结果(n=5)
2.1.6 大鼠滑膜细胞增殖、炎症细胞浸润、血管入侵程度的检测
取“2.1.4”项下滑膜组织,经石蜡包埋、切片、常规HE染色后,在显微镜下进行观察和拍摄,对滑膜细胞增殖、炎症细胞浸润、血管入侵程度等情况进行评价。HE染色结果(图3)显示,空白组大鼠滑膜细胞排列整齐,几乎无炎症细胞浸润;与空白组比较,模型组大鼠滑膜细胞排列紊乱,炎症细胞浸润明显增加,滑膜纤维化加重,胶原沉积增加,可见较多毛细血管增生;与模型组比较,各给药组大鼠滑膜组织炎症细胞浸润减少,纤维化程度减轻,胶原沉积减少,可见少量毛细血管增生;与传统工艺组比较,醇提组与水提组的大鼠滑膜细胞炎症细胞浸润、滑膜纤维化及胶原沉积进一步减轻;醇提组相较于水提组,大鼠滑膜细胞外表无断裂痕迹,且血管增生与炎症细胞浸润等较少。

图3 各组大鼠滑膜组织的HE染色图
2.1.7 大鼠滑膜组织中IL-1β、TNF-α、IL-6 蛋白表达水平的检测
取适量滑膜组织匀浆后加入适量的RIPA 强裂解液,按照BCA 法测定蛋白浓度,加入5×蛋白上样缓冲液将蛋白煮沸变性,上样电泳,转至PVDF膜上;加入含5%脱脂奶粉的封闭液,摇床振荡1 h,封闭结束后,洗膜3 次;将膜放入含IL-1β、TNF-α、IL-6、β-actin 一抗(稀释比均为1∶500)的平皿中,4 ℃摇床振荡孵育过夜后取出,室温振荡30 min,吸弃一抗,洗膜3次;用5%脱脂奶粉封闭液稀释二抗(稀释比为1∶5 000),室温摇床振荡反应2 h;二抗反应结束后,回收二抗,洗膜3次。滴加适量ECL 工作液进行显色曝光。以目标蛋白与内参蛋白(β-actin)的灰度值比值表示目标蛋白的表达水平。统计学方法同“2.1.3”项下。
结果(图4)显示,与空白组比较,模型组大鼠滑膜组织中IL-1β、TNF-α、IL-6 蛋白表达水平均显著增加(P<0.05);与模型组比较,各给药组大鼠滑膜组织中IL-1β、TNF-α、IL-6 蛋白表达水平均显著降低(P<0.05);与传统工艺组比较,醇提组大鼠滑膜组织中IL-1β 与IL-6 蛋白表达水平均显著降低(P<0.05);水提组大鼠滑膜组织中IL-1β、TNF-α、IL-6 蛋白表达水平与传统工艺组比较,差异均无统计学意义(P>0.05)。
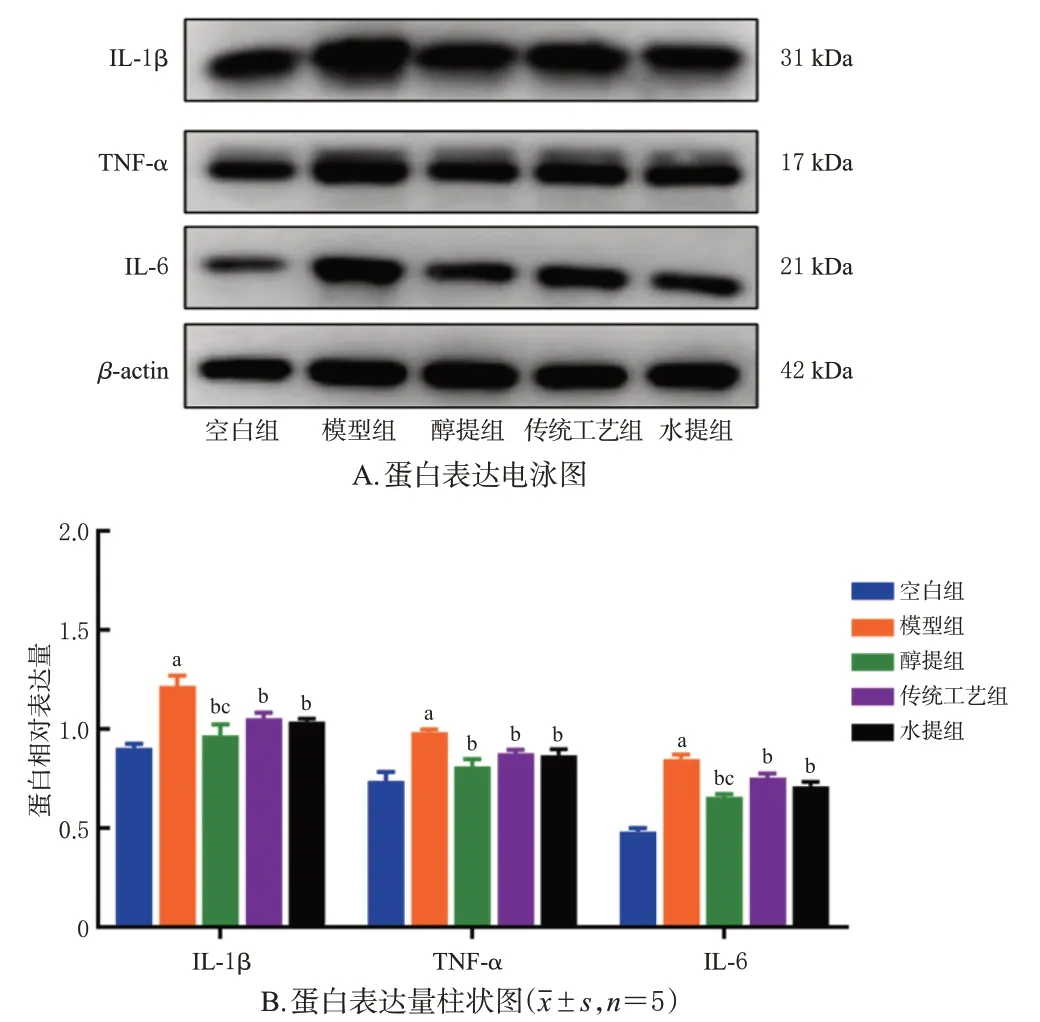
图4 各组大鼠滑膜组织中IL-1β、TNF-α、IL-6 蛋白表达情况
2.1.8 大鼠滑膜组织中IL-1β、TNF-α、IL-6 mRNA 表达水平的检测
按照Trizol法提取滑膜组织总RNA,将符合标准浓度和纯度的RNA 逆转录为cDNA。以cDNA 为模板,β-actin为内参,进行PCR扩增,采用2-ΔΔCt法以ABI 7500 v2.0.5 软件计算各目标基因mRNA 的相对表达量,目标基因及内参基因序列见表1。统计学方法同“2.1.3”项下。

表1 引物序列
结果(图5)显示,与空白组比较,模型组大鼠滑膜组织中IL-1β、TNF-α、IL-6 mRNA 表达水平均显著增加(P<0.05);与模型组比较,各给药组大鼠滑膜组织中IL-1β、TNF-α、IL-6 mRNA 表达水平均显著降低(P<0.05);与传统工艺组比较,醇提组大鼠滑膜组织中IL-1β、IL-6 mRNA表达水平均显著降低(P<0.05),水提组大鼠滑膜组织中IL-6 mRNA 表达水平显著降低(P<0.05)。
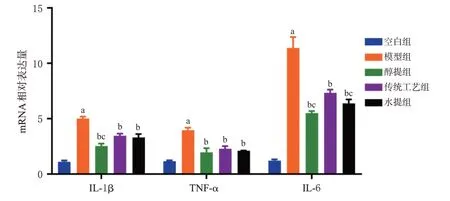
图5 各组大鼠滑膜组织中IL-1β、TNF-α、IL-6 mRNA表达结果(±s,n=5)
2.2 蔓荆子黄素、士的宁和马钱子碱含量测定方法的建立
2.2.1 色谱条件
色谱柱为Kromasil-5-C18(4.6 mm×250 mm,5 μm),以0.1%磷酸溶液为流动相A,乙腈为流动相B进行梯度洗脱(0~15 min,90%A;15~25 min,90%A→55%A;25~40 min,55%A;40~50 min,55%A→10%A;50~60 min,10%A;60~61 min,10%A→90%A;61~75 min,90%A);流速为1.0 mL/min;检测波长为258 nm;进样体积为10 μL;柱温为30 ℃。
2.2.2 混合对照品溶液的制备
精密称取士的宁对照品13.6 mg,置于10 mL容量瓶中,加甲醇溶解并定容摇匀,得1.36 mg/mL 士的宁储备液;精密称取马钱子碱对照品12.8 mg,置于20 mL 容量瓶中,加甲醇溶解并定容摇匀,得0.64 mg/mL 马钱子碱储备液;精密称取蔓荆子黄素对照品12.0 mg,置于25 mL容量瓶中,加甲醇溶解并定容摇匀,得0.48 mg/mL蔓荆子黄素储备液。分别精密量取蔓荆子黄素、士的宁、马钱子碱储备液各2.5 mL,置于50 mL 容量瓶中,加甲醇定容摇匀得混合对照品储备液。精密量取混合对照品储备液1 mL,置于10 mL 容量瓶中,加甲醇定容摇匀即得混合对照品溶液。
2.2.3 供试品溶液的制备
取三色散凝胶贴膏,除去盖衬,剪成0.5 cm×0.5 cm小块,称取12 g,置于圆底烧瓶中,加入氢氧化钠溶液3 mL,静置30 min,加入三氯甲烷50 mL,加热回流4 h;过滤后将滤液转移至50 mL 容量瓶中,使用三氯甲烷定容;精密吸取5 mL上述溶液,转移至10 mL容量瓶中,加甲醇定容摇匀,过0.45 μm微孔滤膜,取滤液,即得。
2.2.4 空白溶剂的制备
量取5 mL三氯甲烷于10 mL容量瓶中,用甲醇稀释定容,即得空白溶剂。
2.2.5 方法学考察
参照2020年版《中国药典》(四部)通则分析方法验证指导原则进行方法学考察。取供试品溶液、混合对照品溶液和空白溶剂,按“2.2.1”项下色谱条件进样检测,结果显示,空白溶剂对士的宁、马钱子碱、蔓荆子黄素的检测无干扰,供试品溶液(去蔓荆子)中其他成分对蔓荆子的检测无干扰,供试品溶液(去马钱子)中其他成分对士的宁、马钱子碱的检测无干扰(图略)。分别精密吸取1、2、3、4、6 mL 混合对照品溶液于20 mL 容量瓶中并定容,摇匀后以0.45 μm微孔滤膜滤过,按“2.2.1”项下色谱条件进样检测,以各对照品的浓度(X)和峰面积(Y)进行线性回归,计算得到蔓荆子黄素的线性方程为Y=61 712X-1 516.5(相关系数为0.996 6),士的宁的线性方程为Y=227 306X-7 905.4(相关系数为0.998 4),马钱子碱的线性方程为Y=192 323X-2 230.4(相关系数为0.999 5),结果表明蔓荆子黄素在0.12~0.72 μg/mL范围内、士的宁在0.34~2.04 μg/mL 范围内、马钱子碱在0.16~0.96 μg/mL 范围内均有良好的线性关系。蔓荆子黄素、士的宁、马钱子碱的精密度、重复性、稳定性(24 h)的RSD 均小于15%(n=6)。蔓荆子黄素、士的宁、马钱子碱平均加样回收率分别为91.46%、96.28%、104.16%,RSD分别为6.1%、4.4%、3.8%(n=6)。
2.3 三色散凝胶贴膏原料药提取工艺的优化
2.3.1 正交试验优化筛选
依据前期单因素实验结果,确定使用三色散细粉(300目)和55%乙醇进行正交试验。选取加醇倍数(A)、提取时间(B)、提取次数(C)、空白(D)作为考察因素,以主要成分蔓荆子黄素(X)、马钱子碱(Y)、士的宁(Z)的含量作为评价指标,进行L9(34)正交试验。因素水平见表2。以综合评分进行统计学分析,综合评分=蔓荆子黄素+马钱子碱+士的宁总分的归一化处理值。正交试验设计与正交试验直观分析见表3,醇提工艺的影响因素为C>B>A,且A1>A2>A3,B3>B1>B2,C2>C3>C1。方差分析表见表4,结果显示,A、B、C三个因素对结果并无显著性影响,根据直观分析表与方差分析表的综合结果,最终选择A1、B3、C2作为提取的最佳条件,即适量三色散细粉加8倍量55%乙醇,加热回流提取90 min,提取2次。

表2 工艺优化的正交试验水平因素表
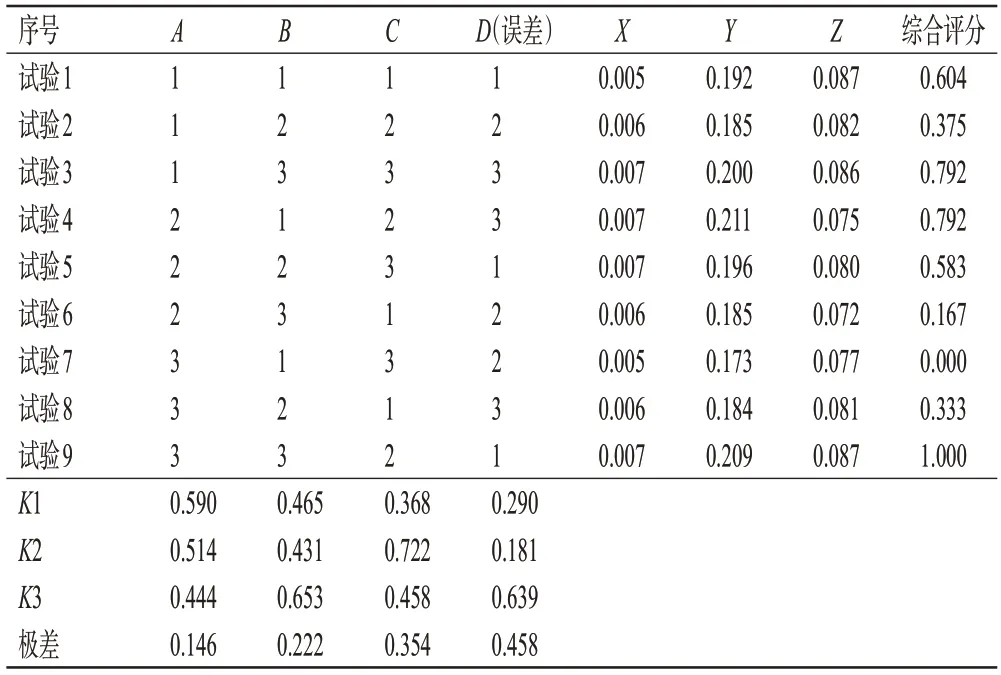
表3 工艺优化的正交试验设计及正交试验直观分析表

表4 工艺优化的正交试验方差分析表
2.3.2 优化工艺验证
按“2.3.1”项下最佳提取条件提取三色散并制备为三色散凝胶贴膏,重复3次,测定得到三色散凝胶贴膏中的蔓荆子黄素、士的宁和马钱子碱含量平均值分别为0.007%、0.092%、0.214%,RSD均小于5%,表明优化的三色散提取工艺稳定、可行。
3 讨论
本课题前期研究建立了三色散凝胶贴膏指纹图谱,为三色散凝胶贴膏的制剂开发提供了质量标准[12]。杨楠等[8]使用三色散药材颗粒制备凝胶贴膏,对三色散凝胶贴膏的辅料进行最佳配比的筛选,得到最佳方案后,通过药理学实验发现凝胶贴膏抗炎镇痛的活性大于三色散传统制法,证明了将三色散贴敷改进为凝胶贴膏剂具有良好的可行性,凝胶贴膏可作为三色散的改进剂型进行后续研究。由于组方中所含药材较多,对每个药材的主要成分都进行测定工作量过大且繁琐,因此,本研究选择君药蔓荆子的主要成分蔓荆子黄素作为组方的标志性成分,相关研究表明其有调节炎症和氧化应激的作用[13],并能抑制活性氧介导的核因子κB信号通路减轻实验性骨关节炎相关的软骨退变[14];马钱子是方中唯一的毒性药物,主要成分士的宁与马钱子碱在治疗KOA上已有广泛应用[15―16]。上述成分含量同时也是凝胶贴膏后续毒理学实验质量标准需关注的部分。综上,最终选择此3 种成分作为本研究及制剂后续研究的考察指标。
本实验通过加热回流提取的方式除去三色散药材颗粒中的杂质,对比水提组、醇提组与传统工艺组大鼠的镇痛行为学实验结果与疼痛介质CGRP、COX-2、SP、PGE2 含量结果,确定乙醇提取所制三色散凝胶贴膏的镇痛效果最佳;对比水提组、醇提组与传统工艺组大鼠的滑膜细胞增殖、炎症细胞浸润、血管入侵程度与滑膜组织中IL-1β、TNF-α、IL-6 蛋白与mRNA 表达水平检测结果,确定乙醇提取所制三色散凝胶贴膏抗炎效果最佳,故选择醇提为最佳提取方式。依据前期单因素实验结果,确定使用三色散细粉(300 目)和55%乙醇进行正交试验,对加醇倍数、提取时间和提取次数进行考察。正交试验结果显示,3 个自变量对试验结果均无显著性影响,推测主要是由于提取方式对成分含量的影响较大,而提取条件更多的是为后续质控提供一个稳定的标准。最后通过正交试验筛选得到三色散提取的最佳工艺为适量三色散细粉加8倍量55%乙醇,加热回流提取90 min,提取2次。
综上所述,本研究优化的三色散原料药提取工艺稳定、可行,解决了传统工艺药效差、原料药储存麻烦的缺陷,筛选得到较佳方案并以此制备凝胶贴膏,为后续制剂的稳定性及安全性评价研究奠定了基础。

