紫丹酸B对糖尿病肾病模型小鼠糖代谢和肾功能的改善作用及机制Δ
刘五梅 ,刘永飞 ,彭 林 ,张海红 ,郭琦丽 ,卢 晶 (1.南昌医学院药学院,南昌 330052;2.江西卫生职业学院药学系,南昌 330052)
糖尿病肾病是糖尿病导致的肾脏病变,严重增加了我国医疗经济负担[1]。其中,糖尿病引起的高血糖和炎症反应是肾小管间质纤维化的主要促进因素[2]。抑制肾小管细胞外基质(extracellular matrix,ECM)沉积和转化生长因子β1(transforming growth factor-β1,TGF-β1)分泌可抑制Ⅳ型胶原蛋白(type Ⅳ collagen,Col Ⅳ)、纤维连接蛋白(fibronectin,Fn)等沉积,可有效阻滞肾小管间质纤维化,延缓糖尿病肾病的发展[3]。此外,核因子E2相关因子2/血红素氧合酶1(nuclear factor erythroid 2-related factor 2/heme oxygenase-1,Nrf2/HO-1)信号通路的抑制、细胞内高血糖引起的活性氧(reactive oxygen species,ROS)产生[4]以及蛋白激酶B(protein kinase B,Akt)/Nrf2信号通路的激活[5]与糖尿病肾病的发展密切相关。
风轮菜Clinopodium chinense(Benth.)O.Ktze.为唇形科风轮菜属多年生草本植物,其味辛、苦,性凉,具有抗肿瘤、抗炎、降血糖等多种药理作用,常用于治疗咽喉肿痛、糖尿病、胆囊炎等疾病[6]。紫丹酸B(tournefolic acid B,TAB)是风轮菜的主要成分之一,具有抗氧化、抗炎、抗心肌缺血等多种生物活性,可减轻ECM的沉积和肾小管间质纤维化[7]。此外,TAB 可以通过阻断大鼠脑皮层神经元中ROS 的积累来减轻谷氨酸引起的神经毒性[8]。同时,TAB还能通过激活Akt信号通路,在心肌缺血再灌注损伤模型中发挥保护作用[9]。这些研究结果表明,风轮菜中的TAB 具有潜在的药用价值,可以应用于糖尿病肾病等相关疾病的治疗和预防。然而,目前尚不清楚TAB 能否通过激活Akt/Nrf2/HO-1 信号通路,进而改善糖尿病肾病。基于此,本研究通过建立糖尿病肾病模型小鼠初步探讨了TAB 对其肾组织糖代谢、肾功能、氧化应激和肾小管间质纤维化的影响,并进一步研究TAB基于Akt/Nrf2/HO-1信号通路的抗氧化和抗纤维化作用,为糖尿病肾损伤的临床治疗提供参考。
1 材料
1.1 主要仪器
Form Steri-Cycle型CO2细胞培养箱、Multiskan Sky-High 型全波长酶标仪均购自美国Thermo Fisher Scientific 公司;TE2000 型荧光显微镜购自日本Nikon 公司;Mini-Protein 型垂直电泳系统、ChemiDoc MP 全能型凝胶成像系统购自美国Bio Rad 公司;强生稳豪倍优型血糖仪购自强生(中国)医疗器械有限公司。
1.2 主要药品与试剂
TAB(分子量为312.063 3 kDa,纯度≥98%)由北京药用植物研究所赠送;盐酸维生素E 肠溶片(批号20201012,规格0.5 g)购自贵州圣济堂制药有限公司;链脲佐菌素(streptozotocin,STZ)(批号为021J2742)均购自美国Sigma公司;血清尿酸、尿素氮、肌酐、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、丙二醛(malondialdehyde,MDA)、胰岛素、尿蛋白、尿微量白蛋白试剂盒(批号分别为20180927、c01311、A00512、S0101S、a00312、20190521、H20311、C03521、20170316)均购自南京建成生物工程研究所有限公司;过碘酸希夫(periodic acidschiff,PAS)染色试剂盒、Masson 染色试剂盒(批号分别为20190712、20200305)均购自北京索莱宝科技有限公司;鼠源8-羟基脱氧鸟苷(8-hydroxydeoxyguanosine,8-OHdG)单克隆抗体、兔源TGF-β1单克隆抗体、Col Ⅳ多克隆抗体、Fn 多克隆抗体、HO-1 单克隆抗体、Nrf2 多克隆抗体、磷酸化Akt(p-Akt)多克隆抗体、β-actin 单克隆抗体(批号分别为GR115731、5832、48508、5830、201734、305290、8226、25831)均购自美国Abcam 公司;辣根过氧化物酶标记的山羊抗兔免疫球蛋白G二抗(批号33101)购自美国Jackson公司。
1.3 动物与饲料
本研究所用动物为4 周龄SPF 级的C57BL/6J 雄性小鼠[10―11],共100只,体重为(15.0±1.5)g,购自北京维通利华实验动物技术有限公司,动物生产许可证号为SCXK(京)2016-0011。本实验方案通过南昌医学院动物伦理委员会批准和审核(伦理号WY.No20191030b0601231),并严格按照实验动物使用和保护的相关规定进行操作。饲养期间小鼠自由进食饮水,动物房内温度稳定在23~25 ℃,每天日光灯照射12 h。高脂饲料(批号ZL20111-0127312.5)购自北京华阜康生物科技股份有限公司。
2 方法
2.1 分组、造模与给药
随机选取12 只小鼠作为正常对照组,给予普通饮食。另外80 只小鼠通过高脂饮食(其中蛋白质占18.14%,脂肪占60.65%,碳水化合物占21.21%)联合小剂量STZ 建立糖尿病肾病小鼠模型[12],具体方法如下:小鼠以相应饲料喂养6周后,禁食12 h,然后一次性腹腔注射5% STZ(50 mg/kg),注射后第3天检测小鼠空腹血糖,当空腹血糖>16.7 mmol/L时,表明糖尿病模型造模成功[13](共造模成功72只糖尿病小鼠);进一步喂养相应饲料10周后,收集糖尿病小鼠尿液,当24 h尿蛋白排泄量>30 mg/dL时,表明糖尿病肾病模型造模成功[13]。最终共造模成功64只糖尿病肾病模型小鼠。
将60 只造模成功的糖尿病肾病模型小鼠随机分为模型组、阳性对照组(维生素E[14],20 mg/kg,剂量参考文献[6]设置)和TAB 低、中、高剂量组(1、2、4 mg/kg,剂量参考文献[4]设置),每组12只。各给药组小鼠灌胃相应药物,正常对照组及模型组小鼠灌胃等量生理盐水,连续4周。
2.2 小鼠糖代谢功能相关生化指标的检测
2.2.1 空腹血糖含量测定
TAB灌胃后,各组小鼠每周用75%乙醇对小鼠尾尖消毒后,于尾静脉处利用血糖仪检测一次空腹血糖(检测前禁食禁水12 h)。
2.2.2 葡萄糖耐量实验和胰岛素耐量实验
葡萄糖耐量实验:给药后第4周,每组小鼠禁食不禁水过夜后,称重,腹腔注射葡萄糖(1.5 g/kg)后,于0、15、30、60、120 min时尾静脉取血0.1 mL,然后检测血糖值,并计算葡萄糖耐量曲线下面积(area under curve,AUC)。
胰岛素耐量实验:给药后第4周,每组随机选取6只小鼠禁食不禁水过夜后,称重,腹腔注射胰岛素(0.75 U/kg)后,于0、15、30、60、120 min时尾静脉取血0.1 mL,然后检测血糖值,并计算胰岛素耐量AUC。
2.2.3 血清胰岛素含量测定
给药后第4周,每组小鼠禁食过夜后,腹腔注射150 mg/kg戊巴比妥钠处死,称重。取小鼠心尖血0.8 mL,以2 000 r/min离心10 min,收集上层血清,采用胰岛素试剂盒检测小鼠血清胰岛素含量。
2.3 小鼠肾脏系数和肾功能相关生化指标水平的检测
2.3.1 肾脏系数
给药后第4 周,每组小鼠进行“2.2.3”项下心尖血取血后,解剖摘取肾脏,称重,计算肾脏系数:肾脏系数(mg/g)=肾脏质量/体重。
2.3.2 血清中尿酸、尿素氮和肌酐水平的测定
给药后第4 周,每组小鼠进行“2.2.3”项下心尖血取血的同时利用眼球采血法收集血液,血样先置于37 ℃条件下1 h,再置于4 ℃下过夜,待血液凝固后,以2 000 r/min 离心10 min,收集上层血清;按照相应试剂盒说明书方法操作分别检测小鼠血清中尿酸、尿素和肌酐水平。
2.3.3 尿微量白蛋白与肌酐比值测定
给药后第4周,每组小鼠放进代谢笼,禁食,采集24 h尿量;按相应试剂盒说明书方法操作,分别检测小鼠尿微量白蛋白和尿肌酐水平,并计算两者的比值。
2.4 小鼠肾组织氧化应激相关生化指标的检测
2.4.1 小鼠肾组织中SOD、GSH-Px和MDA含量测定
“2.3.1”项下肾脏称重后,取一半按照质量体积比1∶9(g/mL)加入生理盐水,2 000 r/min离心15 min,取沉淀研磨制备肾组织匀浆,按相应试剂盒说明书方法操作,检测小鼠肾组织中SOD、GSH-Px和MDA的含量。
2.4.2 小鼠肾组织中8-OHdG含量测定
采用免疫组化法进行检测。取“2.4.1”项下另一半肾组织置于10%甲醛溶液固定48 h,经梯度乙醇脱水浸蜡后进行石蜡包埋、切片(5 μm);取部分切片进行抗原热修复,5%山羊血清封闭非特异抗原,加入8-OHdG 一抗(稀释度1∶200),4 ℃孵育过夜;次日,以磷酸盐缓冲液(PBS)清洗3次,加入相应二抗(稀释度为1∶5 000),37 ℃孵育30 min;以PBS 清洗3 次后,进行DAB 显色和苏木素染色,然后经梯度乙醇脱水、透明、封片。采用荧光显微镜观察切片棕色或棕黑色的阳性区域。
2.5 小鼠肾组织的PAS、Masson染色观察
将“2.4.2”项下剩余切片进行脱蜡水化,取部分切片进行PAS染色,基底膜、系膜基质、糖原及糖蛋白呈紫红色,细胞核呈蓝色。另取部分切片进行Masson 染色,ECM的胶原纤维被染成蓝色,肌纤维和细胞核则呈红色或粉红色。利用荧光显微镜观察肾组织纤维化程度,并用ImageJ V1.8.0软件统计染色面积占比。
2.6 小鼠肾组织中TGF-β1、Fn、Col Ⅳ、p-Akt、Nrf2 和HO-1蛋白表达水平的检测
采用Western blot 法进行检测。使用液氮研磨20 mg肾组织,加入RIPA裂解液置于冰上30 min完全溶解样品后,于4 ℃条件下以12 000 r/min 离心20 min,收集上清液进行BCA 定量,然后进行变性处理。取变性后的蛋白样品进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳和转膜,以5%脱脂牛奶室温封闭1 h,加入TGF-β1、Fn、Col Ⅳ、p-Akt、Nrf2、HO-1、β-actin 一抗(稀释度均为1∶1 000),4 ℃孵育过夜;以PBS 漂洗3 次×5 min,加入相应二抗(稀释度为1∶5 000),室温孵育1 h;以PBS 漂洗3 次×5 min;经显色处理后,进行凝胶成像。采用ImageJ V1.8.0软件分析蛋白条带灰度值,以目标蛋白与内参蛋白β-actin的灰度值比值表示蛋白的表达水平。
2.7 统计分析
3 结果
3.1 TAB 对糖尿病肾病模型小鼠葡萄糖代谢功能的影响
建模第4 周小鼠空腹血糖、血清胰岛素检测及耐量实验结果显示,与正常对照组比较,模型组小鼠空腹血糖、葡萄糖耐量AUC、胰岛素耐量AUC、血清胰岛素含量均显著升高(P<0.05)。与模型组比较,TAB 各剂量组小鼠上述指标均显著降低(P<0.05),且呈剂量依赖性;阳性对照组小鼠上述指标均显著降低(P<0.05)。结果见表1。
表1 各组小鼠葡萄糖代谢功能相关指标的检测结果(±s,n=12)
a:与正常对照组相比,P<0.05;b:与模型组相比,P<0.05;c:与TAB低剂量组相比,P<0.05;d:与TAB中剂量组相比,P<0.05。
组别正常对照组模型组TAB低剂量组TAB中剂量组TAB高剂量组阳性对照组第4周空腹血糖/(mmol/L)5.10±0.42 16.05±0.03a 12.06±0.28b 9.21±0.67bc 5.42±0.61bcd 5.38±0.41b葡萄糖耐量AUC/(mmol·min/L)20.33±1.53 62.33±0.58a 54.00±2.00b 40.67±1.53bc 30.33±2.08bcd 29.27±1.87b胰岛素耐量AUC/(mIU·min/L)34.67±1.53 70.00±1.00a 59.00±1.00b 41.67±0.58bc 38.67±1.53bcd 37.44±2.32b血清胰岛素含量/mIU 10.67±1.53 23.00±1.00a 18.67±1.53b 15.33±0.58bc 12.67±0.58bcd 12.38±0.43b
3.2 TAB对糖尿病肾病模型小鼠肾脏指数和肾功能的影响
与正常对照组相比,模型组小鼠肾脏系数和血清中尿酸、尿素氮、肌酐水平以及尿微量白蛋白与肌酐比值均显著升高(P<0.05)。与模型组比较,TAB 各剂量组小鼠上述指标水平均显著降低(P<0.05),且呈剂量依赖性;阳性对照组小鼠上述指标均显著降低(P<0.05)。结果见表2。
表2 各组小鼠肾脏指数和肾功能相关指标水平的检测结果(±s,n=12)
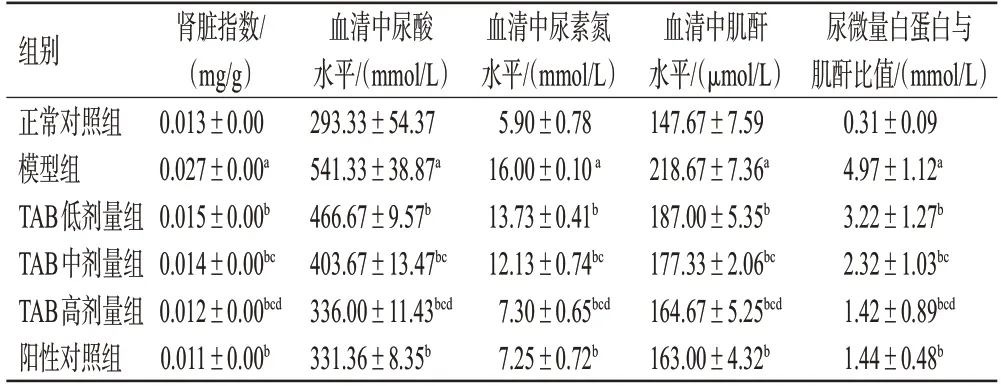
表2 各组小鼠肾脏指数和肾功能相关指标水平的检测结果(±s,n=12)
a:与正常对照组相比,P<0.05;b:与模型组相比,P<0.05;c:与TAB低剂量组相比,P<0.05;d:与TAB中剂量组相比,P<0.05。
组别正常对照组模型组TAB低剂量组TAB中剂量组TAB高剂量组阳性对照组肾脏指数/(mg/g)0.013±0.00 0.027±0.00a 0.015±0.00b 0.014±0.00bc 0.012±0.00bcd 0.011±0.00b血清中尿酸水平/(mmol/L)293.33±54.37 541.33±38.87a 466.67±9.57b 403.67±13.47bc 336.00±11.43bcd 331.36±8.35b血清中尿素氮水平/(mmol/L)5.90±0.78 16.00±0.10 a 13.73±0.41b 12.13±0.74bc 7.30±0.65bcd 7.25±0.72b血清中肌酐水平/(μmol/L)147.67±7.59 218.67±7.36a 187.00±5.35b 177.33±2.06bc 164.67±5.25bcd 163.00±4.32b尿微量白蛋白与肌酐比值/(mmol/L)0.31±0.09 4.97±1.12a 3.22±1.27b 2.32±1.03bc 1.42±0.89bcd 1.44±0.48b
3.3 TAB对糖尿病肾病模型小鼠肾组织氧化应激的影响
与正常对照组相比,模型组小鼠肾组织中SOD、GSH-Px含量均显著降低,MDA、8-OHdG含量均显著升高(P<0.05)。与模型组比较,TAB 各剂量组小鼠上述指标水平均显著逆转(P<0.05),且呈剂量依赖性;阳性对照组小鼠上述指标均显著逆转(P<0.05)。结果见图1(阳性对照组图略)、表3。
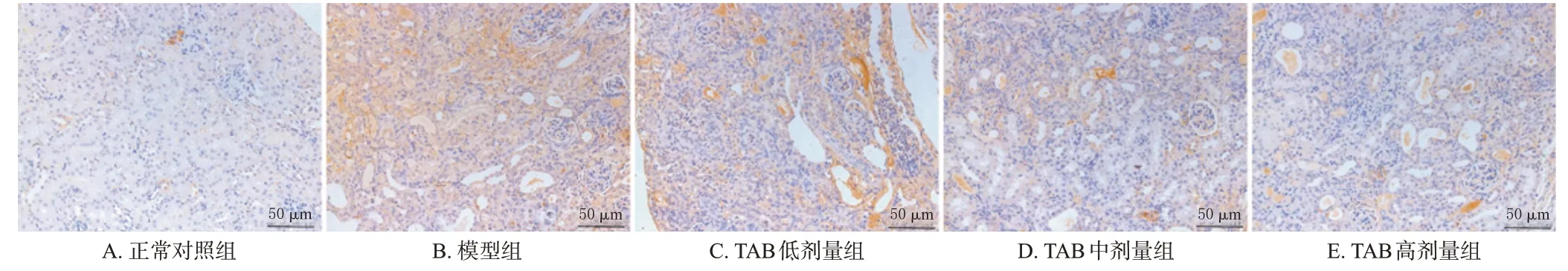
图1 各组小鼠肾组织中8-OHdG的染色图
表3 各组小鼠肾组织氧化应激相关指标含量的检测结果(±s,n=12)
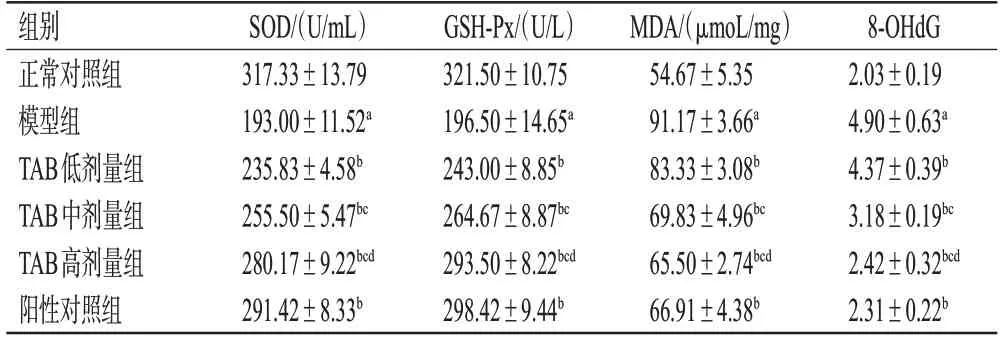
表3 各组小鼠肾组织氧化应激相关指标含量的检测结果(±s,n=12)
a:与正常对照组相比,P<0.05;b:与模型组相比,P<0.05;c:与TAB低剂量组相比,P<0.05;d:与TAB中剂量组相比,P<0.05。
组别正常对照组模型组TAB低剂量组TAB中剂量组TAB高剂量组阳性对照组SOD/(U/mL)317.33±13.79 193.00±11.52a 235.83±4.58b 255.50±5.47bc 280.17±9.22bcd 291.42±8.33b GSH-Px/(U/L)321.50±10.75 196.50±14.65a 243.00±8.85b 264.67±8.87bc 293.50±8.22bcd 298.42±9.44b MDA/(μmoL/mg)54.67±5.35 91.17±3.66a 83.33±3.08b 69.83±4.96bc 65.50±2.74bcd 66.91±4.38b 8-OHdG 2.03±0.19 4.90±0.63a 4.37±0.39b 3.18±0.19bc 2.42±0.32bcd 2.31±0.22b
3.4 TAB对糖尿病肾病模型小鼠肾小管间质纤维化的影响
与正常对照组相比,模型组小鼠基底膜增厚、系膜基质堆积、肾小球硬化、肾小管间质纤维化明显,基质染色面积和ECM沉积染色面积均显著增大(P<0.05)。与模型组比较,TAB 各剂量上述病变减轻,基质染色面积和ECM 染色沉积面积均显著减小(P<0.05),且呈剂量依赖性;阳性对照组小鼠上述病变减轻,基质染色面积和ECM染色沉积面积均显著减小(P<0.05)。结果见图2(阳性对照组图略)、表4。

图2 各组小鼠肾组织的PAS、Masson染色图
表4 各组小鼠肾组织PAS、Masson染色面积的检测结果(±s,n=12)
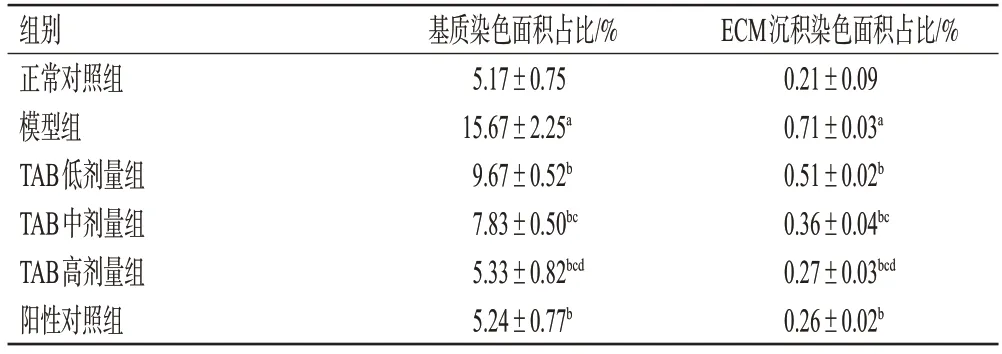
表4 各组小鼠肾组织PAS、Masson染色面积的检测结果(±s,n=12)
a:与正常对照组相比,P<0.05;b:与模型组相比,P<0.05;c:与TAB低剂量组相比,P<0.05;d:与TAB中剂量组相比,P<0.05。
组别正常对照组模型组TAB低剂量组TAB中剂量组TAB高剂量组阳性对照组基质染色面积占比/%5.17±0.75 15.67±2.25a 9.67±0.52b 7.83±0.50bc 5.33±0.82bcd 5.24±0.77b ECM沉积染色面积占比/%0.21±0.09 0.71±0.03a 0.51±0.02b 0.36±0.04bc 0.27±0.03bcd 0.26±0.02b
3.5 TAB 对糖尿病肾病模型小鼠肾组织中ECM 沉积相关蛋白表达的影响
与正常对照组相比,模型组小鼠肾组织中TGF-β1、Fn、Col Ⅳ蛋白表达水平均显著升高(P<0.05)。与模型组比较,TAB 各剂量组小鼠上述指标水平均显著降低(P<0.05),且呈剂量依赖性;阳性对照组小鼠上述指标均显著降低(P<0.05)。结果见图3、表5。
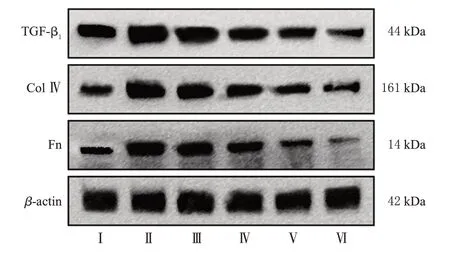
图3 各组小鼠肾组织中ECM沉积相关蛋白的电泳图
表5 各组小鼠肾组织中ECM 沉积相关蛋白表达水平的检测结果(±s,n=12)

表5 各组小鼠肾组织中ECM 沉积相关蛋白表达水平的检测结果(±s,n=12)
a:与正常对照组相比,P<0.05;b:与模型组相比,P<0.05;c:与TAB低剂量组相比,P<0.05;d:与TAB中剂量组相比,P<0.05。
组别正常对照组模型组TAB低剂量组TAB中剂量组TAB高剂量组阳性对照组TGF-β1/β-actin 0.99±0.04 1.79±0.04a 1.27±0.03b 0.89±0.03bc 0.68±0.02bcd 0.99±0.04b Col Ⅳ/β-actin 0.40±0.05 1.50±0.04a 1.00±0.04b 0.67±0.03bc 0.36±0.03bcd 0.40±0.05b Fn/β-actin 0.42±0.04 1.89±0.03a 0.80±0.02b 0.65±0.05bc 0.60±0.02bcd 0.42±0.04b
3.6 TAB 对糖尿病肾病模型小鼠肾组织中Akt/Nrf2/HO-1信号通路相关蛋白表达的影响
与正常对照组相比,模型组小鼠肾组织中p-Akt、Nrf2、HO-1 蛋白表达水平显著降低(P<0.05)。与模型组比较,TAB 各剂量组小鼠上述指标水平均显著升高(P<0.05),且呈剂量依赖性;阳性对照组小鼠上述指标均显著升高(P<0.05)。结果见图4、表6。
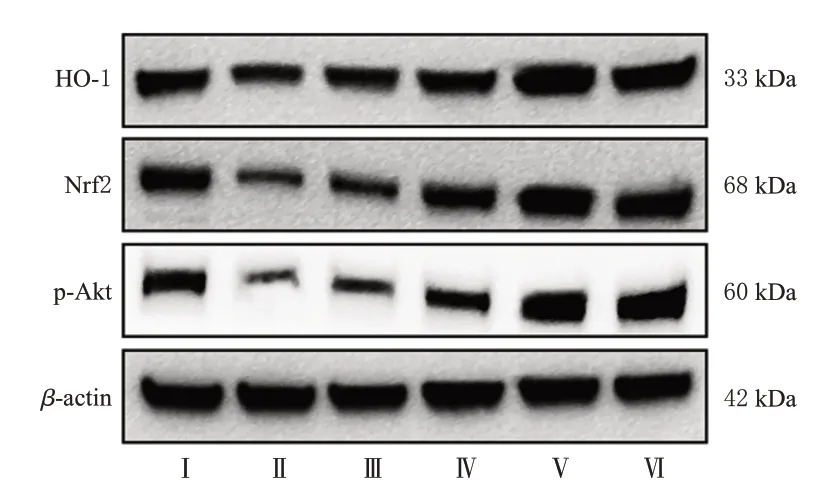
图4 各组小鼠肾组织中Akt/Nrf2/HO-1 信号通路相关蛋白表达的电泳图
表6 各组小鼠肾组织中Akt/Nrf2/HO-1 信号通路相关蛋白表达水平的检测结果(±s,n=12)

表6 各组小鼠肾组织中Akt/Nrf2/HO-1 信号通路相关蛋白表达水平的检测结果(±s,n=12)
a:与正常对照组相比,P<0.05;b:与模型组相比,P<0.05;c:与TAB低剂量组相比,P<0.05;d:与TAB中剂量组相比,P<0.05。
组别正常对照组模型组TAB低剂量组TAB中剂量组TAB高剂量组阳性对照组HO-1/β-actin 0.91±0.03 0.58±0.03a 0.74±0.05b 1.08±0.03bc 1.52±0.04bcd 1.48±0.06b Nrf2/β-actin 1.10±0.02 0.54±0.05a 0.77±0.06b 1.05±0.06bc 1.30±0.07bcd 1.26±0.06b p-Akt/β-actin 1.13±0.02 0.62±0.03a 0.82±0.03b 0.90±0.05bc 1.03±0.03bcd 1.98±0.04b
4 讨论
糖尿病肾病是由于糖尿病所致的慢性肾脏疾病,是糖尿病主要的并发症之一,其主要病理学特征表现为肾小球硬化和肾小管间质纤维化,临床表现主要为持续性蛋白尿。高糖引起的过量ROS 产生被认为是糖尿病肾损伤的始动因素[15]。体内过多的ROS 可通过攻击体内的不饱和脂肪酸导致脂质过氧化,诱导脂质过氧化物MDA 的形成[8]。抗氧化酶如SOD、GSH-Px 的活性可反映机体的抗氧化能力[16],这时可通过检测机体内MDA、GSH-Px等指标含量反映肾脏的受损程度。高脂饮食联合腹腔注射STZ 制备的动物模型与人类糖尿病十分相似,是目前啮齿类动物糖尿病模型常用的构建方法[13]。维生素E作为体内重要的抗氧化剂,可清除生物体中产生的ROS,抑制氧化应激的水平,进而延缓糖尿病肾病患者肾小球硬化和肾小管间质纤维化[17]。因此,本研究采用高脂饮食联合腹腔注射STZ 诱导糖尿病肾病模型小鼠,并以维生素E 为阳性对照。本研究结果显示,与正常对照组相比,模型组小鼠系膜基质堆积、肾小球硬化、肾小管间质纤维化明显,肾脏系数、肾功能相关指标水平和MDA、8-OHdG 含量均显著升高,SOD、GSH-Px含量均显著降低;经TAB干预后,上述指标均显著改善,这提示TAB可改善糖尿病肾病模型小鼠的肾功能、氧化应激水平、肾小管间质纤维化。
在糖尿病肾病中,高血糖和氧化应激会导致肾脏内ECM沉积相关因子的异常积聚,伴随着肾小球硬化和肾小管间质纤维化,从而加剧了肾脏损伤。Akt/Nrf2/HO-1信号通路是重要的细胞保护通路,可对抗氧化应激,减轻细胞受损。在糖尿病肾病中,该信号通路的活性通常受到抑制,导致细胞对氧化应激的抵抗力下降[4—5]。本研究结果显示,经TAB 干预后,小鼠肾组织中TGF-β1、Fn、Col Ⅳ蛋白表达水平均显著降低,p-Akt、Nrf2、HO-1蛋白表达水平均显著升高,这提示TAB可通过激活Akt/Nrf2/HO-1 信号通路,减少肾组织ECM 沉积,进而减缓糖尿病肾病的进展。
综上所述,TAB可改善糖尿病肾病模型小鼠糖代谢和肾功能,减轻肾小管间质纤维化;其作用机制可能与激活Akt/Nrf2/HO-1 信号通路,抑制ECM 沉积,拮抗高糖诱导的氧化应激有关。

