慢性阻塞性肺疾病大鼠气道成纤维细胞过表达HSG基因对Wnt和MAPK信号通路的影响
杨义 周洵 张军 李波 王新星 罗弦 葛正行
1贵州中医药大学(贵阳 550025);贵州中医药大学第二附属医院2呼吸内科,3科研教学部(贵阳 550003)
慢性阻塞性肺疾病(COPD)是呼吸系统常见病,以气流受限不完全可逆为特征的肺部疾病[1]。COPD 病理变化有慢性支气管炎、气道重建、肺动脉重建、肺气肿等,而以慢性支管炎和肺气肿为主要病理改变,在COPD 病程进展中,气道重建是关键,气道重建实质是小气道成纤维细胞的增生,目前研究[2-4]显示MMP-9、PDGF、TGF-β1 等细胞因子是COPD 气道重建的主要参与因子。HSG基因Mitofusin 2,对细胞增殖有抑制作用,研究[5-6]发现HSG在正常细胞呈高表达,在增殖细胞中呈低表达。Wnt 信号通路影响着机体的应激、免疫、细胞的分化、调亡等生理病理过程[7-8]。研究[9-11]表明Wnt信号通路与肺纤维化、特发性肺动脉高压、肺间质性疾病等疾病的机制有重要联系,参与调控细胞的分化、调亡、癌变及机体应激、免疫等生理病理过程。而在呼吸系统,Wnt 信号通路异常激活也与慢性阻塞性肺疾病、支气管哮喘、间质性肺疾病的发生发展密切相关[12]。而TPA能够通过增强CK1激酶活性而上调Wnt信号通路[13]。Wnt信号通路还和MAPK信号通路间有着相互影响[14]。MAPK/ERK 信号通路也是调节细胞生长增殖的信号通路,影响着肺部发育,也有研究[15-17]报道其与肺部肿瘤和肺炎密切相关。而EGF 作为生长因子,也是经典的MAPK通过的激活因子[18]。HSG 基因对Wnt、MAPK 的交叉作用研究较少,推测其在COPD 中起重要作用,本研究构建HSG 过表达载体体外转染COPD 气道成纤维细胞并利用TPA 处理细胞而上调Wnt 信号通路,利用EGF 处理细胞而上调MAPK 信号通路,研究相关基因表达情况的变化,为寻找有效的控制和预防COPD 发展的方法提供依据。
1 材料与仪器
1.1 实验动物SD 大鼠购于湖南斯莱克景达实验动物有限公司,许可证号:SCXK(湘)2016-0002) 。
1.2 主要试剂DMEM(gibco 10566-016);TPA(425KO21,Solarbio);rEGF (L1450411, Cyagen);Lipofectamine®3000(invitrogen, 18882752);OPTIMEM®I (gibco 331985-062);Rat TGF-β1 试剂盒(MM-0181R1,上海酶联);Rat MMP-9 试剂盒(MM-20918R1,上海酶联);Rat PDGF试剂盒(MM-0076R1,上海酶联);Anti-Vimentin antibody (ab92547,abcam);Annexin V-FITC/PI Apoptosis Kit(AP101-100-kit,MULTI SCIENCES);Mouse Monoclonal Anti-GAPDH(TA-08,中杉金桥,1/2000);Rabbit Polyclonal Anti-Mitofusin 2(别名:HSG) (ab124773,Abcam);Rabbit Polyclonal Anti-β-catenin (ab32572,Abcam);Rabbit Polyclonal Anti-RhoA (ab187026,Abcam);Rabbit Polyclonal Anti-Wnt5a (bs-1948R,Bioss);Rabbit Polyclonal Anti-ERK1/2 (D13.14.4E,Cell Signaling)。
1.3 COPD 模型建立在备皮区域用碘伏消毒;用手术剪刀沿着颈部中间剪开表皮和肌肉,使暴露出气管;将吸取好的木瓜蛋白酶溶液(2 mg/mL)按照给药量为0.1 mL/100 g 沿着气管自上而下注射入气管内使其到达肺部,而后将大鼠拿起旋转一周,使其充分进入肺部;缝合伤口后放置于电热毯上待其苏醒后回笼正常饲养8 d。
1.4 COPD 模型大鼠气道成纤维细胞原代分离麻醉处死大鼠,无菌条件下开胸,将切除的新鲜的COPD 大鼠气道组织标本,在无菌工作台里对组织标本反复用加入双抗的PBS冲洗5遍。无菌手术刀刮去气道周围组织和气道内膜,用消毒好的眼科剪将组织块剪成2 mm × 2 mm 大小。将剪好的组织块贴到培养板中,将培养板置于37 ℃,5% CO2培养箱中培养4 h。待其完全贴壁后,在培养板中加入新配制的DMEM + 20% FBS + 双抗培养液,再将细胞置于37 ℃,5% CO2培养箱中继续培养,根据细胞生长情况再进行常规处理。弃去组织块及上清液,加入新配制的DMEM + 20% FBS + 双抗培养液于培养皿中。
1.5 免疫荧光在培养板中将已爬好细胞的培养皿用4%的多聚甲醛固定15 min,再用0.5% Triton X-100(PBS 配制)室温通透20 min。清洗后,在培养皿内滴加5% BSA,37 ℃封闭30 min。吸掉封闭液,不洗,培养皿内滴加足够量的稀释好的一抗Vimentin(1∶250),37 ℃孵育3 h。清洗后,吸干培养皿内多余液体后滴加稀释好的荧光二抗Cy3(1:200),37 ℃孵育30 min;清洗后,滴加DAPI 避光孵育5 min,对标本进行染核,之后洗去多余的DAPI;用50%甘油封闭培养皿,然后在荧光显微镜下观察采集图像。
1.6 过表达HSG载体的构建NCBI查找HSG基因序列(NM_130894),引入酶切位点(HindIII/XhoI)生物合成基因片段克隆至pCDNA3.1(+)载体上。
1.7 荧光定量PCR取各组进行RNA 的提取,提取RNA 后根据逆转录试剂盒合成cDNA,以cDNA为模板,在荧光定量PCR仪上进行检测,以GAPDH为内参,算出各组细胞中HSG、β-catenin、Wnt5a、ERK2 和RhoA 的相对表达量。引物如下:HSG F primer:AACTCCATCGTCACCGTCAA;HSG R primer:CAACCCGCAGGAAGCAA;RhoA F primer:AGAGTTGGCTTTATGGGACAC;RhoA R primer:GATGATGGGCACATTTGGA;Wnt5a F primer:GCTTCAACTCCCCAACCA;Wnt5a R primer:CTCGCAGCCGTCCATC;ERK2 F primer:CAAGCCTTCCAACCTCCTG;ERK2 R primer:TGTTCCACGGCACCTTATTT;β -catenin F primer:TTATGAGTGGGAGCAAGGC;βcatenin R primer:ACAACGGGCTGTTTCTACG;GAPDH F primer:GCAAGTTCAACGGCACAG;GAPDH R primer:CGCCAGTAGACTCCACGAC。
1.8 实验分组空白组(Normal);空载组(Blank);HSG 过表达载体(HSG-oe);空白+TPA;空载+TAP;HSG 过表达载体+TPA;空白+EGF;空载+EGF;HSG 过表达载体+EGF。TPA:10 nmol/L;rEGF:50 ng/mL,需转染质粒的分组在转染48 h 后再加药作用24 h。
1.9 细胞转染接种细胞至80%汇合度时转染,前1 d接种或换液,取出DNA或RNA离心3 000 r/min,5 min;使用Opti-MEM®培养基稀释Lipofectamine®3000 试剂-充分混匀,避光室温孵育5 min。在每管已稀释的Lipofectamine®3000 试剂中加入稀释的DNA 或RNA 中混匀,室温避光孵育45 min。按照上述分组,加入DNA-脂质体复合物中或RNA-脂质体复合物。37 ℃,5% CO2培养箱孵育细胞,转染48 h。
1.10 流式凋亡检测收集1 × 106~ 3 × 106个细胞,离心去上清,加1 mL PBS 洗涤一遍1 500 r/min离心,5 min,弃上清。用双蒸水将5×Binding Buffer稀释为1×Binding Buffer。取300 μL 预冷的1×Binding Buffer 重悬细胞。每管各加入3 μL Annexin V-FITC 和5 μL PI-PE。轻微混匀后,室温避光孵育10 min。再向每管中加入200 μL 预冷的1×Binding Buffer。混匀后上流式仪检测。
1.11 ELISA 检测分别设空白孔、待测样品孔。在酶标包被板上待测样品孔中先加样品稀释液40 μL,然后再加待测样品10 μL。加样将样品加于酶标板孔底部,尽量不触及孔壁,轻轻晃动混匀。每孔加入酶标试剂100 μL,空白孔除外。用封板膜封板后置37 ℃温育60 min。将20 倍浓缩洗涤液用蒸馏水20 倍稀释后备用。小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30 s后弃去,如此重复5 次,拍干。每孔先加入显色剂A 50 μL,再加入显色剂B 50μL,轻轻震荡混匀,37 ℃避光显色15 min。每孔加终止液50 μL,终止反应。以空白孔调零,450 nm 波长依序测量各孔的吸光度(OD值)。测定应在加终止液后15 min以内进行。
1.12 Western blot(WB)取各组细胞加入相应的裂解液,4 ℃裂解30 min,在10 000 r/min 离心10 min,小心吸取上清,即得总蛋白。利用BCA 试剂盒进行蛋白浓度测定。蛋白变性、上样、电泳1 ~ 2 h,湿法转膜30 ~ 50 min。4 ℃孵育一抗溶液过夜;室温孵育二抗1 ~ 2 h。在膜上滴加ECL曝光液,曝光。用“Quantity one”软件分析各抗体条带灰度值。
1.13 流式周期检测收集各组细胞用EP 管分装好后向每管中加入1 mL PBS 溶液2 000 r/min 离心2 min,弃上清,重复3 次。离心收集1 ~ 5 × 105个细胞。加入1 mL 冰浴预冷70%乙醇中,轻轻吹打混匀,4 ℃固定12 h。按照说明书混合染色缓冲液、碘化丙啶和RNAse A,配制碘化丙啶染色液。每管细胞样品中加入0.5 mL 碘化丙啶染色液,缓慢并充分重悬细胞沉淀,37 ℃避光温浴30 min。之后用流式细胞仪在激发波长488 nm 波长处检测红色荧光,同时检测光散射情况并进行细胞DNA 含量分析和光散射分析,根据结果拟合得出细胞周期情况。
1.14 统计学方法所有数据均用SPSS 19.0 统计分析,经t检验,以P< 0.05 为差异有统计学意义。
2 结果
2.1 COPD 模型的组织学鉴定见图1,正常对照组大鼠肺组织病理切片光镜下见肺泡结构规整,无肺泡腔病理性扩张及融合,支气管管壁未见增厚。气道粘膜上皮光滑,纤毛排列整齐,无炎症细胞浸涧,气管腔内无明显炎性渗出。COPD 模型组大鼠肺组织HE 染色出现肺气肿病理变化,肺泡出现扩张,肺泡壁变薄,并逐步断裂融合成肺大疱,肺泡数目显著减少。气道粘膜纤毛出现粘连、变性和坏死,甚至脱落。支气管上皮杯状细胞增生肥大,有大量的炎性细胞如中性粒细胞、巨噬细胞浸润管腔,小气道管腔狭窄同时伴小气道壁纤维结缔组织増生。
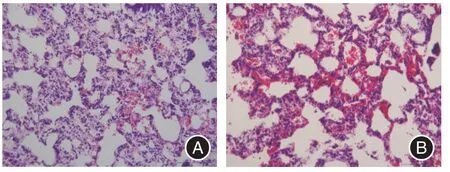
图1 肺组织HE 染色结果Fig.1 HE staining of lung tissue
2.2 成纤维细胞鉴定见图2,红色的是蛋白Vimentin,蓝色是细胞核,分离培养所得的细胞中都大量表达了Vimentin,可以判断细胞为成纤维细胞。
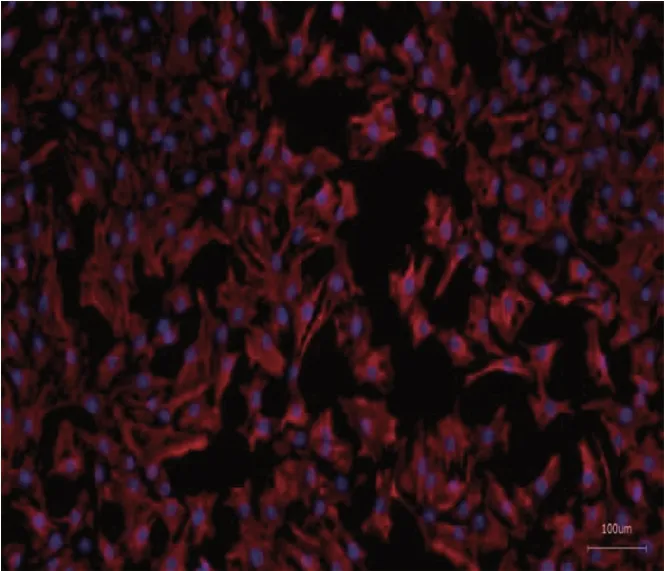
图2 细胞免疫荧光结果(100 ×)Fig.2 Results of cellular immunofluorescence (100 ×)
2.3 qPCR 检测各组实验HSG 和Wnt 信号通路基因表达情况见图3,qPCR检测显示过表达HSG能抑制基因Wnt5a 和ERK1/2 的表达。受TPA 处理后,Wnt5a 表达上调而HSG 表达受抑制;受EGF处理后,ERK2 表达上调而HSG 表达受抑制。
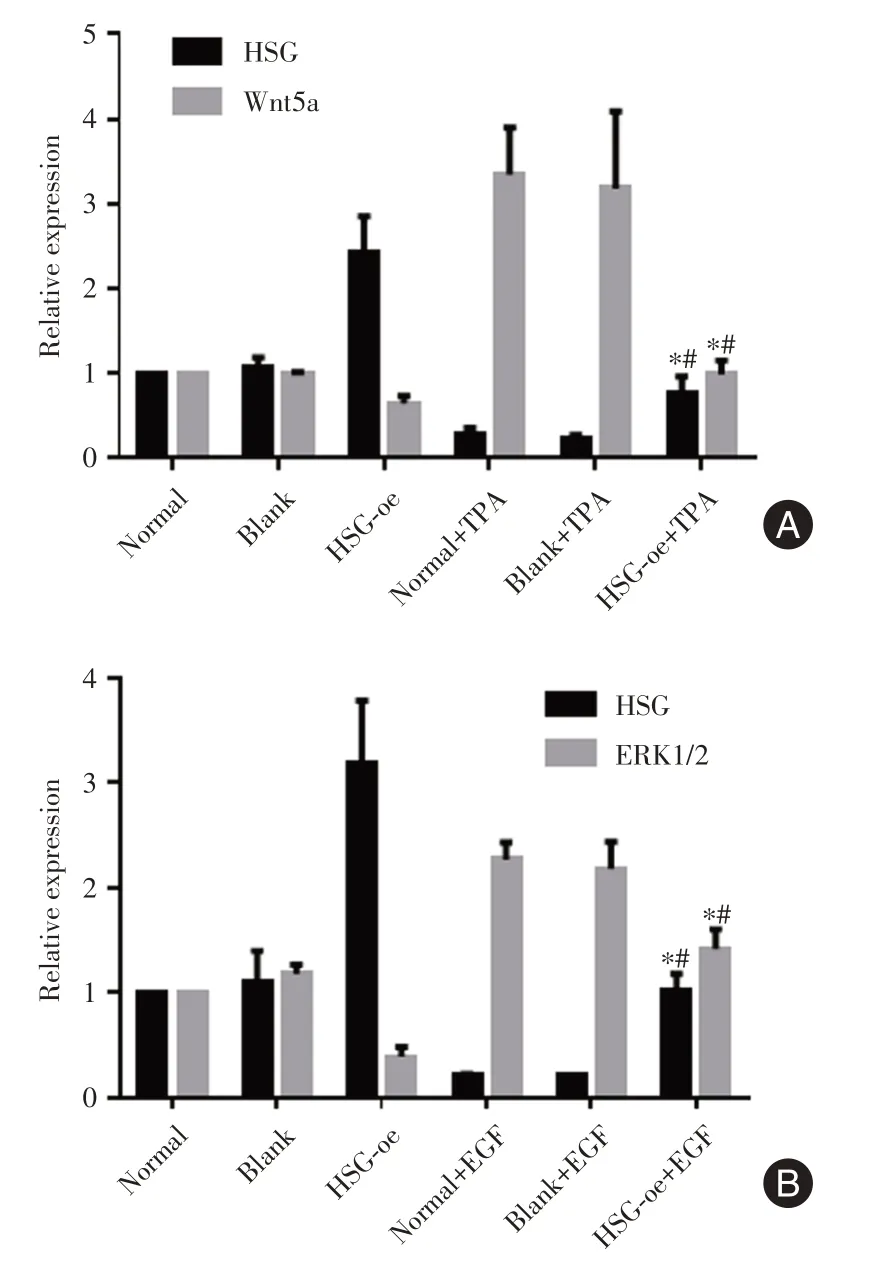
图3 PCR 检测结果Fig.3 PCR detection results
2.4 WB 检测各组实验HSG 和Wnt 信号通路基因表达情况见图4,WB 检测显示过表达HSG 能抑制基因Wnt5a 和ERK1/2 的表达。受TPA 处理后,Wnt5a 表达上调而HSG 表达受抑制;受EGF 处理后,ERK2 表达上调而HSG 表达受抑制。
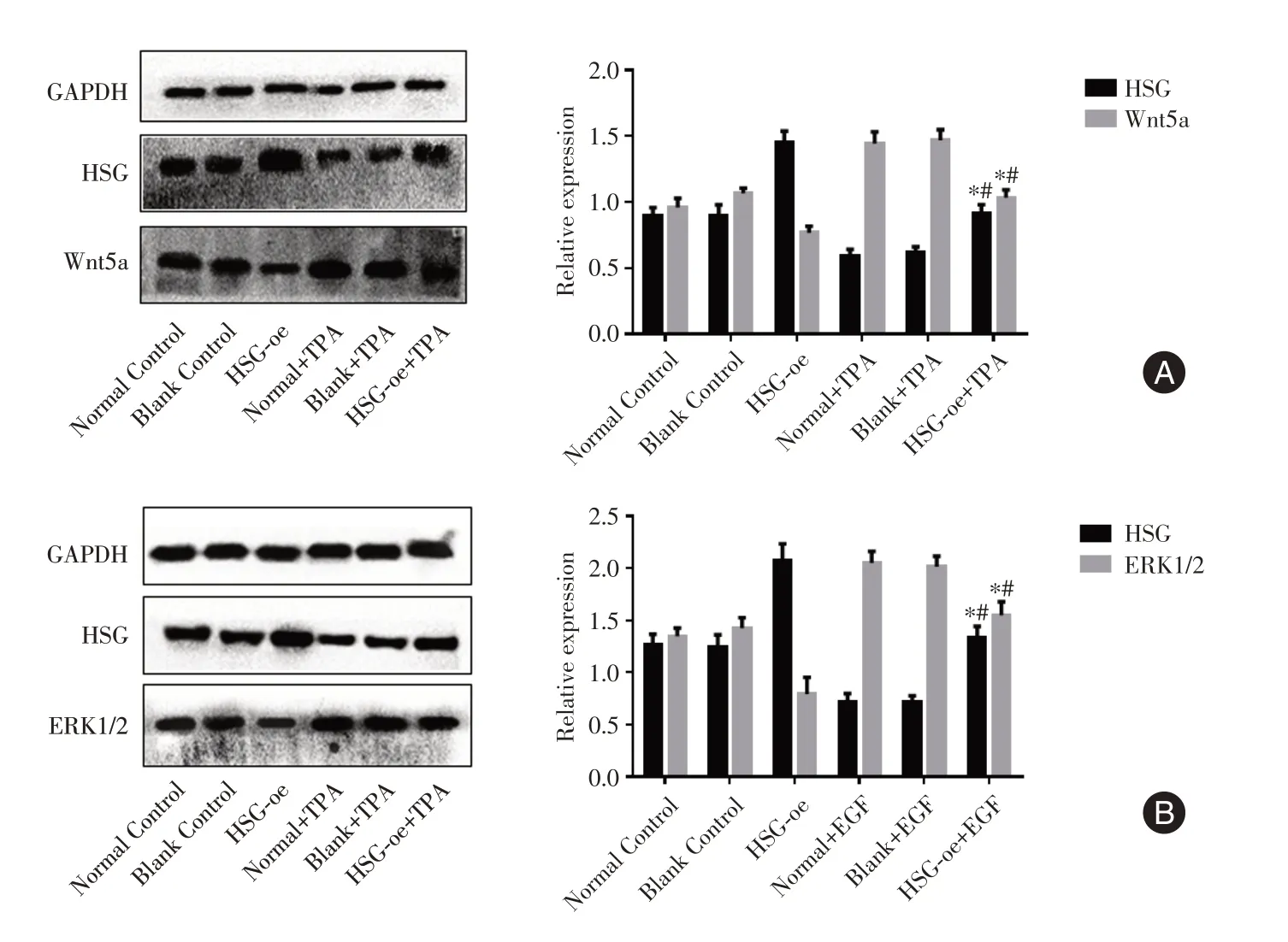
图4 蛋白质表达的WB 检测结果Fig.4 Western blot (WB) detection results of protein expression
2.5 ELISA 检测各组实验细胞上清中TGF-β1、PDGF、MMP-9 的含量见图5,ELISA 检测结果显示,过表达HSG 能降低TGF-β1、PDGF、MMP-9的含量,受相应激动剂处理后TGF-β1、PDGF、MMP-9 的含量上升,而过表达HSG 依然有抑制效果。
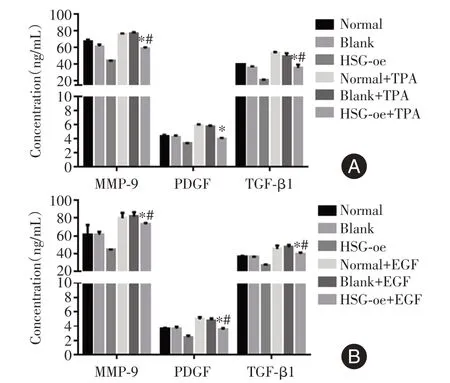
图5 细胞培养液上清中TGF-β1、PDGF、MMP-9 的含量Fig.5 Contents of TGF-β1, PDGF, and MMP-9 in the cell culture supernatant
2.6 细胞流式检测细胞凋亡见图6,各组实验细胞流式检测细胞凋亡结果显示过表达HSG 会明显上调细胞凋亡率,而相应的激动剂处理会降低过表达HSG 促进细胞凋亡的效果。
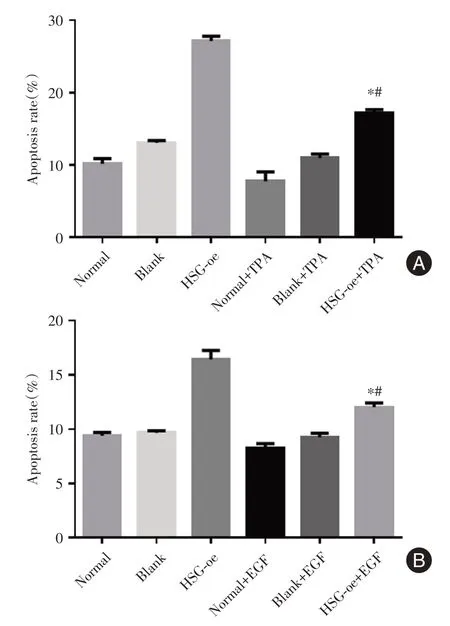
图6 细胞凋亡率检测结果Fig.6 Results of cell apoptosis rate detection
3 讨论
本文的实验设计旨在检验过表达HSG 基因能否抑制COPD 模型大鼠气道中的成纤维细胞生长,从而抑制相关的肺部纤维化,并研究此效果与Wnt 信号通路和MAPK 信号通路的相关性。Wnt信号通路和MAPK 信号通路功能上有着相似性,而且两个信号通路间也有着相互促进的作用[19-20]。MAPK 信号通路中的成分例如ERK1/2、p38 和JNK 能够促进LRP6 蛋白质磷酸化,从而上调Wnt/β-catenin 信号通路[21]。Wnt5a 则能够促进ERK1/2蛋白质磷酸化[14,22]。TGF-β1 是Wnt 信号通路的一个靶基因,广泛分布于气管支气管内,在COPD 发病过程中其主要来源于肺部局部浸润的中性粒细胞、巨噬细胞及气道壁成纤维细胞,它是最重要的致纤维化细胞因子,并且能反向调节刺激成纤维细胞合成和分泌细胞外基质,进而导致气道纤维增生[23-25]。MMP-9 则是另一个受Wnt 信号通路调节的基因,在COPD 的发病机制上主要是通过对肺泡基质成分的破坏,加重扩大肺泡腔,导致其弹性下降,回缩力降低;另一方面,通过破坏上皮细胞及内皮细胞而参与气道组织重建[26-28]。而PDGF是对间质细胞有着显著影响的生长因子,能刺激小气道成纤维细胞趋化和增殖及细胞外基质合成,是引起气道重建机制之一,而其受体属于酪氨酸激酶受体,可以激活MAPK 信号通路和Wnt 信号通路[29-31]。Wnt 信号通路可通过抑制糖原合成酶激酶-3β(GSK3β)介导的磷酸化和抑制细胞质中β-连环素的降解来诱导EMT[32]。TGF-β 可通过MAPK 信号通路(如p38,Erk1/2)刺激细胞外基质(ECM)的合成和积累从而诱导EMT[33]。进一步证实差异基因可能通过影响EMT/MET 平衡从而参与细胞纤维化进程进而改善或加剧COPD 症状。
实验结果显示,过表达HSG 会大大提高成纤维细胞凋亡率,降低成纤维细胞的增殖,降低细胞分泌TGF-β1、PDGF、MMP-9 的含量,可以推测过表达HSG 能抑制肺部纤维化。而且过表达HSG会抑制Wnt5a 和ERK1/2 的表达,说明Wnt 信号通路和MAPK 信号通路都受到了抑制。用Wnt 信号通路激动剂TPA 或者MAPK 信号通路激动剂EGF处理成纤维细胞之后,相应的Wnt5a 和ERK1/2 的表达上升,但是HSG 过表达组的Wnt5a 和ERK1/2的表达水平是明显低于受对应激动剂处理的空载组的,这些实验结果说明HSG 拮抗Wnt 信号通路和MAPK 信号通路。值得注意的是,在激动剂处理成纤维细胞之后,正常对照组和空载组HSG 表达水平下降,同时HSG 过表达组的HSG 表达水平也明显下降,约为受激动剂处理前HSG 表达水平的三分之一。这说明Wnt 信号通路和MAPK 信号通路上调不仅调控抑制成纤维细胞本身的HSG 表达,也同样调控抑制外源转染的HSG 表达,由此可以推测Wnt 信号通路和MAPK 信号通路可以直接调控细胞质中HSG 的mRNA 水平,Wnt 信号通路和MAPK信号通路或能够促进HSG的mRNA降解,这也许涉及到受Wnt 信号通路和MAPK 信号通路诱导的microRNA。
综上所述,HSG 基因通过拮抗Wnt 信号通路和MAPK 信号通路可以达到抑制肺部纤维化的效果。然而,研究并没有对介导HSG 基因的上游通路及EMT 途径影响纤维化进行分析。在未来的研究中,将进一步探索HSG 如何调节COPD 的纤维化,旨在明确HSG 在COPD 发展中的临床价值和潜在机制。
【Author contributions】GE Zhengxing participated in project design and manuscript modification, YANG Yi participated in project design, experiments, and manuscript writing. ZHOU Xun, ZHANG Jun, LI Bo, WANG Xinxing, and LUO Xian all participated in the experiments. All authors have read and agreed to submit the final manuscript.

