复方氨基酸注射液中胱氨酸含量的测定方法
文/乔晓芳 蒋芙蓉 刘再德 兰香南 周慧
本文第一作者乔晓芳就职于河南省药品审评查验中心;通讯作者周慧和其他作者均就职于湖南科伦制药有限公司。
本文建立了一种复方氨基酸注射液(18AA)中胱氨酸含量的测定方法——在碱性条件下,采用1,4-二硫代苏糖醇将胱氨酸还原成半胱氨酸,生成的半胱氨酸与酸性茚三酮溶液反应,生成红色产物,在560 nm 波长处测定吸光度,用对照品标准曲线法测定复方氨基酸注射液(18AA)中胱氨酸的含量。测定结果显示胱氨酸浓度在0.0418 ~0.2088 mg/ml 范围内线性关系良好(r=0.9992); 平均加样回收率为101.61%(RSD 为1.96%,n=9)。这证明本方法准确、重现性好,可用于复方氨基酸注射液(18AA)中胱氨酸的含量测定。
复方氨基酸注射液在临床上应用广泛,目前在临床应用的品种主要有补充营养用氨基酸、小儿用氨基酸、肾病用氨基酸和肝病用氨基酸,适用人群包括老人、成人、儿童,主要以中心静脉插管或由外周静脉滴注,还有补充氨基酸的口服制剂在临床应用[1-8]。复方氨基酸注射液(18AA)含必需氨基酸与非必需氨基酸,在临床主要用于蛋白质摄入不足、吸收障碍等氨基酸不能满足机体代谢需要的患者。鉴于当前质量标准中未对胱氨酸的含量进行测定[9-11],特开展复方氨基酸注射液(18AA)中胱氨酸含量检测方法的研究,便于全面控制该品种的质量。
1.试验材料
1.1 仪器
UV2450 双光束紫外-可见分光光度计,岛津公司产。电子分析天平BP211D,北京赛多利斯仪器系统有限公司产。电子天平ES-1000HA,长沙湘平科技发展有限公司产。
1.2 样品与试剂
复方氨基酸注射液,批号:C120426 C;规格:500 ml:25 g(总氨基酸);湖南科伦制药有限公司产。胱氨酸对照品,中国药品生物制品检定所提供。盐酸为分析纯。二硫代苏糖醇为分析纯。茚三酮为分析纯。试验用水为湖南科伦制药有限公司自制。其他试剂均为分析纯。
2.方法与结果
2.1 测定方法:
标准曲线制备:称取胱氨酸对照品适量,用少量0.1 mol/L 盐酸溶解后用水稀释制成每1 ml 中约含0.5 mg 的溶液,分别精密量取1 ml、2 ml、3 ml、4 ml、5 ml 置10 ml 量瓶中,加水稀释至刻度,摇匀,分别精密量取2.5 ml 稀释后溶液置10 ml 量瓶中,加入酚酞指示液3 滴,再加10 mol/L 氢氧化钠溶液50 μl 使溶液呈红色,精密加入二硫代苏糖醇溶液(取1,4-二硫代苏糖醇40 mg,加水溶解并稀释至25 ml)2.5 ml,用水稀释至刻度,摇匀,在室温放置30 min 后,精密量取1 ml 置25 ml 具塞试管底部,精密加入冰醋酸1 ml 和酸性茚三酮溶液(取茚三酮0.5 g,加冰醋酸6 ml 和盐酸4 ml 使之溶解)1 ml,轻轻摇匀,密塞,在90℃水浴中准确加热10 min,立即冷却,最后精密加入乙醇15 ml,摇匀。在560 nm波长处测定吸光度,以吸光度与其相应的浓度计算回归方程。
测定:精密量取复方氨基酸注射液2.5 ml 置10 ml 量瓶中,从上述“加入酚酞指示液3 滴”开始,依法操作,测定吸光度,由回归方程计算胱氨酸的含量。
2.2 方法原理
在碱性条件下,采用1,4-二硫代苏糖醇将胱氨酸还原成半胱氨酸,生成的半胱氨酸与酸性茚三酮溶液反应,生成红色产物,在560 nm 波长处测定吸光度,用对照品标准曲线法测定注射液中胱氨酸的含量。
2.3 验证
2.3.1 专属性
空白溶液配制:按处方量称取除胱氨酸以外的各原辅料,配制成溶液,精密量取2.5 ml 置10 ml量瓶中,按照前文“2.1”项下“加入酚酞指示液3 滴”起,同法操作。
对照品溶液配制:精密称取胱氨酸对照品13.98 mg 置25 ml 量瓶中,先用适量0.1 mol/L 盐酸溶解后,再用水稀释至刻度,摇匀,精密量取2.5 ml 稀释后溶液置10 ml 量瓶中,按照“2.1”项下“加入酚酞指示液3 滴”起,同法操作。
供试品溶液配制:精密量取C120426 C 批复方氨基酸注射液(18AA)2.5 ml 置10 ml 量瓶中,按照前文“2.1”项下“加入酚酞指示液3 滴”起,同法操作。
扫描上述样品,结果显示对照品溶液和供试品溶液在560 nm有最大吸收,空白溶液基本无干扰。
2.3.2 线性范围
精密称取胱氨酸对照品(140624-200805)20.88 mg 置50 ml 量瓶中,先用适量0.1 mol/L盐酸溶解后,再用水稀释至刻度,摇匀,得对照品贮备液。分别精密量取1 ml、2 ml、3 ml、4 ml、5 ml 对照品贮备液置于10 ml 量瓶中,用水稀释至刻度。分别精密量取2.5 ml 稀释后溶液置10 ml量瓶中,按照前文“2.1”项下“加入酚酞指示液3 滴”起,同法操作。结果见表1。
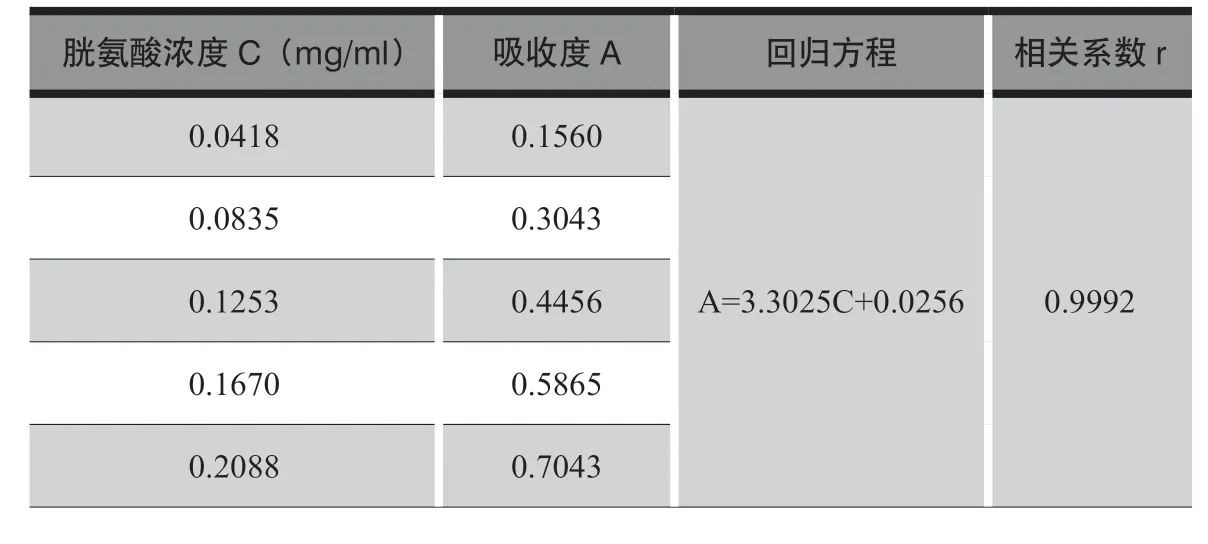
表1 胱氨酸含量测定——线性与范围
结果表明胱氨酸浓度在0.0418 ~0.2088 mg/ml 范围内线性关系良好。样品测定浓度在0.1 mg/ml,在此范围内。
2.3.3 空白回收试验
低浓度样品溶液配制(55%):精密量取线性范围项下对照品贮备液1.3 ml 置10 ml 量瓶中,加水稀释至刻度摇匀,精密量取2.5 ml 置10 ml 量瓶中,加空白溶液2.5 ml,按照前文“2.1”项下“加入酚酞指示液3 滴”起,同法操作。平行制备3 份样品。
中浓度样品溶液配制(100%):精密量取线性范围项下对照品贮备液2.5 ml 置10 ml 量瓶中,加水稀释至刻度摇匀,精密量取2.5 ml 稀释后溶液置10 ml量瓶中,加空白溶液2.5 ml,按照前文“2.1”项下“加入酚酞指示液3 滴”起,同法操作。平行制备3 份样品。
高浓度样品溶液配制(120%):精密量取线性范围项下对照品贮备液3 ml 置10 ml 量瓶中,加水稀释至刻度摇匀,精密量取2.5 ml 稀释后溶液置10 ml 量瓶中,加空白溶液2.5 ml,按照前文“2.1”项下“加入酚酞指示液3 滴”起,同法操作。平行制备3份样品。
将上述样品测得的吸光度用线性范围项下的标准曲线计算含量,结果见表2。
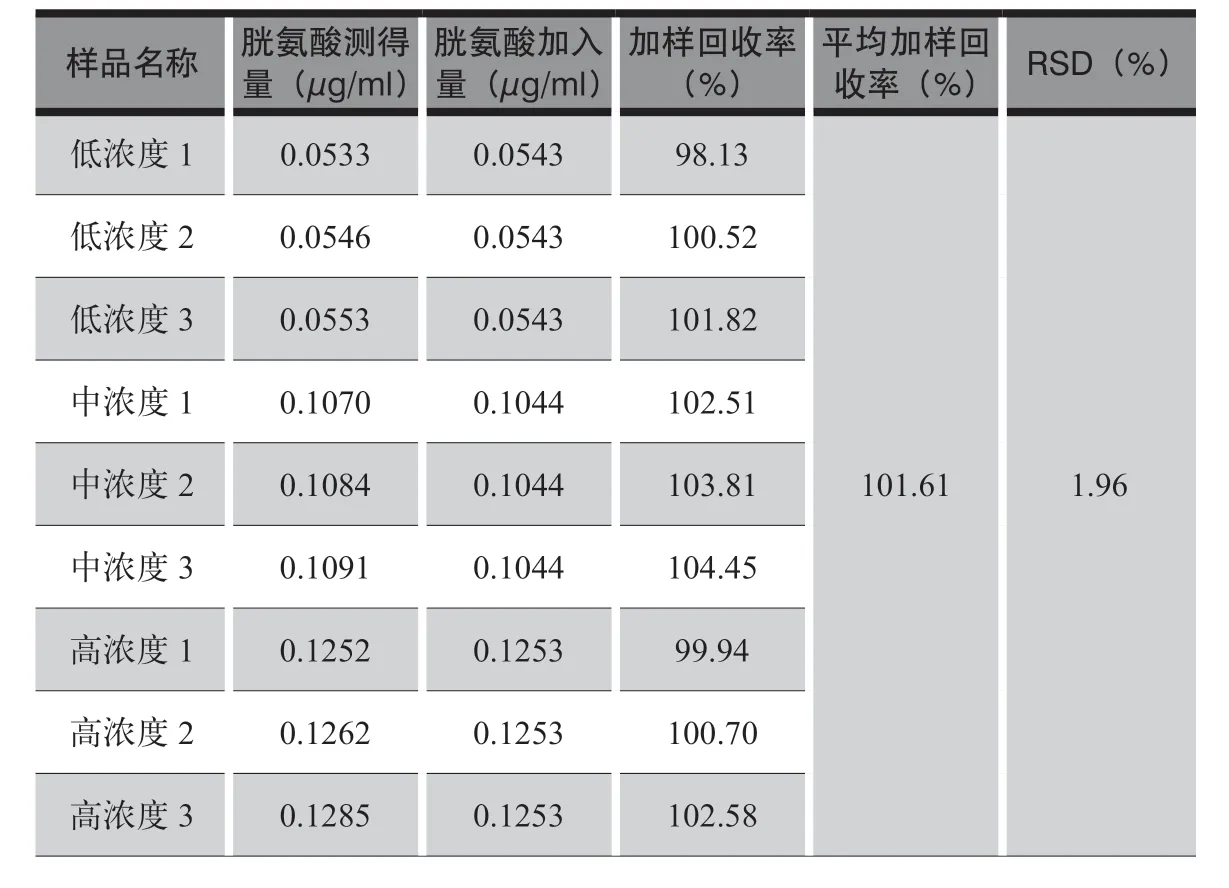
表2 胱氨酸含量测定——空白回收试验
表2 的结果表明该方法准确度好。
2.3.4 重复性试验
精密量取复方氨基酸注射液(18AA)2.5 ml 置10 ml 量瓶中,按照前文“2.1”项下“加入酚酞指示液3 滴”起,同法操作。平行制备6 份。测定结果见表3。

表3 胱氨酸含量测定——重复性试验
表3 的结果表明该方法重复性较好。
2.3.5 溶液稳定性试验
精密称取胱氨酸对照品12.62 mg 置25 ml 量瓶中,用少量0.1 mol/L 盐酸溶解后,加水稀释至刻度,分别精密量取0.5 ml、1 ml、2 ml、3 ml、4 ml 置10 ml量瓶中,加水稀释至刻度,摇匀。精密量取2.5 ml 置10 ml 量瓶中,按照前文“2.1”项下“加入酚酞指示液3 滴”起,同法操作。另精密量取复方氨基酸注射液(18AA)2.5 ml 置10 ml 量瓶中,同法测定(分别放置一定时间后再测定吸收值)。计算供试品中的胱氨酸含量。结果见表4。
表4 的结果表明本品在显色反应完成后,吸收值有下降趋势,所以应尽量在30 min 内测定。
2.3.6 耐用性考察
按照前文“2.1”项下方法,考察本试验中反应温度、时间不同对胱氨酸含量测定的影响。结果见表5。
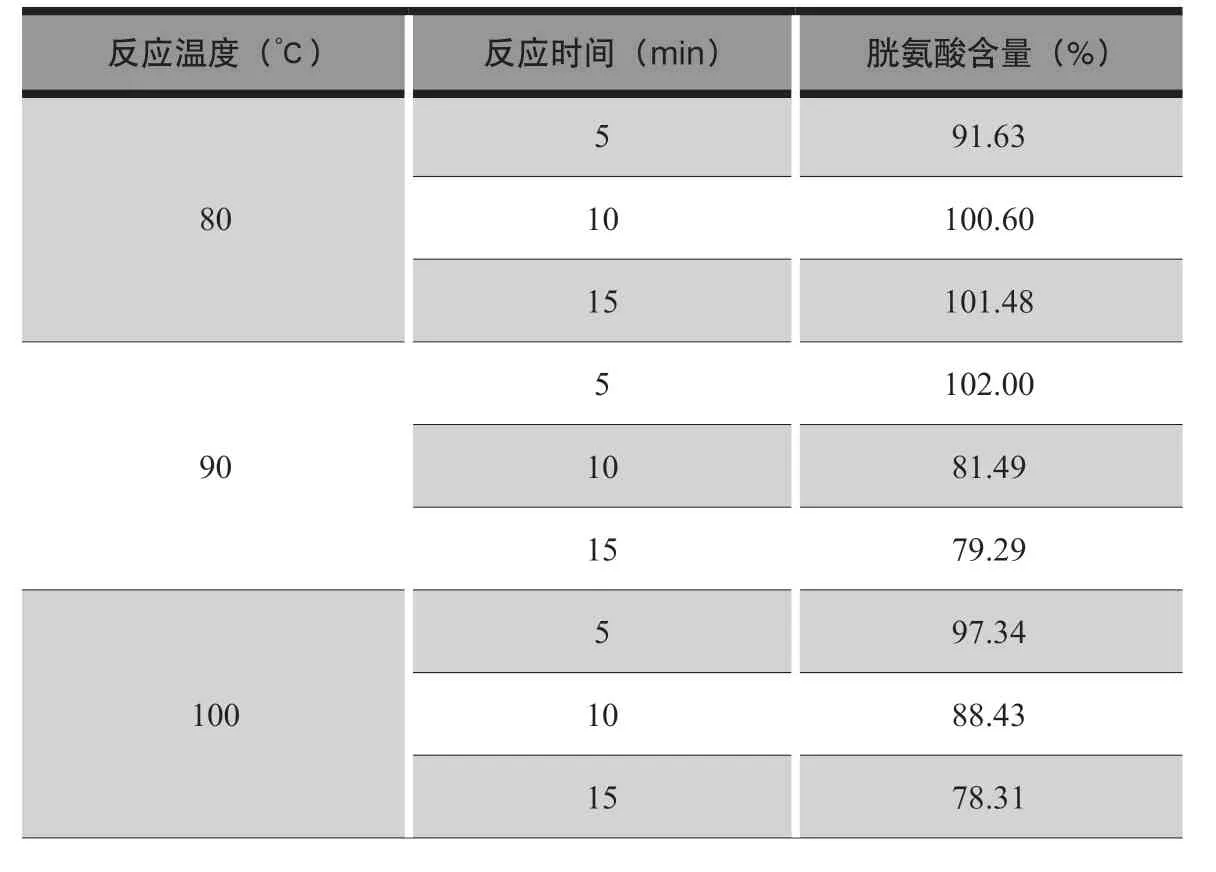
表5 胱氨酸含量测定耐用性考察
从表5 的试验结果可以看出,反应温度在80℃~100℃、反应时间在5 ~15 min 范围变化时,胱氨酸含量测定结果有一定的差异,耐用性不是很理想,但在90℃准确反应10 min 时该方法准确度、线性、重复性均好,这表明操作时需注意反应条件及反应时间。
2.3.7 样品测定
取C120426 C、C120426 D、C120426 E 三批复方氨基酸注射液(18AA)样品,分别按照前文“2.1”项下进行测定,反应温度为90℃,反应时间为10 min。 结果见表6。

表6 胱氨酸含量测定结果
3.讨论
在现有的复方氨基酸注射液(18AA)国家标准中均未收载胱氨酸含量的相关内容,但胱氨酸确为该产品的有效成分之一,增加胱氨酸含量检测是有必要的。以上方法的线性、准确度、重现性均比较好,虽然耐用性不理想,但通过控制反应条件、加强检验人员的考核便能够使检验结果稳定准确,不失为一种可行的测定方法。

