基于能量代谢分析白藜芦醇对H2O2诱导SH-SY5Y细胞保护作用
王淑静,黄冬梅,王立,谢雯
(1.厦门医学院,福建 厦门 361023;2.机能与临床转化福建省高校重点实验室,福建 厦门 361023)
目前,人口老龄化已成为社会性问题,包括阿尔茨海默病(Alzheimer′s disease,AD)、帕金森病(Parkinson′s disease,PD)以及亨廷顿病(Huntington disease,HD)等在内的神经退行性疾病(neurodegenerative disease,NDDs)的发病率随着人口老龄化问题的严重,呈逐年增长趋势[1]。研究表明,神经退行性疾病的发生常常伴随神经细胞内氧化应激的发生,而氧化应激与能量产生密切相关,神经细胞具有独特的能量代谢方式,其主要依靠葡萄糖有氧氧化和糖酵解提供能量,且糖酵解占有相当大的比重,研究发现脑内能量代谢障碍是阿尔茨海默病、帕金森病等多种神经退行性变的启动因素和核心环节[2],而神经细胞能量代谢障碍与氧化损伤之间的关系还不十分清楚。多酚类化合物白藜芦醇(Res)广泛存在于多种植物中,其具有一定的抗氧化作用,发挥神经保护作用[3]。近期一些研究发现白藜芦醇能够通过影响葡萄糖转运体的表达,从而影响神经退行性疾病模型中大鼠的糖代谢产能[4],且其抗氧化作用与线粒体的功能密切相关,而线粒体又是机体主要的产能细胞器,因此推测白藜芦醇的神经保护作用可能与其影响大脑能量供应有关。本课题在体外通过H2O2致SH-SY5Y细胞损伤来模拟体内神经细胞氧化损伤,通过白藜芦醇组和H2O2氧化损伤组比较,检测用药后细胞活力的变化,能量代谢相关蛋白表达、酶活力及代谢产物的含量,探究白藜芦醇对神经细胞糖代谢产能的影响及氧化损伤保护作用,为白藜芦醇神经保护作用机制的研究提供新的思路。
1 材料
1.1 试剂、试药SH-SY5Y细胞(人神经母细胞瘤细胞,哈尔滨商业大学药学院冻存);白藜芦醇(纯度≥98%,美国Sigma公司);己糖激酶(HK)、磷酸果糖激酶(PFK)、琥珀酸脱氢酶(SDH)、丙酮酸激酶(PK)、乳酸脱氢酶(LDH)、三磷酸腺苷(ATP)含量测定,葡萄糖测定等试剂盒均为南京建成生物工程研究所产品;缺氧诱导因子-1α(HIF-1α)抗体、葡萄糖转运体1(GLUT-1)、β-actin抗体为美国Santa Cruz公司。
1.2 主要仪器Mco-15AC型 CO2培养箱(日本Sanyo公司);CKX 41型倒置显微镜(日本Olympus公司);3K30型高速冷冻离心机(德国Sigma公司);Model 680 型酶标仪、Mini-Protean 电泳仪、TRANS OT-SD电转槽(美国Bio-Rad公司);TanonGIS -2019凝胶成像系统(上海天能科技有限公司)。
2 方法
2.1 MTT法检测细胞增殖抑制率将对数生长期的SH-SY5Y细胞用0.25%的胰酶消化,制成细胞悬液,调整细胞浓度为6×104个/mL。每孔100 μL接种于96孔板,37 ℃,5%CO2培养24 h。吸弃培养液,白藜芦醇组加入白藜芦醇使其终浓度分别为1、2、4、6、8、10、20 μmol·L-1,空白组和H2O2氧化损伤组加入等量培养基,溶剂对照组加入0.2‰ DMSO,培养24 h。弃原液,H2O2氧化损伤组和白藜芦醇组加入终浓度为1.2 mmol·L-1H2O2进行氧化损伤,空白组加入等量无血清培养基,继续培养24 h后,每孔加10 μL MTT(5 mg·mL-1)培养4 h,加入150 μL DMSO振荡混匀,酶标仪490 nm波长检测吸光度(OD)值,计算抑制率。

2.2 流式细胞术Annexin V单染法检测细胞凋亡率将对数生长期SH-SY5Y细胞用0.25%胰酶消化,制成细胞悬液,调整细胞浓度为2×105个/mL。6孔板每孔加1 mL细胞悬液,37 ℃,5%CO2培养24 h。
细胞进行分组和加药处理:白藜芦醇分为4组,加入白藜芦醇,使其终浓度分别为20、10、5、1 μmol·L-1,EDA(依达拉奉)组作为阳性对照组,其终浓度为10 μmol·L-1,空白对照组和H2O2氧化损伤组加等量培养基,37 ℃,5% CO2培养24 h,吸弃原液,白藜芦醇不同浓度组、H2O2氧化损伤组和EDA组每孔加入H2O2使其终浓度为1.2 mmol·L-1,空白对照组加入等量无血清培养液,继续培养24 h。
采用流式细胞术Annexin V单染法分别检测细胞凋亡率,具体方法见文献和试剂盒说明[5]。
2.3 细胞能量代谢相关酶活力及代谢物含量检测细胞进行分组和加药处理具体操作同“2.2”项下,取2 mL细胞悬液接种于培养瓶中,置于37 ℃、5% CO2培养箱中培养24 h。吸取部分培养液上清备用,胰酶消化后,吹打成细胞悬液并收集,4 ℃,3 000 r·min-1离心10 min。弃上清,1 mL生理盐水重悬,3 000 r·min-1离心10 min,重复2次,收集备用。
葡萄糖消耗量和LDH样品:直接收集培养液上清进行测定。
HK、PFK、PK、SDH样品:按照说明书加入提取液重悬细胞,超声破碎后, 取20 μL破碎后的样品用于蛋白浓度测定,其余样品-80 ℃保存待测。
ATP样品:热水浴中使用玻璃匀浆器手动匀浆破碎3 min,吸取悬液于沸水浴中加热10 min,涡旋混匀后,20 μL样品用于蛋白浓度测定,其余样品-80 ℃保存待测。
样品制备完成后,测定计算葡萄糖消耗量、ATP含量、HK、PFK、PK、LDH、SDH酶活力,具体方法均严格按照试剂盒说明书的操作步骤进行[6]。
2.4 Western blot法检测HIF-1α、GLUT-1蛋白表达细胞进行分组和加药处理具体操作同“2.2”项下,冷PBS(4 ℃)洗涤细胞3次,每瓶加入100 μL细胞裂解液冰上裂解5 min;4 ℃,12 000×g,离心5 min,取上清-20 ℃保存,BCA法进行蛋白定量。10% SDS-PAGE电泳分离蛋白,半干转膜后,将膜用奶粉封闭液封闭,60 r·min-1摇床室温孵育15 h。选用TBST稀释一抗(β-actin:1∶3 000、GLUT-1:1∶500、HIF-1α:1∶500)将稀释好的抗体和膜一起孵育,60 r·min-1摇床室温孵育1 h,4 ℃过夜。TBST洗涤3次后将NC膜放入封膜袋中,加入二抗,60 r·min-1室温孵育1 h。ECL显色,凝胶成像系统拍照显影。使用AzureSpot和Image J软件分析条带并计算蛋白表达量。
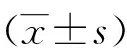
3 结果
3.1 白藜芦醇对H2O2氧化损伤的SH-SY5Y细胞活力的影响MTT结果显示,加入1.2 mmol·L-1H2O2的氧化损伤组SH-SY5Y细胞抑制率为29.57%。与H2O2氧化损伤组相比,4~20 μmol·L-1的白藜芦醇处理氧化损伤SH-SY5Y细胞抑制率显著降低(P<0.01),在1~10 μmol·L-1范围内,随着白藜芦醇浓度的增加,抑制率逐渐降低,其中10 μmol·L-1的白藜芦醇抑制率最低为8.31%,在1~2 μmol·L-1范围内,白藜芦醇组细胞抑制率明显降低(P<0.05),根据以上结果,选取20、10、5、1 μmol·L-1的白藜芦醇进行预处理氧化损伤SH-SY5Y细胞24 h,探究其对H2O2氧化损伤SH-SY5Y细胞的保护作用。

图1 不同浓度白藜芦醇对H2O2氧化损伤的SH-SY5Y细胞活力影响 注:与H2O2损伤组相比,#P<0.05,##P<0.01。
3.2 白藜芦醇对H2O2氧化损伤的SH-SY5Y细胞凋亡的影响流式细胞术检测凋亡率,与对照组相比, H2O2氧化损伤组SH-SY5Y细胞凋亡率显著升高(P<0.01),为33.9%,与H2O2氧化损伤组比较,20、10、5 μmol·L-1的白藜芦醇及EDA预处理后细胞凋亡率显著下降(P<0.01),其中10 μmol·L-1的白藜芦醇的凋亡率为21.5%,均低于20 μmol·L-1和5 μmol·L-1白藜芦醇组,说明10 μmol·L-1的白藜芦醇作用效果较好。1 μmol·L-1的白藜芦醇组细胞凋亡率与H2O2氧化损伤组比较无显著性差异(P>0.05)。
3.3 白藜芦醇对H2O2氧化损伤的SH-SY5Y细胞葡萄糖消耗量和ATP含量影响细胞主要依靠葡萄糖分解,产生大量能量ATP,满足生理活动需要。与对照组相比,H2O2氧化损伤组细胞的葡萄糖消耗量、ATP含量显著降低(P<0.01),说明H2O2降低细胞的葡萄糖分解产能;与氧化损伤模型组比较,20、10以及5 μmol·L-1白藜芦醇预处理组细胞葡萄糖消耗量、ATP含量显著升高(P<0.01),1 μmol·L-1白藜芦醇预处理组葡萄糖消耗量与损伤组无显著性差异(P>0.05),20、10以及5 μmol·L-1白藜芦醇可提高氧化损伤SH-SY5Y葡萄糖的分解,促进能量ATP的生成,其中白藜芦醇10 μmol·L-1的作用效果较好。
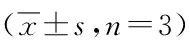
表1 白藜芦醇对H2O2氧化损伤的SH-SY5Y细胞葡萄糖消耗量和ATP含量影响
3.4 白藜芦醇对H2O2氧化损伤SH-SY5Y细胞糖酵解酶活力影响与对照组相比,H2O2氧化损伤组SH-SY5Y细胞HK活力、细胞外LDH活力显著升高(P<0.01);PFK活力、PK活力显著降低(P<0.01);与H2O2氧化损伤组相比,20、10、5 μmol·L-1的白藜芦醇预处理后SH-SY5Y细胞HK活力、细胞外LDH活力明显降低(P<0.01),PFK活力、PK活力显著升高(P<0.01)。1 μmol·L-1的白藜芦醇的作用较弱,其可引起氧化损伤SH-SY5Y细胞PFK明显升高(P<0.05),PK活力无显著性差异(P>0.05),其中10 μmol·L-1白藜芦醇预处理组HK活力、LDH活力低于其他3个浓度,PFK活力、PK活力高于其他3个浓度。PFK、PK是糖酵解中可调节得最主要的关键酶,说明不同浓度白藜芦醇可不同程度提高氧化损伤SH-SY5Y细胞的糖酵解产能,其中10 μmol·L-1白藜芦醇组作用较强。
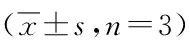
表2 白藜芦醇对H2O2氧化损伤的SH-SY5Y细胞糖酵解酶活力的影响
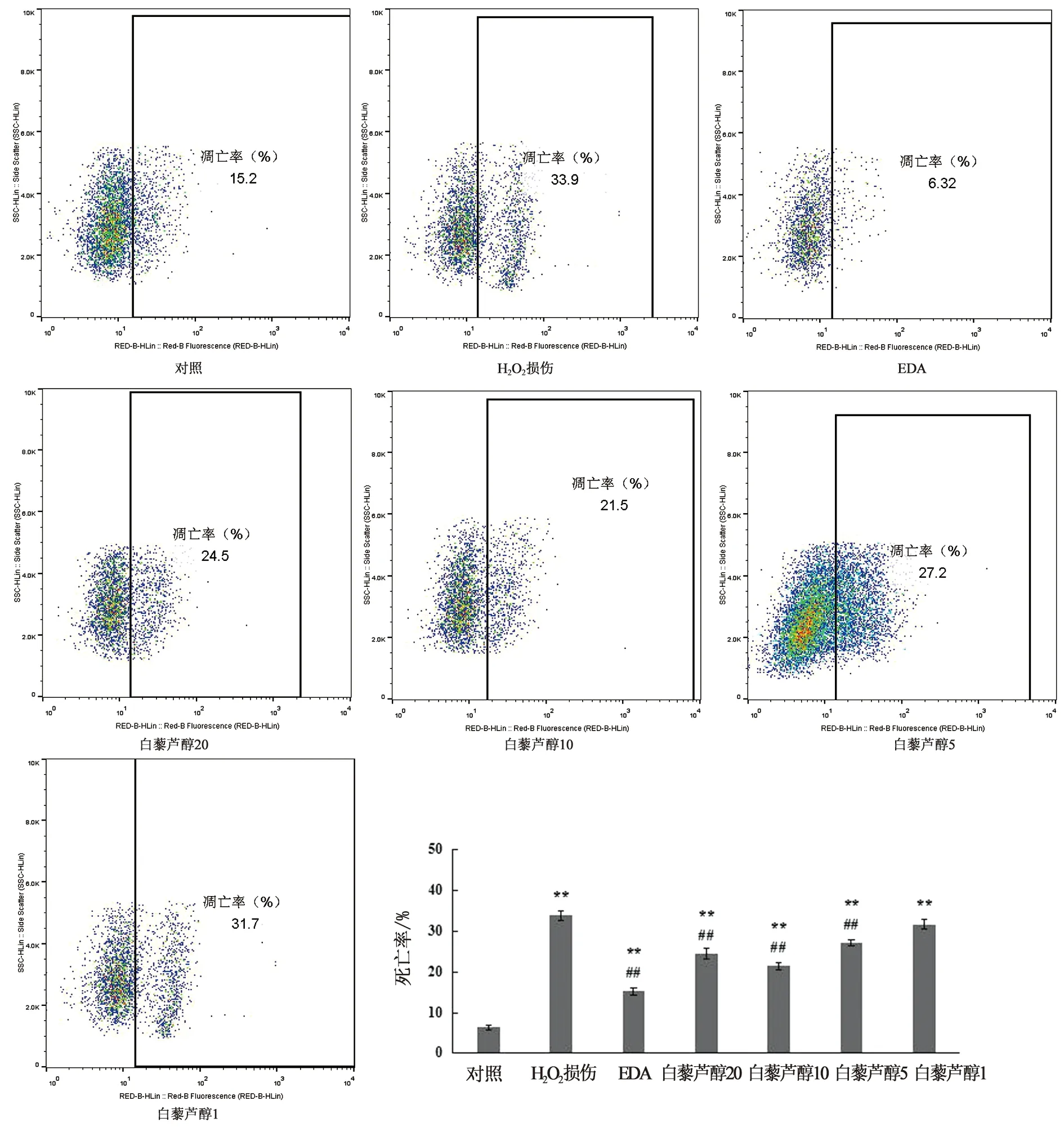
图2 白藜芦醇预处理对H2O2氧化损伤的SH-SY5Y细胞凋亡的影响 注:与对照组相比,*P<0.05,**P<0.01;与H2O2氧化损伤组相比,#P<0.05,##P<0.01。
3.5 白藜芦醇对H2O2氧化损伤SH-SY5Y细胞三羧酸循环酶SDH活力影响琥珀酸脱氢酶(SDH)是三羧酸循环中唯一嵌入到线粒体内膜上的酶,能够反映线粒体的结构和功能,其催化反应后脱下的氢可进入氧化磷酸化生成ATP,与能量生成密切相关。与对照组相比,H2O2氧化损伤模型组SH-SY5Y细胞中SDH的活力显著降低(P<0.01);与H2O2氧化损伤模型组相比,20、10、5、1 μmol·L-1的白藜芦醇及阳性药EDA预处理后SDH活力显著增高(P<0.01),说明不同浓度的白藜芦醇及EDA可提高SDH的活力,提高细胞三羧酸循环产能水平,其中10 μmol·L-1的SDH活力高于其他浓度白藜芦醇组。
表3 白藜芦醇对H2O2氧化损伤的SH-SY5Y细胞SDH活力的影响
3.6 白藜芦醇对H2O2氧化损伤的SH-SY5Y细胞能量代谢相关蛋白表达的影响与对照组相比,H2O2氧化损伤组SH-SY5Y细胞GLUT-1蛋白表达量显著降低(P<0.01),HIF-1α的表达显著升高(P<0.01);与H2O2氧化损伤组相比,20、10和5 μmol·L-1的白藜芦醇预处理SH-SY5Y细胞中GLUT-1表达量显著升高(P<0.01),1 μmol·L-1的白藜芦醇GLUT-1表达量无显著变化(P>0.05);Res 20 μmol·L-1预处理组HIF-1α的表达量明显降低(P<0.05),10 μmol·L-1的白藜芦醇组HIF-1α的表达量非常显著性降低(P<0.01),5和1 μmol·L-1组HIF-1α的表达量无显著性差异(P>0.05)。说明不同浓度白藜芦醇对GLUT-1和HIF-1α蛋白表达,葡萄糖的代谢影响不同,其中10 μmol·L-1的白藜芦醇作用较强。
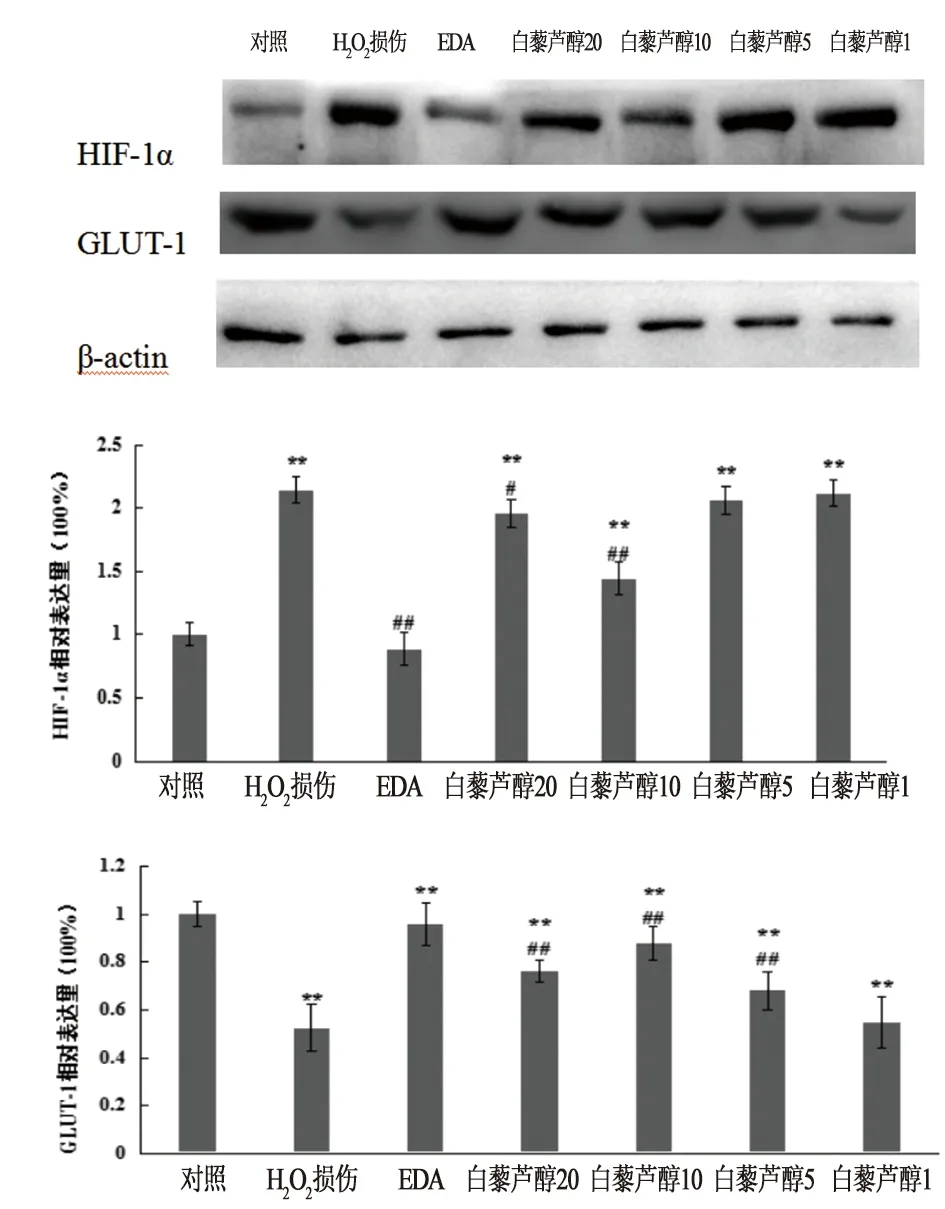
图3 白藜芦醇对H2O2氧化损伤的SH-SY5Y细胞能量代谢相关蛋白表达的影响 注:与对照组相比,*P<0.05,**P<0.01;与H2O2损伤组相比,#P<0.05,##P<0.01。
4 讨论
神经退行性疾病具有年龄依赖性,随着人口老龄化程度加剧,发病率逐年上升,神经退行性疾病患病时间长、难治愈,严重危害老年人的生理和心理,给家庭和社会带来巨大负担。氧化损伤是导致神经退行性疾病最常见的因素,H2O2是体内氧化代谢产物,能够穿透细胞膜,转化为ROS,造成氧化损伤,被广泛应用在神经元氧化应激模型的建立中。人神经母细胞瘤SH-SY5Y细胞的生理功能、形态以及生化特点等与人神经元细胞相似[7],因此选用H2O2体外损伤SH-SY5Y细胞作为神经元细胞氧化损伤的模型。
前期实验采用MTT法体外检测不同浓度的H2O2对SH-SY5Y细胞的增殖抑制作用,当H2O2浓度高于1.3 mmol·L-1时,抑制率超过60%,低于1.2 mmol·L-1时,抑制率低于30%,根据抑制率和IC50值,选取1.2 mmol·L-1作为后续氧化损伤浓度。结合细胞增殖、细胞凋亡等活性检测实验,证明1.2 mmol·L-1的H2O2可造成SH-SY5Y细胞氧化损伤。
白藜芦醇具有改善中枢神经退行性病变,降低炎症因子的释放,抗氧化损伤,保护神经元等活性,其可影响葡糖糖转运及线粒体功能,对糖代谢及能量生成有一定影响,但白芦藜醇具有双重性,在一定浓度范围可发挥保护作用,但在超过一定的浓度就有细胞毒性,结合文献及实验室之前的研究,选用40 μmol·L-1作为最大给药浓度进行关于SH-SY5Y细胞毒性实验,MTT结果显示,随白藜芦醇浓度升高,抑制率也随之升高,但当浓度在低于20 μmol·L-1范围内,抑制率在8%以下,细胞毒性较低,因此,初步选取浓度20 μmol·L-1以下作为后续实验给药浓度。与氧化损伤组相比,4~20 μmol·L-1白藜芦醇细胞抑制率显著降低(P<0.01)。当白藜芦醇浓度为10 μmol·L-1时,抑制率最低,根据实验结果,初步选取20、10、5以及1 μmol·L-1的白藜芦醇进行预处理SH-SY5Y细胞24 h,探究其H2O2氧化损伤的保护作用。流式细胞凋亡实验结果显示,与H2O2氧化损伤组相比,20、10以及5 μmol·L-1白藜芦醇抑制细胞凋亡,具有保护作用,其中10 μmol·L-1白藜芦醇作用较强。
脑内能量主要来源于葡萄糖,研究人员通过利用正电子发射断层显像技术,对健康成年人脑内的氧和糖代谢速率进行检测,发现在大脑前额皮质、外侧顶叶皮质等部位发现了有氧糖酵解的高速运行,在海马、小脑等组织内也发现了低速糖酵解的发生[8]。糖酵解和有氧氧化是糖分解产能的主要途径,当神经元供能不足时会引起功能障碍,白藜芦醇影响糖代谢及能量生成,但其对神经元退行性改变是否与能量生成有关还不清楚,因此选用HK、PFK、PK以及LDH活力检测白藜芦醇对氧化损伤SH-SY5Y细胞中糖酵解影响。选用SDH活力检测其对线粒体氧化磷酸化产能影响,选用葡萄糖消耗及ATP含量检测其对葡萄糖摄取、产能影响。实验结果显示,与氧化损伤组比较,20、10以及5 μmol·L-1白藜芦醇预处理后,糖酵解和氧化磷酸化相关酶活力具有显著变化,葡萄糖消耗量及ATP含量显著升高(P<0.01)。以上数据显示,20,10以及5 μmol·L-1白藜芦醇通过调节能量代谢相关酶活力,促进葡萄糖摄取,提高葡萄糖产生能量ATP,对H2O2诱导的SH-SY5Y细胞的氧化损伤产生保护作用。其中10 μmol·L-1的白藜芦醇作用较强。
神经元通过多种途径调控GLUT-1的表达,影响摄取葡萄糖,进而影响糖酵解和糖有氧氧化产能过程[9],HIF-1α是能量代谢的重要调控蛋白,有研究表明,当缺氧或者神经细胞受到刺激时,HIF-1α升高,抑制线粒体功能及产能过程[10]。实验结果显示,与对照组相比,H2O2氧化损伤后HIF-1α的表达量显著升高,GLUT-1表达显著降低。经过20、10 μmol·L-1白藜芦醇预处理后,HIF-1α的表达量显著降低,GLUT-1的表达显著升高。说明白藜芦醇可通过影响能量代谢相关蛋白来调节能量代谢过程,从而发挥保护细胞的作用。
通过实验可以得出,一定浓度的白藜芦醇可通过影响能量代谢相关蛋白表达,促进葡萄糖的转运,提高葡萄糖氧化分解代谢,促进产能,对氧化损伤的SH-SY5Y细胞具有保护作用,本实验为神经退行性疾病的作用机制研究提供新的思路,对白芦藜醇等相关药物开发具有指导意义。

