不同叶片病害症状桃Lhcb基因的克隆与表达分析
张子萌 杨丽娟 卢美光 李世访


摘要:以我国健康山毛桃和不同症状的油桃叶片为试验材料,基于转录组测序数据,通过基因克隆获得编码捕光叶绿素a/b结合蛋白的Lhcb基因全长序列,并进行生物信息学分析,以期揭示不同桃品种Lhcb基因序列差异及其表达与功能,丰富Lhcb基因的序列信息,探究Lhcb基因表达与不同叶片病害症状间的关系。克隆获得山毛桃、无症状及花叶症状油桃的Lhcb基因全长序列,分别命名为Lhcb-Pd1、Lhcb-Ppn1和Lhcb-Ppn3,全长均为1 925 bp,与美国国家生物技术信息中心(NCBI)网站上登录的桃Lhcb-Pp1基因(1 912 bp)相比,在1 593 nt处多出10个碱基。全长包括1个804 bp(编码267个氨基酸)的开放阅读框、CAAT-signal和TATA box等作用元件。遗传进化分析结果表明,获得的3个目的基因序列与李属植物的基因序列聚为1组。蛋白质分析结果表明,桃Lhcb蛋白的相对分子量为 28 332.17 u,理论等电点为5.30,是亲水性蛋白;其二级结构主要由53% α-螺旋、33%无规卷曲和24%跨膜螺旋组成,无β-折叠结构。对无症状及花叶症状油桃样品中Lhcb基因表达差异进行分析,通过半定量RT-PCR和RT-qPCR,结果表明,与无症状样品相比,花叶油桃中Lhcb转录本的转录水平较低,Lhcb基因的相对表达量显著下调。
关键词:桃;Lhcb基因;基因克隆;基因表达;蛋白分析
中图分类号:S436.621.1文献标志码:A
文章编号:1002-S662.11302(2023)11-0035-08
收稿日期:2022-11-01
基金项目:国家农业产业技术体系建设专项(编号:CARS-30-3-01)。
作者简介:张子萌(1998—),女,河北保定人,硕士研究生,主要从事果树病毒学研究。E-mail:zimeng980809@163.com。
通信作者:卢美光,博士,研究员,主要从事果树病毒学研究。E-mail:mglu@ippcaas.cn。
桃树是我国非常重要的落叶核果类果树,属于蔷薇科(Rosaceae)李属(Prunus),在世界范圍内被普遍引种、栽培。山毛桃(Prunus davidiana Franch)耐寒、耐旱且具有发达的根系,是黄土丘陵和北方实质山区自然分布的树种。油桃(Prunus persica cv. nectarina)是桃的变种,由于其采摘食用便利,商品性强,经济效益高[1],故其在桃产业中所占比重逐年增大。与蔷薇科其余木本植物(如李、樱桃)相比,桃的基因组较小(230 Mbp),且童期仅为2~3年,因此桃可作为蔷薇科植物研究中的模式基因组物种[2]。
捕光叶绿素a/b结合蛋白在高等植物的光合作用中发挥着重要功能,其与光合反应体系中的有机色素分子连接形成复合体,将光能信号迅速传递到光系统Ⅰ(PSⅠ)、光系统Ⅱ(PS Ⅱ)的反应中心,推动光合反应的进行[3]。捕光叶绿素a/b结合蛋白复合体在PSⅠ和PSⅡ中均存在,PS Ⅱ-LHCⅡ[the light-harvesting chlorophyll a/b-binding proteins (LHC Ⅱ) associated with photosystem Ⅱ (PS Ⅱ)]主要包括1个三聚体和3个单体蛋白,三聚体分别由Lhcb1、Lhcb2和Lhcb3基因编码,3个单体蛋白则分别由 Lhcb4(CP29)、Lhcb5(CP24)和Lhcb6(CP26)基因编码[4]。目前,已有许多植物的Lhcb基因被克隆,如豌豆[5]、矮牵牛[6]、拟南芥[7]、番茄[8]、小麦[9]、花椰菜[10]、毛竹[11]、长白松[12]等。据报道,捕光叶绿素a/b结合蛋白也参与了植物抗逆、环境适应性等方面的调节。例如,Zhang等在研究2种生态型东南景天Lhcb2基因在镉、锌胁迫下的表达变化时发现,镉、锌胁迫处理能够提高转基因烟草中该基因的表达量[13]。Petit等对杀菌剂胁迫后葡萄光合作用相关基因的表达情况进行研究,发现光合作用的降低伴随着PS Ⅱ的psbP1(PsbP subunit of photosystem Ⅱ)基因、PSⅠ的cab基因[chlorophyll a/b-binding (Cab) proteins]的抑制表达,使得光合作用受到影响,但没有触发任何植物防御反应[14]。
本研究基于大田温室中具有不同病害症状的油桃叶片(无症状和花叶)样品的sRNA和转录组测序数据,筛选获得桃中与光合作用密切相关的Lhcb基因。虽然目前在NCBI中已登录1条桃(Prunus persica cv. Stark Earlilo)Lhcb基因(Lhcb-Pp1)全序列,但是未见对其相关序列和功能研究的报道。因此,本研究以Lhcb-Pp1基因为模板,分别设计5′、3′端和特异性引物,利用RT-PCR技术扩增我国山毛桃与油桃中不同表型叶片的Lhcb基因序列;利用BioEdit、MEGA 7.0、Phyre2、SWISS MODEL及ExPASy-ProtParam等软件/在线工具对获得的基因序列及其编码的蛋白质结构进行分析;利用半定量RT-PCR、RT-qPCR技术检测具有不同病害症状的油桃样品中Lhcb基因的表达量差异。研究结果能解析不同桃品种相关Lhcb基因的序列差异及油桃Lhcb基因与花叶症状的相关性,从而为植物病害防治研究提供参考依据。
1 材料与方法
1.1 试验材料
山毛桃种子于2021年3月份购自浙江杭州,于4 ℃黑暗冷藏至少2个月后进行消毒、去壳、播种得到实生苗;油桃叶片样品(S01、S03)品种来源为中油4号,于2017年5月采自管理与栽培条件一致的辽宁省大连市大田温室,其中S01为无症状,S03为花叶。采集的新鲜叶片经液氮处理后,于-80 ℃保存备用,后续试验于2021年12月在中国农业科学院植物保护研究所进行。
1.2 试验方法
1.2.1 编码捕光叶绿素a/b结合蛋白Lhcb基因的克隆与测序 植物总RNA的提取和引物设计:使用多糖、多酚植物总RNA提取试剂盒提取植物总RNA,并于-80 ℃保存备用。根据GenBank中已登录的桃Lhcb-Pp1基因序列(登录号L36064.1)设计引物(表1),对Lhcb基因进行全长扩增。5′、3′端全长扩增引物(Full-F/R)预期扩增出大小为 1 912 nt 左右的目的基因全序列及5′或3′端部分片段。另设计3′端序列扩增引物(5′-991F),预期目的片段扩增大小为900 nt左右。引物均由北京擎科生物科技有限公司合成,详见表1。
RT-PCR扩增:以植物总RNA为模板,使用反转录试剂盒合成cDNA;用Q5 High-Fidelity 2X Master Mix试剂盒进行PCR反应,并用1.2%琼脂糖凝胶电泳对PCR产物进行分析。
目的基因片段的克隆和测序:PCR目的产物用琼脂糖凝胶DNA回收试剂盒纯化。将纯化产物连接至pTOPO-Blunt克隆载体,转化到大肠杆菌Escherichia coli DH5α感受态细胞,经菌液PCR检测鉴定后,挑选阳性克隆送至北京擎科生物科技有限公司测序。用BioEdit[15]软件对克隆测序得到的序列进行拼接,获得Lhcb基因全长序列。
1.2.2 序列分析 从NCBI数据库中下载已登录的桃Lhcb-Pp1基因序列及其编码的蛋白质序列(登录号:AAA50310.1),用BioEdit软件对“1.2.1”节扩增到的基因序列進行比对,分析其序列的差异。
1.2.3 系统发育树的构建 为了确定所得Lhcb基因的遗传进化关系,除供试样品Lhcb基因外,从NCBI上下载桃、杏、梅、甜樱桃、月季、白梨、苹果、野草莓、蓖麻、大麻、大豆、野大豆、美花烟草、拟南芥、雷公藤、胡杨、茶、油茶、银白杨、莲、向日葵、核桃、山核桃、木薯、橄榄、葡萄的Lhcb基因及其编码的蛋白序列,在BioEdit中进行序列比对,用MEGA 7.0[16]构建系统发育树。系统发育树的构建选择General Time Reversible model和Gamma Distributed(G)模式运行程序,采用最大似然法(maximum likelihood,ML),Bootstrap值设为1 000次。
1.2.4 Lhcb蛋白的理化性质分析 为了明确不同植物Lhcb蛋白之间的亲缘关系是否和其理化性质相关,用ExPASy-ProtParam[17](https://www.expasy.org/resources/protparam)对桃和其他物种的Lhcb蛋白进行理化性质分析。
1.2.5 Lhcb蛋白二级结构、三维结构的预测 利用Phyre2在线工具[18](http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)对桃中的Lhcb蛋白进行分析。先输入蛋白序列,再预测Lhcb蛋白的二级结构,并以Pea Light-Harvesting Complex(PDB ID:2bhw)为模型,用Swiss Model在线工具(https://swissmodel.expasy.org/)进行同源建模,用Swiss-PDB Viewer软件查阅其三维结构[19]。
1.2.6 半定量RT-PCR及RT-qPCR技术 将油桃样品的RNA定量2 μg后再反转录为cDNA,稀释20倍后可用作模板。以TEF2(translation enlongation factor 2,翻译延伸因子2)[20]为内参基因,以桃转录本PRUPE_ppa0100 15 mg基因序列设计特异引物。半定量RT-PCR:将得到的cDNA分别按1 ∶2、1 ∶20、1 ∶200的比例稀释,PCR反应使用2×Taq PCR MasterMix试剂盒进行。引物 Lhcb-F:5′-AACCGCATCCAAGTCCA-3′,Lhcb-R:5′-CTCAAGTTCTCAGGCTCAC-3′。RT-qPCR:用含有 SYBR GreenⅠ的 TransStart Green qPCR SuperMix试剂盒配制反应体系,在MyGo Pro Real-Time PCR System (IT-IS Life Science Ltd.,UK)上进行RT-qPCR扩增。引物qLhcb-F:5′-CTCTTACCTCACTGGAGAATT-3′,qLhcb-R:5′-ATACAGCCTCACCGAACT-3′,每个qPCR反应设1个阴性对照。
2 结果与分析
2.1 编码捕光叶绿素a/b结合蛋白Lhcb基因的克隆与序列分析
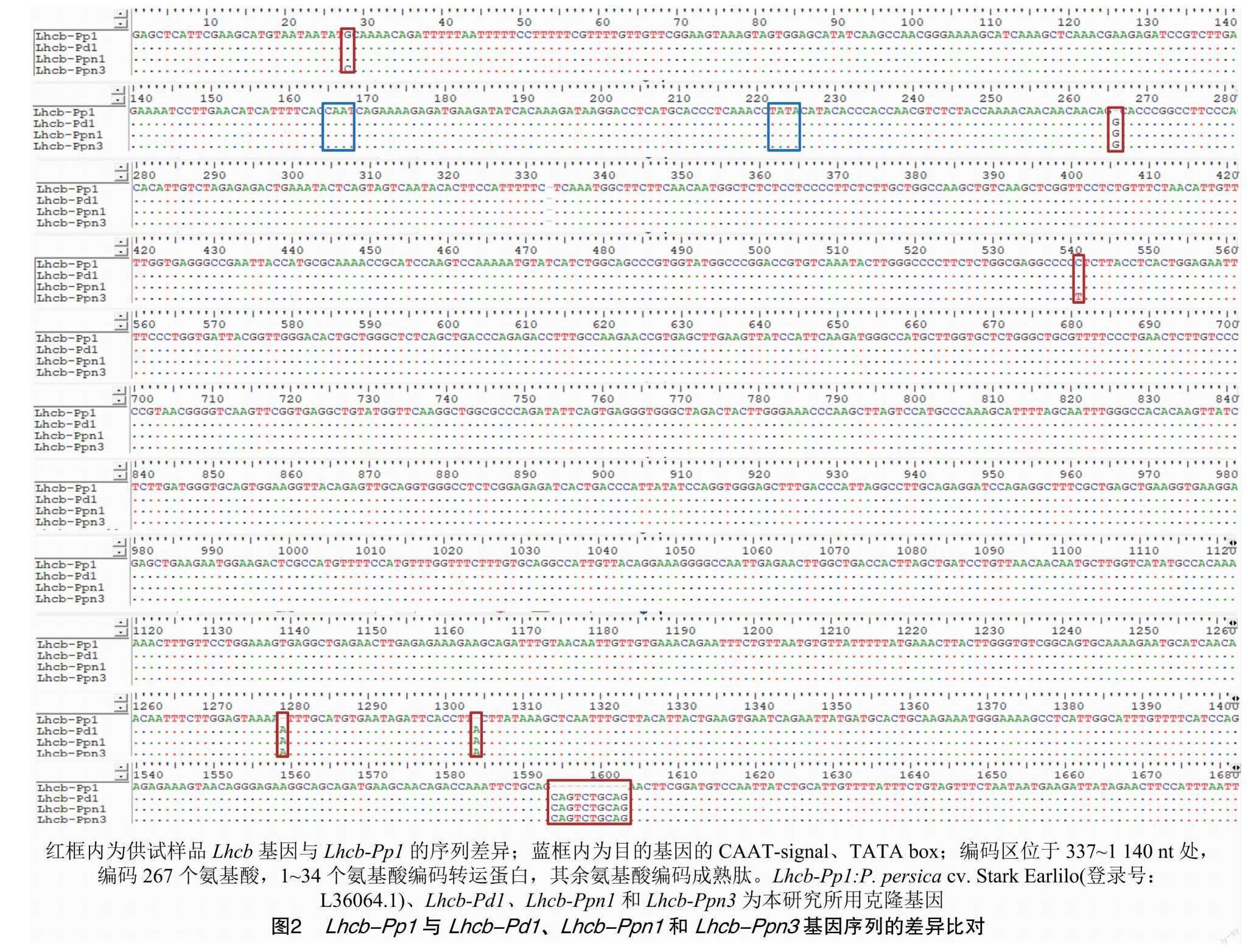
利用5′、3′端全长扩增引物Full-F/R,通过 RT-PCR 扩增、克隆测序得到山毛桃全序列与油桃S01 5′端1 047 bp、3′端1 400 bp的片段及S03 5′端1 047 bp的部分序列。通过3′端扩增引物5′-991F、3′-Full-R扩增,获得S03 3′端889 bp的片段。最终通过克隆、序列拼接与测序,获得S01、S03的完整序列。山毛桃、油桃S01、S03的Lhcb基因分别命名为Lhcb-Pd1、Lhcb-Ppn1、Lhcb-Ppn3(图1)。
序列分析结果表明,Lhcb-Pd1、Lhcb-Ppn1和Lhcb-Ppn3基因全长1 925 bp,包括1个804 bp的开放阅读框(ORF),可编码267个氨基酸,预测其编码PSⅡ-LHC Ⅱ,Type1,非编码区中包含 CAAT-signal、TATA box等作用元件。与 Lhcb-Pp1序列(基因全长1 912 bp)相比,明显的差异是克隆的3个目的基因序列在1 593 nt处均有10 bp碱基(CAGTCTGCAG)的插入(图2),在266 nt处有G插入,在1 278、1 303 nt处有A插入(图2)。但是与Lhcb-Pp1基因编码区(位置:337~1 140 nt)的氨基酸序列比对发现,其编码的氨基酸高度保守,相似性为100%。此外,将得到的目的基因在NCBI中进行比对,发现100余种植物的Lhcb基因中,只在杏(登录号:AP019299.1)中发现相同的10 bp碱基插入(图中未显示),其他物种并未发现相同碱基插入。
2.2 Lhcb基因及其编码蛋白的系统发育树分析
将Lhcb-Pd1、Lhcb-Ppn1和Lhcb-Ppn3全长基因与模式植物拟南芥的Lhcb1全长基因进行序列比对,结果表明,3条目的基因核苷酸全序列与拟南芥Lhcb1的5条基因序列的一致性都较低,为34.6%~39.8%,但其编码区的蛋白编码核苷酸序列的一致性较高,为67.4%~67.9%,氨基酸序列一致性为87.8%~88.1%;李属代表植物如甜樱桃、梅、杏等与桃目的基因编码蛋白编码氨基酸序列的一致性为96.3%~98.6%,不同桃品种之间的Lhcb基因同源性较高,其所编码的蛋白编码氨基酸序列一致性可达100%。上述结果表明,虽然不同物种相应的Lhcb基因亲缘关系不同,但是其编码的蛋白质在进化上还是相对保守的。
对不同物种Lhcb基因编码核苷酸序列和编码蛋白的遗传进化分析结果表明,从桃中克隆到的3条基因与大多数李属植物的基因聚在一起,亲缘关系最近;与拟南芥亲缘关系较远,与序列比对结果一致;对不同桃品种而言,山毛桃、桃和油桃单独聚在李属植物遗传组的1个亚组上(图3)。
2.3 不同物种Lhcb蛋白质的理化性质分析
不同物种Lhcb蛋白的理化性质分析结果表明,毛桃与油桃Lhcb蛋白的理化性质一致。由表2可知,除月季、向日葵外,其余物种Lhcb蛋白的氨基酸残基数为261~269个,相对分子量为27 700.74~28 633.67 u,理论等电点为5.10~6.33,大多数为亲水性蛋白;不同植物的Lhcb蛋白理化性质较一致,但也有差异,如拟南芥Lhcb1中的5个蛋白大都为疏水蛋白,可能是由氨基酸非保守域序列的差别造成的。
2.4 桃Lhcb蛋白的二级结构、三维结构分析
用Phyre2对桃Lhcb蛋白的二级结构进行分析,结果表明,Lhcb主要由53% α-螺旋、33%无规卷曲和24%跨膜螺旋组成,无β-折叠结构,预测结果的可信度为100%。以Pea Light-Harvesting Complex(LHC;PDB ID:2bhw)为模型,用Swiss-Model进行三维结构的同源建模,结果表明,桃Lhcb与Pea LHC的氨基酸序列相似性为94%,二者具有相似的三维结构。桃Lhcb蛋白的空间结构分析结果显示,其主要由3条链组成,包括α-螺旋、无规卷曲结构(图4)。与模式植物拟南芥相比,桃Lhcb蛋白的整体三维结构与拟南芥S-LHCⅡ、M-LHCⅡ的三维结构均相似,这些结构也是捕光叶绿素a/b结合蛋白的典型空间结构,是其行使生物学功能的基础,也表明LHCⅡ蛋白在进化上相当保守。
2.5 半定量RT-PCR、RT-qPCR对油桃中Lhcb基因表达量的分析
图5-A的半定量RT-PCR结果表明,随着模板量的逐渐减少,S01、S03中内参基因的量均无显著差异,但S03中Lhcb基因的量表现为降低趋势,当cDNA含量稀释200倍时,S01样品中仍能见较亮的Lhcb扩增条带,而S03样品中已基本看不见扩增条带。图5-B的RT-qPCR结果也表明,S03花叶样品中的Lhcb基因表达量明显下调,S01样品中的Lhcb基因表达量是S03的40倍左右(图5-B)。以TEF2为内参基因,通过半定量RT-PCR、RT-qPCR检测油桃无症状(图5-C)和花叶叶片(图5-D的Lhcb基因表达量差异,获得一致结果。由试验结果可以推测,S03样品中花叶症状的出现与Lhcb基因表达量的下调密切相关。
3 讨论与结论
在光合作用和植物抗逆的过程中,捕光叶绿素a/b结合蛋白都发挥着重要作用。本研究以我国山毛桃、油桃为供试样品进行Lhcb的全基因克隆,获得了不同桃品种和不同症状样品的Lhcb全基因序列,预测其编码PS Ⅱ-LHCⅡ,Type1。序列分析结果表明,与NCBI中提交的桃品种Stark Earlilo的Lhcb基因相比,获得的3条Lhcb全基因的序列均在1 593 nt非编码区多出了10 bp碱基的插入,说明我國不同桃品种的Lhcb基因序列与NCBI中提交的桃品种存在差异,但获得的目的基因编码的Lhcb蛋白是高度保守的。经过对NCBI中不同物种的Lhcb基因序列进行比对,发现只在杏中可以比对到插入的这10个碱基,而有研究发现,早在1992年,马锋旺等就已进行桃与杏的杂交试验,发现多数杂交组合有一定的亲和性[21]。在我国目前的果园中,果树混种的现象十分普遍,难以避免桃杏之间的杂交,笔者推测,本研究中目的基因组DNA多出10个碱基可能与品种起源有关。
在模式植物拟南芥中,Lhcb1基因编码PSⅡ-LHC Ⅱ(Type1蛋白),包含5条Lhcb1亚型基因(lhcb1.1、lhcb1.2、lhcb1.3、lhcb1.4、lhcb1.5)[4]。对本研究获得的目的基因编码的蛋白质进行理化性质分析发现,李属植物的Lhcb蛋白大多为亲水蛋白,而拟南芥Lhcb1中的5个蛋白大多为疏水蛋白。由于拟南芥Lhcb1基因编码的蛋白质中含有1段高度疏水序列即“通用LHC基序”(ELINGRLAMLGFLGFLVPELIT),而此序列并未在李属植物中比对到,因此推测李属植物和拟南芥Lhcb1蛋白的疏水性可能由氨基酸非保守域序列的差别造成[22]。在拟南芥中,LHCⅡ蛋白中的几个三聚体组件可以在特定位置同时与PSⅡ核心复合体结合,根据它们与PSⅡ二聚体核心(C2)的相对位置及与PSⅡ-LHCⅡ相互作用的强度,创造了4个不同的LHCⅡ类别:强(S)、中(M)、松散(L)和裸露(N),其中较为常见的是S-LHCⅡ、M-LHCⅡ,S-LHCⅡ是lhcb1.3的产物,M-LHCⅡ为lhcb1.4的产物[22-23],而桃Lhcb蛋白整体的三维结构与S-LHCⅡ、M-LHCⅡ的三维结构相似,这是捕光叶绿素a/b结合蛋白的典型空间结构,表明LHCⅡ蛋白在进化上比较保守。
在田間条件下,桃花叶症状普遍发生,通常由缺素或病毒侵染引发。有研究表明,Lhcb基因普遍参与光能的捕获与传递、叶片发育及各种胁迫应答,如干旱胁迫、盐胁迫、激素信号及病原胁迫[24-25]。笔者用半定量RT-PCR、RT-qPCR技术对不同表型油桃样品进行Lhcb基因表达的差异分析,结果表明,花叶症状的油桃样品PSⅡ-LHCⅡ,1型Lhcb基因的表达量显著下调。笔者通过对无症状及花叶油桃样品进行病毒检测,均检测到桃潜隐花叶类病毒(PLMVd)[26],这是一种由335~351 nt 组成的环状RNA分子[27],用不同的PLMVd序列分离物侵染桃树后会有不同表型,被侵染的植株一般表现为不同症状的花叶、白化、延迟发芽等,有些表现为无症状的潜隐性侵染[28]。笔者也发现了由PLMVd侵染引发的花叶症状的报道[29],与本研究样品的花叶表型一致。此外,在本研究中,油桃无症状及花叶叶片样品采集于相同管理条件和栽培环境的田间温室,由此可以初步推测,花叶症状的产生可能与PLMVd侵染导致PSⅡ-LHCⅡ 1型Lhcb基因表达量下调有关,进一步的研究正在进行中。Lhcb蛋白为光合作用中的重要功能蛋白,其生理功能复杂,占光合膜中近50%的色素和约1/3的蛋白质。Lhcb在植物生长发育中发挥着重要作用,因此对其研究也逐渐增多[30]。LHC蛋白作为自然界最丰富的膜蛋白之一,目前关于Lhc基因的测序分析在一些模式植物中已较完善,在毛竹、金银花、橡胶树、景天、李属植物等物种中,有少数LHC蛋白相关的基因被克隆测序,但对桃Lhcb基因的研究未见报道。此外,已有报道显示,植物Lhcb基因的表达与非生物协迫有关,但对其与植物病原侵染的关系研究较少。因此,本研究对桃不同品种和不同病害症状的Lhcb基因的克隆与表达分析不仅有助于丰富Lhcb基因的序列信息,而且可为木本李属植物栽培及病害防治等提供重要的参考依据。
参考文献:
[1]王志强,宗学普,刘淑娥,等. 我国油桃生产发展现状及其对策[J]. 柑桔与亚热带果树信息,2001,17(3):3-5.
[2]霍如雪,刘振宁,杨 青,等. 桃PG基因家族的鉴定与分析[J]. 江苏农业科学,2016,44(6):33-40.
[3]Raghvendra A S. Photosynthesis:a comprehensive treatise[M]. Cambridge:Cambridge University Press,1998:644-653.
[4]Jansson S. A guide to the Lhc genes and their relatives in Arabidopsis[J]. Trends Plant Science,1999,4(6):236-240.
[5]Coruzzi G,Broglie R,Cashmore A R,et al. Nucleotide sequences of two pea cDNA clones encoding the small subunit of ribulose 1,5-bisphosphate carboxylase and the major chlorophyll a/b binding thylakoid polypeptide[J]. Journal of Biology Chemistry,1983,258(3):1399-1402.
[6]Dunsmuir P,Smith S M,Bedbrook J. The major chlorophyll a/b binding protein of petunia is composed of several polypeptides encoded by a number of distinct nuclear genes[J]. Journal of Molecular and Applied Genetics,1983,2(3):285-300.
[7]Leutwiler L S,Meyerowitz E M,Tobin E M. Structure and expression of three light-harvesting chlorophyll a/b binding protein genes in Arabidopsis thaliana[J]. Nucleic Acids Research,1986,14(10):4051-4064.
[8]Pichersky E,Bernatzky R,Tanksley S D,et al. Molecular characterization and genetic mapping of clusters of genes coding chlorophyll a/b binding proteins in Lycopersicon esculentum (tomato)[J]. Gene,1985,40(2/3):247-258.
[9]Lamppa G,Nagy F,Chua N H. Light regulated and organ specific expression of a wheat Cab gene in transgenic tobacco[J]. Nature,1985,316(6030):750-752.
[10]Damarajua S,Schledeb S,Eckhardta U,et al. Functions of the water soluble chlorophyll-binding protein in plants[J]. Journal of Plant Physiology,2011,168(12):1444-1451.
[11]高志民,刘 成,刘颖丽,等. 毛竹捕光叶绿素a/b结合蛋白基因cab-PhE1的克隆与表达分析[J]. 林业科学,2009,45(3):145-149.
[12]Jansson S,Gustafsson P. Type and type-genes for chlorophyll a/b binding proteins in the gymnosperm Pinus sylvestris (Scots pine):cDNA cloning and sequence analysis[J]. Plant Molecular Biology,1990,14(3):287-296.
[13]Zhang M,Senoura T,Yang X E,et al. Lhcb2 gene expression analysis in two ecotypes of Sedum alfredii subjected to Zn/Cd treatments with functional analysis of SaLhcb2 isolated from a Zn/Cd hyperaccumulator[J]. Biotechnology Letters,2011,33(9):1865-1871.
[14]Petit A N,Wojnarowiez G,Panon M L,et al. Botryticides affect grapevine leaf photosynthesis without inducing defense mechanisms[J]. Planta,2009,229(3):497-506.
[15]Gupta S K,Padmanabhan B R,Diene S M,et al. ARG-ANNOT,a new bioinformatic tool to discover antibiotic resistance genes in bacterial genomes[J]. Antimicrob Agents Chemother,2014,58(1):212-220.
[16]Kumar S,Stecher G,Tamura K. MEGA7:molecular evolutionary genetics analysis Version 7.0 for bigger datasets[J]. Molecular Biology and Evolution,2016,33(7):1870-1874.
[17]Duvaud S,Gabella C,Lisacek F,et al. Expasy,the Swiss Bioinformatics Resource Portal,as designed by its users[J]. Nucleic Acids Research,2021,49(W1):W216-W227.
[18]Kelley L A,Mezulis S,Yates C M,et al. The Phyre2 web portal for protein modeling,prediction and analysis[J]. Nature Protocols,2015,10(6):845-858.
[19]刘子楠,黎河山,宋枭禹. 蛋白质结构预测综述[J]. 中国医学物理学杂志,2020,37(9):1203-1207.
[20]Tong Z G,Gao Z H,Wang F,et al. Selection of reliable reference genes for gene expression studies in peach using real-time PCR[J]. BMC Molecular Biology,2009(10):71-85.
[21]马锋旺,康俊生. 桃和杏杂交亲和性试验[J]. 果树科学,1996,13(4):251-252.
[22]Kühlbrandt W,Wang D N,Fujiyoshi Y. Atomic model of plant light-harvesting complex by electron crystallography[J]. Nature,1994,367(6464):614-621.
[23]Graca A T,Hall M,Persson K,et al. High-resolution model of Arabidopsis Photosystem Ⅱ reveals the structural consequences of digitonin-extraction[J]. Scientific Report,2021,11(1):15534-15545.
[24]Staneloni R T,Rodriguez Batiller M J,Casal J J. Abscisic acid,high-light,and oxidative stress down-regulate a photosynthetic gene via a promoter motif not involved in phytochrome-mediated transcriptional regulation[J]. Molecular Plant,2008,1(1):75-83.
[25]Xia Y S,Ning Z X,Bai G H,et al. Allelic variations of a light harvesting chlorophyⅡ A/B binding protein gene (Lhcb1) associated with agronomic traits in barley[J]. PLoS One,2012,7(5):e37573-e37583.
[26]Xu Y X,Li S F,Na C Y,et al. Analyses of virus/viroid communities in nectarine trees by next-generation sequencing and insight into viral synergisms implication in host disease symptoms[J]. Scientific Report,2019,9(1):12261-12273.
[27]Lee H J,Cho I S,Ju H J,et al. Development of a reverse transcription droplet digital PCR assay for sensitive detection of peach latent mosaic viroid[J]. Molecular and Cellular Probes,2021,58:101746-101753.
[28]Hadidi A,Giunchedi L,Shamloul A M,et al. Occurrence of peach latent mosaic viroid in stone fruits and its transmission with contaminated blades[J]. Plant Disease,1997,81(2):154-158.
[29]Hammann C,Steger G. Viroid-specific small RNA in plant disease[J]. RNA Biology,2012,9(6):809-819.
[30]孫钦秒,冷 静,李良璧,等. 高等植物光系统Ⅱ捕光色素蛋白复合体结构与功能研究的新进展 [J]. 植物学通报,2000,17(4):289-301.

